Препараты на основе высокоочищенного гидролизата плаценты человека (ГПЧ) характеризуются широким спектром возможных клинических эффектов: гепатопротекция, иммуномодуляция, ранозаживление и другие виды регенерации тканей, нейротрофические эффекты, нормализация пигментации кожи и др. (рис. 1) [1].
Препарат Лаеннек, технология получения которого разработана компанией Japan Bioproducts Ltd на основе ГПЧ, разрешен к применению в РФ с 2003 г. в качестве гепатопротекторного и иммуномодулирующего средства. Геропротекция представляется одним из перспективных направлений использования Лаеннека. В работе [2] было изучено действие Лаеннека на маркеры старения in vitro (накопление β-галактозидазы в фибробластах человека) и in vivo (гистоморфологические маркеры регенерации тканей кожи, печени и других органов). При выращивании культуры фибробластов добавление Лаеннека снижало число стареющих клеток на 7,9% (р=0,01, маркер β-галактозидаза). Экспериментальное исследование эффектов Лаеннека на заживление ран и ожогов (в дозировке 0,2 мл/кг массы тела внутрибрюшинно, 5 р/нед, 4 нед) показало существенное повышение скорости и качества заживления повреждений кожи (в частности, повышение количества эластиновых волокон и основного аморфного вещества, формирование волосяных фолликулов). Патогистологическое исследование секционного материала печени, почек и миокарда, полученного в результате создания модели алкогольного поражения печени, подтверждает регенеративное действие Лаеннека (снижение воспалительно-клеточной инфильтрации, отека стромы, жировой дистрофии, накопления билирубина) [2].
Исследованные маркеры указывают на более интенсивные процессы репарации тканей и косвенно указывают на геропротекторный эффект Лаеннека. В этой связи целесообразным представляется изучение in vivo возможного влияния Лаеннека на продолжительность жизни целого организма. В настоящей работе изучение геропротекторного действия Лаеннека было проведено на модельном организме Caenorhabditis elegans (C. elegans), который широко используется в современной молекулярно-клеточной биологии (в частности, в качестве модельной системы для скрининга потенциальных геропротекторов). Препарат тестировался по таким маркерам старения, как продолжительность жизни, устойчивость к температурному, токсическому и оксидативному стрессу.
 Одной из наиболее «горячих точек» в современной геронтологии является вопрос о роли возрастных изменений в системе гормон роста (ГР)/инсулиноподобный фактор роста-1 (ИФР-1)/инсулин в механизме старения и развития ассоциированной с возрастом патологии [10]. Важным звеном в возрастных нарушениях является уменьшение индуцируемой ГР продукции ИФР-1. У старых крыс отмечено двукратное увеличение концентрации рецепторов к ГР в тканях, что, однако, не компенсирует возрастного снижения секреции этого гормона. С возрастом способность ГР индуцировать экспрессию гена ИФР-1 также существенно снижается. Таким образом, и у человека, и у лабораторных животных с возрастом развиваются нарушения в системе передачи сигнала рецептора ГР, приводящие к снижению секреции ИФР-1 [11].
Одной из наиболее «горячих точек» в современной геронтологии является вопрос о роли возрастных изменений в системе гормон роста (ГР)/инсулиноподобный фактор роста-1 (ИФР-1)/инсулин в механизме старения и развития ассоциированной с возрастом патологии [10]. Важным звеном в возрастных нарушениях является уменьшение индуцируемой ГР продукции ИФР-1. У старых крыс отмечено двукратное увеличение концентрации рецепторов к ГР в тканях, что, однако, не компенсирует возрастного снижения секреции этого гормона. С возрастом способность ГР индуцировать экспрессию гена ИФР-1 также существенно снижается. Таким образом, и у человека, и у лабораторных животных с возрастом развиваются нарушения в системе передачи сигнала рецептора ГР, приводящие к снижению секреции ИФР-1 [11].
ГР и ИФР-1 стимулируют синтез ДНК, РНК и белков в мозге, образование нейритов, пролиферацию олигодендроцитов и выживание нейронов и глии in vitro, усиливают образование синапсов в мышцах и способствуют репарации нервной ткани. ИФР-1 участвует в регуляции уровня обмена кальция в мозге и экспрессии онкогена с-fos. Введение ГР увеличивало концентрацию ИФР-1 в головном мозге и защищало нейроны от гибели в условиях ишемии, что свидетельствует о его способности преодолевать гематоэнцефалический барьер [11]. Имеются убедительные доказательства избирательной стимуляции введением ИФР-1 утилизации глюкозы в мозге старых крыс, а также нейротропного действия ИФР-1. Так, введение его в желудочки головного мозга старых животных увеличивало утилизацию глюкозы и активность глютамата в областях мозга, связанных со способностью к обучению и памятью.
МАТЕРИАЛЫ И МЕТОДЫ
Оценка показателей состояния и выживаемости C. elegans в присутствии Лаеннека
Целью настоящей работы являлась оценка геропротекторных свойств Лаеннека на C. elegans с использованием технологии фенотипического скрининга. Эксперимент ставился в стандартизованных условиях. Во-первых, тестирование Лаеннека проводили на популяции синхронизированных зрелых C. elegans стадии L4, развивающихся одновременно из одной кладки яиц C. elegans. Во-вторых, возможности получения смешанной популяции червей избегали посредством ингибирования репродуктивной функции добавлением реактива FUDR (фтордезоксиуридин) в инкубационную среду.
 Эксперименты проводились в формате 96-луночного планшета (объем 150 мкл/лунка) при температуре +20°С в климатической камере Binder (Германия), помещенной в стерильные условия ламинара FastFlow (Италия). Планшет покрывали защитной пленкой во избежание испарения жидкой питательной среды. Пленку с планшета снимали один раз в неделю для обеспечения доступа кислорода к C. elegans. В качестве пищи C. elegans использовали бактерии Escherichia coli (E. coli) PO-50, которые вносились однократно (в начале эксперимента). Наблюдения проводили под микроскопом в течение 30 дней с периодичностью 3 р/нед. Отмечались изменения подвижности, размера тела C. elegans, а также в культуральной среде обитания C. elegans. Критерием нежизнеспособности (смерти) C. elegans считали полное отсутствие двигательной активности при воздействии на них ярким пучком света. Эксперимент считали законченным при полном отсутствии единичного живого червя в популяции контрольных червей. В ходе мониторинга эксперимента велась фотосъемка изменений, наблюдаемых у C. elegans и в культуральной среде. В качестве контроля использовали C. elegans, которые инкубировались в тех же условиях, но в отсутствие Лаеннека.
Эксперименты проводились в формате 96-луночного планшета (объем 150 мкл/лунка) при температуре +20°С в климатической камере Binder (Германия), помещенной в стерильные условия ламинара FastFlow (Италия). Планшет покрывали защитной пленкой во избежание испарения жидкой питательной среды. Пленку с планшета снимали один раз в неделю для обеспечения доступа кислорода к C. elegans. В качестве пищи C. elegans использовали бактерии Escherichia coli (E. coli) PO-50, которые вносились однократно (в начале эксперимента). Наблюдения проводили под микроскопом в течение 30 дней с периодичностью 3 р/нед. Отмечались изменения подвижности, размера тела C. elegans, а также в культуральной среде обитания C. elegans. Критерием нежизнеспособности (смерти) C. elegans считали полное отсутствие двигательной активности при воздействии на них ярким пучком света. Эксперимент считали законченным при полном отсутствии единичного живого червя в популяции контрольных червей. В ходе мониторинга эксперимента велась фотосъемка изменений, наблюдаемых у C. elegans и в культуральной среде. В качестве контроля использовали C. elegans, которые инкубировались в тех же условиях, но в отсутствие Лаеннека.
Моделирование теплового стресса
После инкубации С. elegans в присутствии препарата Лаеннек (7 сут при t=20°С) проводили подсчет числа живых C. elegans, а затем доводили температуру до 35оС. Через 8 ч проводили подсчет числа живых C. elegans и продолжали инкубацию, контролируя количество живых червей в контроле. При достижении 100% смертности контрольных червей эксперимент останавливался (типично – через 24 ч).
 Моделирование оксидативного и токсического стресса
Моделирование оксидативного и токсического стресса
В исследованиях использовали два индуктора оксидативного стресса – перекись водорода в концентрациях 100 мкМ и 10 мМ и гербицид Паракват в концентрации 100 мМ. Паракват характеризуется тем, что индуцирует оксидативный и токсический стресс, поэтому широко используется при изучении механизмов оксидативного стресса [3]. Влияние препарата Лаеннек на способность увеличивать устойчивость C. elegans к оксидативному стрессу проверяли в присутствии 100 мМ Параквата. После 7 сут инкубации С. elegans с препаратом Лаеннек в различных разведениях в каждую ячейку 96-луночного планшета добавляли 15 мкл 1 М раствора Параквата к 150 мкл среды, так что конечная концентрация Параквата в каждой ячейке составила 100 мМ. Мониторинг и подсчет выживаемости C. elegans проводили 2 р/сут в первые 4 дня, далее каждые 2 дня в течение 14 дней до полного окончания эксперимента.
Аналогичным образом приготовлялись растворы перекиси водорода. В экспериментах использовалась 38% Н2О2 (категория чистоты – «техническая»). Проводили две серии экспериментов в присутствии рабочих концентраций Н2О2 100 мкМ и 10 мМ. В качестве позитивного контроля использовали геропротектор метформин в концентрации 10 мкМ.
Критерием оценки устойчивости к стрессу являлась продолжительность жизни популяции C. elegans в различных условиях (при стрессе, при добавлении Лаеннека и др.). В контрольной группе C. elegans инкубировались в тех же условиях, что и нематоды опытной группы, но без добавления Лаеннека.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наблюдения позволили установить качественные особенности двигательной активности и общего состояния C. elegans, характерные для действия Лаеннека. Во-первых, при всех исследованных разведениях Лаеннека отмечена исключительная подвижность опытных групп C. elegans по сравнению с контролем. Отмечались движения с резким выбросом тела из положения сложенного кольца в прямую линию. Такая двигательная активность (не характерная, отметим, для других тестируемых соединений) отмечалась даже после 30 сут инкубации с Лаеннеком. Во-вторых, в среде, в которую был добавлен Лаеннек, отмечено отчуждение C. elegans от пищи (E. coli) в течение первых 5–7 дней, выражающееся в том, что животные сбивали еду к центру и двигались по краям ячейки. После 5–7 дней поведение C. elegans нормализовалось, и наблюдалось равномерное распределение особей среди ячейки. В третьих, наблюдалось увеличение тела нематод уже в течение первых 3–5 дней инкубации, что, вероятно, указывает на ценность Лаеннека как важного источника эссенциальных микронутриентов и аминокислот для жизнеобеспечения C. elegans.
Продолжительность жизни C. elegans в зависимости от разведения Лаеннека
Результаты продемонстрировали увеличение продолжительности жизни C. elegans на 92% в присутствии Лаеннека. Полная активность и жизнеспособность наблюдались у 95–98% популяции C. elegans в течение 16 дней, после чего отмечено плавное сокращение популяции. В то же время в контрольной группе уже на 4-й день эксперимента длительность жизни резко (на 20%) сократилась и составила в среднем всего 15 дней.

Популяция жизнеспособных C. elegans, инкубируемых в присутствии Лаеннека, более чем в 2 раза превосходила популяцию контрольных C. elegans к концу эксперимента. Продолжительность жизни C. elegans в популяции также существенно увеличивалась. Так, в контрольной группе к 17-м суткам эксперимента 50% популяции погибало. В то же время при выращивании C. elegans в присутствии Лаеннека 50% популяции сохранялось не до 17, а до 30 сут эксперимента (рис. 2). При этом двигательная активность C. elegans в присутствии Лаеннека значительно превосходила подвижность контрольных червей.
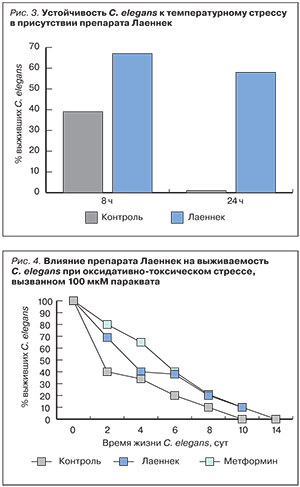
Устойчивость C. elegans к тепловому стрессу в присутствии Лаеннека
После 8-часовой инкубации при повышенной температуре 35°С выживаемость популяций C. elegans в присутствии Лаеннека на 27% превышала таковую популяции контрольных C. elegans (рис. 3). После 24-часовой инкубации контрольные C. elegans умерли, в то время как 59% популяции C. elegans в присутствии Лаеннека оставались живыми.
Устойчивость С. еlegans к действию оксидативно-токсического агента Параквата
Как известно, Паракват является индуктором образования активных форм кислорода (АФК) в клетках, поэтому широко используется при изучении механизмов оксидативного стресса [3]. Во всем диапазоне тестируемых разведений препарат Лаеннек повышал устойчивость C. elegans к оксидативно-токсическому стрессу, индуцированному присутствием 100 мМ Параквата (рис. 4).
 Заметим, что при добавлении «золотого стандарта препарата с доказанным действием продления жизни» метформина в концентрации, обладающей максимальной эффективностью для C. elegans в плане продления жизни, средняя продолжительность жизни нематод увеличивалась всего в 2 раза.
Заметим, что при добавлении «золотого стандарта препарата с доказанным действием продления жизни» метформина в концентрации, обладающей максимальной эффективностью для C. elegans в плане продления жизни, средняя продолжительность жизни нематод увеличивалась всего в 2 раза.
Устойчивость С. еlegans к прооксидантному действию перекиси водорода
Перекись водорода (H2O2, структурная формула – HO-OH) относится к числу АФК (к их числу также относятся ионы кислорода, свободные радикалы и перекиси), повышение внутриклеточных концентраций которых вызывает оксидативный стресс. Связь O–O непрочна, поэтому H2O2 – весьма неустойчивое соединение, самопроизвольно распадающееся на молекулу H2O и кислородный радикал, который наносит существенный ущерб белкам, ДНК и другим молекулярным компонентам клеток.
В настоящей работе было оценено действие Лаеннека на устойчивость С. еlegans к действию H2O2. Перекись водорода даже в концентрации 100 мкМ весьма агрессивна по отношению к С. еlegans: уже после 1,5-часовой экспозиции H2O2 погибает более 40% популяции нематод. При добавлении перекиси водорода в реакционную среду культивирования С. еlegans как в присутствии Лаеннека, так и в контрольных образцах, наблюдалось резкое газообразование и вспенивание раствора. При этом С. еlegans начинали очень энергично двигаться. Добавление перекиси водорода в концентрации 100 мкМ не вызывало видимых морфологических изменений С. еlegans, включая нарушения целостности кожных покровов, на всем протяжении эксперимента (14 сут). Однако с момента внесения H2O2 в среду и до окончания наблюдений отмечено потемнение внутренних органов нематод. Внесение Лаеннека, напротив, предотвращало эти изменения (рис. 5) и способствовало нормализации двигательной активности С. еlegans. Отмечено достоверное увеличение выживаемости С. еlegans, начиная с 4 сут эксперимента (рис. 6). Препарат Лаеннек увеличивал продолжительность жизни С. еlegans в среднем на 25% (рис. 7).
Подтвержденное в настоящей работе антиоксидантное и геропротекторное действие Лаеннека может быть обусловлено теми же молекулярно-физиологическими механизмами действия ГПЧ, которые обуславливают ускоренную регенерацию тканей. Использование ГПЧ для ускорения процессов регенерации тканей (например, ранозаживления) основано на трофическом, противовоспалительном и антитромботическом эффектах, которые способствуют значительному сокращению размера раны, индекса тяжести ее состояния, уменьшению среднего числа дней, необходимых для полного заживления, значительному приросту эластичности рубца и его прочности на растяжение [4].
 Важным компонентом регенеративного действия ГПЧ является противовоспалительный эффект, т.к. именно воспаление провоцируется действием АФК. В эксперименте введение препарата стандартизированного ГПЧ Лаеннек внутривенно достоверно снижало уровни фактора некроза опухоли α (ФНО- α) и фермента синтеза простагландинов циклооксигеназы-2 при избыточно повышенных уровнях/активности этих белков [5].
Важным компонентом регенеративного действия ГПЧ является противовоспалительный эффект, т.к. именно воспаление провоцируется действием АФК. В эксперименте введение препарата стандартизированного ГПЧ Лаеннек внутривенно достоверно снижало уровни фактора некроза опухоли α (ФНО- α) и фермента синтеза простагландинов циклооксигеназы-2 при избыточно повышенных уровнях/активности этих белков [5].
Регенеративный, противовоспалительный и противоболевой эффекты ГПЧ обусловлены компонентами его пептидного состава. В частности, в состав препарата Лаеннек входит противовоспалительный дипептид JBP485 (цикло-транс-4-гидроксипролилсерин), который снижает уровни секреции и ФНО-α и проявляет антиапоптотический эффект (снижение уровня и активности каспазы-3 – фермента-активатора апоптоза клеток [6]).
В состав Лаеннека также входят пептидные фрагменты ИФР-1, факторов роста фибробластов (ФРФ), фактора роста гепатоцитов, активный пептид нейромедина N и фрагмент активного пептида кокальцигенина [7]. ИФР-1 осуществляет эндокринную, аутокринную и паракринную регуляцию процессов роста, развития и дифференцировки клеток и тканей организма. ИФР-1 продуцируется гепатоцитами печени в ответ на стимуляцию их соматотропиновых рецепторов и способствует реализации физиологического воздействия соматотропного гормона. Подавление сигнального механизма, опосредованного инсулином и ИФР-1, влияет на продолжительность жизни посредством изменения экспрессии генов, кодирующих ряд факторов транскрипции (в том числе DAF-16, FOXO, HSF-1 и SKN-1). Эти факторы, в свою очередь, стимулируют или подавляют экспрессию других генов, в том числе участвующих в развитии стресс-реакций, обеспечивающих механизмы аутофагии (переработки дефектных фрагментов клетки для синтеза новых органелл), а также кодирующих антимикробные пептиды, белки-шапероны, апо-липопротеины, липазы и ионные каналы. Кумулятивным эффектом происходящих при этом изменений и является увеличение продолжительности жизни. Возможно, подавление опосредуемого инсулином и ИФР-1 сигнального механизма и повышение активности белков-аналогов DAF-16 (FOXO) запускает замедляющий старение сдвиг физиологических процессов в сторону защиты и поддержания жизнедеятельности клеток. ИФР-1 синергичен с инсулином и соматотропином по отношению к процессам роста и развития тканей. ИФР-1 связывается с одноименным рецептором, который был найден во многих тканях. При связывании ИФР-1 тирозинкиназный домен его рецептора активируется и, в свою очередь, инициирует передачу внутриклеточного сигнала по каскаду AKT (протеинкиназы В), стимулирующему рост и воспроизводство тканей, в частности скелетных мышц, соединительной ткани, печени, почек, нервов, кожи и легких.
Для регенерации любых тканей наиболее важна активность ФРФ, которые индуцируют клеточное деление фибробластов, хондроцитов, остеоцитов и других видов клеток соединительной ткани. Связываясь с одноименными рецепторами, ФРФ активируют несколько путей передачи сигнала, в том числе с участием таких широко известных сигнальных белков, как Mg-зависимые митоген-активируемые протеинкиназы, ERK (внеклеточно регулируемые киназы), фосфатидилинозитол-3-киназы, фосфолипаза-C-γ, JNK (Jun-N-терминальная киназа) и протеинкиназа-С. Активация рецепторов вызывает фосфорилирование определенного тирозинового остатка белка FRS2, который затем взаимодействует с сигнальными белками Grb2, SOS, GAB1 и др. [1].
Входящий в состав препарата Лаеннек пептид с аминокислотной последовательностью KIPYI, соответствующей биологически активному пептиду нейромедина N, активирует внутриклеточные пути выживания клетки (в частности, сигнальный каскад внеклеточно-регулируемых ERK-1 и -2), что снижает уровни и активность проапоптотического белка JNK и, следовательно, тормозит гибель клеток организма вследствие воздействия оксидативного и других видов стресса. В Лаеннек входит фрагмент активного пептида кокальцигенина с аминокислотной последовательностью QKRAC [7], который также усиливает регенерацию тканей [8] и снижает уровни провоспалительного белка ФНО-α [9].
В состав Лаеннека входит дегидроэпиандростерон (ДГЭА) – естественный метаболит надпочечников, обладающий рядом важных биологических свойств. Его продукция с возрастом уменьшается [12], что послужило поводом к широкому изучению геропротекторной активности ДГЭА. Было установлено, что ДГЭА угнетает синтез ДНК и образование супероксидов в тканях организма, снижает массу тела, обладает антиатерогенным, антидиабетическим и антиаутоиммунным действием [12].
ЗАКЛЮЧЕНИЕ
Cегодня очевидно, что дальнейший прогресс современной профилактической медицины невозможен без принципиального изменения подхода к охране здоровья и увеличению продолжительности жизни человека. В условиях бурной индустриализации, урбанизации и нарастающего загрязнения окружающей среды можно надеяться лишь на частичное ослабление неблагоприятного воздействия этих факторов на организм. В реализации концепции «здорового старения», или «благополучного старения», рассматриваемой экспертами ООН как один из основных приоритетов «Программы научных исследований по проблемам старения в XXI веке», важное значение придается изменению «стиля жизни» человека, что уже в наше время может способствовать снижению заболеваемости и, следовательно, увеличению продолжительности жизни [11]. Можно надеяться, что применение воздействий, нормализующих возрастные гормонально-метаболические и иммунологические изменения и тем самым замедляющих реализацию генетической программы старения (уменьшающих темп, скорость старения, а не отодвигающих его начало), окажет значимый геропротекторный эффект. Препарат, препятствующий воздействию повреждающих агентов, – ГПЧ Лаеннек может оказаться важным средством профилактики преждевременного старения в условиях повышенного риска влияния на организм неблагоприятных условий внешней среды.
Отправными точками для оценки геропротекторного потенциала любого препарата являются тесты на маркеры старения (проводимые на клетках человека в культуре) и исследования на животных. В частности, влияние препаратов на продолжительность жизни отдельных особей и популяции в целом удобно оценивать на одном из простейших модельных организмов – свободноживущих нематодах C. elegans. Существенное удлинение жизни нематод (на 50% и более) под воздействием препарата указывает на его перспективность как геропротектора.
В настоящей работе проведено изучение геропротекторного потенциала препарата Лаеннек на модельном организме C. elegans в условиях теплового, токсико-оксидативного и оксидативного стресса:
- в условиях теплового стресса выживание под действием Лаеннека повышалось на 27%;
- в условиях токсико-оксидативного стресса выживание под действием Лаеннека повышалось в 4 раза;
- показано, что в условиях отсутствия стресса добавление Лаеннека увеличивало продолжительность жизни C. elegans на 92% (29 сут) по сравнению с контролем (15 сут).
Приведенные выше данные позволяют рассматривать применение препарата ГПЧ Лаеннек в качестве перспективного средства для профилактики ассоциированной с возрастом патологии, а также в качестве геропротектора.



