Акромегалия – это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией соматотропного гормона (СТГ) у лиц с законченным физиологическим ростом и характеризующееся патологическим диспропорциональным периостальным ростом костей, хрящей, мягких тканей, внутренних органов, а также нарушением морфофункционального состояния сердечно-сосудистой и легочной систем, периферических эндокринных желез, различных видов метаболизма. Наиболее часто акромегалией заболевают между 20 и 40 годами, но иногда наблюдается ее возникновение и в возрасте старше 50 лет [1]. По данным различных регистров, женщины болеют в 2 раза чаще по сравнению с мужчинами [2].
В подавляющем большинстве случаев (95–98%) причиной заболевания является аденома гипофиза, бесконтрольно продуцирующая СТГ, либо СТГ и пролактин [1, 3]. Последние эпидемиологические исследования показали, что распространенность акромегалии при активном скрининге составила от 125 до 295 случаев на 1 млн населения против 50–70 случаев согласно предшествующим данным [4, 5]. Точно оценить распространенность акромегалии и соматотропином достаточно сложно в связи с тем, что время от появления первых их признаков до установления точного диагноза колеблется от 5 до 15 лет [1, 6, 7]. Такой длительный промежуток времени до установления диагноза объясняется медленным развитием заболевания и широким многообразием клинической картины. Характерные для акромегалии изменения внешности также формируются годами, а в ряде случаев вообще могут не наблюдаться. Постепенное развитие симптоматики проводит к тому, что акромегалия впервые диагностируется в достаточно зрелом возрасте (в среднем около 40 лет). По самым скромным предварительным расчетам пока еще неполной российской базы пациентов с акромегалией, это заболевание встречается с частотой 30 случаев на 1 млн жителей России [1]. Фактическая распространенность акромегалии может значимо превышать указанные значения.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ АКРОМЕГАЛИИ
Клинические проявления акромегалии обусловлены эффектами избыточной продукции СТГ и ИРФ-1 (инсулиноподобного ростового фактора, который синтезируется в печени под действием СТГ) и сдавлением соматотропиномой окружающих гипофиз структур. По данным федеральных и международных клинических рекомендаций, обследование для диагностики акромегалии следует проводить при сочетании ≥2 из следующих симптомов:
- сахарный диабет (СД) / нарушенная толерантность к глюкозе;
- боли в суставах;
- карпальный туннельный синдром (или синдром запястного канала);
- прогрессирование выраженности неправильного прикуса;
- артериальная гипертензия;
- гипертрофия левого желудочка, аритмии, систолическая/диастолическая дисфункция;
- синдром апноэ сна (храп с нарушением дыхания);
- полипы толстой кишки;
- избыточная потливость;
- нарушение зрения;
- головная боль;
- слабость, утомляемость.
Избыток СТГ способствует развитию инсулинорезистентности как периферических тканей, так и ткани печени, в связи с чем при акромегалии наблюдаются гиперинсулинемия и повышенный глюконеогенез, ведущие к развитию СД. По разным данным отечественных и зарубежных исследователей, распространенность нарушений углеводного обмена (СД и нарушенной толерантности к глюкозе) среди больных акромегалией суммарно составляет от 15 до 50% [8, 9].
Эффекты СТГ и ИРФ-1 на костную и хрящевую ткань приводят к формированию гипертрофической остеоартропатии, которая проявляется выраженным болевым синдромом, усиливающимся при физической активности. По данным Z. Killinger и соавт., артропатия поражает примерно 75% больных акромегалией и является ведущей причиной инвалидизации этих пациентов [10]. Один из недавних метаанализов показал, что более высокий уровень костного обмена у больных акромегалией ассоциирован с большей частотой переломов позвонков по сравнению с группой контроля [11]. Примерно у 25–51% пациентов по мере прогрессирования заболевания наблюдается синдром карпального канала [1], который проявляется парестезиями кистей рук за счет сдавления срединного нерва гиперплазированными и отечными мягкими тканями и костными образованиями.
Влияние СТГ и ИРФ-1 на костную ткань также приводит к таким характерным изменениям внешности, как увеличение надбровных дуг, скуловых костей, нижней челюсти, утолщение пальцев («сигарообразные» пальцы), увеличение размеров кистей и стоп. Прогрессирующее увеличение нижней челюсти ведет к изменению прикуса с формированием прогнатизма и расширением межзубных промежутков (диастема). Утолщение голосовых связок и расширение воздухоносных пазух черепа ведет к появлению низкого грубого голоса. Характерно утолщение кожных покровов, могут наблюдаться распространенный папилломатоз, появление складок на коже, утолщение языка. Как упоминалось выше, несмотря на характерные изменения внешности, в связи с их постепенным развитием сами пациенты и их родственники крайне редко обращают внимание на эти симптомы. При акромегалоидном типе внешности рекомендуется просмотреть фотографии пациента за несколько предшествующих лет, узнать, не менял ли он размер обуви или обручального кольца в течение жизни, что поможет выявить наличие указанных изменений.
До 50% больных акромегалией имеют артериальную гипертензию, которая является основным отрицательным прогностическим фактором смертности [12]. Важно, что формирование артериальной гипертензии не всегда зависит от длительности заболевания, и она может встречаться на самых ранних стадиях заболевания. Развитие гипертензии при акромегалии обусловлено как прямым влиянием СТ и ИРФ-1 на сосудистую стенку, способствующим увеличению сосудистого тонуса и повышению диастолического давления, так задержкой натрия и воды в организме, снижением продукции предсердного натрийуретического пептида, инсулинорезистентностью [13, 14]. Для акромегалии характерно развитие концентрической бивентрикулярной гипертрофии миокарда. С прогрессированием заболевания концентрическая гипертрофия сменяется интерстициальным ремоделированием миокарда за счет пролиферации фиброзной ткани с последующим формированием дилатационной миокардиодистрофии и развитием постепенно прогрессирующей сердечной недостаточности. Нарушения сердечного ритма у больных акромегалией наблюдается в 48% случаев [15]. Встречаются такие нарушения ритма, как фибрилляция предсердий, наджелудочковая тахикардия и желудочковая аритмия. В 30–60% случаев причиной смерти больных акромегалией являются кардиоваскулярные нарушения [16]. Поэтому важно помнить, что кардиомиопатия при акромегалии может полностью или частично регрессировать при своевременном начале терапии и нормализации секреции СТГ и ИРФ-1 [12].
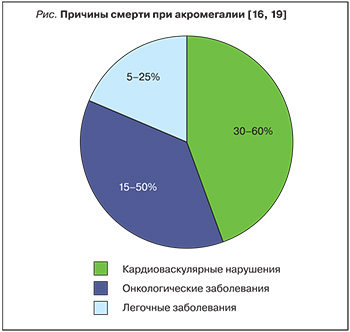 Обструктивное апноэ во сне встречается почти в 60% случаев акромегалии, и с ним связывают до 25% смертности пациентов (рисунок) [17]. Нарушениям дыхания способствуют деформация лицевого скелета, макроглоссия, увеличение толщины мягких тканей гортани и бронхов. У части пациентов наблюдается апноэ центрального генеза, которое связывают с нарушением работы дыхательного центра и повышением порога чувствительности для диоксида углерода.
Обструктивное апноэ во сне встречается почти в 60% случаев акромегалии, и с ним связывают до 25% смертности пациентов (рисунок) [17]. Нарушениям дыхания способствуют деформация лицевого скелета, макроглоссия, увеличение толщины мягких тканей гортани и бронхов. У части пациентов наблюдается апноэ центрального генеза, которое связывают с нарушением работы дыхательного центра и повышением порога чувствительности для диоксида углерода.
Новообразования толстой кишки у больных акромегалией, по различным данным, встречаются до 2–3 раз чаще, чем в общей популяции [1]. По данным О.В. Олейник и соавт., полипы толстой кишки встречались у 37% пациентов, у подавляющего большинства которых наблюдались их доброкачественные формы (аденоматозные и гиперпластические) [18]. Однако к настоящему времени показано, что у пациентов в активной стадии акромегалии увеличивается частота колоректального рака, причем на фоне достижения контроля над заболеванием этот показатель соотносится с общепопуляционным уровнем [19]. Таким образом, всем пациентам при установке диагноза акромегалии рекомендуется проведение колоноскопии [1]. В 30–70% случаев акромегалии наблюдается увеличение щитовидной железы с узлообразованием или без него. В большинстве случаев сохраняется эутиреоз [20].
Довольно характерной жалобой пациентов при акромегалии является повышенная потливость, которая связана с перераспределением внутри- и внеклеточной жидкости в гипертрофированных тканях и повышенной активностью потовых и сальных желез, что также ведет к появлению жирной себореи, акне и специфического неприятного запаха тела.
По данным Е.Г. Старостиной и соавт., психические расстройства были диагностированы у 79,1% из 115 больных акромегалией, а более чем у трети пациентов выявили более одного коморбидного психического нарушения. Распространенность расстройств шизофренического круга (5,2%) у больных акромегалией также многократно превышало популяционную, что авторы связывают с вовлечением дофаминергических структур в патогенез заболевания [21]. Таким образом, к настоящему времени появляются данные о прямой связи акромегалии и развитием психических нарушений.
Как указывалось выше, в большинстве случаев развитие акромегалии обусловлено аденомой гипофиза, бесконтрольно продуцирующей СТГ. Если соматотропинома распространяется за пределы турецкого седла, может происходить сдавление окружающих структур головного мозга, так называемый масс-эффект опухоли. В случае сдавления перекреста зрительных нервов отмечается нарушение зрения (сужение полей зрения, появление скотом), при осмотре глазного дна могут наблюдаться признаки атрофии диска зрительного нерва. Значительное распространение опухоли латерально в кавернозные синусы может привести к парезу черепно-мозговых нервов (III, IV, V и VI пар), что клинически проявляется офтальмоплегией, птозом, дисфункцией зрачков, болями по ходу тройничного нерва, снижением рефлексов. Всем пациентам с акромегалией показано проведение офтальмологического обследования. Сдавление здоровой ткани аденогифиза ведет к нарушению функции других его клеток (гонадотрофов, кортикотрофов и тиреотрофов). У женщин могут возникать нарушения менструального цикла, бесплодие. У части больных наблюдается лакторея, обусловленная гиперпролактинемией. Повышение уровня пролактина может развиваться в случае формирования смешанной аденомы гипофиза, продуцирующей не только СТГ, но и пролактин (соматопролактинома), или нарушением поступления в переднюю долю гипофиза регулятора секреции пролактина (дофамина). При росте опухоли в сторону диафрагмы турецкого седла характерно повышение внутричерепного давления, которое в ряде случаев может обусловливать развитие головной боли, имеющей упорный характер. Однако истинная причина возникновения упорной головной боли у больных акромегалией остается неизвестной.
СКРИНИНГ И ДИАГНОСТИКА АКРОМЕГАЛИИ
В случае выявления ≥2 выше описанных симптомов рекомендуется провести исследование уровня ИРФ-1 в крови. Анализ уровня СТГ нецелесообразен, так как гормон роста имеет большую вариабельность секреции в течение суток, которая значимо меняется на фоне множества различных факторов и характеризуется коротким периодом полужизни. Концентрация ИРФ-1 в сыворотке крови подвергается циркадным изменениям в значительно меньшей степени, при этом отражает интегрированную секрецию СТГ и может измеряться в любое время суток. К настоящему времени это наилучший маркер для скрининга акромегалии. При оценке показателя ИРФ-1 необходимо учитывать, что снижают содержание этого фактора системные заболевания и состояния, сопровождающиеся повышенным катаболизмом (ВИЧ-инфекция, обширные ожоги, хирургические вмешательства), печеночная и почечная недостаточность, голодание, СД, гипотиреоз, прием некоторых препаратов (например, высоких доз эстрогенов). Повышение концентрации ИРФ-1 наблюдается на фоне беременности, гиперинсулинемии, гиперандрогении, избытка тиреоидных гормонов, глюкокортикоидов. У больных СД определение уровня ИРФ-1 более информативно на фоне компенсации углеводного обмена.
В случае повышения уровня ИРФ-1 с целью окончательного подтверждения диагноза акромегалии необходимо проведение теста с нагрузкой 75 г безводной глюкозы с определением уровня СТГ исходно и через 30, 60, 90 и 120 мин после нагрузки. В норме хотя бы в одной «временной точке» наблюдается уровень СТГ <1 нг/ мл (при высокочувствительном методе определения СТГ <0,4 мкг/л). У больных акромегалией на фоне нагрузки глюкозой такого подавления секреции СТГ не возникает даже при исходной концентрации СТГ в пределах референсных значений. В 15–20% случаев может наблюдаться парадоксальное повышение секреции СТГ, что также подтверждает диагноз акромегалии.
После лабораторного подтверждения хронической гиперсекреции СТГ необходимо проведение магнитно-резонансной томаграфии (МРТ) гипофиза, при которой примерно у 25% больных акромегалией выявляются микроаденомы гипофиза (диаметром до 10 мм), а у 75% больных – макроаденомы (диаметром более 10 мм) [4, 22].
ЛЕЧЕНИЕ АКРОМЕГАЛИИ
Целями лечения акромегалии (критериями ремиссии) являются:
- нормализация уровня ИРФ-1 соответственно полу и возрасту пациента, достижение среднесуточной концентрации СТГ ≤2нг/мл (≤1мкг/л при высокочувствительном методе определения), подавление уровня СТГ на фоне глюкозотолерантного теста <1 нг/мл (<0,4 мкг/л при высокочувствительном методе определения) для регресса клинических проявлений, снижения частоты осложнений и увеличения продолжительности жизни больных [9, 23, 24];
- удаление аденомы гипофиза и/или предотвращение ее дальнейшего роста (для устранения/профилактики симптомов, связанных с масс-эффектом опухоли).
Методами лечения соматотропином являются хирургический, медикаментозный и лучевой. В настоящее время методом выбора признана нейрохирургичская операция – транссфеноидальная аденомэктомия [1, 9, 23, 24]. Эффективность нейрохирургического лечения зависит от квалификации нейрохирурга и особенностей роста опухоли гипофиза. По разным данным, достижение целевых значений уровней СТГ и ИРФ-1 после нейрохирургического лечения в специализированном учреждении наблюдается примерно у 50% прооперированных больных (у 70–85% пациентов с соматотропиномами, располагающимися в пределах турецкого седла, и лишь у 10–40% больных с аденомами гипофиза, имеющих экспансивный рост за пределы турецкого седла) [24, 25]. Рецидив акромегалии в течение 5 лет после проведенной операции развивается примерно у 2–8% больных. Только инвазия соматотропиномы в кавернозный синус может прогнозировать неоперабельность опухоли [3]. Однако и в этом случае может быть предложено оперативное лечение с целью уменьшения размеров опухоли и улучшения ответа на медикаментозную или лучевую терапию. При симптомах компрессии перекреста зрительных нервов проведение операции показано в кратчайшие сроки [1].
Оперативное лечение может быть достаточно эффективным и при повторном его проведении у пациентов, не достигших ремиссии заболевания после первой операции. Согласно одному из недавних исследований, у 8 из 14 пациентов после повторного хирургического вмешательства удалось достичь целевых значений СТГ и ИРФ-1 [26].
После проведения транссфеноидальной аденомэктомии окончательная оценка клинико-лабораторной ремиссии проводится через 6 мес после операции, показано определение уровня ИРФ-1 сыворотки крови и проведение МРТ гипофиза, по результатам которых решается вопрос о дальнейшей тактике ведения. В более ранние сроки (на 6–12 нед после операции) необходимо исключить послеоперационный гипопитуитаризм (контроль гормонов щитовидной железы, половых гормонов, оценка функции надпочечников) и контролировать осмоляльность крови и мочи в случае развития центрального несахарного диабета.
В качестве медикаментозной терапии могут применяться аналоги соматостатина (АС), агонисты рецепторов дофамина и антагонисты рецепторов СТГ. Препаратами первой линии являются пролонгированные АС.
Соматостатин – гормон гипоталамуса, который подавляет секрецию СТГ и контролирует пролиферацию соматотрофов. В настоящее время доступны две формы АС длительного действия – октреотид и ланреотид, которые обладают всеми эффектами соматостатина, но медленнее метаболизируются. Препараты адаптированы для глубокого внутримышечного или подкожного введения.
Основным показанием к назначению АС является сохранение активности акромегалии в исходе хирургического вмешательства. Также применение медикаментозной терапии должно рассматриваться:
- как альтернатива хирургическому лечению при низкой вероятности его эффективности (например, при инвазии в кавернозный синус);
- в качестве подготовки к оперативному лечению для уменьшения размеров аденомы и улучшения гормональных показателей;
- если операция противопоказана или ее проведение отложено из-за сопутствующих заболеваний пациента;
- в период до наступления максимального эффекта после проведения сеанса лучевой терапии [1].
По данным различных авторов, на фоне медикаментозной терапии АС длительное достижение целевых значений СТГ и ИРФ-1 наблюдается у 17–66% больных, получающих как первичную терапию, так и терапию после проведенного оперативного лечения [8, 27–29]. По данным А. Giustina и соавт., у 59% пациентов, получающих терапию АС, наблюдалось уменьшение объема опухоли более чем на 50% [30]. Возможными побочными эффектами терапии АС являются:
- симптомы со стороны желудочно-кишечного тракта (диарея, запоры, метеоризм);
- симптомы со стороны гепатобилиарной системы (расширение желчных протоков; образование камней желчного пузыря);
- выпадение волос;
- брадикардия;
- нарушения углеводного обмена (как правило, не являются клинически значимыми и не требуют отмены препарата).
Октреотид длительного действия выпускают в дозах 10, 20, 30 или 40 мг – Сандостатин ЛАР (оригинальный препарат, Novartis, Швейцария), Октреотид-лонг (Ф-Синтез, Россия), Октреотид-депо (Фармсинтез, Россия). Препарат разводится непосредственно перед инъекцией, имеет определенные технические особенности введения, выполнение инъекции обычно требует участия специально обученного медицинского персонала. Назначают глубокие внутримышечные инъекции препарата с периодичностью 1 раз в 4 нед для поддержания стабильной терапевтической концентрации в крови.
Ланреотид пролонгированного действия, или Соматулин® Аутожель® (оригинальный препарат, Ipsen, Франция), зарегистрирован в дозах 60, 90 и 120 мг 1 раз в 28 дней в форме водорастворимого геля пролонгированного действия в уже готовом для глубокого подкожного введения шприце. При достижении целевых гормональных показателей препарат может назначаться в дозе 120 мг 1 раз в 56 дней.
В многоцентровом международном проспективном исследовании PRIMARYS было продемонстрировано быстрое и стойкое уменьшение объема опухоли на 20% на 48 нед лечения у 62,96% больных, получавших ланреотид, а также быстрое, уже к 12 нед лечения, и устойчивое снижение уровней ГР и ИРФ-I на 71 и 57% соответственно [33]. Кроме того, пациенты заметили улучшение самочувствия и регресс клинических проявлений акромегалии. Симптомы акромегалии и качество жизни, связанное со здоровьем, значительно улучшались с 12 до 48 нед лечения [34]. По данным опросника, выраженность физических симптомов в конце исследования не различалась у пациентов с контролируемой и неконтролируемой акромегалией, в то время как общие показатели и психологические симптомы были лучше у больных с контролируемым заболеванием [34]. В post-hoc анализе исследования PRIMARYS авторами было рассмотрено влияние ланреотида на углеводный и липидный обмен. Согласно современным представлениям АС, обладая контринсулярным действием и подавляя секрецию инсулина, могут оказывать незначительный неблагоприятный эффект на метаболизм глюкозы [35]. Так, например, в одной из российских публикаций, посвященной механизмам нарушения углеводного обмена у пациенток с акромегалией, нарушение гликемического профиля, в частности развитие сахарного диабета, было отмечено у 30% пациентов при приеме октреотида (Октреотид-лонг ФС®) [36]. Тем не менее анализ данных гликемического и липидного профиля в исследовании PRIMARYS говорит о том, ланреотид не оказывает неблагоприятного действия на углеводный обмен. Напротив, у пациентов с подтвержденным на начало исследования сахарным диабетом достоверно снижался уровень HbA1c (-1,44% (ДИ 95%:-2,52;-0,36)), при этом среди пациентов с нормальным гликемическим профилем показатели гликированного гемоглобина практически не менялись. Также в общей группе пациентов и у пациентов без диабета достоверно снижался уровень триглицеридов на 0,2 и 0,17 ммоль/л соответственно (ДИ 95%) и повышался уровень ЛПВП на 0,2 и 0,22 ммоль/л соответственно (ДИ 95%) [37].
Терапия октреотидом короткого действия может быть применена в предоперационном периоде (с целью возможного регресса симптомов акромегалии и уменьшения объема аденомы, прогнозирования чувствительности пациента к лечению АС в дальнейшем).
Дозу соматостатина пролонгированного действия титруют по уровню ИРФ-1. Если не удается достичь целевых показателей СТГ и ИРФ-1, рекомендуется смена АС.
Реже пациентам с умеренным повышением уровня ИРФ-1 и стертыми клиническими признаками акромегалии в качестве первой линии терапии могут быть назначены агонисты дофамина (бромкриптин, каберголин) в виде монотерапии или в комбинации с АС.
В случае резистентности к терапии перечисленными АС в качестве метода лечения рассматриваются:
- антагонист рецепторов гормона роста (Пегвисомант);
- мультилигандный АС длительного действия (Пасиреотид ЛАР);
- и/или лучевая терапия.
В настоящее время пегвисомант в Российской Федерации не зарегистрирован.
Пасиреотид ЛАР – это новый АС длительного действия, обладающий высокой аффинностью к большому числу соматостатиновых рецепторов. В клиническом исследовании 3 фазы было показано, что с помощью этого препарата удалось нормализовать ИРФ-1 в 35% случаев. Однако он способствовал развитию гипергликемии у 57% больных [31].
Лучевая терапия может использоваться не только при отсутствии эффекта от оперативного лечения и терапии длительно действующими АС, но и в качестве первой линии при условии абсолютных противопоказаний к проведению аденомэктомии или категорического отказа пациента от операции и непереносимости лекарственной терапии.
Как дополнительный метод лучевая терапия наиболее часто применяется при агрессивных опухолях гипофиза с инвазией в окружающие структуры (кавернозные синусы, височные доли) и в случае неполного удаления аденомы.
Различают традиционную фракционную радиотерапию и стереотаксическую радиохирургию. Предпочтение отдается применению стереотаксической радиохирургии (гамма-нож, кибер-нож, линейный ускоритель), которая дает возможность однократно направить большую дозу узким фокусирующим пучком четко на зону поражения, что значительно уменьшает число осложнений и повышает эффективность этого вида лучевой терапии. Ремиссии можно ожидать в течение от 2 до 15 лет после лечения [32]. Потому пациенты продолжают получать медикаментозную терапию до наступления ремиссии. При этом примерно в 50% случаев через 5–10 лет после сеанса стереотаксической радиохирургии у пациентов развивается гипопитуитаризм [1]. В связи с этим всем больным, перенесшим лучевую терапию, необходим контроль функционального состояния надпочечников, щитовидной железы и половых желез, и при необходимости инициируется заместительная гормональная терапия. У 30–70% больных может развиваться СТГ-недостаточность [1].
Примерно в 2–4% случаев лучевая терапия может приводить к увеличению риска цереброваскулярных заболеваний, зрительным нарушениям, индукции вторичных опухолей головного мозга и радионекрозам. Всем больным после радиохирургии необходимо наблюдение невролога и окулиста [1].
Лучевая терапия противопоказана при близком расположении аденомы (менее 5 мм) к перекресту зрительных нервов, что обусловлено риском развития отека мягких тканей, способного привести к нарушению зрения [1, 3].
Как в случае проведения транссфеноидальной аденомэктомии, так и при назначении медикаментозного метода лечения окончательная оценка клинико-лабораторной ремиссии акромегалии проводится через 6 мес после операции и/или начала лекарственной терапии: показано определение уровня ИРФ-1 в сыворотке крови и проведение МРТ гипофиза, по результатам которых решается вопрос о дальнейшей тактике ведения больных. После хирургического лечения в более ранние сроки (на 6–12 нед) необходимо исключить послеоперационный гипопитуитаризм (контроль гормонов щитовидной железы, половых гормонов, оценка функции надпочечников) и контролировать осмоляльность крови и мочи в случае развития послеоперационного несахарного диабета.
Безусловно, акромегалия является тяжелым инвалидизирующим заболеванием, снижающим качество и продолжительность жизни пациентов. С каждым годом повышается эффективность нейрохирургического лечения, а современные лекарственные средства в большинстве случаев помогают добиться клинико-лабораторной ремиссии акромегалии, что позволяет предотвратить развитие осложнений и снизить смертность, улучшить качество жизни этих пациентов. Но мы сможем достичь наилучших результатов только при условии своевременной диагностики и начале лечения на этапе ранних клинических проявлений, не допуская развития тяжелых необратимых последствий заболевания. Для этого каждому клиницисту необходимо помнить о симптомах акромегалии, методах ранней диагностики заболевания, подходах к лечению и критериях его эффективности.



