Митохондрии – клеточные органеллы, основной функцией которых является обеспечение энергетического и электролитного баланса клетки, т.е. синтез АТФ и поддержание мембранного потенциала. Нарушения функций митохондрий ассоциированы с комплексом негативных последствий для всех типов клеток и приводят к ускоренному старению тканей организма [1, 2].
Ниже представлены результаты анализа пептидного состава препарата Лаеннек, указывающие на молекулярные механизмы его воздействия на функцию митохондрий. В пилотных клинических исследованиях, включавших 240 пациентов в возрасте 20–55 лет с астенией и переутомлением, страдавших стеатогепатитом алкогольного и неалкогольного генеза, вирусным гепатитом С, было показано, что курсовое применение Лаеннека не только устраняло клиническую симптоматику астении, но и способствовало восстановлению энергетического метаболизма митохондрий [3]. Базовый курс терапии Лаеннеком проводили внутривенно, капельно, по 4 мл два раза в неделю в 500 мл 5% глюкозы курсом № 10, при необходимости курс повторяли через 3–6 мес [3].
Препарат Лаеннек получают из плаценты человека методом ферментативного гидролиза [4], позволяющим выделить чрезвычайно сложный состав, включающий многочисленные низкомолекулярные белки, их пептидные фрагменты (в том числе нейропептиды), микроэлементы, витамины, стероиды, липиды и др. [5]. Опубликованные ранее результаты масс-спектрометрического анализа пептидного состава Лаеннека [5] свидетельствуют о наличии в нем более чем 10 000 пептидных фрагментов. Использование стандартного программного обеспечения (программный пакет и сервер MASCOT) позволило установить аминокислотные последовательности всего лишь 47 пептидов. Для получения более подробной информации об аминокислотных последовательностях пептидов Лаеннека (для которых в работе [5] были известны только масса, заряд и время хроматографического удержания) нами был разработан комплекс программ DNVSEQP для проведения секвенирования пептидов аминокислотных последовательностей de novo на основании масс-спектрометрических данных. Указанные программы основаны на применении метрического анализа данных [6] и теории классификации значений признаков [7] к задачам идентификации аминокислотных последовательностей.
Результаты настоящего исследования указывают на то, что положительный эффект пептидов Лаеннека на функцию митохондрий связан со значительным снижением апоптоза и феномена открытия митохондриальной поры (МП) [8]. МП – белковый комплекс в мембране митохондрий, который формируется при таких патологических состояниях, как, например, ишемия, и приводит к набуханию митохондрий с их последующей гибелью вследствие апоптоза или некроза. В состав МП входят белки TSPO («периферический бензодиазепиновый рецептор») и циклофилин-D матрикса митохондрии [9, 10].
Открытие МП является одним из ключевых факторов гибели клеток после ишемии и гибели нейронов при эксайтотоксичности [11]. При открытии МП резко увеличивается количество молекул цитохрома с, переносимых из митохондриального межмембранного пространства в цитозоль и необходимых для инициации программы апоптоза [12]. И наоборот, торможение открытия МП способствует защите клеток от апоптоза [13].
АНАЛИЗ ПЕПТИДНОГО СОСТАВА ЛАЕННЕКА ПОСРЕДСТВОМ МАСС-СПЕКТРОМЕТРИЧЕСКОГО СЕКВЕНИРОВАНИЯ DE NOVO
Исследование проводилось в три этапа:
- de novo секвенирование пептидов Лаеннека;
- анализ функциональных взаимосвязей для установления пептидов, способных потенциально влиять на функцию митохондрий;
- экспертный анализ пептидов, имеющих обоснованные молекулярные механизмы стимуляции функции митохондрий.
В результате проведения секвенирования de novo с использованием разработанного программного обеспечения стали возможными определение аминокислотных последовательностей около 5200 пептидных фрагментов в составе Лаеннека (т.е. более 50%) и их идентификация с применением базы данных UNIPROT. Идентификация методами биоинформатики соответствия этих пептидов определенным фрагментам белков протеома человека позволяет в значительной мере уточнить механизмы молекулярного действия Лаеннека на функцию митохондрий.

С использованием комплекса методов для анализа функциональных взаимосвязей [14] из списка 5200 пептидных фрагментов, найденных в составе Лаеннека, был выделено 650 пептидов, которые могут потенциально влиять на функционирование митохондрий. Проведение экспертного анализа позволило выделить 32 пептида, для которых установлены обоснованные молекулярные механизмы воздействия на структуру и функцию митохондрий.
В табл. 1 перечислены пептидные фрагменты, которые могут позитивно влиять на функционирование митохондрий. Пептиды, способные влиять на функционирование митохондрий посредством специфического ингибирования определенных таргетных белков, перечислены в табл. 2.
Из перечисленных в табл. 1 пептидных фрагментов наибольший интерес, на наш взгляд, представляют последовательности, воздействующие на процессы апоптоза (пептиды VGDELD, LAHFGEK, RFLEQLG). Все эти пептиды являются фрагментами так называемого мотива BH3, который необходим для взаимодействия с белком-регулятором апоптоза Bcl-2 [15].
Процесс апоптоза (программируемая смерть клеток) тесно взаимосвязан с нарушением функции митохондрий. При этом регулятор апоптоза Bcl-2 - внутриклеточный белковый фактор, подавляет апоптоз посредством поддержания оптимальной проницаемости митохондриальной мембраны, ингибируя проапоптотические ферменты каспазы прежде всего за счет предотвращения выхода цитохрома c из митохондрий [16]. Соответственно пептиды Лаеннека VGDELD, LAHFGEK и RFLEQLG, представляющие аминокислотный мотив типа «BH3», могут взаимодействовать с белком Bcl-2 и участвовать в его активации [17], что соответствует повышению сохранности митохондриальной мембраны.
Пептиды Лаеннека GLPTLL и EDLGPLL (табл. 1), являющиеся фрагментами белков-коактиваторов рецептора PPARA, содержат аминокислотный мотив «LxxLL», участвующий во взаимодействиях между PPARA и факторами транскрипции, модулируя их активность [18]. Белки-рецепторы типа PPAR (активированный рецептор пролифераторов пероксисом) необходимы для переработки избыточного количества холестерина и снижения уровня глюкозы в крови.
PPAR-рецепторы способствуют увеличению в клетке числа пероксисом – обязательных клеточных органелл, содержащих окислительно-восстановительные ферменты (например, уратоксидазу, каталазу, энзимы расщепления жирных кислот). Пероксисомы необходимы для осуществления таких процессов, как метаболизм глюкозы, окисление жирных кислот, детоксикация, синтез желчных кислот, построение миелиновой оболочки нервных волокон и др. Наряду с митохондриями, пероксисомы являются главными потребителями кислорода в клетке. Наличие в пероксисомах высокого содержания ферментов метаболизма жирных кислот (например, гидроксиметилглутариллиазы, пероксисомального многофункционального фермента HSD17B4, пероксисомальной ацил-КoА-оксидазы ACOX1, лигаз длинноцепочечных жирных кислот и др.) обусловливает резкое увеличение интенсивности переработки жиров при увеличении числа клеточных пероксисом [19].
 Активация белков PPAR приводит не только к увеличению числа пероксисом в клетках и усилению транскрипции генов, кодирующих белки переработки сахаров. Как оказалось, повышение активности белков-рецепторов типа PPAR оказывает благоприятное воздействие на функционирование митохондрий. В частности, агонисты рецептора PPARα улучшают окисление жиров в митохондриях [20], а восстановление абнормально сниженной активности белков PPAR улучшает активность «дыхательного комплекса I» митохондрий [21]. Повышенная экспрессия белка PPARγ защищает потенциал митохондриальной мембраны и предотвращает апоптоз путем активации антиапоптотических белков семейства Bcl-2 [22]. Соответственно можно предположить, что пептиды Лаеннека GLPTLL и EDLGPLL, содержащие аминокислотный мотив «LxxLL», будут стимулировать антиапоптотическую активность рецепторов типа PPAR.
Активация белков PPAR приводит не только к увеличению числа пероксисом в клетках и усилению транскрипции генов, кодирующих белки переработки сахаров. Как оказалось, повышение активности белков-рецепторов типа PPAR оказывает благоприятное воздействие на функционирование митохондрий. В частности, агонисты рецептора PPARα улучшают окисление жиров в митохондриях [20], а восстановление абнормально сниженной активности белков PPAR улучшает активность «дыхательного комплекса I» митохондрий [21]. Повышенная экспрессия белка PPARγ защищает потенциал митохондриальной мембраны и предотвращает апоптоз путем активации антиапоптотических белков семейства Bcl-2 [22]. Соответственно можно предположить, что пептиды Лаеннека GLPTLL и EDLGPLL, содержащие аминокислотный мотив «LxxLL», будут стимулировать антиапоптотическую активность рецепторов типа PPAR.
Среди перечисленных в табл. 1 пептидов следует выделить GVLMDL, который на 100% идентичен пептиду 844-849 в составе адгезионного G-белкового рецептора G6 (ADGRG6), активируемому коллагеном-IV [23] и необходимому для дифференциации клеток Шванна и миелинизации аксонов [23]. Пептид GVLMDL входит в состав аминокислотной последовательности типа «Stachel» и является внутримолекулярным агонистом рецептора ADGRG6 [24], способствующим дифференциации клеток Шванна, в частности, за счет активации митохондрий.
 ПЕПТИДЫ ЛАЕННЕКА, ИНГИБИРУЮЩИЕ ТАРГЕТНЫЕ БЕЛКИ, УЧАСТВУЮЩИЕ В ФУНКЦИОНИРОВАНИИ МИТОХОНДРИЙ
ПЕПТИДЫ ЛАЕННЕКА, ИНГИБИРУЮЩИЕ ТАРГЕТНЫЕ БЕЛКИ, УЧАСТВУЮЩИЕ В ФУНКЦИОНИРОВАНИИ МИТОХОНДРИЙ
В табл. 2 перечислены пептидные фрагменты, найденые в составе Лаеннека посредством секвенирования de novo, которые могут влиять на функционирование митохондрий посредством ингибирования определенных таргетных белков. Соответствующие таргетные белки перечислены в табл. 3.
Перечисленные в табл. 2 пептиды Лаеннека, которые могут влиять на функционирование митохондрий посредством ингибирования определенных таргетных белков, представляют собой, в первую очередь, ингибиторы MAP-киназ (MAPK) и ингибиторы AKT1 (табл. 3).
ИНГИБИРОВАНИЕ MAP-КИНАЗ ПЕПТИДАМИ ЛАЕННЕКА
Сигнальные пути MAPK (митоген-активируемые протеинкиназы) контролируют транскрипцию генов, метаболизм, деление, подвижность, апоптоз и выживание клеток [25]. Сигнал по пути MAPK передается от рецепторов ростовых факторов, хемокинов, нейротрансмиттеров. Посредством G-белков рецепторы активируют ГТФазы Ras/Rho, которые передают сигнал на модуль, состоящий из трех MAP-киназ. Избыточная активация сигнальных путей MAPK инициирует рост опухолей и развитие хронического воспаления [27].
В целом MAP-киназы (в частности, MAPK1 и MAPK3) стимулируют выживаемость клеток посредством активации антиапоптотических BCL2-белков (BCL2, BCL-xL, MCL1 и др) [28]. Однако в условиях хронического воспаления, оксидативного стресса, присутствия цитотоксических веществ избыточная активность MAP-киназ, наборот, вызывает гибель митохондрий и усиливает апоптоз клеток. Поэтому ингибирование пептидами Лаеннека MAP-киназ (MAPK1, MAPK3, MAPK8, MAPK9) поддерживает выживание и митохондрий, и клеток.
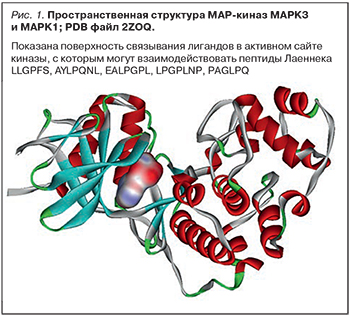
 В составе Лаеннека было найдено 8 пептидов (табл. 3), которые могут ингибировать MAP-киназы: 5 пептидов, ингибирующих киназы MAPK1 (ERK2) и MAPK3 (ERK1), и 3 пептида, ингибирующих киназы MAPK8 (JNK1) и MAPK9 (JNK2). Митоген-активируемые протеинкиназы MAPK1 и MAPK3 участвуют в передаче сигнала в путях выживания клетки (рис. 1).
В составе Лаеннека было найдено 8 пептидов (табл. 3), которые могут ингибировать MAP-киназы: 5 пептидов, ингибирующих киназы MAPK1 (ERK2) и MAPK3 (ERK1), и 3 пептида, ингибирующих киназы MAPK8 (JNK1) и MAPK9 (JNK2). Митоген-активируемые протеинкиназы MAPK1 и MAPK3 участвуют в передаче сигнала в путях выживания клетки (рис. 1).
Ингибирование киназ MAPK1 и MAPK3 (сокращенно MAPK1/3) способствует поддержке митохондриальной функции и выживанию клеток в условиях оксидативного и/или токсического стресса. Например, ингибирование MAPK1/3 в нейронах с митохондриальной дисфункцией, взятых от пациентов с болезнью Альцгеймера, не только снижало оксидативный стресс и улучшало аберрантную морфологию митохондрий, но и восстанавливало процессы деления (воспроизводства) митохондрий [29].
Ингибирование MAPK1/3 противодействует токсическим эффектам метилртути (MeHg) на митохондрии и клетки. Как известно, MeHg стимулирует развитие необратимой дегенерации клеток почек, нейронов и других типов клеток (в частности, вследствие существенного усиления оксидативного стресса), приводящей к апоптозу. Одним из эффектов MeHg на клетку является избыточное повышение активности MAPK1/3, так что ингибирование MAPK1/3 снижало прооксидативную цитотоксичность MeHg [30].
В составе Лаеннека было найдено 5 пептидов, которые, по всей видимости, являются специфическими ингибиторами MAPK1/3. Например, пептид LLGPFS, найденный в составе 3 из 7 исследованных образцов Лаеннека, соответствует пептидному фрагменту 416-421 LLSPFS белка GRB10 (табл. 2). Данный фрагмент интересен тем, что он включает серин-418, который специфически фосфорилируется MAPK1/3 [31-34]. Однако пептид Лаеннека LLGPFS не содержит серина в соответствующей позиции и поэтому будет являться ингибитором MAPK1/3.
 Биоинформационный анализ соответствий пептидов Лаеннека AYLPQNL, EALPGPL, LPGPLNP и PAGLPQ белкам протеома человека (табл. 2) также показал, что данные пептиды могут являться эффективными специфическими ингибиторами MAPK1/3. Например, пептид AYLPQNL соответствует фрагменту 1455-1561 AYTPQNL белка MED1. Данный фрагмент этого белка фосфорилируется по треонину-1457 (AYTPQNL) посредством MAPK1/3 [35], а в аминокислотной последовательности пептида Лаеннека AYLPQNL треонин отсутствует. Пептид PAGLPQ соответствует фрагменту 361-366 PAALPQ белка RPS6KA5, в котором киназы MAPK1, MAPK3 и MAPK14 фосфорилируют серин-360 [36], который опять же отсутствует в пептиде Лаеннека. Аналогично пептиды Лаеннека EALPGPL и LPGPLNP также являются потенциальными ингибиторами MAPK1/3.
Биоинформационный анализ соответствий пептидов Лаеннека AYLPQNL, EALPGPL, LPGPLNP и PAGLPQ белкам протеома человека (табл. 2) также показал, что данные пептиды могут являться эффективными специфическими ингибиторами MAPK1/3. Например, пептид AYLPQNL соответствует фрагменту 1455-1561 AYTPQNL белка MED1. Данный фрагмент этого белка фосфорилируется по треонину-1457 (AYTPQNL) посредством MAPK1/3 [35], а в аминокислотной последовательности пептида Лаеннека AYLPQNL треонин отсутствует. Пептид PAGLPQ соответствует фрагменту 361-366 PAALPQ белка RPS6KA5, в котором киназы MAPK1, MAPK3 и MAPK14 фосфорилируют серин-360 [36], который опять же отсутствует в пептиде Лаеннека. Аналогично пептиды Лаеннека EALPGPL и LPGPLNP также являются потенциальными ингибиторами MAPK1/3.
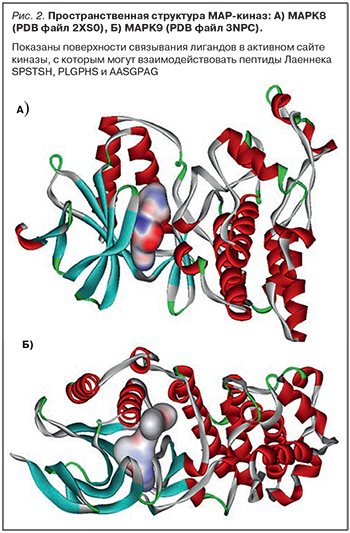
Митоген-активируемые протеинкиназы MAPK8 и MAPK9 (МАРК 8/9) являются серин/треонин-фосфорилирующими ферментами, необходимыми для деления, дифференциации, миграции, трансформации и апоптоза различных типов клеток (табл. 3). Данные киназы (рис. 2) являются активно исследуемыми таргетными белками, ингибирование которые важно для противодействия хроническому воспалению.
Ингибирование MAPK8/9 повышает выживаемость митохондрий и клеток в условиях хронического воспаления и окислительного стресса. Например, воздействие провоспалительного интерлейкина-1β на β-клетки панкреатической железы снижает потенциал митохондрий, повышает уровни активных форм кислорода, увеличивает проницаемость и открытие МП, что стимулирует апоптоз клеток. Все эти негативные эффекты воздействия интерлейкина-1β на митохондрии блокируются при снижении активности MAPK8/9 посредством специальных микроРНК, блокирующих экспрессию генов MAPK8 и MAPK9 [37]. Ингибирование MAPK8/9 также эффективно в плане защиты митохондрий от воздействия перекиси водорода [38].
 В составе Лаеннека найдено 3 пептида, которые являются потенциальными ингибиторами MAPK8/9 (табл. 2). Прежде всего следует отметить пептид AASGPAG, найденный в 4 из 7 исследованных образцов Лаеннека. Этот пептид соответствует фрагменту 24-30 AASSPAG белка SIRT1, в котором остаток серин-27 (AASSPAG) фосфорилируется посредством MAPK8 [33, 39–41]. В пептиде Лаеннека AASGPAG в соответствующей серину-27 позиции представлен остаток глицина (AASGPAG), что делает данный пептид потенциальным ингибитором киназы MAPK8. Пептиды Лаеннека SPSTSH и PLGPHS также являются потенциальными ингибиторами MAPK8, MAPK9 и MAPK13 [42]. Таким образом, ингибирование MAPK8/9 пептидами Лаеннека будет способствовать выживанию митохондрий в условиях оксидативного стресса и хронического воспаления.
В составе Лаеннека найдено 3 пептида, которые являются потенциальными ингибиторами MAPK8/9 (табл. 2). Прежде всего следует отметить пептид AASGPAG, найденный в 4 из 7 исследованных образцов Лаеннека. Этот пептид соответствует фрагменту 24-30 AASSPAG белка SIRT1, в котором остаток серин-27 (AASSPAG) фосфорилируется посредством MAPK8 [33, 39–41]. В пептиде Лаеннека AASGPAG в соответствующей серину-27 позиции представлен остаток глицина (AASGPAG), что делает данный пептид потенциальным ингибитором киназы MAPK8. Пептиды Лаеннека SPSTSH и PLGPHS также являются потенциальными ингибиторами MAPK8, MAPK9 и MAPK13 [42]. Таким образом, ингибирование MAPK8/9 пептидами Лаеннека будет способствовать выживанию митохондрий в условиях оксидативного стресса и хронического воспаления.
ИНГИБИРОВАНИЕ AKT1-КИНАЗЫ ПЕПТИДАМИ ЛАЕННЕКА
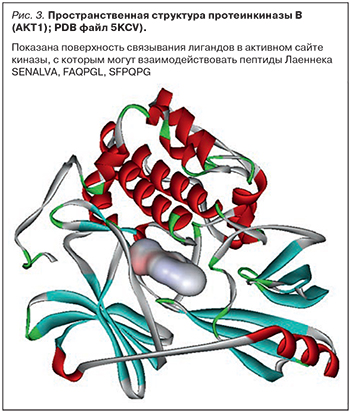
В составе Лаеннека были найдены пептиды SENALVA, FAQPGL, SFPQPG, которые могут ингибировать AKT1-киназу, которая регулирует метаболизм, деление, выживаемость и рост клеток (рис. 3).
Akt1-киназа или протеинкиназа В (ПКВ) оказывает антиапоптотические эффекты и стимулирует деление клеток в ответ на те или иные стимулы. Однако в определенных внутриклеточных контекстах избыточная активность ПКВ приобретает проапоптотический характер. Например, при стимулировании апоптоза цитотоксичным веществом этопозидом происходит транслокация ПКВ в митохондрии, где этот фермент фосфорилирует белок Smac, что приводит к активации каспаз и ускорению апоптоза [43]. При воздействии на клетки токсического микроэлемента кадмия происходит повышение уровней активных форм кислорода, что приводит к избыточной активации ПКВ и апоптозу [44]. Напомним, что интоксикация кадмием (сигаретный дым, неблагоприятная экологическая среда) ведет к тяжелым поражениям почек, печени и центральной нервной системы, которые ассоциированы с необратимыми повреждениями митохондрий [45].
Известно также, что избыточные уровни инсулина при гиперинсулинемии также стимулируют перенос ПКВ в митохондрии, что усиливает оксидативный стресс и ускоряет гибель митохондрий [46]. Перенос ПКВ в митохондрии также происходит при воздействии теплового, токсического и оксидативного стресса [47]. Накапливаясь в митохондриях в условиях гипоксии, ПКВ фосфорилирует фермент киназу пируватдегидрогеназы-1 по треонину-346, что приводит к инактивации пируватдегидрогеназного комплекса, т.е. к снижению митохондриального синтеза АТФ [48].
Избыточная активность ПКВ в митохондриях приводит к активации проапоптотического белка Bax за счет фосфорилирования его серина-184 [49]. Активация Bax ведет к блокированию активности антиапоптотического белка BCL2, активируя тем самым процесс открытия митохондриального ионного канала VDAC, потере потенциала мембраны митохондрий и апоптозу [50].
 Таким образом, ингибирование избыточной активности ПКВ в условиях оксидативного или токсического стресса, а также при гиперинсулинемии может способствовать торможению апоптоза и выживанию митохондрий. Пептиды Лаеннека SENALVA, FAQPGL и SFPQPG являются потенциальными ингибиторами ПКВ.
Таким образом, ингибирование избыточной активности ПКВ в условиях оксидативного или токсического стресса, а также при гиперинсулинемии может способствовать торможению апоптоза и выживанию митохондрий. Пептиды Лаеннека SENALVA, FAQPGL и SFPQPG являются потенциальными ингибиторами ПКВ.
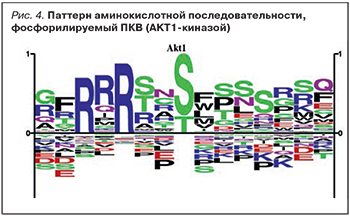
Пептид FAQPGL, найденный в 5 из 7 исследованных образцов Лаеннека, соответствует фрагменту 236-241 FSQPGL белка TBC1D1 (табл. 2). Из биохимических исследований известно, что остаток серин-235 этого белка фосфорилируется киназой PKB/AKT1 [39]. При этом в состав пептида FAQPGL серин не входит, так что данный пептид также может ингибировать активность ПКВ. Потенциальными ингибиторами ПКВ являются и пептиды SENALVA и SFPQPG, которые, хотя и содержат остатки серина, соответствуют только правой половине паттерна аминокислотной последовательности, фосфорилируемого ПКВ (рис. 4).
ПЕПТИДЫ ЛАЕННЕКА, ИНГИБИРУЮЩИЕ ДРУГИЕ ТАРГЕТНЫЕ БЕЛКИ, ВЛИЯЮЩИЕ НА ФУНКЦИИ МИТОХОНДРИЙ
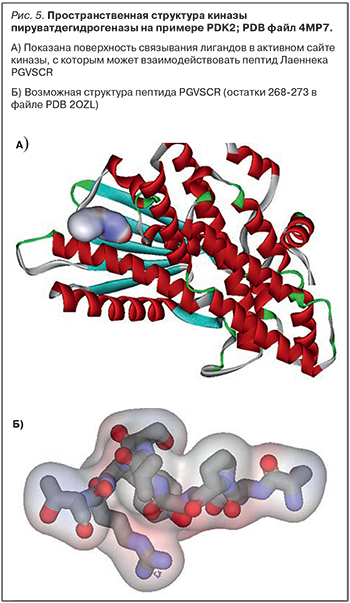
Среди других таргетных белков, перечисленных в табл. 3, наибольший интерес, на наш взгляд, представляют киназы пируватдегидрогеназы (PDK1-PDK4) и НАД-зависимая белковая деацетилаза сиртуин-1 (SIRT1). Напомним, что пируватдегидрогеназа – основная молекулярная машина биосинтеза АТФ, расположенная в митохондриях клетки и катализирующая превращение пирувата в ацетил-КоА и СО2, тем самым связывая гликолиз и цикл Кребса [51, 52].
Киназы пируватдегидрогеназы (рис. 5) являются митохондриальными ферментами, которые осуществляют регуляцию метаболизма глюкозы и жирных кислот посредством фосфорилирования пируватдегидрогеназного комплекса (точнее, субъединиц PDHA1 и PDHA2), что ингибирует активность пируватдегидрогеназы. Повышенные уровни и активность киназ пируватдегидрогеназы отмечаются при гиперинсулинемии, сахарном диабете, метаболическом синдроме и ожирении, что обусловливает интерес в разработке специфических ингибиторов этих ферментов [53].
Найденный в составе препарата Лаеннека пептид PGVSCR соответствует фрагменту 297-302 PGVSYR белка PDHA1 (т.е. субъединицы Е1-альфа пируватдегидрогеназы, которую и фосфорилируют киназы PDK1, PDK2, PDK3 и PDK4). Остаток серин-300 (PGVSYR) фосфорилируется PDK1, PDK2, PDK3 и PDK4 [54], так что можно предположить, что пептид Лаеннека PGVSCR является частичным ингибитором PDK-киназ.
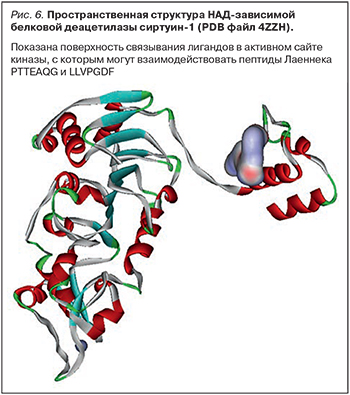
НАД-зависимая белковая деацетилаза сиртуин-1 (рис. 6) улучшает активность «дыхательного комплекса I» митохондрий [21]. Пептиды Лаеннека PTTEAQG (соответствует фрагменту 453-459 PTQEAQG белка CCAR2) и LLVPGDF (соответствует 250-256 LLVPSDF белка CCAR2) соответствуют фрагментам белка CCAR2 (регулятора-2 клеточного цикла), который синхронизирует удлинение транскрипта с регулированием альтернативного сплайсинга. Белок CCAR2 ингибирует сиртуин-1, причем с участием указанных пептидных фаргментов: мутация 454 Т->А значительно снижает взаимодействие с сиртуином-1, а делеция 243-264 устраняет связывание с сиртуином-1 [55]. Можно предположить, что пептиды Лаеннека PTTEAQG и LLVPGDF будут взаимодействовать с сиртуином-1 и тем самым предотвращать взаимодействие сиртуина-1 с белком CCAR2 (что способствует поддержанию антиапоптотической активности сиртуина-1 и сохранению активности дыхательного комплекса I митохондрий).
ЗАКЛЮЧЕНИЕ
Если «классические» болезни митохондрий (МКБ 10) встречаются достаточно редко, то дисфункция митохондрий гораздо более распространена и имеет место при широком спектре заболеваний. Митохондриальная недостаточность сопровождает астению, переутомление (в частности, после интенсивных спортивных тренировок), период реконвалесценции после перенесенного гриппа (также пневмонии, ОРЗ), сердечно-сосудистые заболевания, ишемические заболевания головного мозга и др. Нарушения энергетического метаболизма митохондрий приводит к ускоренному старению клеток и организма в целом.
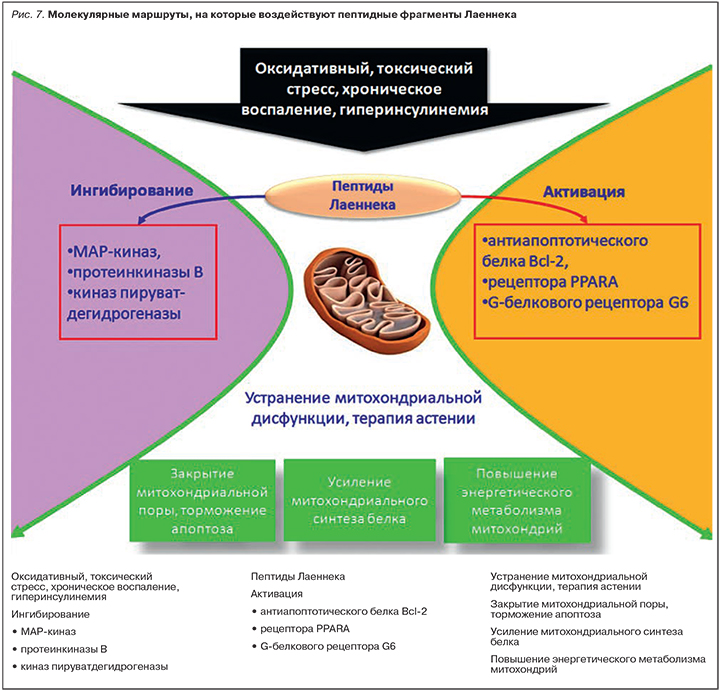
В представленной работе впервые установлены пептидные компоненты в составе препарата Лаеннек, способные поддерживать функционирование митохондрий. Эти пептиды могут тормозить избыточный апоптоз клеток, развивающийся в условиях оксидативного и токсического стресса, а также хронического воспаления и гиперинсулинемии. Молекулярные механизмы действия этих пептидов Лаеннека осуществляются посредством активации антиапоптотического белка Bcl-2, рецептора PPARA, адгезионного G-белкового рецептора G6, ингибирования МАР-киназ, ПКВ и киназ пируватдегидрогеназы. Важно отметить, что перечисленные молекулярные маршруты весьма актуальны для фармакологии и являются таргетными для поиска новых лекарственных средств, в том числе улучшающих качество и длительность жизни. Установленные в настоящей работе пептидные компоненты Лаеннека оказывают мягкое модулирующее действие на все перечисленные маршруты, осуществляя комплексную поддержку функционирования митохондрий (рис. 7).



