Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) – высоко распространенное в популяции заболевание, привлекающее в последнее время внимание ученых и практикующих врачей многих стран мира, что связано с ростом частоты выявления данной патологии и разнообразием ее клинических проявлений. Актуальность проблемы ГЭРБ обусловлена также тем, что она приводит к значительному снижению качества жизни больного, особенно при ночной симптоматике, сопряжена с развитием внепищеводной симптоматики (боли в грудной клетке, упорный кашель) и риском таких осложнений, как кровотечение из язв и эрозий, формирование пептических стриктур и, что вызывает наибольшую настороженность, аденокарциномы пищевода на фоне пищевода Барретта.
По распространенности ГЭРБ выходит на лидирующие позиции среди других гастроэнтерологических заболеваний. В России распространенность ГЭРБ составляет от 11,6 до 23,6% [1]. В США и Бельгии только эндоскопически позитивная ГЭРБ выявляется у 21–27% популяции, в Японии – у 16,5%, а в ряде стран Азии – у 3–6% [2, 3]. Истинный уровень заболеваемости, очевидно, превышает статистические данные, что обусловлено высокой вариабельностью симптоматики и низкой обращаемостью пациентов за медицинской помощью. В некоторых регионах России основной симптом ГЭРБ – изжогу, по данным выборочных исследований, периодически испытывают до 48,5% мужчин и 51,4% женщин [4]. По результатам исследования МЭГРЕ (2006), изжогу и/или регургитацию 1 раз в неделю и чаще в течение последних 12 мес испытывали 13% населения [5]. Частота же более редкой изжоги значительно выше и составляет в Санкт-Петербурге 33,3%, Красноярске – 39,4%, Кемерово – 32,2%, Рязани – 39,7% [1]. При этом к врачу обращается только 1/3 пациентов.
ГЭРБ – хроническое рецидивирующее заболевание, обусловленное нарушением моторно-эвакуаторной функции органов гастроэзофагеальной зоны и характеризующееся спонтанным или регулярно повторяющимся забрасыванием в пищевод желудочного или дуоденального содержимого, функциональными нарушениями и/или дистрофическими изменениями неороговевающего многослойного плоского эпителия, простым (катаральным), эрозивным или язвенным эзофагитом (рефлюкс-эзофагит), а у части больных – развитием со временем цилиндроклеточной (железистой) метаплазии (пищевод Барретта) [6].
Клинически типичный рефлюксный синдром включает такие симптомы, как изжога, отрыжка, срыгивание, дисфагия (нарушение прохождения пищи по пищеводу, которое пациенты ощущают как затруднение при глотании, локализованное ретростернально или у мечевидного отростка), одинофагия (боль при прохождении пищи по пищеводу во время ее проглатывания). При этом самым частым клиническим симптомом ГЭРБ является изжога. Она встречается более чем у трети больных и усиливается при погрешностях в диете, приеме алкоголя, газированных напитков, физическом напряжении, наклонах туловища и в горизонтальном положении.
ДИАГНОСТИКА РАННИХ СТАДИЙ ГЭРБ
Диагностика ранних стадий ГЭРБ основана на первичной обращаемости и анализе клинической картины заболевания. Однако при рефрактерном течении ГЭРБ (отсутствии убедительной клинической и эндоскопической ремиссии в течение 4–8 нед проведения терапии стандартной дозой ингибитора протонной помпы – ИПП), а также наличии осложнений заболевания (стриктуры, пищевод Барретта) необходимо проведение обследования в условиях специализированного стационара, где больным должны быть выполнены:
- Эзофагогастродуоденоскопия с биопсией пищевода и гистологическим исследованием биоптатов для исключения пищевода Барретта, аденокарциномы, эозинофильного эзофагита. Эндоскопическое исследование является одним из основных методов диагностики ГЭРБ, так как позволяет определить уровень расположения Z-линии и состояние слизистой оболочки пищеводно-желудочного перехода, использовать уточняющие методики (хромоскопия, флюоресцентная и ZOOM-эндоскопия, режим NBI).
- Внутрипищеводная суточная рН-метрия или рН-импедансометрия. До недавнего времени «золотым стандартом» диагностики рефлюксов считалось 24-часовое мониторирование рН в просвете пищевода. Все рефлюксные эпизоды в диапазоне от 7 до 4 не рассматривались как патологические и не использовались для характеристики кислотной экспозиции в пищеводе больных ГЭРБ. С внедрением рН-импедансометрии стала возможной регистрация всех эпизодов рефлюксов независимо от характера рефлюктата (газ, жидкость, смешанный рефлюктат) и его рН, что позволило различать кислотные (рН <4), слабокислотные (рН 4–7) и слабощелочные (рН >7) рефлюксы.
- Пищеводная манометрия высокого разрешения.
- Рентгенологическое исследование пищевода и желудка.
- Комплексное ультразвуковое исследование внутренних органов.
- Регистрация электрокардиограммы и другие специальные методы.
- Консультации кардиолога, пульмонолога, оториноларинголога с целью дифференциальной диагностики внепищеводных проявлений ГЭРБ.
Определенные трудности возникают при лечении больных ГЭРБ. Если средние сроки заживления язв двенадцатиперстной кишки (ДПК) составляют 3–4 нед, язв желудка – 4–6 нед, то сроки заживления эрозий пищевода у многих больных могут достигать 8–12 нед. При этом у части больных наблюдаются рефрактерность к приему антисекреторных средств, низкая приверженность лечению. Прекращение приема лекарственных препаратов сопровождается быстрым развитием рецидива заболевания, который, в свою очередь, является главным фактором риска развития пищевода Барретта – предраковой патологии пищевода.
ЛЕЧЕНИЕ ГЭРБ
Лечение пациентов с ГЭРБ должно быть индивидуализировано и ориентировано в соответствии с клиническими проявлениями заболевания и интенсивностью симптомов, направлено на уменьшение рефлюкса, снижение повреждающих свойств рефлюктата, улучшение пищеводного клиренса и защиту слизистой оболочки пищевода. Основными целями терапии являются купирование и контроль симптомов, улучшение самочувствия и качества жизни, лечение и предотвращение осложнений. Согласно российским и международным рекомендациям по ведению пациентов с ГЭРБ, модификацию образа жизни следует считать обязательной предпосылкой эффективного антирефлюксного лечения. Она включает снижение веса у пациентов с избыточной массой тела/ожирением, прекращение приема пищи за 2–3 ч до сна, сон с приподнятым изголовьем кровати (15 см) и уменьшение потребления продуктов, провоцирующих развитие рефлюкс-симптомов (томаты, кислые фруктовые соки, газированные напитки, шоколад, кофе, чеснок, лук, перец, алкогольные напитки) [6].
 Медикаментозная терапия
Медикаментозная терапия
Эффективная медикаментозная терапия включает назначение антацидов, альгинатов, адсорбентов, прокинетиков, ИПП, а при выявлении инфекции Helicobacter pylori – проведение эрадикационной терапии.
На сегодняшний день антисекреторная терапия с применением ИПП является «золотым стандартом» лечения ГЭРБ [7]. ИПП в большинстве случаев оказываются высокоэффективными в купировании симптоматики заболевания, заживлении эрозивных повреждений пищевода и предотвращении осложнений. Однако около 20–30% пациентов, в первую очередь с неэрозивной рефлюксной болезнью (НЭРБ) и/или внепищеводными проявлениями, характеризуются низким ответом на терапию ИПП [8, 9]. Рефрактерными к терапии ИПП считаются пациенты с отсутствием полного заживления слизистой оболочки пищевода и/ или удовлетворительного купирования симптомов после проведения полного курса лечения стандартной (1 раз в сутки) дозой ИПП [7]. Порядка 40–50% больных не отвечают на стандартную дозу ИПП, применяемую в течение 4–8 нед [10].
Неэффективность терапии ИПП объясняется влиянием множества факторов, среди которых необходимо выделить недостаточное подавление кислотопродукции, связанное с особенностями фармакокинетики ИПП, низкую приверженность пациента лечению, а также особенности патофизиологии ГЭРБ [11]. Так, с патофизиологической точки зрения ГЭРБ рассматривается как кислотозависимое заболевание, развивающееся на фоне первичного нарушения двигательной функции верхних отделов пищеварительного тракта. В основе патогенеза ГЭРБ лежит гастроэзофагеальный рефлюкс (ГЭР), возникновение которого обусловлено рядом механизмов:
- снижением давления и транзиторным расслаблением нижнего пищеводного сфинктера;
- снижением пищеводного клиренса – объемного (нарушение вторичной перистальтики пищевода, обеспечивающей освобождение пищевода от рефлюктата) и химического (снижение выработки слюны и содержания бикарбонатов, присутствующих в слюне и пищеводном секрете);
- уменьшением резистентности слизистой оболочки пищевода (разрушение слизистого барьера пепсином, желчными кислотами, снижение внутриклеточного рН, ухудшение пищеводного кровотока);
- нарушением моторно-эвакуационной функции желудка и ДПК (по типу псевдостеноза выходного отдела желудка, хронической дуоденальной непроходимости с гиперкинезией ДПК, гипокинезии ДПК и желудка);
- повышением внутрибрюшного давления;
- грыжей пищеводного отверстия диафрагмы.
Определяющую роль в развитии и прогрессировании ГЭРБ играет состав рефлюктата. Кислое содержимое желудка вызывает менее выраженные воспалительно-деструктивные изменения слизистой оболочки нижней трети пищевода по сравнению с желчным, имеющим щелочные значения рН. Кроме того, присутствие в рефлюктате желчи повышает риск развития пищевода Барретта и рака пищевода [12]. Наличие слабокислых и слабощелочных рефлюксов, когда, помимо соляной кислоты, патологическое воздействие на слизистую оболочку пищевода оказывают желчные кислоты, лизолецитин и трипсин, также может быть причиной неэффективности ИПП у пациентов с ГЭРБ. При выявлении у пациента дуоденогастроэзофагеального рефлюкса (ДГЭР) необходима комбинированная терапия, включающая, помимо ИПП, прокинетики, адсорбенты, антациды/альгинаты, урсодезоксихолевую кислоту.
Следует отметить, что наибольшее число кислотных рефлюксов отмечается после приема пищи, буферные свойства которой, казалось бы, должны снижать кислотность желудочного содержимого. Такой «парадокс» объясняется теорией «кислотного кармана», который является источником кислоты, поступающей в дистальный отдел пищевода после приема пищи. Согласно современным представлениям о патофизиологии ГЭРБ, именно сочетание максимальных размеров и проксимального положения «кислотного кармана» с патологическими транзиторными расслаблениями нижнего пищеводного сфинктера лежит в основе формирования наиболее агрессивных кислотных рефлюксов, повреждающее действие которых значительно потенцируется нарушением клиренса пищевода вплоть до формирования так называемой персистирующей кислотной выстилки в дистальных отделах пищевода [13]. Наличие неконтролируемого постпрандиального «кислотного кармана» является одним из факторов, определяющих недостаточную эффективность ИПП. Однако применение ИПП в данном случае представляется вполне оправданным, поскольку, несмотря на то что «кислотный карман» сохраняется, возрастает значение pH его содержимого, оно становится менее кислым. Согласно концепции «кислотного кармана» лечение ГЭРБ должно быть направлено на его перемещение и нейтрализацию с помощью антирефлюксных препаратов – альгинатов.
Еще одной из причин неэффективности терапии ИПП является изжога, не связанная с ГЭРБ. Формирование этого ощущения может быть обусловлено нарушениями моторики пищевода и гиперсенситивностью его слизистой оболочки. Согласно Римским критериям IV, официально представленным в мае 2016 г., о гиперчувствительности пищевода можно говорить при наличии следующих симптомов по крайней мере в течение 3 мес за последние 6 мес до постановки диагноза с частотой как минимум дважды в неделю: 1) наличие изжоги или боли за грудиной; 2) нормальной эндоскопической картины и отсутствии доказательств, что причиной симптомов является эозинофильный эзофагит; 3) отсутствия основных двигательных расстройств со стороны пищевода (ахалазия кардии/обструкция гастроэзофагеального соединения, диффузный эзофагеальный спазм, отсутствие перистальтики, пневмоперфорация пищевода); 4) наличие симптомов, несмотря на нормальное время экспозиции кислоты в пищеводе по данным 24-часовой pH-импедансометрии пищевода [14, 15].
Кроме того, изжога может быть вариантом функционального расстройства – функциональной изжоги, критериями которой, согласно Римским критериям IV, также является наличие следующих симптомов по крайней мере в течение 3 мес за последние 6 мес до постановки диагноза с частотой как минимум дважды в неделю:
- наличие жжения или боли за грудиной;
- нет облегчения симптомов, несмотря на оптимальную антисекреторную терапию;
- отсутствия доказательств, что ГЭР или эозинофильный эзофагит являются причиной симптомов;
- отсутствия основных двигательных расстройств пищевода, перечисленных выше [15].
В лечении пациентов с гиперсенситивным пищеводом и функциональной изжогой должны использоваться модуляторы боли: ингибиторы обратного захвата серотонина и трициклические антидепрессанты в низких дозах [15–17].
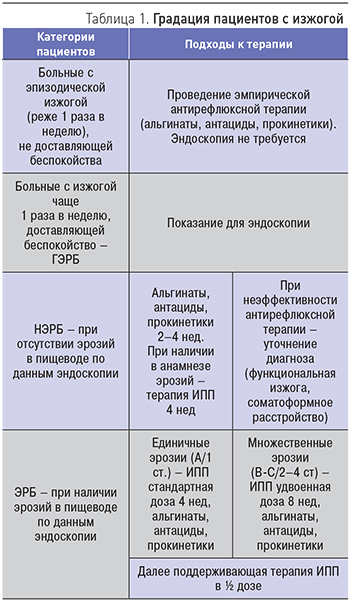
Подходы к терапии пациентов с изжогой и рефлюкс-эзофагитом представлены в табл. 1.
Эрадикационная терапия
Несколько лет назад высказывались разные мнения по поводу влияния инфекции H. pylori на течение ГЭРБ, в том числе появлялись публикации, в которых указывалось на «протективную» роль микроорганизма по отношению к повреждающему действию рефлюксата. Эпидемиологические исследования демонстрируют меньшую распространенность H. pylori у больных ГЭРБ, чем в популяции (39 против 50%), однако значение этой отрицательной взаимосвязи не имеет убедительного объяснения [18].
Наличие или отсутствие H. pylori не влияет на выраженность симптомов ГЭРБ, их рецидивирование и эффективность лечения этого заболевания, а эрадикация не усугубляет существующую ГЭРБ и не влияет на эффективность терапии [19, 20]. Между тем, если речь идет о сочетании ГЭРБ с хронической инфекцией, вызванной H. pylori, и планируется длительное подавление кислотопродукции ИПП, в схему лечения обязательно включается эрадикационная терапия с целью снижения риска развития язвенной болезни и рака желудка, а при необходимости длительного назначения ИПП – предотвращения транслокации микроорганизма с развитием пангастрита и гастрита тела желудка [21].
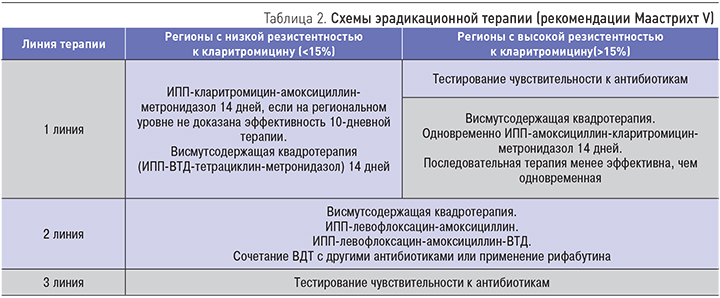
Согласно рекомендациям V Маастрихтского соглашения, в регионах с высокой (>15%) резистентностью к кларитромицину рекомендуется квадротерапия с препаратами висмута (висмут трикалия дицитрат – ВТД) или без них, включающая также ИПП, амоксициллин, кларитромицин и нитроимидазол. В регионах с высокой одновременной резистентностью к кларитромицину и метронидазолу висмутсодержащая квадротерапия рекомендуется в качестве терапии первой линии. Продолжительность эрадикационной квадротерапии с висмутом должна быть удлинена до 14 дней, хотя для отдельных регионов доказана эффективность 10-дневной терапии. Продолжительность эрадикационной тройной терапии с кларитромицином должна быть удлинена до 14 дней. В регионах с низкой резистентностью к кларитромицину стандартная ИПП-кларитромицинсодержащая тройная терапия рекомендуется в качестве эмпирической терапии первой линии (табл. 2) [22, 23].
Дополнительное включение ВТД в схемы эрадикационной терапии существенно повышает частоту успешной эрадикации H. pylori без роста частоты побочных эффектов.
Основными молекулярными механизмами антихеликобактерного действия ВТД являются:
- блокада адгезии H. pylori к поверхности эпителиальных клеток;
- подавление ряда ферментов, продуцируемых H. pylori (уреаза, каталаза, липаза/фосфолипаза, алкилгидропероксидредуктаза и др.), и трансляционного фактора (Ef-Tu);
- прямое взаимодействие с белками теплового шока (HspA, HspB), нейтрофил-активирующим белком (NapA), нарушение структуры и функции других белков;
- нарушение синтеза АТФ и других макроэргов;
- нарушение синтеза, структуры и функции клеточной стенки и функции мембраны;
- индукция свободно-радикальных процессов [24, 25].
При этом бактерицидное действие ВТД, в отличие от действия большинства антибактериальных средств, проявляется в отношении как вегетативных, так и кокковых форм H. pylori. Применение препаратов висмута в составе эрадикационной терапии позволяет преодолевать резистентность H. pylori к метронидазолу и кларитромицину. Важным обстоятельством является полное отсутствие штаммов H. pylori, резистентных к солям висмута. Следует отметить, что ВТД также снижает активность пепсина и пепсиногена, вероятно, за счет связывания пепсина, а при кислых значениях рН способен связывать желчные кислоты, что наиболее актуально в случае ДГЭР. Кроме того, ВТД достоверно увеличивает секрецию простагландинов и бикарбонатов в желудке и ДПК, образование слизи, стимулирует активность цитопротекторных механизмов и повышает резистентность слизистой оболочки к воздействию факторов агрессии (соляная кислота, пепсин, ферменты, соли желчных кислот) [26–28].
Таким образом, многокомпонентный механизм действия ВТД обеспечивает защиту слизистой оболочки желудка и ДПК от воздействия различных повреждающих факторов, а антихеликобактерная активность позволяет преодолевать устойчивость H. pylori к антибиотикам, повышая эффективность фармакотерапии.
Своевременная диагностика и систематическое лечение ГЭРБ позволяют предупредить прогрессирование заболевания и развитие опасных для жизни осложнений. Лечение ГЭРБ должно быть комплексным, соответствующим клиническим проявлениям заболевания, интенсивности симптомов, и направлено на уменьшение рефлюкса, снижение повреждающих свойств рефлюктата, улучшение пищеводного клиренса и защиту слизистой оболочки пищевода.



