Диагностика

1.
• Эквивалентами загрудинной боли при ишемической болезни сердца (ИБС) бывают состояния, описываемые пациентом как одышка, ощущение «тяжести», «жжения». Иногда боль может иррадиировать в эпигастральную область (реже, чем в левую руку, спину или нижнюю челюсть) [1].
• Эквивалентом физической нагрузки, провоцирующей приступы ангинозной боли, может выступать кризовое повышение артериального давления (АД) с увеличением нагрузки на миокард, а также обильный прием пищи [1].
• Признаки неангинозных (нестенокардитических) болей в грудной клетке [1]:
– попеременная локализация справа и слева от грудины;
– локальный, «точечный» характер;
– длительность более 30 мин после возникновения (до нескольких часов или суток).
Такие боли могут быть постоянными, «простреливающими» или «внезапно прокалывающими»;
– боли, не связанные с ходьбой или иной физической нагрузкой, однако зависящие от положения тела: возникают при наклонах и поворотах корпуса, в положении лежа (за исключением стенокардии decubitus – истинной стенокардии, возникающей в лежачем положении в результате увеличения венозного возврата и увеличения преднагрузки на сердце с увеличением потребности миокарда в кислороде), длительном нахождении тела в неудобном положении, глубоком дыхании на высоте вдоха;
– боли, не купируемые приемом нитроглицерина;
– боли, усиливающиеся при пальпации грудины и/или грудной клетки по ходу межреберных промежутков.
• Особенности ангинозной боли при вазоспастической и микрососудистой стенокардии указаны в таблице 1.

2.
При выявлении во время расспроса синдрома стенокардии напряжения для оценки его выраженности рекомендуется определить функциональный класс (в соответствии с Канадской классификацией стенокардии) в зависимости от переносимой физической нагрузки (табл. 2).

3.
• В процессе сбора анамнеза у пациента с подозрением на ИБС уточняются факт курения в настоящее время или в прошлом, случаи сердечно-сосудистых заболеваний (ССЗ) и смерти от ССЗ у ближайших родственников для выявления кардиоваскулярных факторов риска; известные самому больному сопутствующие заболевания с целью оценки дополнительных рисков [1].
• Также при изучении анамнеза выясняются предыдущие случаи обращения за медицинской помощью и результаты таких обращений, наличие ранее зарегистрированных электрокардиограмм (ЭКГ), результатов других инструментальных исследований и заключений по этим исследованиям с целью оценки изменений различных показателей в динамике. Для оптимального выбора или коррекции медикаментозной терапии, снижения риска аллергических и анафилактических реакций производится сбор информации обо всех лекарствах, принимаемых в настоящее время пациентом, а также обо всех препаратах, прием которых ранее был прекращен из-за непереносимости или неэффективности [1].
• На этапе первичной диагностики всем пациентам с подозрением на ИБС проводится физикальное обследование для выявления ряда факторов риска, а также сопутствующих заболеваний. Оно включает определение индекса массы тела (ИМТ), перкуссию и аускультацию сердца и легких, пальпацию пульса на лучевых артериях и артериях тыльной поверхности стоп, измерение артериального давления (АД) по Короткову в положении лежа, сидя и стоя, подсчет частоты сердечных сокращений (ЧСС) и пульса, аускультацию точек проекций сонных артерий, брюшной аорты, подвздошных артерий, пальпацию живота, парастернальных точек и межреберных промежутков [1].
• Обычно физикальное обследование при неосложненной стабильной ИБС имеет малую специфичность, однако при его выполнении можно выявить избыточную массу тела, заподозрить сахарный диабет (по характерным расчесам, сухости и дряблости кожи, снижению кожной чувствительности). Важное значение на этом этапе диагностики имеют признаки атеросклероза клапанов сердца, аорты, магистральных и периферических артерий: шум над проекциями сердца, брюшной аорты, сонных, почечных и бедренных артерий, клиника перемежающейся хромоты, похолодание стоп, ослабление пульсации артерий и атрофия мышц нижних конечностей. Существенный фактор риска ИБС, выявляемый при физикальном обследовании, – повышение АД. Кроме того, следует обращать внимание на внешние симптомы анемии. У больных с семейными формами гиперхолестеринемии при осмотре можно выявить ксантомы на кистях, локтях, ягодицах, коленях и сухожилиях, а также ксантелазмы на веках [1].
• Физикальное обследование может оказаться более информативным, если присутствуют симптомы осложнений ИБС, в первую очередь сердечной недостаточности: одышка, застойные хрипы в легких, кардиомегалия, аритмия, набухание шейных вен, гепатомегалия, отеки ног и др. Выявление симптомов сердечной недостаточности при физикальном обследовании обычно заставляет предполагать постинфарктный кардиосклероз и очень высокий риск осложнений, что требует безотлагательного комплексного лечения, в том числе, возможно, хирургического [1].
4.
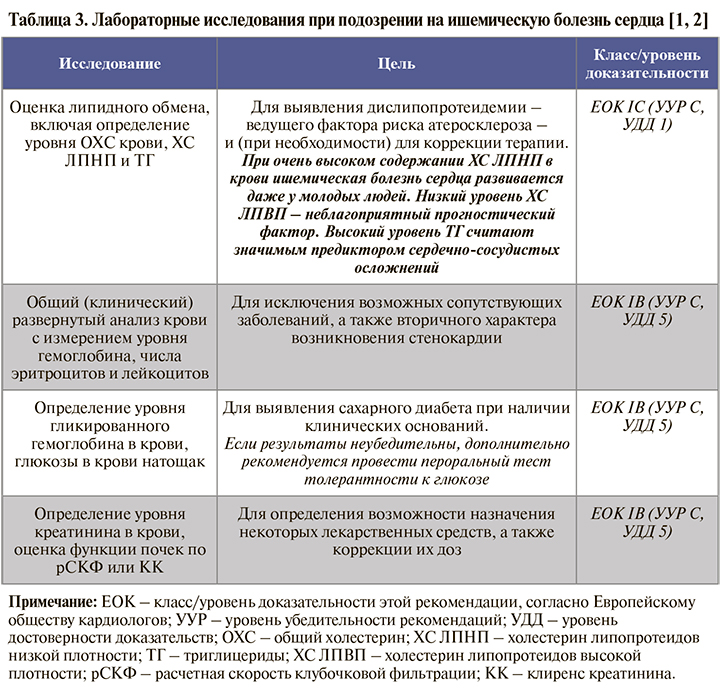
• Основной круг лабораторных исследований, рекомендуемых пациентам с подозрением на ИБС при первичном обращении к врачу, представлен в таблице 3. Отметим, что лишь немногие из них обладают самостоятельной прогностической ценностью при стабильной ИБС; самым важным параметром является липидный спектр крови. Остальные анализы позволяют выявить коморбидные заболевания и синдромы, которые ухудшают прогноз ИБС и требуют учета при подборе лекарственной терапии и возможном направлении больного на оперативное лечение [1].
• В зависимости от сопутствующих жалоб и анамнеза пациента набор лабораторных исследований может также включать:
– при клинических проявлениях патологии щитовидной железы – исследование тиреотропного гормона (ТТГ), тироксина (Т4), свободного тироксина (СТ4), трийодтиронина (Т3) и свободного трийодтиронина (СТ3) в крови: класс/уровень доказательности этой рекомендации, согласно Европейскому обществу кардиологов (EOK) – IC; уровень убедительности рекомендаций (УУР) – C, уровень достоверности доказательств (УДД) – 5 [1, 3];
– при подозрении на сердечную недостаточность – исследование уровня N-терминального фрагмента мозгового натрийуретического пропептида в крови для исключения этого заболевания и оценки прогноза: ЕОК IIaC (УУР – С, УДД – 5) [1, 3];
– при клинической нестабильности состояния или подозрении на острый коронарный синдром – повторное исследование уровня тропонинов I, T в крови высоко- или сверхвысокочувствительным методом для исключения некроза миокарда: ЕОК – IА (УУР – С, УДД – 5) [1, 3];
– при фибрилляции предсердий – определение клиренса креатинина по формуле Кокрофта–Голта на основании исследования уровня креатинина в крови и с учетом необходимости назначения антикоагулянтов: ЕОК – IC (УУР – С, УДД – 5) [1, 3];
– у пациентов с жалобами на симптомы миопатии на фоне приема статинов – определение активности креатинкиназы в крови для исключения негативных побочных эффектов статинов и при необходимости коррекции терапии: ЕОК – IC (УУР – С, УДД – 5) [1, 4].
• При повторных лабораторных исследованиях у всех пациентов с диагнозом стабильной ИБС рекомендуется проводить ежегодный контроль общего (клинического) развернутого анализа крови, биохимического общетерапевтического анализа крови, биохимического анализа крови по оценке нарушений липидного обмена, исследование уровня креатинина в крови и глюкозы в крови натощак с целью своевременной коррекции терапии: ЕОК – IC (УУР – С, УДД – 5) [1, 3].
5.
• Регистрация 12-канальной ЭКГ в покое и расшифровка, описание и интерпретация ЭКГ-данных рекомендована всем пациентам с подозрением на ИБС для выявления признаков ишемии в покое (в том числе безболевой ишемии миокарда), а также возможного наличия зубца Q, сопутствующих нарушений ритма и проводимости сердца: ЕОК – IС (УУР – С, УДД – 4) [1, 3]. При неосложненной стабильной ИБС специфические ЭКГ-признаки ишемии миокарда вне нагрузки обычно отсутствуют. Единственным достаточно специфичным признаком ИБС на ЭКГ покоя служит зубец Q после перенесенного острого инфаркта миокарда. Изолированные изменения зубца Т мало специфичны и требуют сопоставления с клиникой заболевания и данными других исследований [1].
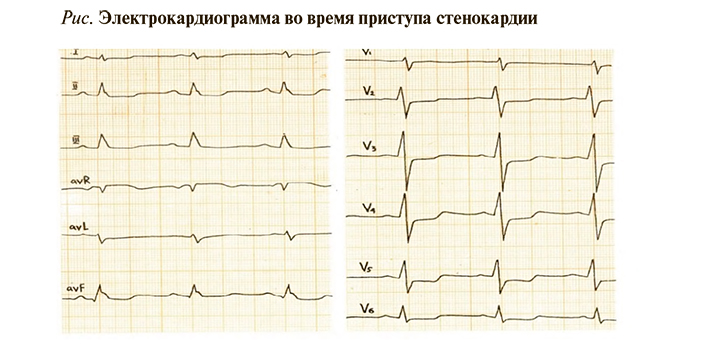
• Регистрация 12-канальной ЭКГ во время или сразу после приступа боли в грудной клетке (рис.) с расшифровкой, описанием и интерпретацией ЭКГ-данных для выявления признаков ишемии рекомендована всем пациентам с подозрением на ИБС: ЕОК IС (УУР – С, УДД – 5) [1, 3]. Регистрация ЭКГ во время болевого приступа в грудной клетке имеет большее значение, чем ЭКГ покоя. Если во время боли изменения на ЭКГ отсутствуют, вероятность ИБС у таких больных снижается, хотя заболевание не исключается полностью. Появление изменений ЭКГ во время болевого приступа или сразу после него существенно повышает вероятность ИБС [1].
• Специфическим ЭКГ-признаком ишемии служит горизонтальная или косонисходящая депрессия сегмента ST глубиной не менее 0,1 мВ продолжительностью не менее 0,06–0,08 с от точки J в одном и более ЭКГ-отведении. Специфическим признаком вазоспазма является транзиторный подъем сегмента ST не менее 0,1 мВ в двух и более отведениях. Ишемические изменения ЭКГ сразу в нескольких отведениях выступают неблагоприятным прогностическим признаком. Чувствительность метода снижается у больных с исходно измененной ЭКГ вследствие рубцовых изменений, внутрижелудочковых блокад, гипертрофии левого желудочка (ЛЖ). Изменения сегмента ST не должны расцениваться как признак ишемии у пациентов с пароксизмом суправентрикулярной тахикардии [1].
6.
• Трансторакальная эхокардиография (ЭхоКГ) в состоянии покоя с использованием допплеровских режимов рекомендована всем пациентам с подозрением на ИБС для: 1) исключения других причин боли в грудной клетке; 2) выявления нарушений локальной сократимости ЛЖ; 3) измерения фракции выброса (ФВ) ЛЖ; 4) оценки диастолической функции ЛЖ; 5) выявления патологии клапанного аппарата сердца: ЕОК IВ (УУР – С, УДД – 4) [1, 3].
• ЭхоКГ в покое предоставляет важную информацию об анатомии и функции сердца. Основная цель этого исследования – оценка систолической и диастолической функции ЛЖ, обнаружение нарушений локальной сократимости, а также исключение других причин боли в грудной клетке, в частности клапанного поражения, перикардита, миокардита, аневризмы восходящей аорты, гипертрофической кардиомиопатии и других заболеваний [1]. Важно помнить, что обнаружение других заболеваний не обязательно исключает ИБС. У пациентов с подозрением на ИБС ФВ ЛЖ часто нормальная. Нарушения локальной сократимости стенок ЛЖ, выявленные при визуальной оценке или с помощью технологий оценки деформации, повышают вероятность обнаружения ИБС у пациентов с нормальной функцией ЛЖ [1]. Сниженная ФВ ЛЖ также повышает вероятность обнаружения ИБС [1].
• Типичными ЭхоКГ-признаками перенесенного острого инфаркта выступают нарушения локальной сократимости на территории кровоснабжения соответствующей артерии. Ранним признаком ИБС или микрососудистой дисфункции может быть нарушенная диастолическая функция ЛЖ [1].
7.
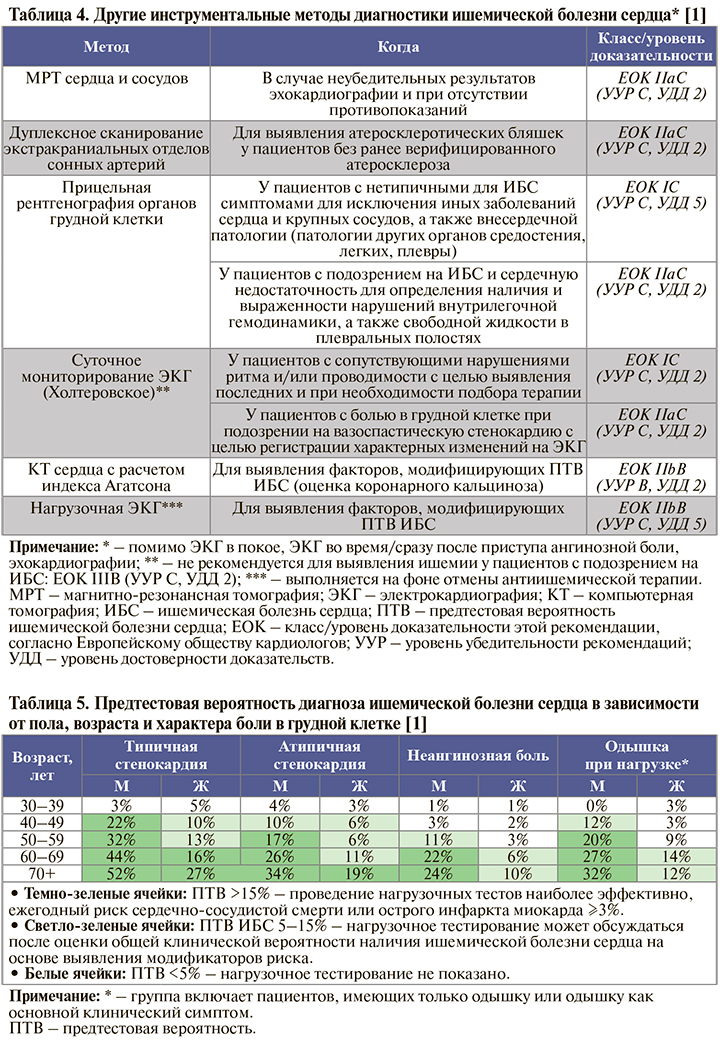
Другие инструментальные исследования, применяемые в определенных обстоятельствах (и при условии доступности) для диагностики ИБС, отражены в таблице 4.
8.
• Выбор дальнейшей стратегии обследования больного зависит от предтестовой вероятности (ПТВ) ИБС (табл. 5) и данных первичного обследования (анамнеза, обследования и лабораторного исследования, ЭКГ в покое, ЭхоКГ в покое и проведенных по показаниям и при возможности рентгенографии грудной клетки, мониторирования ЭКГ, оценки коронарного кальциноза и нагрузочной ЭКГ), модифицирующих ПТВ ИБС. На основании этих данных принимается решение о необходимости выполнения дополнительных специфических неинвазивных и инвазивных тестов, имеющих высокую чувствительность при диагностике ИБС [1].
• Факторами, повышающими ПТВ ИБС, рекомендуется считать [1]:
– факторы риска ССЗ (семейный анамнез ССЗ, дислипидемия, сахарный диабет, артериальная гипертензия, курение, ожирение);
– наличие зубца Q или изменения сегмента ST–T на ЭКГ;
– дисфункцию ЛЖ;
– патологическую нагрузочную ЭКГ;
– кальциноз коронарных артерий (EOK – IС; УУР – В, УДД – 2).
В свою очередь, факторами, снижающими ПТВ ИБС, считают отрицательные результаты нагрузочной ЭКГ и отсутствие коронарного кальция (индекс Агатстона = 0) при компьютерной томографии (EOK – IС; УУР – В, УДД – 2) [1].
• Клинические факторы, модифицирующие ПТВ ИБС, не являются самостоятельными специфическими признаками ИБС, но повышают или понижают вероятность заболевания и риск развития сердечно-сосудистых осложнений [1].
9.
Пациентам с очень низкой ПТВ ИБС (<5%) в отсутствие факторов, повышающих этот показатель, факторов высокого риска сердечно-сосудистых осложнений или при наличии факторов, снижающих ПТВ ИБС, рекомендуется ограничиться проведенной оценкой ПТВ ИБС и первичным обследованием, позволяющими убедительно отвергнуть диагноз ИБС: EOK – IС (УУР – В, УДД – 2) [1]. Подавляющее большинство больных этой категории в популяционных исследованиях не имеют стенозов коронарных артерий >50% и сниженного фракционного резерва кровотока ≤0,80 при последующем инвазивном обследовании. Поэтому оценки ПТВ ИБС и первичных симптомов достаточно, чтобы убедительно отвергнуть ИБС. Дополнительное использование неинвазивных визуализирующих методов не повышает диагностическую точность в этой группе, но существенно увеличивает стоимость и длительность диагностики [1].
10.
• Пациентам с умеренной ПТВ ИБС (>15%), низкой ПТВ ИБС (5–15%) + типичными симптомами и/или факторами, повышающими ПТВ, и/или факторами высокого риска сердечно-сосудистых осложнений, а также больным с очень низкой ПТВ ИБС (<5%) + факторами высокого риска сердечно-сосудистых осложнений рекомендуется проведение дополнительных специфических неинвазивных визуализирующих тестов для подтверждения или исключения диагноза ИБС: EOK I С (УУР В, УДД 2) [1].
• При ПТВ 5–15% большинство больных в популяционных исследованиях не имеет стенозов коронарных артерий >50% и сниженного фракционного резерва кровотока ≤0,80 при последующем инвазивном обследовании. Однако выполнение дополнительных неинвазивных визуализирующих методов диагностики у пациентов с факторами риска и/или изменениями на ЭКГ покоя/нагрузки способны повысить точность диагностики гемодинамически значимых коронарных стенозов [1].
• В качестве первого неинвазивного визуализирующего теста для диагностики ИБС (в отсутствие противопоказаний) рекомендуется один из следующих неинвазивных визуализирующих стресс-методов выявления ишемии миокарда: ЭхоКГ с физической нагрузкой или с чреспищеводной стимуляцией или с фармакологической нагрузкой; сцинтиграфия миокарда с функциональными пробами; позитронно-эмиссионная томография миокарда: EOK – IB (УУР – B, УДД – 1) [1].
Лечение
1.
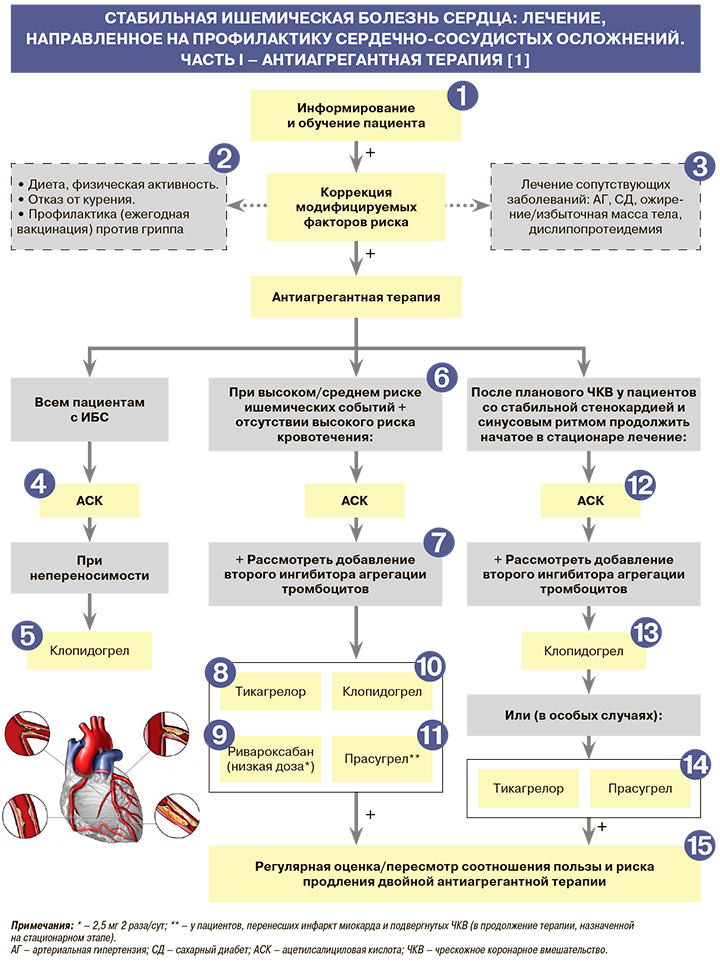
• Информирование и обучение – необходимый компонент лечения, поскольку правильно информированный и обученный больной более тщательно выполняет врачебные рекомендации и может самостоятельно принимать важные решения в зависимости от симптомов заболевания. Следует обсудить с пациентом перспективы как медикаментозного, так и хирургического лечения выявленной у него формы ИБС, а также оговорить необходимость и периодичность дальнейших инструментальных и лабораторных исследований. Рекомендуется рассказать о самых типичных симптомах нестабильной стенокардии, острого инфаркта миокарда и подчеркнуть важность своевременного обращения за помощью при их появлении, дать больному конкретные советы по здоровому образу жизни и важности правильного лечения сопутствующих заболеваний [1].
2.
• При выявлении избыточной массы тела рекомендуется ее снижение с помощью дозированных физических нагрузок и низкокалорийной диеты. При необходимости рекомендуется направить пациента к врачу-диетологу для коррекции диеты и/или подбора медикаментозного лечения ожирения: EOK I С (УУР C, УДД 5) [1, 3].
• Всем пациентам со стабильной ИБС рекомендуется соблюдение специальной диеты и регулярный контроль массы тела: EOK I С (УУР C, УДД 5) [1, 3]. Основная цель диетотерапии при этом заболевании – снижение избыточной массы тела (нормальный ИМТ –18,5–24,9 кг/м2) и уровня общего холестерина (ОХС) крови. Строгой диетой можно добиться снижения уровня ОХС плазмы на 10–15%. Снижение избыточной массы тела снижает риск общей и сердечно-сосудистой смерти [1].
• Основные требования к диете при стабильной ИБС [1]:
– энергетическая ценность до 2000 ккал/сут;
– содержание ОХС в пище до 300 мг/сут;
– обеспечение за счет жиров не более 30% энергетической ценности пищи.
• Целесообразно рекомендовать увеличение в пищевом рационе содержания свежих фруктов и овощей (более 200–300 г/сут), пищевых волокон, цельных зерен, уменьшение употребления сладкого и сладких газированных напитков. Следует ограничивать употребление жирных сортов мяса, вообще красного мяса и гастрономических продуктов. Полезно употребление рыбы 2 раза в неделю. Больным ИБС, особенно с сопутствующей АГ, следует ограничивать употребление поваренной соли до 5 г/сут. Употребление 1–2 порций алкоголя в сутки безопасно для пациентов с ИБС [1].
• Наиболее приемлемые типы нагрузки при ИБС – ходьба, прогулки, плавание. Физическая нагрузка оказывает многочисленные положительные эффекты на факторы риска и физиологические процессы в сердечно-сосудистой системе: тренирующий эффект с увеличением толерантности к физической нагрузке, повышение уровня холестерина липопротеидов высокой плотности (ХС ЛПВП), снижение массы тела, уменьшение психологического стресса, положительные эмоции, особенно при занятиях в группах. Увеличение пикового потребления кислорода на 1 мл/кг/мин сопровождается снижением риска сердечно-сосудистых заболеваний на 14–17% и смерти от всех причин. Малоподвижный образ жизни, напротив, влияет на больного ИБС неблагоприятно [1].
• Курящим пациентам настоятельно рекомендуется отказ от курения при помощи не только изменения поведенческой стратегии, но и использования фармакологической поддержки; необходимо избегать также пассивного курения: EOK IС (УУР C, УДД 5) [1, 3].
• Пациентам с ИБС, особенно пожилым, рекомендована ежегодная вакцинация против гриппа для снижения риска сердечно-сосудистых осложнений и улучшения качества жизни: EOK – IВ (УУР – С, УДД – 5) [1, 3].
3.
• Повышенное АД – важнейший фактор риска развития атеросклероза и осложнений ИБС. Поэтому при сопутствующей артериальной гипертензии (АГ) рекомендуется включать в состав медикаментозной терапии антигипертензивные средства для достижения целевого уровня АД <140/80 мм рт.ст. (первичная цель), при условии хорошей переносимости и в возрасте до 65 – <130/80 мм рт.ст. (вторичная цель), но не менее 120 и 70 мм рт.ст.: EOK – IВ (УУР – B, УДД – 1) [1].
• Нарушение углеводного обмена и сахарный диабет (СД) увеличивают риск сердечно-сосудистых осложнений у мужчин в 3 раза, а у женщин в 5 раз по сравнению с лицами без СД. В связи с этим у больных стабильной ИБС при сопутствующем СД рекомендуется достижение целевых уровней гликемии (гликированного гемоглобина) с помощью диеты и гипогликемических средств. Важно при этом избегать эпизодов гипогликемии, которые ухудшают прогноз у пациентов с ИБС. При необходимости рекомендуется направлять пациента к врачу-эндокринологу для коррекции диеты и/или медикаментозного лечения: EOK – IС (УУР – C, УДД – 5) [1, 3].
• Получены данные, свидетельствующие о благоприятном прогнозе на течение ИБС, гипогликемических средств из групп ингибиторов натрийзависимого котранспортера глюкозы 2-го типа и аналогов глюкагоноподобного пептида-1, в том числе у лиц, перенесших инфаркт миокарда, а также имеющих сердечную недостаточность с низкой ФВ ЛЖ [1].
5.
• Для профилактики сердечно-сосудистых осложнений всем пациентам со стабильной ИБС в качестве ингибитора агрегации тромбоцитов рекомендуется назначение ацетилсалициловой кислоты (АСК) в дозе 75–100 мг/сут: EOK – IA (УУР – А, УДД – 1) [1, 5]. АСК остается самым распространенным и доступным антиагрегантом и в отсутствие противопоказаний должна быть назначена всем больным со стабильной ИБС [1].
• Возможность назначения АСК 75–100 мг/сут с целью профилактики сердечно-сосудистых осложнений рекомендуется также рассмотреть у больных без клинических проявлений стенокардии, но с поражением коронарных артерий по данным визуализирующих методов [1].
При непереносимости АСК в качестве альтернативного ингибитора агрегации тромбоцитов для профилактики кардиоваскулярных осложнений пациентам со стабильной ИБС рекомендуется назначить клопидогрел в дозе 75 мг/сут: EOK – IB (УУР – А, УДД – 2) [1, 6]. Нет данных о преимуществах других ингибиторов агрегации тромбоцитов (прасугрела и тикагрелора) перед АСК или клопидогрелом у больных стабильной ИБС. Применение тикагрелора можно рассмотреть в крайних случаях у пациентов, не переносящих ни АСК, ни клопидогрел [1].
6.
Факторы высокого и среднего риска ишемических событий, а также высокого риска кровотечений приведены в таблице 6.

7.
У пациентов со стабильной ИБС, имеющих высокий риск ишемических событий и не имеющих высокого риска кровотечения (см. табл. 6), рекомендуется рассмотреть возможность присоединения к АСК второго ингибитора агрегации тромбоцитов. При этом соотношение пользы и риска продления такой терапии должно регулярно пересматриваться: EOK – IIaA (УУР – А, УДД – 2) [1, 7–10]. Аналогичная рекомендация применима и к пациентам со средним риском ишемических событий и без высокого риска кровотечения: EOK – IIbA (УУР – В, УДД – 2) [1, 7–10].
8.
У пациентов со стабильной ИБС, перенесших инфаркт миокарда и не имевших кровотечений в первый год двойной терапии ингибиторами агрегации тромбоцитов, рекомендуется рассмотреть возможность ее продления в виде сочетания АСК с уменьшенной дозой тикагрелора (60 мг 2 раза/сут) вплоть до 36 мес для профилактики атеротромботических сердечно-сосудистых событий: EOK – IIaB (УУР – B, УДД – 2) [1, 10].
9.
У пациентов со стабильной ИБС, высоким риском тромботических осложнений и невысоким риском кровотечений рекомендуется рассмотреть возможность длительного использования АСК 75–100 мг в сочетании с ингибитором фактора Ха ривароксабаном в дозе 2,5 мг 2 раза/сут для профилактики развития атеротромботических сердечно-сосудистых событий: EOK – IIaB (УУР – A, УДД – 2) [1, 9]. В исследовании COMPASS сочетание ривароксабана 2,5 мг 2 раза/сут с АСК сравнивалось с монотерапией АСК, а также с монотерапией ривароксабаном в дозе 5 мг 2 раза/сут у пациентов со стабильной ИБС или заболеванием периферических артерий. Применение «сосудистой» дозы ривароксабана продемонстрировало снижение ишемических событий, в том числе сердечно-сосудистой смерти, при одновременном увеличении риска преимущественно не жизнеугрожающих кровотечений [1, 9].
10.
При приеме комбинации АСК 75–100 мг и клопидогрела 75 мг/сут у пациентов со стабильной ИБС, перенесших инфаркт миокарда и не имевших кровотечений в течение первого года терапии, рекомендуется рассмотреть возможность ее продления на больший срок для профилактики сердечно-сосудистых осложнений: EOK – IIaB (УУР – B, УДД – 2) [1, 7]. Отметим, что на фармрынке России, кроме монопрепаратов АСК и клопидогрела, представлены их фиксированные комбинации в дозах 100 мг + 75 мг и 75 мг + 75 мг [11].
11.
У пациентов со стабильной ИБС, перенесших инфаркт миокарда и подвергнутых чрескожному коронарному вмешательству (ЧКВ), для профилактики сердечно-сосудистых осложнений рекомендуется рассмотреть возможность продления терапии АСК (75–100 мг/сут) с прасугрелом в дозе 10 мг/сут (5 мг/сут при массе тела менее 60 кг или возрасте старше 75 лет) более 1 года: EOK – IIаB (УУР – B, УДД – 2) [1, 7].
12.
Пациентам со стабильной стенокардией после планового ЧКВ рекомендуется продолжить прием АСК в дозе 75–100 мг/сут для профилактики сердечно-сосудистых осложнений: EOK – IA (УУР – А, УДД – 2) [1, 12, 13].
13.
Пациентам со стабильной стенокардией после планового ЧКВ к АСК рекомендуется добавить клопидогрел в поддерживающей дозе 75 мг/сутки (в случае приема поддерживающей дозы менее 5 дней рекомендуется добавление нагрузочной дозы клопидогрела 600 мг) на 6 мес после стентирования вне зависимости от типа установленного стента для коронарных артерий. В случае возникновения жизнеугрожающего кровотечения или его высокого риска продолжительность приема клопидогрела может быть уменьшена до 3 мес, а в случае очень высокого риска кровотечения – до 1 мес:
EOK – IA (УУР – С, УДД – 5) [1, 14].
14.
• В особых случаях при плановом стентировании, сопровождающемся высоким риском осложнений (неоптимальное позиционирование стента для коронарных артерий, другие осложнения ЧКВ, повышающие риск тромбоза стента для коронарных артерий, ЧКВ на стволе левой коронарной артерии или множественное стентирование коронарных артерий, а также при непереносимости АСК), рекомендуется рассмотреть возможность использования в качестве антиагрегантов прасугрела или тикагрелора [1, 15] по крайней мере в период начальной терапии для профилактики сердечно-сосудистых осложнений. Баланс эффективности и безопасности применения прасугрела или тикагрелора по сравнению с клопидогрелом после ЧКВ у больных стабильной стенокардией и высоким ишемическим риском не исследован. Возможность применения прасугрела или тикагрелора изучалась лишь в единичных фармакодинамических исследованиях [1].
15.
• Для определения целесообразности продления двойной антитромбоцитарной терапии в случае сочетания АСК с клопидогрелом/тикагрелором/прасугрелом после 12-месячного курса можно использовать валидированную шкалу DAPT (табл. 7).

16.
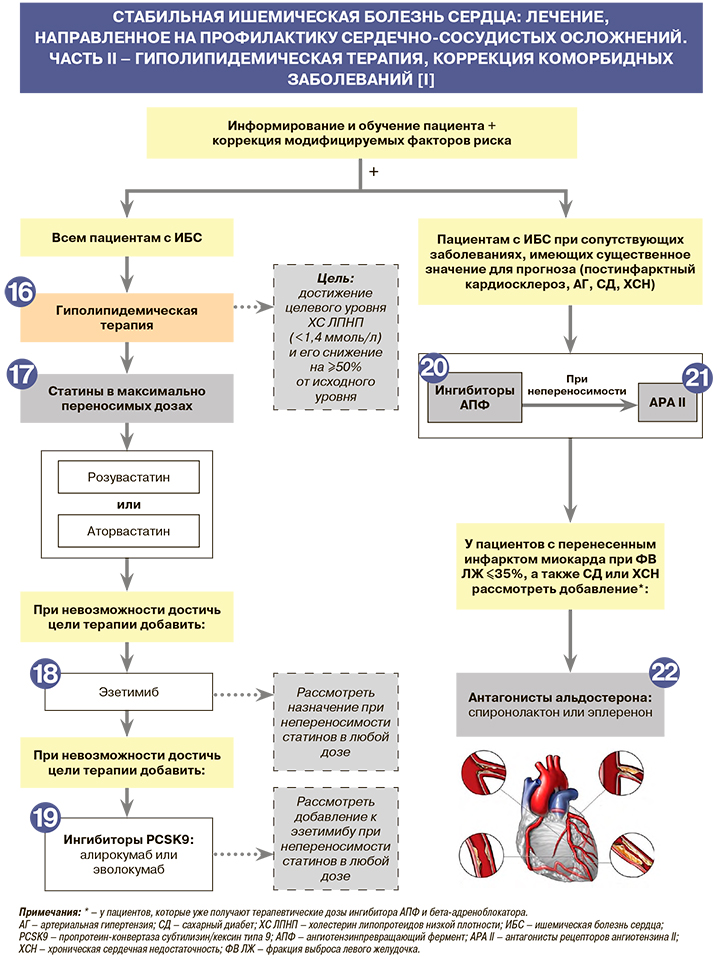
• Все пациенты с хронической ИБС относятся к категории лиц очень высокого риска, поэтому для профилактики сердечно-сосудистых осложнений им всем рекомендуется коррекция дислипидемии с использованием мероприятий по здоровому образу жизни и оптимальной медикаментозной терапии: EOK – IA (УУР – C, УДД – 5) [1, 3, 4].
17.
• Для профилактики сердечно-сосудистых осложнений всем пациентам со стабильной ИБС рекомендуется назначать статины (ингибиторы ГМГ-КоА-редуктазы) в максимально переносимой дозировке до достижения целевого уровня холестерина липопротеидов низкой плотности (ХС ЛПНП <1,4 ммоль/л) и его снижения на ≥50% от исходного уровня: EOK – IA (УУР – C, УДД – 5) [1, 17].
• При всех формах ИБС терапию статинами нужно начинать сразу после установления диагноза независимо от уровней ОХС и ХС ЛПНП (в отсутствие прямых противопоказаний). Доказано, что снижение уровней ОХС и ХС ЛПНП в крови сопровождается снижением общей смертности в популяции и риска всех сердечно-сосудистых осложнений приблизительно на 20%. В случае отсутствия побочных эффектов липидоснижающая терапия при хронической ИБС проводится неопределенно долго [1, 17].
• В порядке убывания величины гиполипидемического эффекта зарегистрированные в России статины располагаются следующим образом: розувастатин (максимальная суточная доза 40 мг), аторвастатин (максимальная суточная доза 80 мг), питавастатин (максимальная суточная доза 4 мг), симвастатин (максимальная суточная доза 80 мг), флувастатин (максимальная суточная доза 80 мг) [11, 18]. Некоторые из них представлены в России не только монопрепаратами, но и фиксированными комбинациями с другими лекарственными средствами, применяемыми в комплексной терапии стабильной ИБС: аторвастатин + АСК, аторвастатин + амлодипин, аторвастатин + амлодипин + периндоприл; розувастатин + валсартан, розувастатин + эзетимиб; симвастатин + эзетимиб [11].
• Перед назначением статина, помимо определения целевого уровня ХС ЛПНП в соответствии с категорией риска, следует подсчитать в процентах степень снижения ХС ЛНП, необходимого для достижения этого уровня, и выбрать препарат, который может обеспечить искомую цель. Процент достигаемого снижения ХС ЛПНП при приеме различных статинов в различных суточных дозах отражен в таблице 8. Максимальное снижение ХС ЛНП (на 50–55%) возможно при использовании высоких доз розувастатина и аторвастатина [18].

• Согласно данным рандомизированного двойного слепого плацебо-контролируемого клинического исследования JUPITER, оригинальный розувастатин в группе пациентов с высоким сердечно-сосудистым риском (n=17 802) при приеме в дозе 20 мг/сут достоверно снижает риск смерти от любой причины на 20% (отношение рисков (ОР) 0,80; 95% доверительный интервал (ДИ): 0,67–0,97; p=0,02) [19].
• В 26-недельном двойном слепом рандомизированном исследовании POLARIS было показано, что у пациентов среднего и пожилого возраста с ИБС и высоким коронарным риском (n=871) розувастатин в дозе 40 мг/сут достоверно более выраженно снижал уровень ХС ЛПНП через 8 нед терапии, чем аторвастатин 80 мг/сут: (-56 против -52%; p <0,001). Кроме того, розувастатин в большей степени повышал уровень ХС ЛПВП (+9,6 против +4,4%; p <0,05) [20].
• По данным открытого рандомизированного исследования ECLIPSE, у 522 больных ИБС или ее эквивалентами с исходным ХС ЛПНП 160–250 мг/дл на фоне приема розувастатина в дозе 40 мг/сут целевой уровень ХС ЛПНП через 24 нед терапии был достигнут у 83,6% пациентов [21].
• У пациентов с умеренным сердечно-сосудистым риском розувастатин эффективен в отношении вторичных конечных точек в сравнении с плацебо: в рандомизированном плацебо-контролируемом исследовании НОРЕ-3 (n=12 705) на фоне приема этого статина в дозе 10 мг/сут наблюдалось снижение частоты обострений ИБС (1,7 против 2,2%; p=0,02) и госпитализаций (4,4 против 5,8%; p <0,001). Кроме того, отмечалась достоверно более высокая эффективность розувастатина 10 мг/сут в отношении первой первичной конечной точки: частота сердечно-сосудистой смерти/инфаркта миокарда/инсульта в группе активной терапии составила 3,7 против 4,8% в группе плацебо (ОР 0,76; 95% ДИ: 0,64–0,91; p=0,002). Схожая разница в пользу розувастатина наблюдалась и для второй первичной конечной точки исследования: частота сердечно-сосудистой смерти/инфаркта миокарда/инсульта/внезапной смерти/сердечной недостаточности/реваскуляризации в группе активной терапии равнялась 4,4 против 5,7% в группе плацебо (ОР 0,75; 95% ДИ: 0,64–0,88; p <0,001) [22].
• Ответ пациента на терапию (степень эффективности, переносимость) рекомендуется оценивать через 6–8 нед после начала приема статинов или при изменении дозы препарата. Стандартная практика последующего мониторинга предполагает проведение повторного анализа через 6–12 мес. Целесообразно наряду с определением липидного профиля оценивать приверженность пациентов к соблюдению рекомендаций по изменению образа жизни и приему назначенных препаратов [18].
18.
• У пациентов с ИБС, перенесших в течение 2 лет на фоне липидоснижающей терапии повторное сердечно-сосудистое событие, рекомендуется рассмотреть возможность комбинированной липидоснижающей терапии для достижения целевого уровня ХС ЛПНП <1,0 ммоль/л: EOK – IIbB (УУР – C, УДД – 5) [1, 17].
• При невозможности достижения у пациентов со стабильной ИБС целевого уровня ХС ЛПНП (<1,4 ммоль/л) и его снижения на 50% от исходного уровня на фоне максимальных переносимых доз статинов или у пациентов с непереносимостью статинов рекомендуется добавить к лечению ингибитор абсорбции холестерина эзетимиб для профилактики сердечно-сосудистых осложнений: EOK IB (УУР C, УДД 5) [1, 17]. Как уже отмечалось выше, эзетимиб зарегистрирован в России не только в виде монопрепаратов, но и фиксированных комбинаций со статинами (с аторвастатином и розувастатином) [11].
19.
• У пациентов со стабильной ИБС при невозможности достижения целевого уровня ХС ЛПНП, несмотря на применение максимальной переносимой дозы статина в комбинации с эзетимибом, или у пациентов с непереносимостью статинов для профилактики сердечно-сосудистых осложнений рекомендуется назначить один из ингибиторов пропротеиновой конвертазы субтилизин-кексинового 9-го типа (PCSK9) – алирокумаб или эволокумаб: EOK – IIaА (УУР – А, УДД – 2) [1, 18]. При этом широкое применение ингибиторов PCSK9 ограничено нерешенным вопросом финансирования такой терапии из-за ее высокой стоимости [1].
20.
• У пациентов со стабильной ИБС при сопутствующих заболеваниях, имеющих существенное значение для прогноза (постинфарктный кардиосклероз, АГ, СД, ХСН), для профилактики сердечно-сосудистых осложнений рекомендуется назначать ингибиторы АПФ или антагонисты рецепторов ангиотензина II (АРА II): EOK – IA (УУР – C, УДД – 5) [1, 3].
• Ингибиторы АПФ снижают общую смертность, риск развития инфаркта миокарда, инсульта и прогрессирования ХСН у пациентов, перенесших инфаркт, а также при сопутствующем СД. Назначение ингибиторов АПФ пациентам со стабильной ИБС особенно показано при наличии АГ, ХСН при ФВ ЛЖ <40%, хронических заболеваниях почек с начальной и умеренной азотемией. Из препаратов этого класса при наличии ИБС назначают периндоприл и рамиприл [1].
21.
АРА II применяют при непереносимости ингибиторов АПФ по тем же показаниям.
Из препаратов этого класса при ИБС назначают лозартан, валсартан, кандесартан [1, 3].
22.
Возможность назначения антагонистов альдостерона – спиронолактона (25 мг/сут) или эплеренона (25 мг/сут с повышением дозы через 4 нед до 50 мг/сут с контролем калия в сыворотке крови) – рекомендуется рассмотреть для профилактики сердечно-сосудистой смерти у пациентов, перенесших инфаркт миокарда, которые уже получают терапевтические дозы ингибитора АПФ и бета-адреноблокатора, имеют ФВ ЛЖ ≤35%, а также СД или ХСН: EOK – IIbB (УУР – B, УДД – 2) [1, 23, 24]. Следует соблюдать осторожность при применении антагонистов альдостерона у пациентов с нарушением функции почек (рСКФ <45 мл/мин/1,73 м2) и у пациентов с уровнем калия в сыворотке крови >5,0 ммоль/л [1, 25].
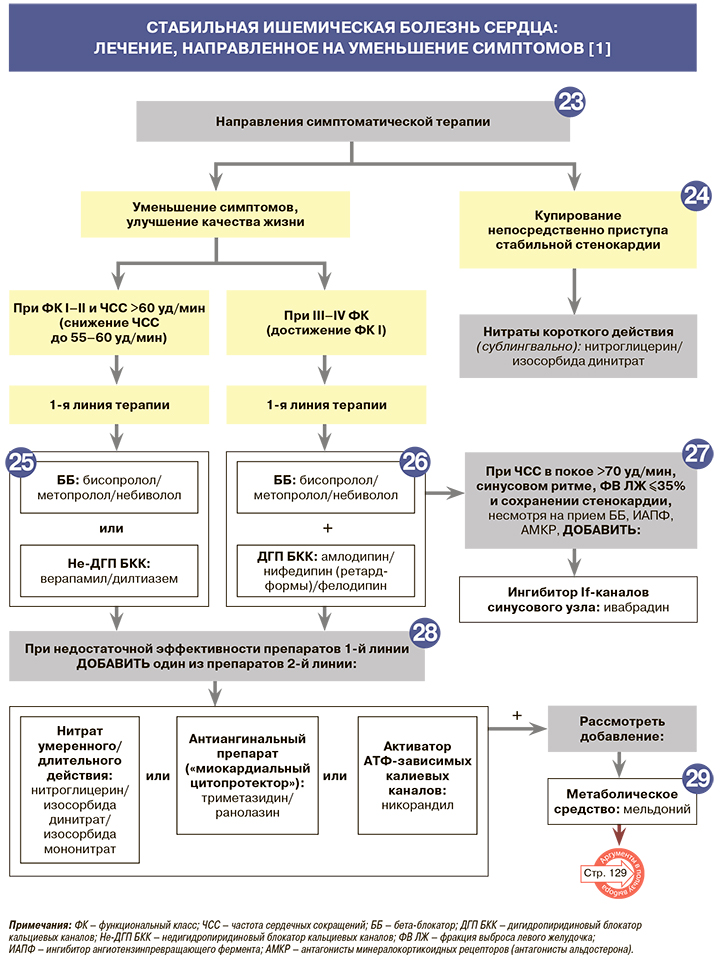
23.
Пациентам со стабильной ИБС рекомендуется назначить как минимум один препарат для устранения стенокардии/ишемии миокарда и улучшения качества жизни: EOK – IС (УУР – C, УДД – 5) [1]. У всех пациентов с ИБС целесообразно оценивать эффективность назначенного лечения в ближайшее время (через 3–5 дней) и через 2–4 нед после начала терапии для проведения в случае необходимости ее дальнейшей коррекции. Критериями такой оценки служат частота приступов стенокардии в неделю, потребность в приеме короткодействующих нитратов, расстояние, которое пациент проходит до появления приступов стенокардии, или его возможности подъема по лестнице. Для этого целесообразно рекомендовать пациентам ведение дневников самочувствия. В ряде случаев целесообразно выполнять нагрузочный тест для определения динамики толерантности к физической нагрузке [1].
24.
• Для устранения непосредственно приступа стабильной стенокардии (обезболивания) рекомендуется назначать органические нитраты короткого действия: EOK – I B (УУР – С, УДД – 5) [1]. С этой целью используют короткодействующие препараты нитроглицерина либо изосорбида динитрата – в таблетках под язык или в форме спрея для аппликации (распрыскивания) на слизистую оболочку полости рта. Эффект наступает через 1,5–2 мин после приема таблетки или ингаляции и достигает максимума через 5–7 мин [1].
• Если приступ стенокардии не купируется в течение 15–20 мин, в том числе после повторного приема нитроглицерина или изосорбида динитрата, возникает угроза развития инфаркта миокарда [1].
25.
• При стабильной стенокардии I–II ФК и ЧСС >60 уд/мин рекомендуется назначить в качестве препарата 1-й линии бета-блокатор (ББ) ИЛИ недигидропиридиновый блокатор «медленных» кальциевых каналов (БКК, верапамил или дилтиазем) для снижения ЧСС до значений 55–60 уд/мин: EOK – IС (УУР – C, УДД – 5) [1].
• ББ не только устраняют симптомы заболевания (стенокардию), оказывают антиишемическое действие и улучшают качество жизни больного, но и способны улучшить прогноз после перенесенного инфаркта миокарда (в течение первого года), а также у больных с низкой ФВ ЛЖ и ХСН. Для лечения стенокардии ББ назначают в минимальной дозе, которую при необходимости постепенно повышают до полного устранения приступов стенокардии или достижения максимально допустимой дозы. Следует отметить, что при приеме этой группы лекарственных средств наибольшее снижение потребности миокарда в кислороде и прирост коронарного кровотока достигается при ЧСС 55–60 уд/мин [1].
• Недигиропиридиновые БКК (дилтиазем и верапамил) действуют преимущественно на миокард. Они уменьшают ЧСС, угнетают сократимость миокарда и атриовентрикулярную проводимость, оказывают антиаритмическое действие. В этом недигидропиридиновые ритмурежающие БКК схожи с ББ [1].
• Не рекомендуется комбинированное назначение ББ с недигиропиридиновыми БКК (верапамилом, дилтиаземом) у всех пациентов со стабильной ИБС из-за риска суммирования побочных эффектов: EOK – IIIС (УУР – C, УДД – 5) [1].
• Не рекомендуется одновременное назначение дигидропиридиновых БКК с не-ДГП-БКК (верапамилом, дилтиаземом) у всех пациентов со стабильной ИБС из-за риска суммирования побочных эффектов: EOK – IIIС (УУР – C, УДД – 5) [1, 26].
26.
• При стабильной стенокардии III–IV ФК рекомендуется сразу назначить комбинацию бета-блокатора с дигидропиридиновым блокатором «медленных» кальциевых каналов для достижения ФК I: EOK – IС (УУР – C, УДД – 5) [1]. Поскольку приступы стенокардии (эпизоды ишемии) возникают вследствие повышения потребности миокарда в кислороде, лечение, направленное на снижение ЧСС и АД, патогенетически обосновано [1].
• БКК по антиангинальной эффективности сопоставимы с ББ. Дигидропиридиновые БКК (амлодипин, нифедипин пролонгированного действия, фелодипин) преимущественно действуют на тонус артериол, снижая постнагрузку, улучшая кровоток и доставку кислорода в ишемизированной зоне сердца. Одновременно они могут повышать ЧСС и снижать системное АД [1].
• Наилучшие результаты по профилактике ишемии БКК показывают у больных с вазоспастической стенокардией. Эти препараты обладают рядом преимуществ перед другими антиангинальными и антиишемическими средствами и могут применяться у более широкого круга больных с сопутствующими заболеваниями, чем ББ. Препараты этого класса рекомендуется назначать при сочетании стабильной стенокардии с АГ [1, 2].
У пациентов со стабильной ИБС особых групп (пожилой возраст, почечная и печеночная недостаточности) применение препаратов необходимо осуществлять в соответствии с инструкцией по безопасному использованию (при необходимости допустимо снижение дозировки) [1].
• БКК также назначают в случаях, когда ББ противопоказаны или не переносятся [1].
27.
• Пациентам с синусовым ритмом, ФВ ЛЖ <35% и ЧСС покоя >70 уд/мин при сохранении стенокардии, несмотря на прием ББ, ингибиторов АПФ и антагонистов минералокортикоидных рецепторов (антагониста альдостерона), для снижения риска смертности рекомендуется назначение ивабрадина: EOK IIa – B (УУР – C, УДД – 5) [1].
• Назначать ивабрадин пациентам со стабильной стенокардией рекомендуется также в случае ЧСС >80 уд/мин и синусового ритма при наличии противопоказаний к назначению БАБ или не-ДГП-БКК (верапамил, дилтиазем): EOK – IIa C (УУР – C, УДД – 5) [1, 2].
• Не рекомендуется одновременное назначение ивабрадина и не-ДГП-БКК (верапамила, дилтиазема) у пациентов со стабильной ИБС, за исключением случаев, когда, несмотря на комбинированную терапию в максимально переносимых дозах, сохраняется ЧСС >80 уд/мин [1, 2].
28.
При недостаточной эффективности препаратов 1-й линии у пациентов со стабильной стенокардией рекомендуется добавить к лечению один из препаратов 2-й линии (нитраты пролонгированного действия или ивабрадин или триметазидин, ранолазин или никорандил) в зависимости от АД, ЧСС и переносимости профилактики приступов стенокардии и достижения ФК I: EOK – IIa B (УУР – C, УДД – 5) [1, 2].
29.
• К лекарственным препаратом из группы метаболических средств, показанных для применения в комплексной терапии ИБС, относится мельдоний [26]. Препарат в условиях ишемии восстанавливает равновесие процессов доставки кислорода и его потребления в клетках, предупреждает нарушение транспорта АТФ. Одновременно с этим мельдоний активирует гликолиз, который протекает без дополнительного потребления кислорода. В результате снижения концентрации карнитина усиленно синтезируется гамма-бутиробетаин, обладающий вазодилатирующими свойствами [26].
• Влияние различных доз мельдония на толерантность к физической нагрузке при стабильной стенокардии II–III ФК было изучено в проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании MILSS I [27, 28]. Пациенты пяти параллельных групп (n=512) в течение 12 нед в дополнение к стандартной терапии ИБС получали мельдоний (100, 300, 1000, 3000 мг) или плацебо. По результатам велоэргометрической пробы, наиболее эффективной дозой мельдония, влияющей на длительность и переносимость физической нагрузки, в комбинации со стандартной терапией стабильной стенокардии оказалась дозировка 500 мг 2 раза/сут [27, 28].
• Дальнейшее наблюдение изучения эффективности в плане переносимости физической нагрузки и безопасности мельдония в комбинации со стандартной терапией при стабильной стенокардии было продолжено в двойном слепом плацебо-контролируемом исследовании MILSS II [27, 29], которое проводилось в 37 центрах тех же четырех стран в течение 13 мес. В основную группу вошли 317 амбулаторных пациентов (мужчин и женщин) со стабильной стенокардией II–III ФК (средний возраст 60,96 года), в группу плацебо – 110 человек (средний возраст 62,61 года). После первичного скрининга и рандомизации пациенты на протяжении 12 мес принимали милдронат в дозе 500 мг 2 раза/сут. Для оценки толерантности к физической нагрузке применяли велоэргометрический тест исходно и на фоне лечения мельдонием через 12 мес. Продолжительность физической нагрузки после лечения в группе, получавшей мельдоний, значимо возросла по сравнению с исходным значением и группой плацебо – на 6,5 и 10,6% соответственно (р <0,001). Исследователи отметили увеличение времени до появления ангинозной боли и депрессии сегмента ST. При анализе побочных эффектов и лабораторных показателей статистически значимых различий между мельдонием и плацебо выявлено не было, что свидетельствовало о хорошей переносимости исследуемого препарата [27, 29].



