Диагностика
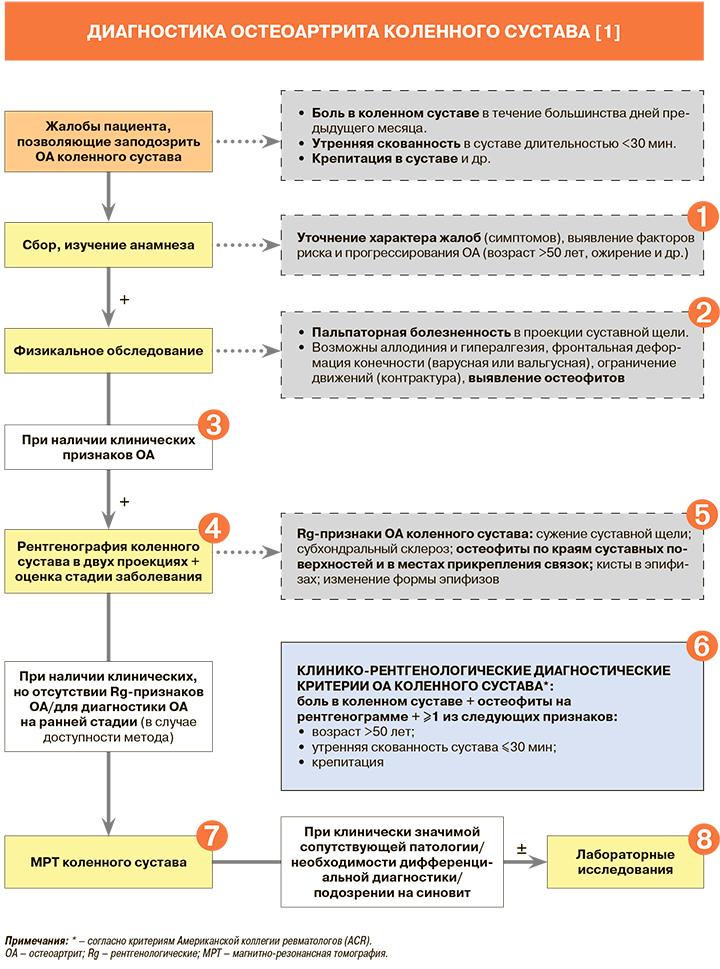
1.
• При обследовании пациента с подозрением на остеоартрит (ОА) коленного сустава рекомендован тщательный сбор анамнеза и проведение полноценного клинического осмотра: уровень убедительности рекомендаций (УУР) – В, уровень достоверности доказательств (УДД) – 3 [1].
• Ведущим клиническим симптомом деформирующего остеоартрита (ОА) коленного сустава является боль, усиливающаяся при движениях или нагрузке на сустав, к концу дня, при охлаждении и в сырую погоду. Интенсивность болевого синдрома прямо не коррелирует со стадией заболевания и степенью морфологических изменений в суставе [1].
• На ранних стадиях боль болевой синдром носит непостоянный характер и может самопроизвольно купироваться. Тем не менее интегральные показатели выраженности боли нередко сопоставимы с терминальной стадией заболевания [1].
• Для боли при ОА характерно постепенное начало. Боль может быть как диффузной, так и локальной, сопровождатьсч умеренным отеком (припухлостью) и легкой крепитацией. Возможны жалобы пациента на «стартовые боли», т.е. боли, возникающие после периодов покоя и проходящие на фоне двигательной активности. При более выраженных стадиях ОА может отмечаться ночная боль, свидетельствующая о присоединении воспалительного компонента [1].
• Скованность движений при ОА может наблюдаться утром, или после периода покоя: она непродолжительна и проходит после начала движений через несколько минут [1].
• По мере прогрессирования патологического процесса боль приобретает хронический характер, появляются ограничение амплитуды движений в суставах (контрактура), крепитация, деформация (варусная или вальгусная) сустава и увеличение его в размерах, периодические синовиты [1].
• Хроническая боль при ОА приводит к миостатическому дисбалансу и нарушению сенсомоторной функции, в результате чего развивается атрофия мышц, вызывающая вторичные функциональные нарушения [1]. Ухудшение проприоцепции влечет мышечную слабость в сочетании с повышением чувства «разболтанности» сустава [1].
В результате этого пациенты испытывают затруднения при приседании или опоре на колено, подъеме или спуске по лестнице, а также подъеме со стула или кресла [1].
Постепенно происходит изменение походки – появляется хромота и необходимость в дополнительной опоре при ходьбе [1].
• К факторам, ассоциированным с развитием и прогрессированием ОА коленного сустава, относятся [1]:
– возраст >50 лет;
– ожирение (при индексе массы тела >30 риск раннего ОА увеличивается втрое);
– изменение оси нижней конечности (в любой из трех плоскостей) или дисплазия бедренно-надколенникового сочленения;
– уменьшение объема и силы мышц нижней конечности;
– любое нарушение нормальной биомеханики сустава;
– травматическое повреждение хряща, связок и менисков, внутрисуставные переломы мыщелков бедренной и большеберцовой костей, а также надколенника;
– воспаление в синовиальной оболочке любой этиологии, включая гемартроз (кровоизлияние в полость сустава);
– полиморфизм отдельных генов (как структурных, так и регуляторных).
2.
• Рекомендовано выполнить ортопедический осмотр и оценку функции сустава: оценку общего состояния пациента, функции пораженных суставов, а также измерения его роста и массы тела: УУР – С, УДД – 5 [1].
• Пальпаторная болезненность в проекции суставной щели при объективном обследовании пациента с подозрением на ОА максимально выражена в области пораженного отдела коленного сустава. При преимущественной локализации процесса в бедренно-надколенниковом сочленении болезненность может превалировать при пальпации и смещении надколенника [1].
• Причиной возможного формирования при ОА хронического болевого синдрома, сопровождающегося механической аллодинией и гипералгезией, служит постоянная ирритация периферической и центральной нервной системы [1].
• По мере прогрессирования ОА коленного сустава появляется фронтальная деформация конечности (варусная или вальгусная) и ограничение движений (контрактура) вначале при сгибании, а затем и разгибании коленного сустава, выраженность которых уточняется во время осмотра. В дальнейшем деформация и контрактура принимают фиксированный характер. При синовите коленного сустава положительным становится симптом баллотирования надколенника (патологическое колебание сесамовидной кости, которая входит в состав коленного сустава) [1].
3.
Клинические критерии ОА коленных суставов Американской коллегии ревматологов (ACR), приводимые в действующих российских клинических рекомендациях по гонартрозу [1], представлены в таблице 1. Добавим, что, согласно рекомендациям другой зарубежной ассоциации – Европейской лиги против ревматизма (EULAR), диагноз ОА может быть установлен клинически при наличии у пациента следующих признаков: возраст >40 лет + боль в коленном суставе, возникающая при нагрузке + непродолжительная утренняя скованность + функциональные нарушения + ≥1 типичного физикального признака (крепитация, ограничение движений, костные разрастания). Такой подход применим даже в отсутствие видимых изменений на рентгенограммах коленных суставов (сильная рекомендация) [2].

4.
• Всем пациентам с клиническими признаками ОА рекомендовано выполнить рентгенографию коленного сустава в двух проекциях для оценки стадии развития заболевания и определения его этиологического типа: УУР – А, УДД – 1 [1].
• Рентгенография коленного сустава выполняется в прямой (переднезадней) и боковой проекциях. Для дополнительной оценки бедренно-надколенникового сочленения используется аксиальная проекция надколенника в положении лежа на спине или функциональная рентгенография – аксиальная проекция стоя [1].
• При раннем ОА коленного сустава, когда патологический процесс чаще всего локализован преимущественно в одном из отделов бедренно-большеберцового сочленения, снимки в положении лежа на спине малоинформативны. Выявить сужение суставной щели помогает выполнение рентгенографии стоя в заднепрямой проекции с осевой нагрузкой в положении сгибания 30–45° (проекция Розенберга или Lyon–Schuss) [1].
• Наиболее широко используемая рентгенологическая классификация ОА Kellgren & Lawrence отражена в таблице 2. При этом в действующих российских клинических рекомендациях по гонартрозу [1] отмечается, что данная классификация не учитывает наличие и выраженность клинических симптомов ОА. В связи с этим в тех же рекомендациях более предпочтительной признается клинико-рентгенологическая классификация ОА Н.С. Косинской (табл. 3), которая позволяет выбрать наиболее эффективный способ лечения пациента исходя из комплексной характеристики стадии заболевания. Клинико-рентгенологический подход к оценке стадии ОА коленного сустава рекомендуется всем пациентам с целью выявления как выраженности жалоб и функциональных нарушений, так и степени разрушения коленного сустава, позволяя персонифицировать выбор лечения, а также прогноз развития заболевания у конкретного пациента: УУР – С, УДД – 5 [1].
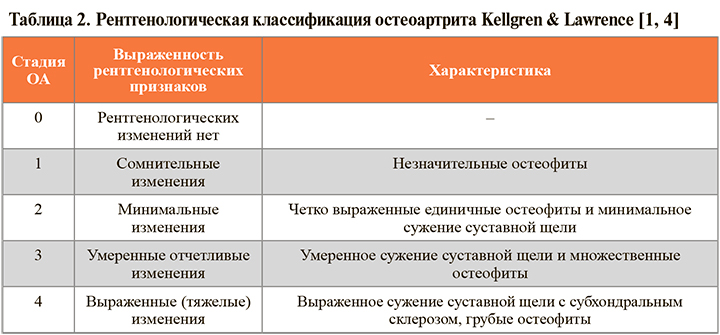
5.
При наличии явных рентгенологических признаков ОА коленного сустава дальнейшего инструментального обследования для диагностики не требуется [1]. При этом следует помнить, что рентгенологические признаки заболевания появляются позже начальных морфологических изменений в суставе, в связи с чем диагностика раннего ОА коленного сустава с помощью данного метода исследования весьма затруднена. Невозможность визуализировать начальные патологические изменения в тканях сустава, в связи с чем большинство больных начинают лечение уже только на стадии органной недостаточности, когда репарационные возможности уже полностью утеряны [1].
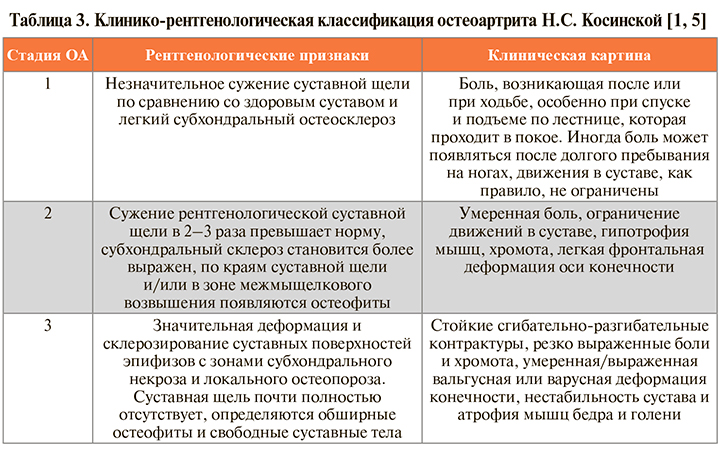
6.
Чувствительность приведенной в схеме клинико-рентгенологической формулы диагностики ОА коленного сустава (по критериям ACR) составляет 91%, специфичность – 86% [1, 3].
7.
• При наличии клинических, но отсутствии рентгенологических признаков ОА коленного сустава, а также для выявления ранних этапов патологического процесса рекомендована магнитно-резонансная томография (МРТ) коленного сустава (один сустав), позволяющая определить начальные патологические изменения в суставном хряще (истончение, нарушение целостности, появление хрящевых и костно-хрящевых разрастаний), субхондральной кости (участки отека, кистовидной перестройки, остеонекроза) и менисках (дегенеративные изменения), а также синовиальной оболочке (гипертрофия, наличие избыточного содержания синовиальной жидкости), связках, сухожилиях и мышцах: УУР – А, УДД – 1 [1].
• С помощью МРТ возможен расчет общего объема пораженного хряща и измененных участков субхондральной кости, а также оценка состояния связок коленного сустава. При этом, к сожалению, до настоящего времени отсутствует общепринятая МРТ-классификации гонартроза [1].
8.
• Лабораторные исследования крови или синовиальной жидкости не требуются собственно для диагностики OA коленных суставов, но могут использоваться для определения тактики фармакотерапии при наличии серьезных коморбидных заболеваний, для подтверждения или исключения других воспалительных заболеваний (табл. 4) [1].
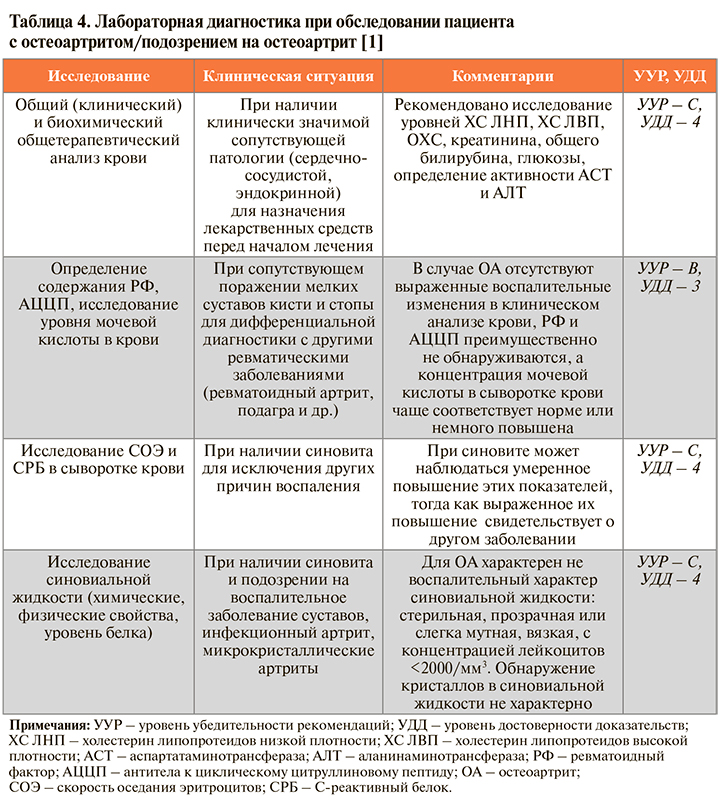
• Добавим, что в соответствии с критериями ACR результаты лабораторных исследований вместе с клиническими данными могут быть использованы для верификации ОА коленных суставов. Диагноз ставят при наличии суставной боли + хотя бы 5 из 9 следующих признаков: возраст >50 лет; утренняя скованность суставов ≤30 мин; крепитация; боль при пальпации; остеофиты; отсутствие гипертермии; СОЭ <40 мм/ч; РФ <1:40; синовиальная жидкость, характерная для ОА. Чувствительность этого клинико-лабораторного метода диагностики составляет 92%, специфичность – 75% [3].
Лечение
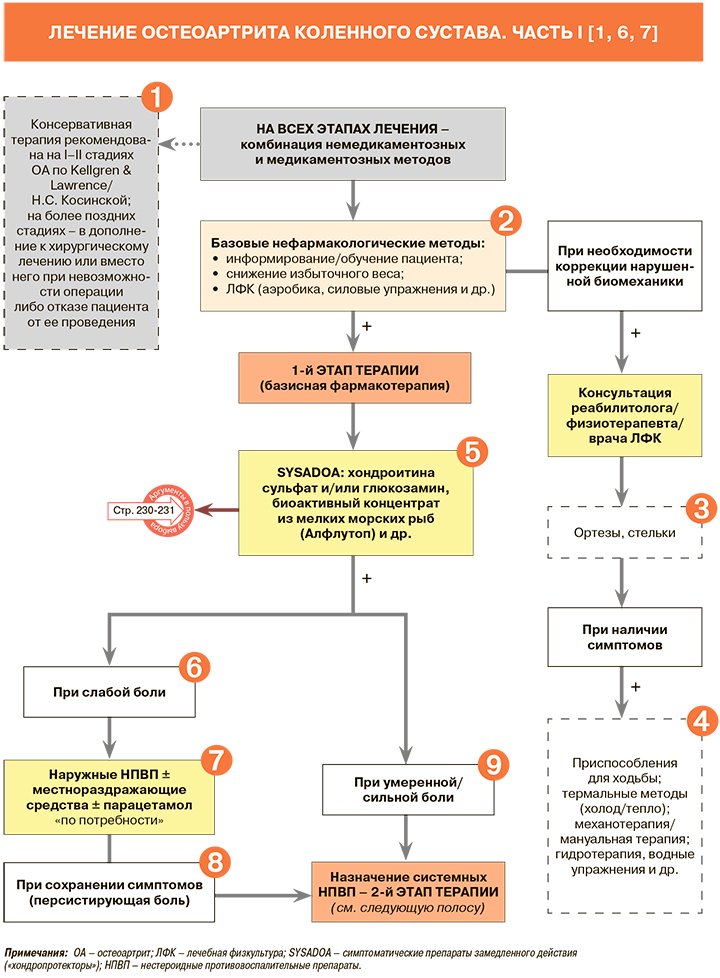
1.
• Консервативное (неоперативное) лечение рекомендовано при начальных стадиях ОА коленного сустава (I–II стадия по классификации Н.С. Косинской, I–II стадиях по классификации Kellgren & Lawrence – см. табл. 2 и 3), тогда как хирургическое, наряду с продолжением консервативной терапии, при II–III стадии по Н.С. Косинской и III–IV по Kellgren & Lawrence: УУР – С, УДД – 5 [1]. В ряде случаев оперативное лечение профильных пациентов может проводиться и на ранних стадиях развития гонартроза (I и II стадии – по Н.С. Косинской или по Kellgren & Lawrence), например, в случаях выраженного и плохо купируемого болевого синдрома, а также при очевидной неэффективности консервативной терапии [1].
• Пациентам с ОА рекомендовано снижать выраженность болевого синдрома, поддерживать или восстанавливать амплитуду движений в коленном суставе и купировать проявления синовита, если он имеется. План лечения должен быть индивидуализирован с учетом имеющихся у пациента сопутствующих соматических заболеваний, при которых может быть противопоказан тот или иной способ немедикаментозного или фармакологического воздействия: УУР – С, УДД – 5 [1].
2.
• Образовательные программы для пациентов – обязательный компонент всех терапевтических схем лечения ОА [1]. Они проводятся с учетом индивидуальных особенностей больного. Программы должны содержать информацию о природе заболевания и разных методах лечения. Обучение может осуществляться как индивидуально, так и в группах, его цель – изменение образа жизни больного, разъяснение целесообразности снижения избыточной массы тела (≥10% от первоначальной), занятий лечебной физкультурой (ЛФК) и правильной разгрузки суставов [3].
• При наличии избыточной массы тела (индекс массы тела ≥25 кг/м2) пациентам с ОА рекомендовано снижение веса на 10–12%: УУР – В, УДД – 3 [1]. Снижение веса при избыточной массе тела замедляет прогрессирование ОА коленного сустава, уменьшает выраженность симптомов (в том числе боли) и улучшает функциональное состояние пораженного сустава. Наиболее эффективная стратегия снижения веса включает оптимизацию рациона питания (уменьшение жира, углеводов, ограничение соли, увеличение потребления фруктов и овощей) в сочетании с занятиями физкультурой [1].
• Всем пациентам с ОА рекомендована ЛФК, направленная на укрепление мышц бедра и голени и являющаяся наиболее эффективным методом снижения болевых ощущений и улучшения функции сустава в долгосрочной перспективе: УУР – С, УДД – 5 [1]. Необходимо разъяснять пациентам, которые зачастую считают любую форму физической активности фактором, усугубляющим их состояние, что целевые упражнения, напротив, служат эффективным методом терапии. У большинства профильных пациентов не прогнозируется нарастание выраженности симптомов ОА коленного сустава на фоне специальной ЛФК [1].
• Аэробные упражнения наиболее эффективны для снижения боли и улучшения показателей двигательной активности, йога, цигун, тай-чи примерно столь же эффективны для улучшения функции коленного сустава, упражнения, направленные на растяжку и укрепление отдельных групп мышц, умеренно полезны для того и другого. При этом смешанный тип тренировки наименее эффективен [1].
• Всем пациентам с ОА рекомендована модификация спортивных/физических нагрузок и разгрузка пораженного сустава: УУР – С, УДД – 5 [1]. Эта модификация подразумевает избегание воздействия динамических и статических факторов, повышающих осевую нагрузку на коленный сустав (бег, длительная ходьба, прыжки, подъем тяжестей, пребывание в однообразной рабочей позе и т.п.), ношение обуви с хорошо амортизирующей подошвой, дополнительную опору на трость или костыль в руке, противоположной пораженному суставу, при обострении [1].
3.
Ортезирование короткими курсами рекомендовано при обострении и преимущественной локализации ОА в бедренно-надколенниковом сочленении: УУР – В, УДД – 2 [1]. Ортезы должны подбираться узким специалистом дифференцированно в зависимости от паттернов поражения различных отделов коленного сустава [1].
4.
УУР и УДД физиотерапевтических методов лечения ОА коленного сустава представлены в таблице 5. Добавим, что применение акупунктуры у больных ОА коленного сустава в настоящее время НЕ рекомендуется: УУР – А, УДД – 2 [1].

5.
• На начальных стадиях заболевания и при множественном поражении суставов рекомендовано назначение хондроитина сульфата, глюкозамина, их комбинации, а также других симптоматических препаратов замедленного действия (SYSADOA): УУР – В, УДД – 2 [1].
• В настоящее время имеется серьезная доказательная база, основанная на серии метаанализов и систематических обзоров, подтверждающая хороший терапевтический потенциал SYSADOA. Препараты этой группы обладают не только обезболивающим и противовоспалительным эффектами, но и способны замедлять прогрессирование заболевания. В опубликованном в июле 2021 г. большом систематическом обзоре и метаанализе (28 рандомизированных контролируемых исследований, n=11 890) еще раз было продемонстрировано, что глюкозамин и хондроитина сульфат обладают структурно-модифицирующим действием [7, 8].
• Следует учитывать (и проинформировать об этом пациента), что симптоматический эффект от применения SYSADOA развивается медленно – только через 8–12 нед после начала приема. Для достижения структурномодифицирующего действия препаратов продолжительность лечения должна составлять не менее 2 лет. В отличие от нестероидных противовоспалительных препаратов (НПВП), SYSADOA после прекращения лечения могут демонстрировать эффект последействия в течение 2–4 мес. При достижении требуемого уровня аналгезии на фоне применения SYSADOA доза НПВП может быть снижена, что способствует уменьшению частоты неблагоприятных явлений, связанных с использованием последних. Если клинический эффект спустя 3 мес терапии SYSADOA отсутствует, то она должна быть прекращена [1].
• В начале терапии SYSADOA для повышения биодоступности и достижения более быстрого анальгетического эффекта препараты этого класса могут назначаться парентерально в виде внутримышечных инъекций. К таким лекарственным средствам относится биоактивный концентрат из мелких морских рыб (Алфлутоп); в настоящее время существует убедительная доказательная база (результаты, полученные в серии клинических исследований) в отношении его эффективности и безопасности. Так, в 15 исследованиях (более 1200 пациентов), посвященных ОА коленных суставов, уже после первого курса лечения препарата отмечалось значимое уменьшение болевого синдрома (от 25 до 58,6%, в среднем 43,1%) по визуальной аналоговой шкале (ВАШ) и индексу WOMAC, оценивающему состояние больных ОА [7, 9].
Препарат Алфлутоп характеризуется ранним анальгетическим эффектом (на второй неделе терапии), нарастающим эффектом в течение 3 мес по окончании курсового лечения и длительным периодом последействия – до 4–6 мес. Короткий курс введения препарата Алфлутоп (10 внутримышечных инъекций по 2,0 мл через день) способствует удобству его применения и повышению приверженности к терапии пациентов с ОА [10].
6.
Для оценки интенсивности болевого синдрома при ОА можно использовать визуальную аналоговую (ВАШ 100 мм) или числовую рейтинговую шкалу (ЧРШ, 0–10 баллов) боли. Слабой (незначительной) боли соответствуют значения <40 мм по ВАШ или <4 баллов по ЧРШ [7].
7.
• Для купирования боли при ОА коленных суставов до назначения пероральных НПВП рекомендуются трансдермальные (топические) формы НПВП: УУР – А, УДД – 1 [1].
• Наружные НПВП оказывают выраженный анальгетический эффект при ОА коленных суставов, при этом, благодаря низкой системной абсорбции, характеризуются высоким профилем безопасности. Они не увеличивают риск развития класс-специфических нежелательных явлений со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы и почек, что дает возможность назначать их пациентам с выраженной коморбидной патологией [1].
• НПВП для наружного применения следует применять не менее 2 нед до 4 раз/сут. [7, 11]. Важно выполнять рекомендации по дозировке препаратов – до 10 см мягкой лекарственной формы на пораженный коленный сустав [7].
• Локальные формы НПВП, зарегистрированные в России, приведены в таблице 6.

• При болевом синдроме у пациентов с заболеваниями костно-мышечной системы возможно наружное применение препаратов, имеющих в составе пчелиный яд, экстракт перца и другие местнораздражающие компоненты: УУР – С, УДД – 5 [1]. Препараты этой группы, вызывая локальное раздражение кожи, приводят к фармакологическим эффектам как рефлекторного (кожно-висцерального), так и анальгетического (отвлекающее действие дополнительной афферентной импульсации) характера. Возможно, что ослабление боли происходит и за счет активации антиноцицептивных механизмов в центральной нервной системе [1].
• Парацетамол уступает по обезболивающей эффективности НПВП [1, 7, 13, 14]. Согласно актуальным рекомендациям Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO), парацетамол в дозах ≤3 г/сут может использоваться только для краткосрочного обезболивания на 1-м этапе терапии ОА на фоне длительного применения SYSADOA; при этом данная рекомендация классифицирована как «слабая» (низкая доказательность) [6]. В действующих российских рекомендациях по гонартрозу указывается, что последние исследования продемонстрировали не только низкую анальгетическую эффективность парацетамола при ОА коленных суставов, сопоставимую с плацебо, но и связанные с ним частые нежелательные явления со стороны желудочно-кишечного тракта и сердечно-сосудистой системы [1].
• Парацетамол не следует назначать больным с поражениями печени и хроническим алкоголизмом [1].
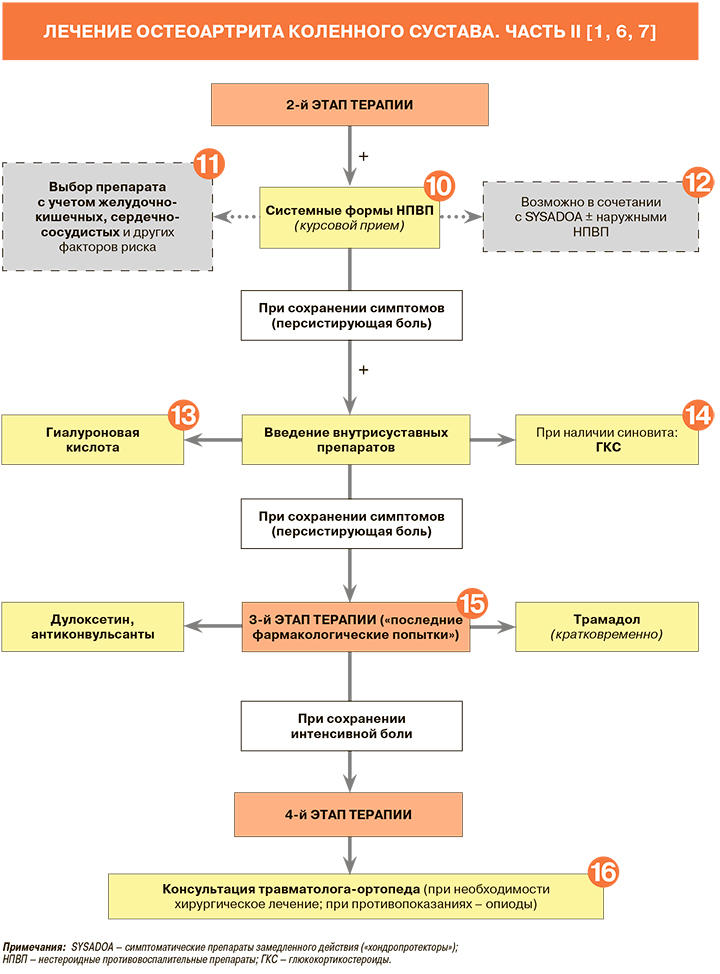
8.
Согласно рекомендациям Американского общества по изучению ОА (OARSI), вывод о неэффективности проводимой терапии (наличие персистирующих симптомов ОА) и переход к следующему ее этапу делаются при условии достаточной приверженности пациента к назначенному лечению на момент оценки. При отсутствии таковой нужно исследовать причины некомплаентности (и сделать все возможное для их устранения), при необходимости – скорректировать дозировку назначенных препаратов и продолжить прежнюю схему лечения [15].
9.
Критериями умеренной/выраженной боли при ОА могут служить значения ≥40 мм по ВАШ или ≥4 баллов по ЧРШ [7].
10.
• Для уменьшения болей в суставах рекомендовано назначение НПВП с учетом коморбидности пациентов: УУР – A, УДД – 1 [1]. НПВП в средних и максимальных терапевтических дозах при лечении хронической боли не уступают по эффективности трамадолу. Все НПВП в средних и максимальных терапевтических дозах при длительном применении имеют равный обезболивающий потенциал [1, 13].
• Пациентам с ОА, нуждающимся в НПВП, рекомендуется непрерывное использование препаратов этой группы, обеспечивающее лучший контроль симптомов и уменьшение частоты рецидивов, чем прием НПВП в режиме «по требованию»: УУР – В, УДД – 2 [1].
• Если болевой синдром выражен постоянно, то НПВП рекомендуется назначать короткими курсами. В случаях, когда интенсивность боли варьирует день ото дня или в течение дня от минимальной до значимой, можно принимать НПВП короткими курсами «по необходимости». При выраженном постоянном болевом синдроме предпочтение следует отдавать пролонгированным формам препаратов, которые позволяют длительно поддерживать высокий уровень препарата в сыворотке крови: УУР – В, УДД – 2 [1].
• Решение о модификации НПВП-терапии целесообразно принимать через 5–7 сут от начала лечения препаратами этой группы (при неэффективности предшествующей анальгетической терапии) [1, 7].
• Не рекомендуется одновременное использование двух и более НПВП, так как это увеличивает риск развития нежелательных реакций: УУР – С, УДД – 5 [1, 7].
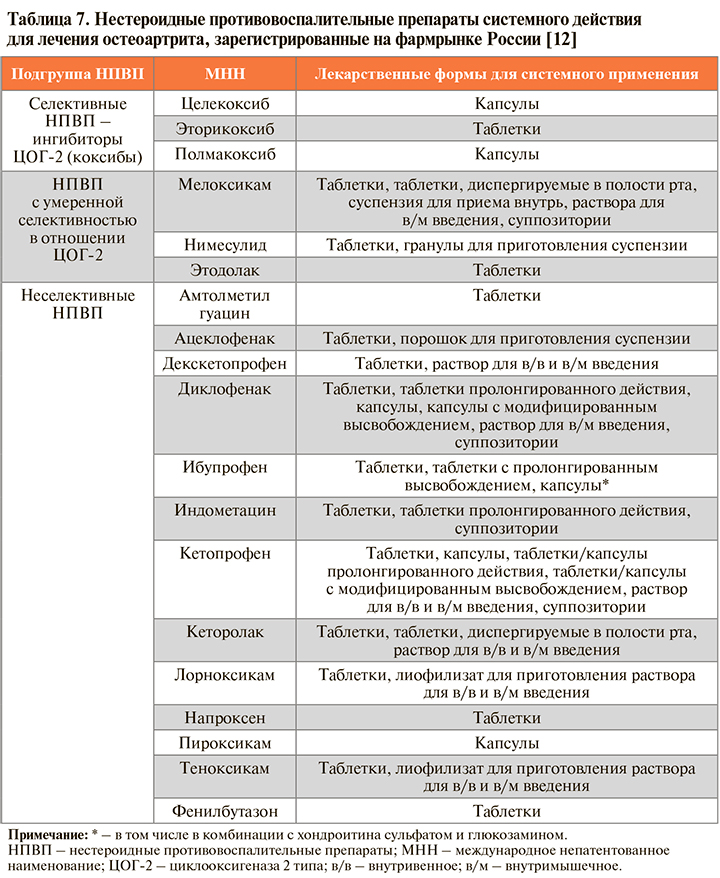
• Зарегистрированные в России системные НПВП, показанные для купирования скелетно-мышечной боли, представлены в таблице 7.
• Согласно действующим российским рекомендациям по гонартрозу, при неэффективности/наличии противопоказаний к НПВП рекомендован прием парацетамола: УУР – А, УДД – 2 [1]. При этом, как уже говорилось выше, парацетамол уступает по обезболивающему эффекту НПВП. Он может использоваться в суточной дозе не выше 3,0 г при условии достижения удовлетворительного клинического эффекта короткими курсами [1].
11.
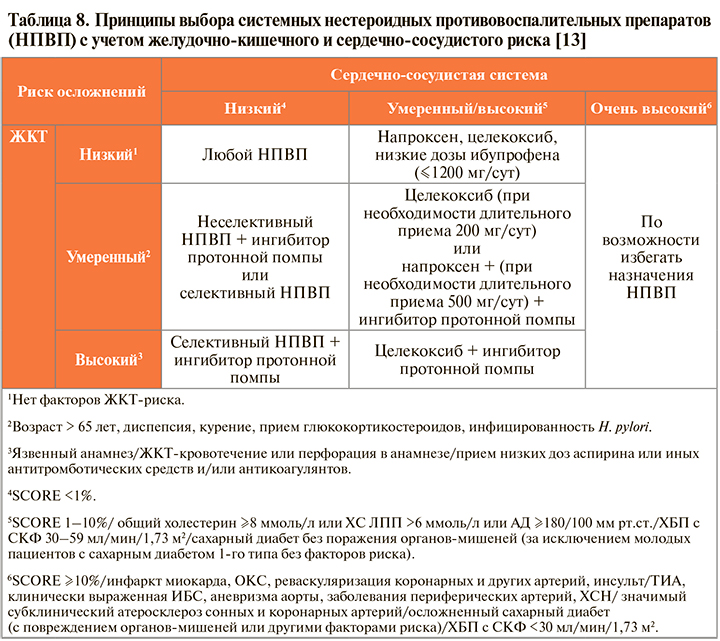
• Обладая примерно равной клинической эффективностью в рекомендуемых дозах НПВП в то же время могут различаться в плане индивидуальной реакции пациентов на конкретный препарат [1]. Поэтому выбор лекарственного средства из этой группы должен осуществляться индивидуально с учетом фармакологических особенностей каждого препарата и коморбидности (сопутствующих заболеваний) конкретного пациента (табл. 8).
• Согласно рекомендациям OARSI, при высоком сердечно-сосудистом риске допустимо рассмотреть прием НПВП лимитрированными курсами: коксибы – менее 30 дней, неселективные НПВП – менее 7 дней (сильная рекомендация, высокая доказательность) [6].
12.
У больных с умеренной или сильной болью в суставах НПВП могут применяться одновременно с SYSADOA, тем более что у последних, как отмечалось выше, клинический эффект развивается не сразу, а спустя 8–12 нед от начала приема [11].
13.
• Рекомендуется внутрисуставное введение протеза синовиальной жидкости на основе гиалуроната натрия для уменьшения боли и улучшения функции сустава при наличии инициативы со стороны пациента: УУР – А, УДД – 2 [1].
• Внутрисуставное применение растворов гиалуроната натрия может приводить к положительному клиническому эффекту различной степени выраженности, средняя продолжительность которого составляет ≥4–6 мес, сильно варьируя в зависимости от физико-химических характеристик конкретного изделия медицинского назначения и клинических особенностей пациента. После окончания клинического эффекта инъекция может быть выполнена повторно [1].
14.
• Рекомендуется внутрисуставное введение глюкокортикостероидов (ГКС) по соответствующим строгим показаниям: УУР – А, УДД – 2 [1].
• Внутрисуставное введение ГКС оказывает сильный противовоспалительный эффект, однако сопряжено с высоким риском развития вторичного остеонекроза и усугублением деградации суставного хряща. Поэтому их использование возможно в ситуациях, когда не удается купировать синовит адекватными дозами НПВП, но не чаще 1 раза в 3 мес. Курсовое применение ГКС при ОА коленных суставов не рекомендуется [1].
• В России в формах для внутрисуставного введения представлены такие ГКС, как бетаметазон, гидрокортизон и триамцинолон [12].
15.
• Трамадол и дулоксетин рекомендовано применять в течение короткого периода для купирования сильной боли в случае неэффективности предшествующей терапии ОА или невозможности назначения оптимальных доз НПВП: УУР – В, УДД – 1 [1].
• Слабый опиоид трамадол применяют кратковременно в низких дозах при условии достижения клинически значимого обезболивающего эффекта [1]. Дулоксетин относится к группе другие антидепрессантов, при этом он слабо подавляет захват дофамина. Метаанализ, посвященный его использованию при ОА коленного сустава, свидетельствует о значимом уменьшении боли, скованности, функциональной недостаточности и улучшении качества жизни [1, 16]. Назначение дулоксетина наиболее предпочтительно у пациентов с признаками центральной сенситизации, депрессии и распространенной боли. При наличии хронической боли у пациентов с ОА, особенно выявлении признаков нейропатической боли, также могут назначаться препараты центрального действия из группы антиконвульсантов (габапентиноиды) [7].
16.
При первичном обращении за медицинской помощью хирургическое лечение может быть рекомендовано, если у пациента с ОА наблюдаются выраженные дегенеративно-дистрофические изменения в суставе, сопровождающиеся стойкими функциональными нарушениями: УУР – В, УДД – 2 [1]. В настоящее время наиболее эффективными методами хирургического лечения ОА коленного сустава считаются корригирующие околосуставные остеотомии бедренной и/или большеберцовой костей и частичное/ тотальное эндопротезирование (артропластика) коленного сустава. Показания к эндоскопическим вмешательствам (артроскопии) у больных ОА коленного сустава за последние годы резко сузились [1].



