ЭПИДЕМИОЛОГИЯ И ЭТИОЛОГИЯ ХРОНИЧЕСКИХ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Хроническими диффузными заболеваниями печени (ХДЗП) во всем мире страдают до 1,5 млрд человек, вследствие чего они входят в первую пятерку причин смертности в экономически развитых странах. К основным этиологическим факторам в структуре патологии печени относятся инфекции вирусами гепатита, злоупотребление алкоголем и жировая болезнь печени. В Бюллетене Всемирной организации здравоохранения (ВОЗ, 2020) указано, что у 20–30% людей, зараженных вирусом гепатита B, в случае развития хронической инфекции заболевание приводит к циррозу и/или раку печени [1]. В свою очередь, после первичного инфицирования вирусом гепатита С у 80% больных происходит хронизация заболевания; при этом также в 80% случаев наблюдается медленное, а в 20% – быстрое его прогрессирование с развитием цирроза печени (ЦП) [2].
Не менее актуальна и проблема алкоголь-ассоциированных заболеваний печени. Официальная заболеваемость алкоголизмом в 2017 г. в России составила 1304,6 тыс. человек. Алкогольная болезнь печени (АБП) возникает у 60–100% лиц, злоупотребляющих алкоголем, и практически у каждого больного, страдающего алкоголизмом. ЦП развивается в среднем через 10–20 лет злоупотребления алкоголем. Доля алкоголя в этиологической структуре ЦП и рака печени в России составляет 45 и 50% соответственно [3].
Неалкогольная жировая болезнь печени (НАЖБП) в настоящее время является самым частым хроническим заболеванием печени в мире, поражающим до 30% людей в мире. Ее распространенность достигает более 40% среди населения экономически развитых стран и занимает первое место в структуре гепатопатологий (71,6%). В России, согласно многоцентровому исследованию DIREG2, у пациентов амбулаторного профиля распространенность НАЖБП составляет 37,3% [4–6].
По данным ВОЗ, ЦП в 2015 г. страдали около 2,8 млн человек, умерли от этого заболевания 1,3 млн. Среди этих смертей алкоголь был причиной в 348 000 случаев, хронический гепатит C (ХГС) – в 326 000, а хронический гепатит B (ХГВ) – в 371 000 [7]. Ежегодно примерно 1 млн смертей происходит вследствие осложнений цирроза, что делает его 11-й по частоте причиной смерти в мире, несмотря на активную трансплантацию печени в развитых странах. В России ЦП – шестая по частоте причина смерти. Согласно мировой статистике, 50% пациентов с ЦП умирают в течение 5 лет после начала развития болезни [8].
ПАТОГЕНЕЗ ХРОНИЧЕСКИХ ДИФФУЗНЫХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Основной путь прогрессирования ХДЗП вне зависимости от этиологии – это процесс активации фиброгенеза. Повреждение паренхимы печени влечет за собой развитие последовательных морфологических стадий — фиброза (в том числе ассоциированного со стеатозом и стеатогепатитом), ЦП и гепатоцеллюлярной карциномы. Фиброз служит показателем, отражающим темпы развития хронических диффузных поражений печени, и позволяющим определить стадию заболевания [9]. Прогрессирование фиброза печени обусловлено рядом морфологических реакций печени на ее повреждение, таких как некроз, воспаление, апоптоз, стеатоз, гемохроматоз, тромбоз, неоангиогенез, патологическая регенерация, а также пролиферация, дифференцировка, миграция гепатоцитов и собственно фиброзные изменения. После острого повреждения (например, при инфекции гепатотропными вирусами и др.) клетки паренхимы регенерируют и замещают некротизированные или подвергшиеся апоптозу гепатоциты. Этот процесс ассоциируется с воспалительным ответом и ограниченным накоплением белков экстрацеллюлярного матрикса. В случае персистенции повреждающего фактора регенерация замедляется и гепатоциты замещаются избыточным количеством белков экстрацеллюлярного матрикса, включая фибриллярный коллаген. По мере прогрессирования заболевания печени наблюдается трансформация коллагеновых волокон в мостовидный фиброз и в конечном итоге развитие ЦП [10, 11].
Особенности патогенеза (рис.) фиброза печени связаны, особенно на ранних этапах развития, с этиологией ХДЗП [11–15]. Он включает следующие звенья.
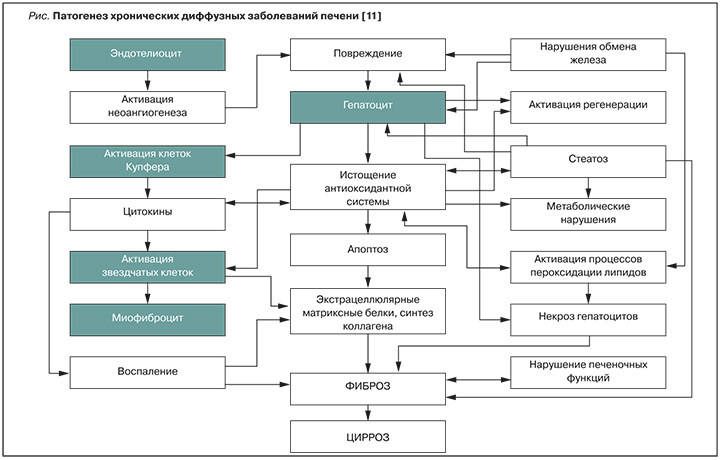
1. Повреждение гепатоцитов под действием этиологического фактора, усугубляемое эндогенной интоксикацией (алкоголь и др.) и приводящее к некрозам гепатоцитов и воспалению.
2. Воспаление (гистологически – лейкоцитарная инфильтрация) – выработка поврежденными клетками провоспалительных цитокинов.
3. Оксидантный стресс при воздействии этиологического фактора ведет к активации перекисного окисления липидов, белков, нуклеиновых кислот и повреждению мембран и органелл гепатоцитов.
4. Эндотелиальная дисфункция при воздействии этиологического фактора вызывает дисбаланс между вазоактивными соединениями – оксидом азота и эндотелином, нарушает кровоснабжение паренхимы печени, а также повышает сократимость звездчатых клеток печени. Следствием этого становятся сужение синусоидов с развитием динамической портальной гипертензии и нарушение внутрипеченочного кровообращения. На фоне повреждения эндотелия внутрипеченочных сосудов повышается выработка васкулоэндотелиального фактора, который способствует неоангиогенезу с последующей перестройкой сосудистой архитектоники печени и стимулирует совместно с эндотелином развитие фиброза в печени.
5. Образование грубой соединительной ткани в печени. Фиброз развивается (перицеллюлярно, перипортально, перисептально) за счет активации звездчатых клеток печени и выработки соединений экстрацеллюлярного матрикса (гиалуроновой кислоты и др.).
6. Нарушение метаболических функций и цитолиз гепатоцитов.
7. Формирование порочного патогенетического круга с прогрессированием поражения печени, вторичными некрозами гепатоцитов и активацией их регенерации (повышение выработки альфа-фетопротеина), а также образованием узлов регенерации с нарушением долькового строения печени.
8. Неоангиогенез с нарушением архитектоники сосудов печени.
9. Развитие ЦП (массивное образование соединительной ткани, нарушение архитектоники печени с формированием ложных долек).
10. Формирование портальной гипертензии и коллатерального кровообращения между портальной веной с нижней и верхней полыми венами и их сосудистыми системами, сопровождающееся осложнениями ЦП и дальнейшим усугублением поражения гепатоцитов.
11. Развитие гепатоцеллюлярной карциномы (стимуляция регенерации гепатоцитов с возникновением мутаций, особенно при воздействии гепатотропных вирусов на геном клеток печени).
12. При воздействии этиологических факторов свою роль в развитии ХДЗП начинает играть и генетическая предрасположенность к этим заболеваниям.
При алкоголь-индуцированных заболеваниях печени C2H5OH повышает продукцию митохондриями оксидантов в гепатоцитах, что приводит к развитию апоптоза. Ацетальдегид, основной продукт метаболизма алкоголя, и активированные звездчатые клетки печени стимулируют воспалительные и фиброгенетические сигналы. При вирусной этиологии ХДЗП, помимо прямого и иммуноопосредованного ответа на инфекцию, некоторые белки вирусов усиливают воспаление и фиброгенетическую активность звездчатых клеток печени. При НАЖБП гиперглицеринемия и резистентность к инсулину вызывают повышение в сыворотке уровня свободных жирных кислот, в результате чего развивается стеатоз печени. При этом стимулируются оксидативный стресс и провоспалительные цитокины, которые индуцируют апоптоз гепатоцитов и ведут к накоплению воспалительных клеток, что способствует прогрессии фиброза [10].
Печень является органом, ответственным за гомеостаз всего организма, источником биологических активных веществ, принимающих участие в реализации различных обменных и иммунных процессов. В ходе длительного поражения ткани печени, усиленного фиброгенеза и нарушений сосудистой архитектоники, обусловленных сложными реактивными изменениями ретикулоэндотелиальной системы, которые дают толчок выходящим за пределы допустимых границ воспалительным реакциям, происходит нарушение функции иммунного надзора. Патологические изменения клеток влекут за собой нарушение целостности структур эндотелия синусоидов, формируя ситоподобный фенестрируемый эндотелий и тем самым вызывая нарушение внутрипеченочной гемодинамики, которое, в свою очередь, чревато портальной гипертензией, желудочно-кишечными кровотечениями и другими осложнениями [16, 17].
Многогранность этиологии и многофакторность патогенеза ХДЗП затрудняют стратификацию, оценку рисков и прогноза у соответствующих больных, что делает эту проблему чрезвычайно актуальной.
МАЛОИНВАЗИВНАЯ ДИАГНОСТИКА СТЕАТОЗА, ФИБРОЗА И ЦИРРОЗА ПЕЧЕНИ
Для определения прогноза развития и выбора оптимальной тактики лечения ХДЗП необходима точная оценка наличия и стадии стеатоза/фиброза/цирроза печени [9]. На современном этапе диагностика ЦП основывается на лабораторных, инструментальных, морфологических методах исследования и использовании расчетных индексов [18, 19].
«Золотой стандарт» диагностики ХДЗП – морфология печени при пункционной биопсии печени (изредка – интраоперационной). Однако биопсия имеет свои методологические ограничения: исследуется очень небольшой участок ткани (около 1/50 000 части органа), присутствует субъективизм в оценке результатов. К тому же у больных ЦП проведение биопсии ограничено наличием портальной гипертензии, угрозой кровотечений и риском летальности. Сравнение результатов парных биопсий (из правой и левой долей печени), выполненных у пациентов с гепатитом С, показало, что различия в стадии фиброза печени обнаруживаются в 33,1–40% случаев [20]. Таким образом, биопсия печени не во всех случаях может считаться окончательным «золотым стандартом» для оценки стадии, степени и, следовательно, прогрессирования ХДЗП. Инвазивность, сложность проведения этой методики, а также возможные ошибки интерпретации ее результатов требуют разработки новых методов диагностики заболеваний печени – малоинвазивных, безопасных, интегративных и точных.
Одним из основных инструментов диагностики фиброза печени в настоящее время считается эластография. Диагностические характеристики этого метода изучены в многочисленных исследованиях. Однако на диагностическую точность эластографии влияют возраст пациента, индекс массы тела и отсутствие стеатоза по данным морфологического исследования ткани печени. Кроме того, существует ряд ограничений для выполнения этой процедуры, таких как асцит, выраженная подкожная клетчатка, беременность [20, 21].
На сегодняшний день диагностика НАЖБП существенно затруднена, что обусловлено скудной клинической картиной или бессимптомным течением стеатоза, необходимостью исключения других заболеваний печени и применения инвазивных методов исследования. Согласно рекомендациям Европейской ассоциации по изучению заболеваний печени (EASL) от 2016 г., инструментальным методом выбора при скрининге стеатоза печени служит ультразвуковое исследование печени, чувствительность которого, по разным данным, составляет 60‒94%, а специфичность – 66‒97%. Однако у пациентов с морбидным ожирением (3‒4-й степени) эти показатели снижаются [22–24].
Актуальной задачей гепатологии сегодня остается диагностика ЦП на стадии компенсации патологического процесса, позволяющая выбрать оптимальную тактику ведения больного. Это связано с тем, что на ранней компенсированной стадии ЦП протекает преимущественно латентно и бессимптомно, а его манифестация чаще всего начинается на стадии декомпенсации, для которой характерны необратимые нарушения функций печени и развитие осложнений, сокращающих жизнь пациентов. При этом у 50% больных с декомпенсированным ЦП отсутствуют явные симптомы портальной гипертензии, а в 20% случаях он выявляется посмертно [25].
По результатам ретроспективного международного исследования, охватившего 195 стран мира, диагноз декомпенсированного ЦП в 2017 г. был поставлен 10,6 млн, а компенсированный цирроз – 112 млн пациентам [26].
Сегодня разработано множество индексов и панелей с применением комбинации лабораторных, биометрических и инструментальных тестов, которые уменьшили потребность в биопсии у 50–70% пациентов с поражением печени. Для диагностики стеатоза предложены следующие тесты:
- FLI (Fatty Liver Index) – индекс жировой дистрофии печени, определяемый на основании объема талии, индекса массы тела (ИМТ), уровня триглицеридов, гамма-глутаминтранспептидазы;
- HSI (Hepatic Steatosis Index) – индекс стеатоза печени, вычисляемый на основании показателя трансаминаз, ИМТ, наличия сахарного диабета. Пороговое значение HSI >36,0 свидетельствует в пользу наличия стеатоза у пациента с чувствительностью 93,1% и специфичностью 92,4%;
- LAP (Lipid accumulation product) – продукт накопления липидов. При его расчете учитываются объем талии и концентрация триглицеридов;
- NAFLD-LFS (NAFLD – liver fat score) – НАЖБП-индекс стеатоза. При его расчете принимаются во внимание наличие метгемоглобина, уровень трансаминаз и наличие сахарного диабета. Значение NAFLD-LFS менее -0,640 свидетельствует в пользу НАЖБП с чувствительностью 86% и специфичностью 71%;
- ИС (индекс стеатоза). Определяется с учетом ИМТ, активности гамма-глутамилтранспептидазы, уровней интерлейкина 6 и васкулоэндотелиального фактора роста. При значении ИС ≥0,5 диагностируют стеатоз, при <0,5 – отсутствие стеатоза с чувствительностью 92,5% и специфичностью 97%;
- ИСП (индекс стеатоза печени). Используется для диагностики стеатоза печени у женщин в ранней постменопаузе с оценкой таких параметров, как ИМТ, триглицериды и липопротеиды низкой плотности с чувствительность 98,4% и специфичностью 95,8% [27–32].
Нами предложены способы дифференциальной диагностики хронического вирусного гепатита и НАЖБП у больных с синдромом дислипидемии по содержанию в крови ферментов супероксиддисмутазы и глутатионредуктазы [33, 34].
Для оценки тяжести фиброза печени в клинической практике предложено более 20 расчетных прогностических индексов, в которых учитываются результаты исследования двух и более непрямых биомаркеров, прямые маркеры и антропометрические данные [11, 35].
Индекс FIB-4, для вычисления которого использовались данные уровня трансфераз, количества тромбоцитов, а также возраст пациентов, подтверждал стадии фиброза печени в 82,1% случаев со специфичностью 98,2%, что позволяло не проводить биопсию 63% этих больных [36].
Применение индекса Bonacini (слагаемые – трансаминазы, международное нормализованное отношение, количество тромбоцитов) дает возможность верифицировать тяжелые стадии фиброза при гепатите C с чувствительностью 46% и специфичностью 98%, а использование индекса Forns (возраст больных, количество тромбоцитов, активность гамма-глутамилтранспептидазы, концентрация холестерина) – исключить выраженный фиброз и необходимость выполнения биопсии у 30% больных [37].
Установлена достаточно высокая диагностическая точность индекса FibroMeter (слагаемые – альфа-2-макроглобулин, гамма-глутамилтранспептидаза, мочевина, протромбиновый индекс, тромбоциты) в выявлении стадий фиброза печени [38]. Нами разработан способ диагностики стадий фиброза (чувствительность 93,3%, специфичность 88%), при котором в расчет берутся такие показатели, как количество тромбоцитов, концентрация фактора некроза опухоли-альфа и уровень альбумина в сыворотке пациентов с гепатитом С [39].
По мнению некоторых исследователей, прямые сывороточные маркеры фиброза по сравнению с непрямыми обладают большей точностью, чувствительностью и специфичностью для диагностики и дифференциации стадий этого состояния печени и позволяют выделять категории пациентов с умеренным и тяжелым фиброзом. В частности, уровень гиалуроновой кислоты прямо коррелирует со степенью повреждения печени, что позволяет оценивать степень фиброза [11].
Для оценки тяжести состояния больных ЦП чаще всего применяется классификация по Child–Turcotte–Pugh, которая позволяет оценить функцию клеток печени и отнести форму заболевания к одному из трех классов на основании балльной системы учета ряда клинико-лабораторных и инструментальных показателей: концентрации в сыворотке крови альбумина и общего билирубина, протромбинового индекса, выраженности асцита и печеночной энцефалопатии. Сумма баллов от 5 до 7 соответствует классу А (компенсация), 8–10 – классу В (субкомпенсация), ≥11 – классу С (декомпенсация). Кроме того, эта шкала дает возможность прогнозировать исход ЦП: при сумме баллов менее 5 средняя продолжительность жизни пациентов составляет 6,4 года, а при ≥12 – 2 мес [3, 40].
Другая оценочная шкала – MELD (Model for End-stage Liver Disease) – построена на определении уровня креатинина, общего билирубина и международного нормализованного отношения с использованием MELD-калькулятора [41]. Она была разработана в 2002 г. в США для определения очередности трансплантации печени. Модификация этой шкалы – MELD-Na, где наряду с вышеуказанными показателями учитывается уровень натрия у обследуемого, является еще более точным методом оценки тяжести состояния больного ЦП и его очередности в листе ожидания пересадки печени. При применении классификации MELD было выявлено, что она обладает большой достоверностью при прогнозировании летального исхода в течение 3 мес у пациентов с декомпенсированным ЦП. Так, при показателях MELD >35 баллов летальный исход прогнозируется в 80% случаев, от 20 до 34 баллов – в 10–60% [42].
В 2003 г. для оценки фиброза и цирроза печени у больных вирусным гепатитом С был предложен индекс соотношения активности аспартатаминотрансферазы (АСТ) к числу тромбоцитов (Aspartateaminotransferase to Platelet Ratio Index, APRI). При значении этого индекса <0,5 выраженный фиброз/цирроз у пациентов отсутствовал, а при его показателях >1,0 имеет место большая вероятность ЦП [42].
Нами в 2016 г. был предложен способ диагностики степени тяжести ЦП смешанной этиологии по сывороточному уровню интерлейкина 6 [43]. Недавно (2021) был также разработан индекс КЦП (классификатор цирроза печени), включающий определение активности АСТ, уровней общего билирубина и альбумина, а также оценку активированного частичного тромбопластинового времени. Диагностическая чувствительность этого индекса составляет 94,7% при эффективности 89,4% [44].
Известен способ диагностики алкогольного ЦП класса C, при котором в сыворотке крови определяют количество Д-димеров, активность фактора Виллебранда и оценивают их соотношение. При увеличении этого соотношения в ≥4 раз диагностируют декомпенсированную стадию алкогольного ЦП [45].
Для неинвазивной диагностики портальной гипертензии Gana J.C. et al. (2010) создали формулу, включающую оценку размера селезенки, число тромбоцитов и уровень альбумина в крови [46]. В то же время Park S.H. et al. (2009) описали неинвазивную прогностическую модель клинически значимой портальной гипертензии у пациентов с выраженным фиброзом на основании числа тромбоцитов и уровня альбумина [47].
М.И. Рачковский с соавт. (2013) установили взаимосвязь альфа-фетопротеина с классами ЦП и предложили использовать определение этого биомаркера для диагностики декомпенсированной стадии цирроза вирусной этиологии [48].
В работе Zhu Shao Ming M.D. (2017) была выявлена роль С-реактивного белка как патогенетического фактора на фоне персистирующего воспаления при ЦП для прогнозирования смертности у госпитализированных больных с этим заболеванием [49].
ЗАКЛЮЧЕНИЕ
Таким образом, для диагностики ХДЗП могут использоваться комбинации биометрических и инструментальных показателей с различными лабораторными параметрами, отражающими патогенетические механизмы поражения печени. Оптимизация известных и создание новых подходов к стратификации стеатоза, дифференциации стадий ФП и оценке степени тяжести ЦП дает возможность своевременно проводить лечебные мероприятия, направленные на профилактику прогрессирования ХДЗП.



