СПИСОК СОКРАЩЕНИЙ
- ВОЗ – Всемирная организация здравоохранения
- ГПЗ – гриппоподобное заболевание
- ИМП – инструкция по медицинскому применению
- ЛС – лекарственное средство
- МКБ-10 – Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра
- ОРВИ – острая респираторная вирусная инфекция
- РНК – рибонуклеиновая кислота
- САД – систолическое артериальное давление
- ТОРС – тяжелый острый респираторный синдром
- УДД – уровень достоверности доказательств
- УУР – уровень убедительности рекомендаций
- ЦНС – центральная нервная система
1. ЛЕЧЕНИЕ ГРИППА, ВКЛЮЧАЯ МЕДИКАМЕНТОЗНУЮ ТЕРАПИЮ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ЛЕЧЕНИЯ
Сроки начала лечения больных с предполагаемым или вероятным случаями гриппа не зависят от отсутствия или задержки получения результата диагностического тестирования на грипп [1].
На выбор тактики лечения оказывают влияние следующие факторы [2–8]:
- возраст пациента;
- характер сопутствующих заболеваний;
- клиническая форма болезни;
- характер течения болезни (динамики нарастания симптомов);
- тяжесть заболевания;
- наличие и характер осложнений.
Информация, касающаяся доз, показаний и способов применения лекарственных средств (ЛС), содержащаяся в данных рекомендациях, может отличаться от информации, указанной в инструкциях по медицинскому применению (ИМП) лекарственных препаратов. Для получения полной информации о применении того или иного ЛС следует ознакомиться с ИМП. Персональная ответственность за интерпретацию и использование настоящих рекомендаций лежит на лечащем враче.
Диагностическое тестирование на грипп ни в коем случае не должно задерживать начало лечения противовирусными препаратами и выполнения процедур по борьбе с инфекцией.
1.1. Консервативное лечение
• РЕКОМЕНДУЕТСЯ начать лечение препаратами с прямым противовирусным действием не позднее 48 ч (занамивир – в первые 36 ч) после манифестации болезни всем пациентам с симптомами гриппа для прекращения репликации вируса [9–14]: уровень убедительности рекомендаций (УУР) – А, уровень достоверности доказательств (УДД) – 1.
Комментарии: лечение необходимо начинать немедленно, не дожидаясь лабораторного подтверждения диагноза, независимо от сведений о вакцинации против гриппа и степени тяжести болезни. Наилучший лечебный эффект достигается в случаях начала применения противовирусных препаратов в первые 12 ч от начала болезни. При отсутствии лечения в ранние сроки прием противовирусных препаратов может быть начат на любом этапе разгара болезни, когда предполагается или документально подтверждена возможность текущей репликации вируса гриппа.
• НЕ РЕКОМЕНДУЮТСЯ для лечения гриппа препараты адамантанового ряда (амантадин, римантадин) [11, 15, 16]: УУР – А, УДД– 2b.
Комментарии: адамантаны не рекомендованы при лечении этого заболевания вследствие резистентности к ним большинства штаммов вируса гриппа.
1.1.1. Лечение легких и среднетяжелых неосложненных форм гриппа в амбулаторных условиях
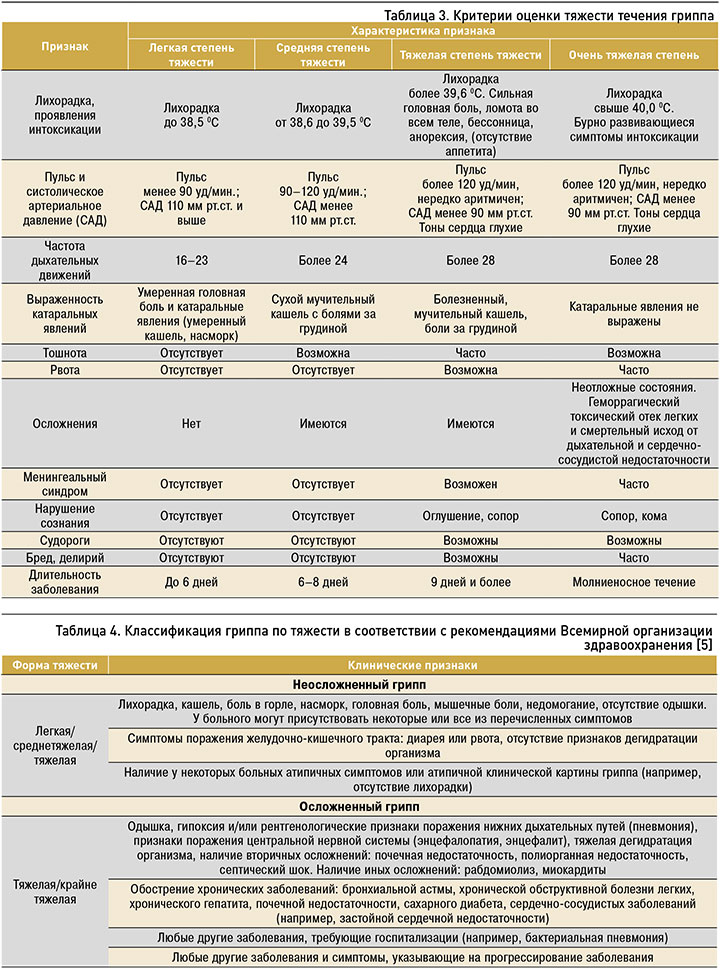
Критерии тяжести течения гриппа приведены в Приложении 4.
• РЕКОМЕНДУЕТСЯ использование при гриппе следующих противовирусных препаратов прямого действия:
− Осельтамивир [1, 4, 11–37]: УУР – А, УДД– 2.
Комментарии: этот препарат относится к селективным ингибиторам нейраминидазы вирусов гриппа А и В. Входит в международные клинические рекомендации по лечению и профилактике гриппа. Осельтамивир назначают внутрь по 75 мг 2 раза/сут в течение 5 дней.
− Занамивир [1, 4, 11, 12, 14, 17, 18, 22, 26, 28–30, 32–45]: УУР – А, УДД– 2.
Комментарии: как и осельтамивир, является селективным ингибитором нейраминидазы вирусов гриппа А и В, входит в международные клинические рекомендации по лечению и профилактике гриппа. Занамивир рекомендуется в случаях резистентности вируса A(H1N1) к осельтамивиру, беременным и пациентам с тяжелой почечной недостаточностью. Назначают по 2 ингаляции (по 5 мг каждая) 2 раза/сут в течение 5 дней. Резистентности к занамивиру не зарегистрировано.
Занамивир в форме порошка для ингаляций не следует применять распылением с помощью аэрозольного ингалятора из-за присутствия лактозы, которая может поставить под угрозу дыхательную функцию. Развитие бронхоспазма и/или ухудшение функции дыхания возможно у пациентов без предшествующих заболеваний в анамнезе.
NB! Пациентам, которые не относятся к группе повышенного риска развития тяжелого и/или осложненного течения гриппа и у которых имеет место лабораторно подтвержденный грипп или (с большой вероятностью) подозрительный случай гриппа, протекающий без осложнений, препараты из группы селективных ингибиторов нейраминидазы (осельтамивир и занамивир) назначать не следует.
− Балоксавир марбоксил [46–50]: УУР – А, УДД– 1.
Комментарии: это лекарственное средство представляет собой пролекарство, которое в процессе гидролиза преобразуется в активный метаболит балоксавир, обладающий действием в отношении вируса гриппа. Балоксавир воздействует на кэп-зависимую эндонуклеазу (CEN) – специфичный для вируса гриппа фермент в полимеразной кислой субъединице комплекса вирусной РНК- полимеразы. Тем самым балоксавир ингибирует транскрипцию генома вируса гриппа, приводя к подавлению вирусной репликации и прекращению выделения вируса в течение суток после приема у больных без факторов риска. Балоксавир обладает активностью в отношении штаммов, резистентных к ингибитору нейраминидазы, включая следующие мутации: H274Y для вируса подтипа A/H1N1; E119V и R292K для вируса подтипа A/H3N2; R152K и D198E для вируса типа B; H274Y для вируса подтипа A/H5N1 и R292K для вируса подтипа A/H7N9.
Балоксавир может быть назначен взрослым и детям старше 12 лет, как не имеющих дополнительных заболеваний, так и подверженных риску развития осложнений гриппа. Препарат применяется внутрь однократно, вне зависимости от приема пищи. При массе тела пациента от 40 кг до 80 кг доза препарата составляет 40 мг, при ≥80 кг – 80 мг.
− Умифеновир [4, 36, 51–58]: УУР – А, УДД– 2.
Комментарии: умифеновир специфически подавляет in vitro вирусы гриппа А и В (Influenza virus A, B), включая высокопатогенные подтипы A(H1N1)pdm09 и A(H5N1), а также другие вирусы – возбудители ОРВИ: коронавирус (Сoronavirus), ассоциированный с тяжелым острым респираторным синдромом (ТОРС), риновирус (Rhinovirus), аденовирус (Adenovirus), респираторно-синцитиальный вирус (Pneumovirus) и вирус парагриппа (Paramyxovirus). В исследованиях in vitro препарат специфически подавлял вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19).
Умифеновир рекомендован к применению Международным профессиональным сообществом по изучению гриппа и других респираторных вирусных заболеваний. Противопоказан при повышенной чувствительности к любому компоненту препарата, в I триместре беременности. Назначают внутрь до приема пищи по 200 мг 4 раза/сут в течение 5 дней.
– Риамиловир [59–73]: УУР – А, УДД– 1.
Комментарии: обладает широким спектром противовирусной активности в отношении РНК-содержащих вирусов, в том числе вирусов гриппа А и В, включая высокопатогенные подтипы A(H1N1)pdm09 и A(H5N1), благодаря подавлению синтеза вирусных РНК и репликации геномных фрагментов. Активное вещество препарата является синтетическим аналогом оснований пуриновых нуклеозидов (гуанина). Не входит в перечень ЛС, рекомендуемых международными клиническими рекомендациями по лечению и профилактике гриппа.
Лечение риамиловиром необходимо начать не позднее второго дня от появления клинических симптомов болезни: внутрь независимо от приема пищи по 1 капсуле (250 мг) 3 раза/сут (суточная доза 750 мг) в течение 5 дней, при необходимости до 7 дней. Противопоказан при повышенной чувствительности к компонентам препарата, беременности, в период грудного вскармливания. У пациентов в возрасте до 18 лет и при почечной/печеночной недостаточности эффективность и безопасность препарата не определены.
– Энисамия йодид [74–76]: УУР – B, УДД – 2.
Комментарии: рекомендованная схема назначения препарата – по 500 мг 3 раза/сут перорально, курс 5–7 дней. Противопоказан при повышенной чувствительности к компонентам препарата, дефиците лактазы, непереносимости лактозы, глюкозно-галактозной мальабсорбции, дефиците сахаразы/изомальтазы, непереносимости фруктозы, беременности и периоде грудного вскармливания, аллергических реакциях в анамнезе, тяжелых органических поражениях печени и почек [74−76].
• РЕКОМЕНДОВАНО использование при гриппе следующих препаратов с широким противовирусным действием:
– Имидазолилэтанамид пентандиовой кислоты [4, 77–85]: УУР – B, УДД – 2.
Комментарии: механизм действия этого ЛС реализуется на уровне инфицированных клеток за счет стимуляции факторов врожденного иммунитета, подавляемых вирусными белками. Препарат вызывает повышение уровня интерферона в крови до физиологической нормы, обладает противовоспалительной активностью.
Прием имидазолилэтанамида пентандиовой кислоты начинают с момента появления первых симптомов заболевания, желательно не позднее 2 сут от начала болезни, внутрь независимо от приема пищи по 1 капсуле (90 мг) 1 раз/сут в течение 5–7 дней. Противопоказан при повышенной чувствительности к любому компоненту препарата, дефиците лактазы, непереносимости лактозы, глюкозо-галактозной мальабсорбции, беременности и в период грудного вскармливания.
– Интерферон альфа 2b или интерферон гамма [4, 86–98]: УУР – B, УДД – 3.
Комментарии: интерфероны, вводимые интраназально, обладают опосредованным противовирусным действием на вирусы гриппа. Используются в схемах комплексной терапии гриппа при первых признаках заболевания. Не входят в перечень ЛС, рекомендуемых международными клиническими рекомендациями по лечению и профилактике гриппа. При интраназальном применении концентрация действующего вещества, достигаемая в крови, не имеет клинической значимости.
Интерферон альфа 2b назначают интраназально по 3 капли/дозы в каждый носовой ход 5–6 раз/ сут (разовая доза 3000 ME, суточная – 15 000–18 000 ME) в течение 5 дней. Интерферон гамма также применяют интраназально по 2 капли в каждый носовой ход 5 раз сут (разовая доза 4000 ME, суточная – 20 000 ME) до третьего дня от начала болезни или в течение 5–7 дней в период реконвалесценции.
– Кагоцел [4, 99–101]: УУР – B, УДД – 3.
Комментарии: обладает опосредованным противовирусным действием на вирусы гриппа (индуктор интерферона). Не входит в перечень ЛС, рекомендуемых международными клиническими рекомендациями по лечению и профилактике гриппа.
Кагоцел применяется перорально по 24 мг (2 таблетки) 3 раза/сут в первые 2 дня, затем по 12 мг (1 таблетка) 3 раза/ сут в течение 2 дней (курсовая доза 216 мг, т.е. 18 таблеток) до четвертого дня болезни или в течение 5–7 дней в период реконвалесценции. Противопоказан при гиперчувствительности к компонентам препарата, беременности, в периоде лактации, дефиците лактазы, непереносимости лактозы, глюкозо-галактозной мальабсорбции.
– Тилорон [102–111]: УУР – B, УДД – 3.
Комментарии: обладает иммуномодулирующим и противовирусным эффектом, индуктор интерферонов. Стимулирует образование в организме интерферонов всех типов (альфа, бета, гамма и лямбда), усиливает антителообразование, уменьшает степень иммунодепрессии, восстанавливает соотношения T-супрессоров и T-хелперов. Не входит в перечень ЛС, рекомендуемых международными клиническими рекомендациями по лечению и профилактике гриппа.
Применяется перорально по 125 мг 1 раз/сут в первые 2 дня, затем по 125 мг/сут через день (курсовая доза 750 мг) до 3-го дня болезни или в течение 5–7 дней в период реконвалесценции. Противопоказан при гиперчувствительности к компонентам препарата, беременности, в период лактации, детском возрасте до 18 лет.
– Эргоферон (антитела к гамма-интерферону афинно очищенные) [110, 112–117]: УУР – B, УДД – 3.
Комментарии: препарат обладает противовирусным, иммуномодулирующим, противовоспалительным и антигистаминным действием, может быть назначен в виде монотерапии либо в сочетании с другими средствами противовирусного, антибактериального, патогенетического и симптоматического действия.
Первые 2 ч препарат принимают по 1 таблетке каждые 30 мин (всего 5 таблеток), затем в течение первых суток осуществляют еще 3 приема через равные промежутки времени. Со вторых суток и далее принимают по 1 таблетке 3 раза/сут до полного выздоровления. Не рекомендован при врожденной галактоземии, синдроме мальабсорбции глюкозы или галактозы, при врожденной лактазной недостаточности. У беременных и в период лактации эффективность и безопасность препарата не изучались.
– Меглюмина акридонацетат [118–127]: УУР – B, УДД – 3.
Комментарии: препарат является низкомолекулярным индуктором интерферона. Обладает прямым противовирусным действием, подавляя репродукцию вируса на ранних сроках (1–5 сут) инфекционного процесса, снижая инфекционность вирусного потомства, приводя к образованию дефектных вирусных частиц. Повышает неспецифическую резистентность организма в отношении вирусных и бактериальных инфекций.
Меглюмина акридонацетат применяют внутрь 1 раз/ сут за 30 мин до еды, не разжевывая и запивая 1/2 стакана воды. Режим дозирования у взрослых и детей старше 12 лет: по 450–600 мг (3–4 таблетки) на прием, препарат принимают на 1, 2, 4, 6, 8-е сутки (курс лечения – 20 таблеток). Лечение необходимо начинать при первых симптомах заболевания. При тяжелом течении гриппа в первый день принимают 6 таблеток.
• При отсутствии эффекта от приема препаратов интерферона и индукторов интерферона в течение 24 ч РЕКОМЕНДОВАНО применение препаратов с прямым противовирусным действием (селективных ингибиторов нейраминидазы или ингибиторов фузии) для прекращения репликации вируса [1, 4, 11, 12, 14, 17–38, 51–56, 128, 129]: УУР – С, УДД – 5.
• РЕКОМЕНДУЕТСЯ проведение пероральной дезинтоксикационной терапии всем пациентам с гриппом для купирования синдрома интоксикации [4, 5]: УУР – С, УДД – 4.
Комментарии: объем дезинтоксикационной терапии зависит от степени тяжести состояния пациента.
• Пациентам с гипертермией выше 38 °C с целью жаропонижающего эффекта РЕКОМЕНДОВАНО назначение следующих нестероидных противовоспалительных препаратов:
– Ибупрофен [4, 5, 97]: УУР – С, УДД – 3.
Комментарий: препарат применяют перорально по 200–400 мг 3–4 раза/сут в течение 3–10 дней (максимальная суточная доза – 1200 мг).
– Парацетамол [4, 5, 97]: УУР – С, УДД – 3.
Комментарий: препарат применяют перорально по 1–2 таблетке (500–1000 мг) до 4 раз/сут (максимальная суточная 4000 мг).
• НЕ РЕКОМЕНДОВАНО пациентам с гипертермией назначение ацетилсалициловой кислоты и содержащих ее комбинированных препаратов из-за возможного развития геморрагического синдрома [4, 5, 13, 97]: УУР – С, УДД – 3.
• РЕКОМЕНДОВАНО назначение отхаркивающих средств пациентам с влажным кашлем для разжижжения и улучшения отхождения мокроты [4, 5]: УУР – С, УДД – 4.
Комментарии: препаратами выбора в этой группе являются ацетилцистеин (применяют внутрь по 200 мг 2–3 раза/сут после еды); гвайфенезин (внутрь 200–400 мг (10–20 мл) 3–4 раза/сут после еды); бромгексин (внутрь по 8 мг 3 (1–2 таблетки) 3–4 раза/сут); амброксол (внутрь по 30 мг 3 раза/сут).
• РЕКОМЕНДОВАНО назначение противокашлевых средств пациентам с сухим непродуктивным надсадным кашлем, значительно ухудшающим качество жизни пациента, для подавления кашлевого рефлекса [4, 5]: УУР – С, УДД – 4.
Комментарии: препаратами выбора в этой группе являются декстрометорфан (входит в состав многокомпонентных препаратов) и бутамират (внутрь по 15 мл 4 раза/сут при использовании в форме сиропа).
• РЕКОМЕНДОВАНО применение противокашлевого препарата Ренгалин (ссылка на приказ) пациентам с сухим непродуктивным надсадным кашлем, значительно ухудшающим качество жизни пациента [130–132]: УУР – А, УДД – 2.
Комментарии: препарат обладает противокашлевым, противовоспалительным, противоотечным, антиаллергическим, спазмолитическим действием. Может быть назначен в виде монотерапии либо в сочетании со средствами противовирусного, антибактериального, патогенетического и симптоматического действия. При необходимости возможно его сочетание с муколитиками.
Схема приема препарата: по 1–2 таблетке (или 5–10 мл раствора для приема внутрь) 3 раза/сут вне приема пищи. В зависимости от тяжести состояния в первые три дня частота приема может быть увеличена до 4–6 раз/сут. Длительность терапии зависит от тяжести заболевания и определяется лечащим врачом. Ренгалин не рекомендован при наследственной непереносимости фруктозы. У беременных и в период лактации эффективность и безопасность препарата не изучались.
• НЕ РЕКОМЕНДОВАНО одновременное применение отхаркивающих и противокашлевых средств пациентам с кашлем, поскольку такое сочетание может способствовать застою мокроты за счет подавления кашлевого рефлекса [4, 5]: УУР – С, УДД – 5.
• РЕКОМЕНДУЕТСЯ местное применение сосудосуживающих средств пациентам с затруднением носового дыхания в комплексном лечении острого ринита для профилактики и лечения синусита, евстахиита, отита [4, 5, 133, 134]: УУР – С, УДД – 4.
Комментарии: из препаратов этой группы могут применяться интраназально: нафазолин (по 1–3 капли 0,05–0,1% раствора в каждый носовой ход 3–4 раза/ сут); ксилометазолин (по 2–3 капли 0,1% раствора или по одному впрыскиванию из распылителя в каждый носовой ход 4 раза/сут); оксиметазолин (по 1–2 капли 0,025–0,05% раствора в 2–3 раза/сут или по 2–3 впрыскивания 0,05% спрея каждый носовой ход).
2. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ПРОФИЛАКТИКИ
2.1. Специфическая профилактика [135–150]
• РЕКОМЕНДОВАНО проведение вакцинации [151]: УУР – А, УДД – 1.
Комментарий: для специфической профилактики гриппа используются живые, инактивированные, в том числе расщепленные и субъединичные гриппозные вакцины отечественного и зарубежного производства, зарегистрированные на территории Российской Федерации и приготовленные из эпидемически актуальных штаммов вируса, рекомендуемых Всемирной организацией здравоохранения (ВОЗ).
Вакцинации против гриппа в предэпидемический период в первую очередь подлежат лица, относящиеся к категории высокого риска заболевания гриппом и неблагоприятных осложнений при заболевании, к которым относятся:
- лица старше 60 лет, прежде всего проживающие в учреждениях социального обеспечения;
- лица, страдающие заболеваниями эндокринной системы (сахарным диабетом), нарушениями обмена веществ (ожирением), болезнями системы кровообращения (гипертонической болезнью, ишемической болезнью сердца), хроническими заболеваниями дыхательной системы (хроническим бронхитом, бронхиальной астмой), хроническими заболеваниями печени и почек;
- беременные женщины (только инактивированными вакцинами);
- лица, часто болеющие острыми респираторными вирусными заболеваниями;
- медицинские работники;
- работники сферы обслуживания, транспорта, учебных заведений;
- воинские контингенты.
Профилактические прививки проводятся лицам, не имеющим противопоказаний (наличие аллергических реакций на куриный белок и другие компоненты вакцины, наличие лихорадки или других признаков острых респираторных инфекций), с их согласия, а также с согласия законных представителей граждан, признанных недееспособными в порядке, установленном законодательством Российской Федерации. Инактивированная вакцина против гриппа может вводиться одновременно с другими инактивированными вакцинами, применяемыми в рамках национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям.
Вакцины против гриппа могут быть слабо иммуногенными у пациентов с тяжелой иммуносупрессией [152], поэтому можно рассмотреть необходимость химиопрофилактики против вируса гриппа для этой группы пациентов. Лицам с иммуносупрессией в возрасте 6 мес и старше рекомендуется ввести как инактивированную вакцину против сезонного гриппа, так и инактивированную моновалентную вакцину против гриппа А(H1N1)2009. Кроме того, лицам в возрасте 6 мес и старше, которые контактируют с членами семьи, имеющими тяжелую иммуносупрессию, рекомендуется ежегодная вакцинация инактивированной вакциной против сезонного гриппа.
Сезонную иммунопрофилактику гриппа рекомендуется закончить не позднее чем за 2–3 нед до начала эпидемического сезона.
2.2. Неспецифическая профилактика
2.2.1. Профилактические мероприятия, направленные на источник инфекции
• РЕКОМЕНДОВАНА своевременная диагностика и лечение больных гриппом [153, 154]: УУР – А, УДД – 1.
Комментарий: больной человек наиболее заразен для окружающих в первые 3–4 дня болезни, хотя выделение вируса возможно на протяжении всего заболевания и даже периода реконвалесценции. Больные дети как источник инфекции опасны более длительный период (7–10 дней). При риске заражения гриппом (вспышка в коллективе, эпидемия в городе) большое значение имеет контроль граждан за состоянием своего здоровья, в первую очередь термометрия и самоизоляция при появлении первых симптомов заболевания с последующим вызовом врача.
• РЕКОМЕНДОВАНО в случае появления в семье больного с симптомами гриппа проведение следующих мероприятий (УУР – А, УДД – 1):
- изолировать больного в отдельном помещении, если же это невозможно, обеспечить, чтобы его кровать, отгороженная ширмой, находилась на расстоянии более 1 м от места расположения других людей;
- часто проветривать помещения и проводить влажную уборку с использованием бытовых моющих и дезинфицирующих средств;
- кипятить и обрабатывать посуду, используемую больным, дезинфицирующими средствами в специальной емкости;
- тщательно мыть руки с мылом после каждого контакта с больным;
- носить маски, имеющиеся в продаже или сделанные из подручных материалов (ватно-марлевые) при условии их смены через каждые два часа с последующей утилизацией или надлежащей стиркой и двухсторонним проглаживанием [153, 154].
2.2.2. Профилактические мероприятия, направленные на механизмы и пути передачи
• РЕКОМЕНДОВАНО использование антисептиков [124, 155, 156]: УУР – А, УДД – 1.
Комментарий: с целью дезинфекции применяют спирт, перекись водорода, щелочь (мыло), антисептики на основе йода в соответствующих концентрациях на протяжении достаточного количества времени. Активным биологическим действием обладают ультрафиолетовые (УФ) лучи. Обеззараживание помещений УФ-лампами проводится как прямым, так и рассеянным облучением. Неотъемлемой и важной частью противоэпидемических мероприятий в очаге является текущая дезинфекция предметов личного обихода и всего помещения. Необходимо тщательное обеззараживание посуды, для чего используются дезинфицирующие растворы, из которых самой доступной и распространенной группой являются хлорсодержащие средства.
• РЕКОМЕНДОВАНО использование одноразовых масок, носовых платков и полотенец [124, 155, 156]: УУР – А, УДД – 1.
Комментарий: маски должны быть одноразовыми и меняться через каждый час. В случае недоступности одноразовых масок они подлежат частой замене и стирке с кипячением, как и остальное белье больного.
2.2.3. Профилактические мероприятия, направленные на восприимчивый организм
• РЕКОМЕНДОВАНА вакцинация против гриппа в предэпидемический сезон [157, 158]: УУР – А, УДД – 1.
• РЕКОМЕНДОВАНО ведение здорового образа жизни (полноценный сон, свежий воздух, активный отдых, сбалансированное питание, прием витаминов) для повышения резистентности к инфекции [157, 158]: УУР – А, УДД – 1.
• РЕКОМЕНДОВАНА профилактика и своевременное лечение сопутствующих заболеваний и состояний, обусловливающих повышение восприимчивости организма к вирусу гриппа: УУР – А, УДД – 1.
• РЕКОМЕНДОВАНО проведение химиопрофилактики (при наличии в анамнезе контакта с больным гриппом и ОРВИ другой этиологии): УУР – А, УДД – 1.
Комментарии: неспецифическая профилактика подразделяется на два варианта: экстренную, рассчитанную на немедленное противовирусное действие химиопрепаратов, интерферонов, индукторов интерферона (внутриочаговая и внеочаговая, она же плановая), и сезонную, проводимую в предэпидемический период с целью повышения резистентности организма человека к респираторным вирусам во время максимальной вероятности заболевания. Внутриочаговую профилактику проводят среди лиц, находившихся в непосредственном контакте с больными, в семьях, квартирах, больничных палатах (эпидемических очагах). Продолжительность внутриочаговой профилактики варьирует от 2 дней при прекращении контакта с источником инфекции до 5–7 дней, если контакт сохраняется. Внеочаговую профилактику проводят среди не привитых людей, а также среди контингентов с повышенным риском заражения гриппом и высоким риском неблагоприятных исходов заболевания.
NB! Химиопрофилактика не заменяет вакцинацию против гриппа.
• РЕКОМЕНДОВАНО избирательное использование с целью неспецифической профилактики гриппа следующих препаратов прямого противовирусного действия [117]:
– Осельтамивир: УУР – А, УДД – 1.
– Занамивир: УУР – А, УДД – 1.
Комментарии: для экстренной профилактики осельтамивир назначают по 75 мг 1 раз/сут в течение 7–10–14 дней после контакта с инфицированным (в зависимости от ситуации). Прием осельтамивира нужно начинать не позднее чем в первые 2 дня после контакта с заболевшим. Экстренная профилактика занамивиром при непосредственном контакте с больным гриппом проводится по схеме: 2 ингаляции по 5 мг 1 раз/сут, 10 дней (общая суточная доза 10 мг).
Рекомендуемая ранее плановая профилактика химиопрепаратами (например, осельтамивиром по 75 мг 1 раз/сут в течение 6 нед или занамивиром) в настоящее время не рекомендуется из-за развития резистентности вирусов к действию препарата. Химиопрофилактика ингибиторами нейраминидазы не рекомендуется, если с момента первого контакта с больным гриппом прошло более 48 ч. В других случаях она избирательно используется:
- у лиц с высоким риском развития осложнений гриппа в случае контакта с больным гриппом человеком в течение первых двух недель после вакцинации;
- у лиц с высоким риском развития осложнений гриппа в случае документально подтвержденного факта низкой клинической эффективности вакцины в эпидсезоне из-за циркуляции штаммов вируса гриппа, антигенно далеких от вакцинных штаммов;
- у лиц с тяжелыми иммунодефицитами или других лиц, которые могут не реагировать адекватно на вакцинацию (например, получающие иммуносупрессивные препараты, онкологических больных, реципиентов гемопоэтических клеточных трансплантатов и др.), после контакта с больным гриппом человеком;
- у лиц с высоким риском осложнений гриппа, которым противопоказана вакцинация, после контакта с больным гриппом человеком;
- среди сотрудников и постояльцев заведений для получения лечения/ухода с длительным/круглосуточным режимом работы во время вспышек гриппа в учреждении.
– Балоксавир марбоксил: УУР – А, УДД – 2.
Комментарии: экстренную профилактику препаратом следует применять как можно скорее в течение 48 ч после близкого контакта с заболевшим гриппом человеком. Балоксавир марбоксил принимают внутрь однократно, вне зависимости от приема пищи; при массе тела пациента от 40 кг до 80 кг дозировка составляет 40 мг, ≥80 кг – 80 мг [159].
– Умифеновир: УУР – А, УДД – 1.
Комментарии: экстренная (постконтактная) профилактика: при контакте с больным по 200 мг/ сут в течение 10–14 дней. В период эпидемии гриппа (сезонная профилактика): по 200 мг 1 раз/сут каждые 3–4 дня в течение 3 нед.
• РЕКОМЕНДОВАНО использование с целью неспецифической профилактики гриппа препаратов интерферона [91, 110]: УУР – В, УДД – 3.
Комментарии: при использовании интерферона альфа в форме лиофилизата для приготовления назального введения содержимое флакона растворяют в 5 мл воды для инъекций и вводят интраназально по 3 капли в каждый носовой ход 2 раза/сут (разовая доза 3000 МЕ, суточная доза 15 000–18 000 МЕ) в течение 5–7 дней. При однократном контакте с больным гриппом достаточно одного закапывания препарата. При необходимости профилактические курсы повторяют. При сезонном повышении заболеваемости интерферон альфа применяют в указанной дозе утром, 1–2 дня.
• РЕКОМЕНДОВАНО использование с целью неспецифической профилактики гриппа индукторов интерферона [79, 80, 91, 92, 110]: УУР – В, УДД – 3.
Комментарии: из этой группы препаратов для профилактики применяются следующие препараты:
- кагоцел: по 24 мг (2 таблетки) 1 раз/сут в течение 2 дней, затем делают перерыв в 5 дней, далее цикл повторяют; длительность приема препарата может варьировать от 1 нед до нескольких мес;
- тилорон: 125 мг 1 раз/нед в течение 6 нед, курсовая доза 750 мг;
- оксодигидроакридинилацетат натрия [160]: разовая профилактическая доза составляет 250 мг (1 ампула) или 4–6 мг на кг массы тела. При длительном применении рекомендуемый интервал между введениями равен 3–7 сут;
- меглюмина акридонацетат [118–127]: внутрь 1 раз/сут за 30 мин до еды взрослым и детям старше 12 лет по 450–600 мг (3–4 таблетки) на прием на 1, 2, 4, 6, 8-е сутки после контакта с заболевшим. Далее делают перерыв 72 ч (трое суток) и продолжают курс на 11, 14, 17, 20, 23-и сутки. Общий курс составляет от 5 до 10 приемов.
NB! Для проведения неспецифической профилактики гриппа можно использовать любые препараты (в соответствии с инструкцией к применению препарата), разрешенные к применению в установленном порядке на территории Российской Федерации.
3. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
На выбор тактики лечения оказывают влияние следующие факторы [2–8]: возраст пациента; характер сопутствующих заболеваний; клиническая форма болезни; характер течения болезни (динамики нарастания симптомов); тяжесть заболевания; наличие и характер осложнений.
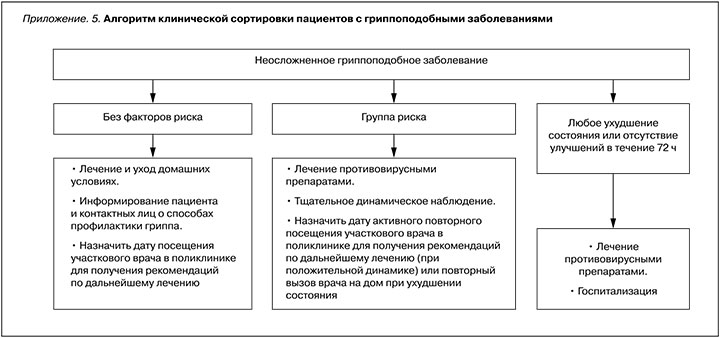
• РЕКОМЕНДУЕТСЯ до принятия решения о тактике ведения установить дефиницию случая гриппа у больного: неосложненный грипп или осложненный/тяжелый грипп [1, 151]: УУР – С, УДД – 4.
Комментарий: алгоритм клинической сортировки пациентов с гриппоподобными заболеваниями (ГПЗ) представлен в Приложении 5.
• РЕКОМЕНДУЕТСЯ госпитализация пациентам с тяжелым и среднетяжелым течением гриппа, больным, проживающим в общежитиях и в условиях неблагоприятных факторов жилой среды, пациентам из группы риска развития неблагоприятного течения болезни [4–6, 151]: УУР – В, УДД – 3.
Комментарий: к группам риска тяжелого течения гриппа относятся следующие лица [151]:
- беременные на любом сроке беременности и женщины в послеродовом периоде;
- лица с хроническими заболеваниями легких (бронхиальной астмой, хронической обструктивной болезни легких и др.);
- лица с хроническими заболеваниями сердечно-сосудистой системы (пороками сердца, гипертонической болезнью, ишемической болезнью сердца, признаками сердечной недостаточности и др.);
- лица с нарушениями обмена веществ (сахарным диабетом, ожирением 2–3 степени и др.);
- лица с хронической болезнью почек;
- лица с хроническими заболеваниями печени;
- лица с определенными неврологическими состояниями (включая нейромускульные, нейрокогнитивные нарушения, эпилепсию);
- лица с гемоглобинопатиями;
- лица с первичными и вторичными иммунодефицитами (ВИЧ-инфекцией, применением иммуносупрессорных средств и т.п.);
- лица со злокачественными новообразованиями;
- лица в возрасте 65 лет и старше.
• РЕКОМЕНДУЕТСЯ срочно пересмотреть схемы ведения больного гриппом при появлении признаков (симптомов) прогрессирующего течения болезни [1]: УУР – В, УДД – 3.
Комментарии: К признакам прогрессирующего течения гриппа относятся:
- симптомы, свидетельствующие об ухудшении снабжения организма кислородом или сердечно-легочной недостаточности (одышка при движении или в состоянии покоя, затрудненное дыхание, синюшность, кровянистая или окрашенная мокрота, боль в груди, гипотония; гипоксия, определяемая по показаниям пульсоксиметра);
- симптомы, свидетельствующие об осложнениях со стороны ЦНС (измененное психическое состояние, бессознательное состояние, сонливость или трудности с пробуждением и периодические или постоянные конвульсии (судороги), спутанность сознания, сильная слабость или паралич);
- подтверждение текущей устойчивой репликации вируса гриппа или вторичной бактериальной инфекции, основанное на результатах лабораторных исследований или клинических признаках (например, сохранение постоянной высокой температуры тела и других симптомов более 3 дней);
- появление тяжелого обезвоживания, проявляющегося в пониженной активности, головокружении, сниженном диурезе и вялости.
4. ПРИЛОЖЕНИЯ
Приложение 1. Состав рабочей группы по разработке и пересмотр клинических рекомендаций
1. В.П. Чуланов, д.м.н., профессор, зам. директора по научной работе и инновационному развитию ФГБУ «Национальный медицинский исследовательский центр» Минздрава России (Москва)
2. А.В. Горелов, д.м.н., профессор, член-корр. РАН, зам. директора по научной работе ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (Москва)
3. А.Г. Малявин, д.м.н., профессор, профессор кафедры фтизиатрии и пульмонологии лечебного факультета ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, руководитель Центра респираторной медицины (Москва)
4. Е.В. Эсауленко, д.м.н., профессор, зав. кафедрой инфекционных болезней взрослых и эпидемиологии ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (Санкт-Петербург)
5. К.Е. Новак, к.м.н., доцент кафедры инфекционных болезней взрослых и эпидемиологии ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (Санкт-Петербург)
6. С.Л. Бабак, д.м.н., доцент, профессор кафедры фтизиатрии и пульмонологии лечебного факультета ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
7. А.А. Зайцев, д.м.н., профессор ФГКУ «Главный военный клинический госпиталь им. академика Н.Н. Бурденко» Министерства обороны России, главный пульмонолог Министерства обороны России (Москва)
8. С.К. Зырянов, д.м.н., профессор, зав. кафедрой общей и клинической фармакологии ФГАОУ ВО «Российский университет дружбы народов» (Москва)
9. Е.А. Климова, д.м.н., профессор кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России (Москва)
10. И.Э. Кравченко, д.м.н., профессор кафедры инфекционных болезней ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России (Казань)
11. Д.А. Лиознов, д.м.н., директор ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России (Санкт-Петербург)
12. В.В. Малеев, д.м.н., профессор, академик РАН, советник директора по научной работе ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (Москва)
13. В.В. Никифоров, д.м.н., профессор, заведующий кафедрой инфекционных болезней и эпидемиологии ФГБОУ ВО «Российского национального исследовательского медицинского университета им. Н.И. Пирогова» Минздрава России (Москва)
14. А.Ф. Попов, д.м.н., профессор, профессор кафедры инфекционных болезней ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Минздрава России (Владивосток)
15. Н.Ю. Пшеничная, д.м.н., профессор, зам. директора по клинико-аналитической работе ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (Москва)
16. Д.В. Усенко, д.м.н., руководитель образовательного центра, ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора (Москва)
17. А.А. Яковлев, д.м.н., профессор, зав. кафедрой инфекционных болезней, эпидемиологии и дерматовенерологии ФГБОУ ВО «Санкт-Петербургский государственный университет» (Санкт-Петербург)
Все члены рабочей группы являются членами некоммерческого партнерства «Национальное научное общество инфекционистов» (ННОИ) или Российского научного медицинского общества терапевтов (РНМОТ)
Приложение 2. Методология разработки клинических рекомендаций
Целевая аудитория клинических рекомендаций:
1. Врач-инфекционист.
2. Врач-терапевт.
3. Врач-гастроэнтеролог.
4. Врач общей практики.
5. Студенты медицинских вузов, ординаторы, аспиранты.

В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме.
Определение уровня достоверности доказательств и убедительности рекомендаций для лечебных, реабилитационных, профилактических вмешательств

Порядок обновления клинических рекомендаций: каждые 3 года.
Приложение 3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Федерального закона от 17.09.1998 № 157-ФЗ «Об иммунопрофилактике инфекционных заболеваний».
2. Федерального закона от 29.11.2010 № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации».
3. Федерального закона от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
4. Приказа Минздравсоцразвития России от 09.08.2005 № 494 «О порядке применения лекарственных средств у больных по жизненным показаниям».
5. Приказа Минздравсоцразвития России от 27.12.2011 № 1664н «Об утверждении номенклатуры медицинских услуг».
6. Приказа Минздравсоцразвития России от 31.01.2012 № 69н «Об утверждении Порядка оказания медицинской помощи взрослым больным при инфекционных заболеваниях».
7. Приказа Минздрава России от 20.12.2012 № 1183н «Об утверждении Номенклатуры должностей медицинских работников и фармацевтических работников».
8. Приказа Минздрава России от 07.10.2015 № 700н «О номенклатуре специальностей специалистов, имеющих высшее медицинское и фармацевтическое образование».
9. Приказа Минздрава России от 17.12.2015 № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
10. Приказа Минздрава России от 15.06.2016 № 520н «Об утверждении критериев оценки качества медицинской помощи».
11. Санитарно-эпидемиологических правил СП 3.1.2.3117-13 «Профилактика гриппа и других острых респираторных вирусных инфекций» (утверждены Постановлением Врио Главного государственного санитарного врача Российской Федерации от 18.11.2013 № 63).
Приложение 4. Критерии оценки тяжести течения гриппа
Приложение 5. Алгоритм клинической сортировки пациентов с гриппоподобными заболеваниями