ВВЕДЕНИЕ
Местный инфекционный процесс у иммунокомпрометированных пациентов характеризуется быстротой развития и тенденцией к распространению. Возникающая септицемия вследствие слабой реактивности организма становится причиной образования во внутренних органах вторичных очагов, которые без правильного лечебного подхода могут привести к летальному исходу [1].
Представляемый ниже в этой статье клинический случай раскрывает важность своевременной диагностики, раннего назначения радикальной терапии пациентам высокого риска развития инфекционных событий с целью предотвращения такого жизнеугрожающего осложнения септического процесса, как инфекционный эндокардит (ИЭ).
ИЭ представляет собой инфекционно-воспалительное заболевание эндокарда, клапанных структур, пристеночного эндокарда и искусственных внутрисердечных устройств, обусловленное инвазией микроорганизмами (бактериями, грибами), с развитием полипозно-язвенного поражения структур сердца. Он протекает с системным воспалением, прогрессирующей сердечной недостаточностью, тромбогеморрагическими и иммунокомплексными внесердечными проявлениями [2].
Заболеваемость ИЭ варьирует от 46 до 150 случаев на 1 млн жителей в год, при этом уровень связанной с ним госпитальной летальности до сих пор остается крайне высоким (в России за 2010–2020 гг. – 23,1%) [2].
Патогенез ИЭ состоит из трех основных составляющих – бактериемии, изменений эндокарда и ослабления резистентности организма. Источниками бактериемии могут выступать очаги хронической инфекции, а также инвазивные исследования и манипуляции. При определенных условиях происходит фиксация бактерий к клапанному и париетальному эндокарду. Факторы, облегчающие адгезию микроорганизмов на эндотелиальной поверхности, могут быть разделены на две группы – местные и общие. Первые включают морфологические изменения клапанного аппарата (врожденные и приобретенные), а также изменения сердечной гемодинамики, обусловленные пороками сердца. К общим факторам, облегчающим развитие ИЭ, могут быть отнесены выраженные изменения системы естественной резистентности [3].
Фактором высокого риска ИЭ, наряду с прочим, служит выполнение процедур гемодиализа (ГД) [4, 5]. Повышенному риску развития ИЭ у гемодиализных пациентов способствуют сосудистый доступ, иммунологическая восприимчивость, сопутствующие заболевания, иммуносупрессивная терапия и белковая недостаточность [6]. По данным исследований, примерно у 2,0–8,3% пациентов, находящихся на ГД, развивается ИЭ, а заболеваемость ИЭ среди таких пациентов в 50–60 раз выше, чем в общей популяции [7, 8]. Особенностями течения ИЭ у больных, получающих гемодиализ, являются более частое поражение митрального клапана, более высокие показатели персистирующей бактериемии, значительно более высокая смертность [8]. При этом частота кардиохирургических вмешательств у пациентов с ИЭ, находящихся на ГД, существенно ниже, чем у пациентов, не получающих эту процедуру. Это объясняется более высоким хирургическим риском у таких пациентов, в связи с чем у них преимущественно проводится консервативная тактика лечения ИЭ [8]. Тем не менее, по данным ряда исследований, выживаемость у гемодиализных пациентов с ИЭ после оперативного лечения значительно выше, чем у получавших консервативное лечение [9]. Это позволяет рассматривать кардиохирургические вмешательства как метод лечения у пациентов данного профиля.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Пациент М., 36 лет, был госпитализирован в отделение реанимации экстракорпоральных методов лечения Городской клинической больницы № 15 им. О.М. Филатова 27.09.2022 с жалобами на боли, отек в области артериовенозной фистулы (АВФ) на правом предплечье, повышение температуры тела до 39,0 °С, а также в связи с ухудшением состояния из-за пропущенной процедуры ГД в виду невозможности ее проведения.
Данные анамнеза: в 2016 г. у пациента развилась диализ-потребная почечная недостаточность в исходе хронического гломерулонефрита без морфологической верификации. В том же году была проведена трансплантация почки от живого родственного донора, в связи с чем до настоящего времени в качестве иммуносупрессивной терапии пациент принимает такролимус.
В июне 2022 г. у пациента были выявлены острая дисфункция нефротрансплантата, рецидив терминальной почечной недостаточности (тХПН). С целью проведения ГД на правом предплечье была сформирована АВФ, на время ее созревания поставлен туннельный центральный венозный катетер (тЦВК) во внутреннюю яремную вену (ВЯВ) слева.
Наследственный анамнез пациента не отягощен. Вредные привычки отрицает.
Данные осмотра на момент поступления: обнаружены гипертермия до 37,6 °С, отек и гиперемия 15×4 см на правом предплечье, некротизированные участки кожи размером 5×4 см и флюктуация в зоне АВФ.
По результатам лабораторных исследований выявлены нормохромная нормоцитарная анемия тяжелой степени (гемоглобин – 60 г/л), нейтрофильный лейкоцитоз (лейкоциты –13,0×109/ л, нейтрофилы – 11,4×109/л), лимфопения (лимфоциты – 0,9×109/л), тромбоцитопения (99×109/л), повышенный уровень С-реактивного белка (167,0 мг/л), уремия (креатинин – 653,5 мкмоль/л, мочевина – 36,8 ммоль/л), гиперкалиемия (5,5 ммоль/л).
При рентгенографии органов грудной клетки (ОГК) очаговых и инфильтративных изменений не обнаружено, в левой ВЯВ визуализирован тЦВК.
Результаты эхокардиографического исследования (ЭхоКГ): гипертрофия миокарда левого желудочка (ЛЖ), диффузный гипокинез его стенок со снижением глобальной сократимости (фракция выброса 37%), расширение левого предсердия, недостаточность митрального (МК) и трикуспидального (ТК) клапанов 1-й степени.
По данным эзофагогастродуоденоскопии (ЭГДС), ультразвукового исследования (УЗИ) органов брюшной полости (ОБП), почек и вен нижних конечностей, значимых изменений не установлено.
По результатам ультразвукового исследования (УЗИ) верхних конечностей был подтвержден диагноз: абсцесс в области АВФ на правом предплечье.
С первого дня госпитализации пациенту была начата антибактериальная терапия (АБТ) – ципрофлоксацин 500 мг 1 раз/сут перорально. Вследствие возникшего в области абсцесса аррозивного кровотечения больному была экстренно выполнена хирургическая обработка гнойного очага с остановкой кровотечения.
В связи с высоким риском присоединения внутрибольничной инфекции на 3-й день госпитализации была произведена замена АБТ на внутривенное (в/в) введение цефоперазона/сульбактама по 2 г 2 раза/сут.
На 11-е сутки по результатам бактериологического исследования хирургического материала у пациента была выявлена MRSA-флора. По рекомендации клинического фармаколога АБТ была скорректирована – назначен линезолид по 600 мг 2 раза/сут в/в.
На 16-е сутки у пациента появились гипертермия до 38 °С и озноб, выраженная слабость, одышка. Учитывая клиническую картину и результаты лабораторных исследований, ему были эмпирически назначены меропенем по 2 г 2 раза/сут и ванкомицин по 1 г 1 раз/сут после процедуры ГД, линезолид отменен.
На 17-й день были выполнены повторная ЭхоКГ и мультиспиральная компьютерная томография (МСКТ) ОГК. По данным ЭхоКГ, в правом предсердии, у основания септальной створки ТК были обнаружены гиперэхогенная подвижная структура размерами до 25 мм, пролабирующая в правый желудочек. Выявлены незначительная недостаточность МК и ТК, фракция выброса левого желудочка (ФВ ЛЖ) составила 44%. На МСКТ ОГК обнаружены множественные участки консолидации в разных сегментах легких с полостями деструкции, что было расценено как признаки двусторонней септической пневмонии, а также малый левосторонний гидроторакс до 15 мм, жидкость в полости перикарда 8 мм, краевые участки разряжения костной ткани замыкательных пластинок тел позвонков в сегменте Th8–Th9 (рис. 1).
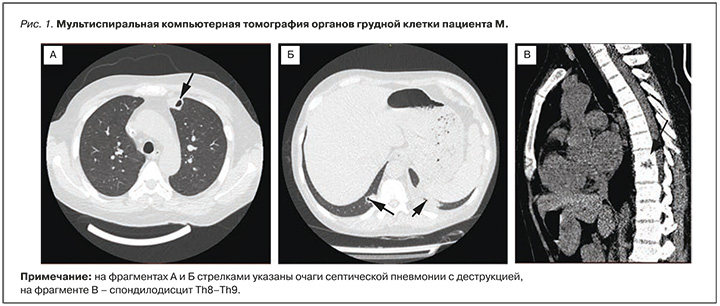
Таким образом, были подтверждены осложнения основного заболевания: острый эндокардит ТК; двусторонняя септическая пневмония; спондилодисцит Th8–Th9. Кроме того, в течение госпитализации неоднократно выявлялась дисфункция временного доступа для ГД.
После консультации с кардиохирургом пациенту было показано оперативное вмешательство. На фоне проводимой в предоперационном периоде АБТ (меропенем, ванкомицин) отмечалась положительная динамика в виде регресса синдрома интоксикации, подъема температуры тела не более 37,5 °С, снижение лейкоцитов до 7,4×109/л.
На 19-й день пребывания в стационаре пациенту было выполнено хирургическое вмешательство по удалению вегетации ТК с последующей пластикой его септальной створки в условиях искусственного кровообращения. АБТ была продолжена по прежней схеме. На 23-е сутки по результатам посева крови определялся золотистый стафилококк, резистентный к цефокситину. Произведена замена схемы АБТ на линезолид по 600 мг 2 раза/сут в/в.
На 33-е сутки больной был переведен в нефрологическое отделение с целью контроля за состоянием и подготовки к формированию новой АВФ. Продолжалось консервативное лечение: АБТ, применение антигипертензивных, антитромботических, иммуносупрессивных, гастропротекторных препаратов, проведение ГД, коррекция анемии и тромбоцитопении.
На 37-й день наблюдения у пациента возобновился интоксикационный синдром, отмечались гипертермия до 38,2 °С, озноб. Для исключения вторичных очагов инфекции были выполнены инструментальные исследования – ЭхоКГ, КТ ОГК, УЗИ ОБП и малого таза, почек: данных в пользу новых изменений получено не было. По результатам посева крови обнаружен рост Staphylococcus aureus и резистентной к карбапенемам Klebsiella pneumoniae. В связи с этим было предпринято назначение комбинированной АБТ в виде цефтаролина в/в 300 мг 2 раза/сут, колистина 60 мг 1 раз/сут с положительной динамикой состояния больного. Результаты посева крови на 42-е сутки указывали на отсутствие патологического роста, было принято решение о продолжении подобранной схемы АБТ.
На 43-й день пациент стал жаловаться на неоформленный стул, тошноту и рвоту съеденной пищей. Данные объективного осмотра: артериальное давление 110/60 мм рт.ст., частота сердечных сокращений 78 уд/мин; живот мягкий, безболезненный при пальпации. В связи со снижением уровня гемоглобина с 122 до 95 г/л и рвотой пациенту были экстренно проведены УЗИ ОБП и ЭГДС: данных в пользу желудочно-кишечного кровотечения обнаружено не было. Кал на Clostridium difficile сдать не удалось.
Вследствие подозрения на развитие псевдомембранозного колита к проводимой АБТ был добавлен метронидазол по 500 мг 3 раз/сут перорально. Наблюдались уменьшение диареи и синдрома интоксикации, снижение острофазовых показателей.
На 52-е сутки по данным посева крови на флору повторно подтвердилось отсутствие патологического роста. На основании положительной динамики состояния пациента, результатов лабораторной диагностики был отменен прием цефтаролина, колистина и метронидазола. Продолжено лечение псевдомембранозного колита ванкомицином в/в 1 г 1 раз/сут после ГД.
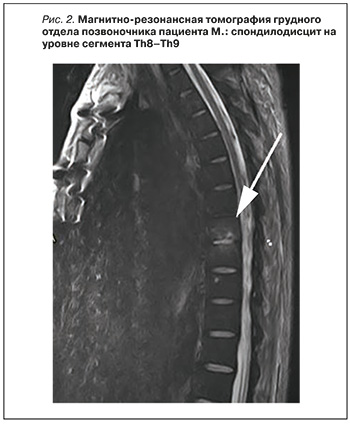
В связи с появлением жалоб на боли в спине была выполнена магнитно-резонансная томография грудного отдела позвоночника, подтверждены признаки спондилодисцита на уровне сегмента Th8–Th9 (рис. 2). Больной получил консультацию нейрохирурга: оперативное вмешательство показано не было, проводилась симптоматическая терапия.
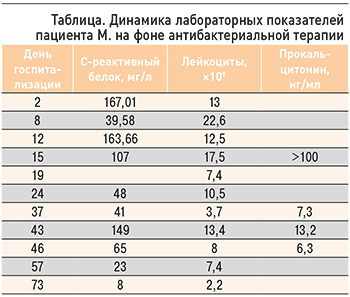
Достигнутые к 57-му дню пребывания в стационаре показатели сделали возможным перевод пациента в отделение сердечно-сосудистой хирургии, где была сформирована АВФ на левом предплечье, имплантирован тЦВК в правую ВЯВ. Полная отмена АБТ ванкомицином состоялась на 77-е сутки. В таблице представлена динамика некоторых лабораторных показателей больного.
Пациент был выписан из стационара на 80-е сутки в удовлетворительном состоянии с диагнозом: острый эндокардит трикуспидального клапана. Состояние после удаления вегетации и пластики септальной створки трикуспидального клапана в условиях искусственного кровообращения 14.10.2022 Двусторонняя септическая пневмония в стадии разрешения. Спондилодисцит Th8–Th9. Антибиотик-ассоциированная диарея.
Предварительно были проведены контрольные ЭхоКГ и КТ ОГК. Картина ЭхоКГ с улучшением, наблюдалось увеличение ФВ ЛЖ до 49%. По данным КТ положительная динамика течения пневмонии в верхней доле левого легкого, остаточные изменения в сегменте Th8–Th9.
ОБСУЖДЕНИЕ
Приведенный клинический случай доказывает актуальность вопроса профилактики и выбора тактики лечения ИЭ у больных с тяжелыми соматическими заболеваниями.
У наблюдавшегося пациента имелись несколько факторов, позволивших отнести его в группу высокого риска развития инфекционных осложнений. Среди них иммуносупрессивная терапия, прогрессирование тХПН, необходимость программного ГД, наличие имплантированного ЦВК, многократные пункции АВФ и ее абсцедирование. Прогрессирование основного заболевания до терминальной стадии ХБП, его осложнения в виде тяжелого анемического синдрома, эндогенной интоксикации продуктами азотистого обмена привели к снижению общей реактивности организма пациента.
Вышеперечисленные факторы способствовали присоединению микст-инфекции, быстрому распространению локального инфекционного процесса с формированием нескольких вторичных очагов – ИЭ, септической пневмонии, спондилодисцита. Иммунокомпрометированность организма больного определила стертость клинической картины, что затруднило своевременную диагностику ИЭ. Наличие постоянных входных ворот для инфекции в виде тЦВК создавало предпосылки рецидивирующего характера инфекции, несмотря на проводимую адекватную АБТ с учетом резистентности микроорганизмов. Кроме того, длительное применене антибактериальных препаратов привело к развитию псевдомембранозного колита, что усугубило состояние пациента и увеличило время его пребывания в стационаре.
Данное наблюдение показывает, что ИЭ характеризуется разнообразной клинической картиной, имеет множественные жизнеугрожающие осложнения и требует длительного лечения. Назначение эффективной АБТ и раннее выполнение оперативного вмешательства обусловили благоприятный исход.
ЗАКЛЮЧЕНИЕ
Представленный клинический случай демонстрирует актуальность проблем диагностики и своевременного лечения ИЭ, особенно у иммунокомпрометированных пациентов. Применение визуализирующих методов исследования на ранних этапах госпитализации, незамедлительное назначение комбинации антибактериальных препаратов широкого спектра действия, активное междисциплинарное взаимодействие специалистов – основные направления, которые позволяют ограничить или даже предотвратить развитие ИЭ и, как следствие, препятствовать отягощению основного заболевания.
Таким образом, тщательный контроль за состоянием больных данного профиля, выбор более радикальной тактики ведения могут повысить эффективность терапии и увеличить выживаемость.



