ВВЕДЕНИЕ
В настоящее время наиболее частой причиной смертности трудоспособного населения являются хронические неинфекционные заболевания (ХНИЗ) [1]. Как можно более раннее выявление ХНИЗ стало одной из приоритетных задач здравоохранения в мире [1, 2].
На сегодняшний день установлены общие предпосылки развития основных ХНИЗ – факторы риска [1–5]. Для эффективного обнаружения ХНИЗ на ранних стадиях разработана и внедрена факторная стратегия профилактики [3–5]. Важно, что при наличии отдельных факторов риска ХНИЗ пациент может чувствовать себя здоровым и не предъявлять жалоб, что затрудняет раннюю диагностику таких заболеваний.
Современные зарубежные и отечественные исследования доказали влияние полиморфизма микробиоты на поддержание оптимального состояния здоровья и на возникновение и поддержание хронического течения заболеваний [6–11]. Однако современными программами профилактики и диспансеризации не предусматривается проведение исследований кишечной микробиоты [12].
Сочетание отдельных факторов риска ХНИЗ может создавать кумулятивный эффект, ухудшающий состояние здоровья, что доказывает необходимость глубокого изучения таких сочетаний. Цель исследования – определить видовое разнообразие просветного культурома толстой кишки у амбулаторных пациентов, считающих себя здоровыми.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 114 амбулаторных пациентов в возрасте от 18 до 72 лет, давших добровольное информированное согласие на медицинское исследование.
Критерии включения в исследование: лица, считающие себя здоровыми и/или не обращавшиеся к врачу в течение последних 3 мес, пришедшие в поликлинику по любой причине и/или приглашенные целенаправленно лечащим врачом общей практики.
Критерии исключения: лица, имеющие жалобы и считающие себя нездоровыми, обращавшиеся к врачу в течение последних 3 мес, больные, находящиеся в состоянии острого заболевания или обострения хронического заболевания, пациенты с декомпенсированными состояниями при наличии ХНИЗ, с наличием инфекционного или онкологического заболевания.
В ходе исследования выполнялись клиническое обследование участников с детализированным активным сбором жалоб и анамнеза, общая самооценка ими здоровья по шкале «Градусник», оценка мотивационной направленности по шкале мотивации успеха и боязни неудачи, осмотр, антропометрическое исследование (расчет индекса массы тела, измерение окружности талии, окружности бедер и их соотношения, оценка степени ожирения при его наличии по критериям Всемирной организации здравоохранения, 1997 г.), дополнительные и лабораторные методы исследования по клиническим показаниям. У всех пациентов был определен видовой состав (культуром) просветной микробиоты толстой кишки. Посевы биоматериала проводились на расширенный перечень питательных сред: 5% кровяной агар (HiMedia, Индия), висмут-сульфитный агар (HiMedia, Индия), SS-агар (HiMedia, Индия), селективную среду для выделения облигатно анаэробных микроорганизмов (HiMedia, Индия), универсальную хромогенную среду (HiMedia, Индия), маннитоловый агар (HiMedia, Индия), среды для селективного выделения клостридий (HiMedia, Индия), лактобактерий (HiMedia, Индия), бифидобактерий (HiMedia, Индия), среду Сабуро (HiMedia, Индия). Анаэробные условия были созданы с использованием газогенерирующих пакетов («Анаэрогаз», Россия). Идентификация всех выросших колоний микроорганизмов осуществлялась методом MALDI-ToF масс-спектрометрии на приборе Microflex LT (Bruker, Германия).
Повторное исследование пациентов и определение спектра просветной микрофлоры кишечника было проведено после дифференцированного врачебного вмешательства.
Исследование было одобрено Комитетом по биоэтике при ФГБОУ «Самарский государственный медицинский университет» Минздрава России (протокол от 22.05.2019 № 200).
Статистический анализ выполнялся с помощью программы Microsoft Excel 2010 и пакета статистических и прикладных программ IBM SPSS Statistics 26.0 с оценкой на нормальность распределения и теста хи-квадрат. Различия между группами определялись с помощью непараметрического анализа и считались достоверными при уровне значимости p <0,05.
РЕЗУЛЬТАТЫ
Общая характеристика участников исследования представлена в таблице 1. Значительная доля пациентов (n=53; 46,5%), считающих себя здоровыми, имела повышенные значения индекса массы тела (ИМТ), причем чаще это наблюдалось у женщин, чем у мужчин: 39 (34,1%) против 14 (12,3%) человек.
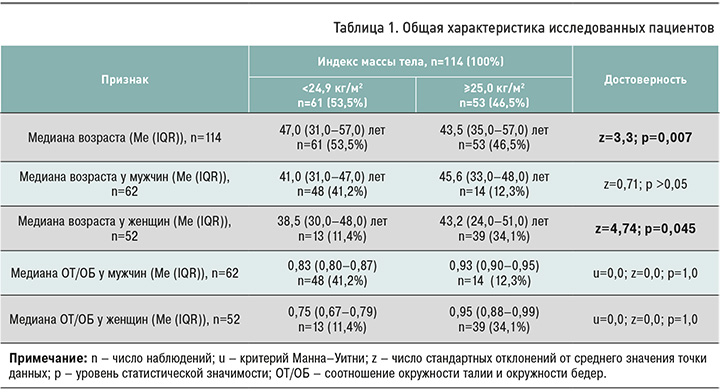
Видовое разнообразие просветного культурома толстой кишки определяли по количеству всех видов микроорганизмов, выросших на всех питательных средах, которые применялись в исследовании, с последующей идентификацией всех колоний методом MALDI-ToF масс-спектрометрии. После видовой идентификации микроорганизмы были сгруппированы по родам. Отдельная группировка была сделана для микроорганизмов, чей основной локус обитания в организме человека – полость рта, рото- и носоглотка (орофарингеальная микрофлора): к ней были отнесены стрептококки, нейссерии, коринебактерии, моракселлы и др. Полученные данные представлены в таблице 2. Как видно из нее, наличие только бифидобактерий было обнаружено у пациентов в возрасте 37±14,85 лет, только лактобактерий – 44,97±14,42 лет. Отсутствие всех групп микрофлоры было выявлено у исследуемых в возрасте 46,25±13,88 лет. Таким образом, с возрастом возможна тенденция к уменьшению обсемененности в целом и снижение содержания бифидобактерий в просветной микрофлоре.
Наименьшие показатели самочувствия (общей самооценки здоровья по шкале «Градусник») были получены в группах пациентов с наличием только бифидобактерий (57,5±3,54 баллов), наибольшие – у пациентов с наличием всех представителей нормальной микрофлоры кишечника (83,5±13,75 баллов). На основании этих данных можно предположить зависимость самочувствия пациента от полиморфизма представленной просветной микрофлоры.
Наиболее значимое повышение ИМТ отмечалось у участников исследования с наличием только бифидобактерий (27,83±5,41 кг/м2), наименьшие – у пациентов с наличием бактероидов и лактобактерий (22,9±3,44 кг/м2). Следовательно, нормализация массы тела, вероятно, зависит от присутствия в просветной микрофлоре бактероидов и лактобактерий.
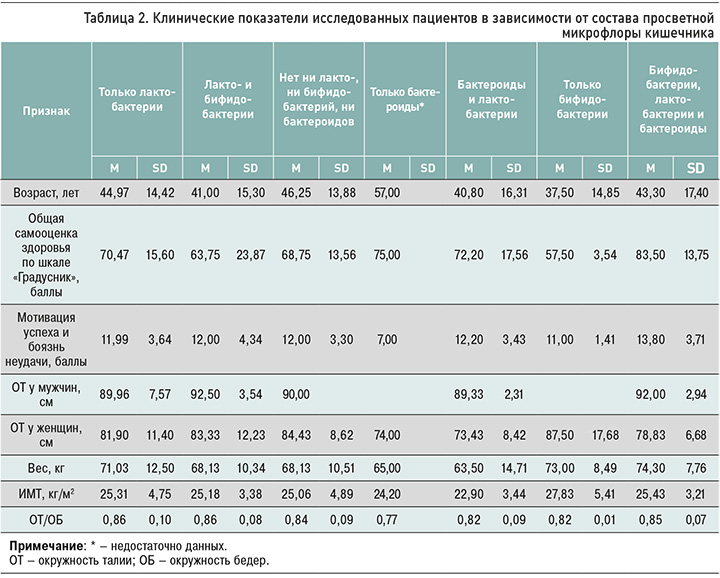
При расчете теста Тьюки (множественные апостериорные сравнения между группами) было обнаружено статистически значимое различие средних результатов массы тела в группах пациентов, где отсутствовала орофарингеальная микрофлора и где были выделены ее представители (р=0,014; 95% доверительный интервал: 1,375–16,922). Не было найдено статистически значимой разницы в показателях массы тела между группами с отсутствием орофарингеальной флоры и группами, где были идентифицированы только стрептококки или только коринебактерии (табл. 3). Статистически значимой разницы видового состава кишечной микрофлоры в группах, отличавшихся по другим антропометрическим показателям, возрасту, самочувствию и мотивации, установлено не было.
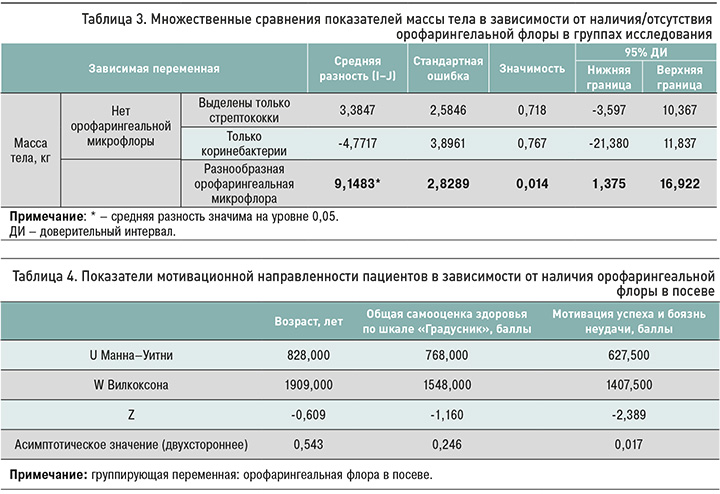
При сравнении непараметрическим методом Манна–Уитни групп участников с наличием орофарингеальной флоры и групп, где в посеве были выделены только стрептококки (табл. 4), мы установили различия между этими пациентами по их мотивационной направленности (мотивация на успех или боязнь неудачи; U=627,5; z=-2,389; р ≤0,05). По другим показателям (возрасту и самочувствию) статистически значимых отличий обнаружено не было. Основываясь на этих результатах, можно предполагать наличие взаимосвязи между наличием орофарингеальных стрептококков в посеве просветной кишечной микрофлоры и направленностью мотивации пациента.
ОБСУЖДЕНИЕ
Избыточная масса тела и ожирение выступают важнейшими модифицируемыми факторами риска атеросклероза, артериальной гипертензии, сахарного диабета, психических заболеваний, патологии опорно-двигательного аппарата, мочеполовой системы, злокачественных новообразований, репродуктивных нарушений и психовегетативных расстройств, при которых общая смертность возрастает в 3 раза [1, 3, 5, 6]. Наибольшую опасность представляет абдоминальное ожирение [3, 5]. В российской популяции избыточную массу тела имеют до 64% жителей, каждый третий страдает ожирением, у 2/3 населения наблюдается абдоминальное ожирение [4, 5].
В нашем исследовании около 50% пациентов, считающих себя здоровыми и вследствие этого не обращающихся к врачу, имели повышенные значения ИМТ. При более раннем выявлении этого фактора риска у этой категории больных можно существенно улучшить их состояние здоровья и прогноз развития ХНИЗ.
При анализе культурома толстой кишки обнаружена тенденция к уменьшению обсемененности в целом и снижению содержания бифидобактерий в просветной микрофлоре при повышении возраста пациентов, к нормализации массы тела при наличии в просветной микрофлоре бактероидов и лактобактерий, зависимость самочувствия пациента от видового разнообразия представителей просветной микрофлоры. Обнаружена взаимосвязь массы тела и направленности мотивации пациента с наличием орофарингеальной флоры в посеве. Таким образом, определение просветной микрофлоры в рамках программ профилактики и диспансеризации может дать дополнительные важные сведения о присутствующих факторах риска ХНИЗ у пациента.
ЗАКЛЮЧЕНИЕ
Несмотря на активно применяемые в настоящее время меры профилактики и диспансеризации, преждевременная смертность и заболеваемость трудоспособного населения от ХНИЗ все еще остаются высокими [2, 4]. Поиск эффективных и надежных методик выявления нарушений здоровья на максимально ранних стадиях заболевания, учитывающих особенности работы в амбулаторных условиях (т.е. дешевых, простых в исполнении и требующих минимума временных затрат), является одной из актуальнейших задач науки и практики здравоохранения. Важными мероприятиями могут оказаться усилия по привлечению к раннему посещению врача пациентов, считающих себя здоровыми, и определение состава просветной микрофлоры кишечника в рамках программ профилактики и диспансеризации.



