Дисплазия соединительной ткани (ДСТ) представляет собой генетически обусловленный дефект развития и метаболизма волокнистых структур и основного вещества соединительной ткани, имеющий медленно прогрессирующее течение и нарушающий гомеостаз на всех уровнях организма [1, 2]. Выделяют дифференцированные (моногенные) формы ДСТ, для которых установлен ген и определен тип его наследования (синдром Марфана, синдром Элерса–Данло, несовершенный остеогенез и т.д.) и недифференцированные (многофакторные) формы ДСТ(нДСТ), возникающие при взаимодействии множественных факторов генетической предрасположенности и неблагоприятных условий среды. НДСТ не является самостоятельным заболеванием, тем не менее может послужить фоном для различной соматической патологии [3].
Согласно данным литературы, частота встречаемости фенотипических признаков нДСТ выше в детском и подростковом возрасте [4, 5]. В то же время активный метаболизм скелетных соединительнотканных структур происходит до 25–28 лет, что говорит о необходимости его ранней коррекции для предотвращения формирования ассоциированной патологии. Одной из актуальных проблем молодых лиц с нДСТ являются высокий риск развития преждевременного остеопороза [6, 7] и болевой синдром, который способен влиять на качество жизни уже на ранних этапах жизни [8]. Тем не менее на сегодняшний день исследования влияния нДСТ на состояние костной ткани у лиц молодого возраста носят фрагментарный характер.
Цель исследования – изучить минеральную плотность костной ткани (МПКТ) у лиц молодого возраста с нДСТ и провести поиск ассоциаций с болевым синдромом различной локализации.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 85 испытуемых, из них 88,23% лиц женского пола (n=75) и 11,77% мужского (n=10). Средний возраст для девушек составил 20,89±0,30 лет, для юношей 21,80±1,17 лет. Все обследованные принимали участие добровольно, были информированы о ходе исследования, было получено письменное согласие.
Признаки нДСТ были определены путем антропометрии, клинического исследования и инструментальных методов диагностики (ультразвуковое исследование органов брюшной полости, эхокардиографии) с применением балльной шкалы Т.И. Кадуриной (2008). Критериями исключения выступали моногенные формы ДСТ, острые заболевания, отказ от обследования. В группу с признаками нДСТ вошли 40 человек, в группу контроля – 45.
Гипермобильность суставов (ГМС) определялась с помощью 9-балльной шкалы Beighton (1998): тест запястья, тест пассивного разгибания мизинца, переразгибания в локтевых и коленных суставах более 10о, передний наклон туловища с касанием пола. Дополнительно участникам исследования были заданы вопросы, связанные с болевым синдромом:
1. Испытывали ли вы в последний месяц боли в суставах?
2. Испытывали ли вы в последний месяц боли в позвоночнике?
3. Сколько раз за последнюю неделю вы испытывали боли в суставах?
4. Сколько раз за последнюю неделю вы испытывали боли в позвоночнике?
5. Оцените интенсивность болевого синдрома в суставах по шкале от 1 до 10.
5. Оцените интенсивность болевого синдрома в позвоночнике по шкале от 1 до 10.
Проводилась рентгеновская денситометрия на аппарате Lunar Prodigy Advance (GE Healthcare, США) в режиме Total Body, с расчетом значения Z-критерия.
Статистическая обработка данных выполнялась в Microsoft Excel, Statistica 12.0 параметрическими и непараметрическими методами, корреляционный анализ осуществлялся по Спирмену, групповое сравнение проводилось с помощью вычисления критерия Манна–Уитни (U) и точного критерия Фишера (χ2).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
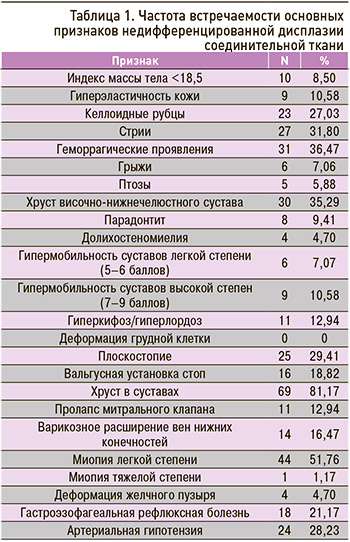 Всем участникам исследования был проведен клинический осмотр и инструментальная диагностика для выявления фенотипических признаков нДСТ. Результаты представлены в таблице 1.
Всем участникам исследования был проведен клинический осмотр и инструментальная диагностика для выявления фенотипических признаков нДСТ. Результаты представлены в таблице 1.
Наиболее часто встречались следующие признаки:
- хруст в суставах (один из неспецифических признаков, который может встречаться как в норме, так и при патологии суставов) – у 69 обследованных (81,17%);
- хруст височно-нижнечелюстного сустава (ВНЧС) – у 30 (35,29%) обследуемых;
- миопия легкой степени (до -4,5 Дпт) – у 44 (51,76%) участников исследования. Миопия тяжелой степени была выявлена только у 1 (1,17%) обследованного, тем не менее ее распространенность, по данным отечественной литературы, прямо пропорциональна степени выраженности нДСТ и может достигать почти 55% [9].
Реже встречались деформация желчного пузыря – у 4 обследованных (4,70%), птозы внутренних органов – у 5 (5,88%), не было выявлено деформаций грудной клетки. Дефекты в развитии волокнистых структур при нДСТ, с одной стороны, приводят к изменению длины и размеров полых органов, что может проявляться в виде перегиба желчного пузыря, удлиненного желчного пузыря, долихосигмы и мегаколона [10], приводящие к нарушению их сократительной функции, застойным явлениям и явлениям дистрофии [11]. С другой же стороны, несостоятельность связочного аппарата паренхиматозных органов приводит к птозам внутренних органов.
Одним из наиболее характерных клинических проявлений ДСТ принято считать ГМС, которая входит в симптомокомплекс многих моногенных форм и встречается в изолированном состоянии. ГМС легкой степени была выявлена у 6 человек (7,07 %), выраженной степени у 9 человек (10,58%). Единичные признаки ГМС (1–4 балла по шкале Beighton) встречались у подавляющего большинства обследованных (n=70), однако известно, что к 35 годам количество лиц с единичными признаками гипермобильности уменьшается почти в 3 раза [12].
Было проведено исследование болевого синдрома различной локализации в группах нДСТ, ГМС и контроля. Боль в суставах за последний месяц отмечали 36 обследованных, боль в позвоночнике – 47. Результаты сравнительного анализа характеристик болевого синдрома в зависимости от наличия нДСТ и ГМС представлены в таблицах 2 и 3.
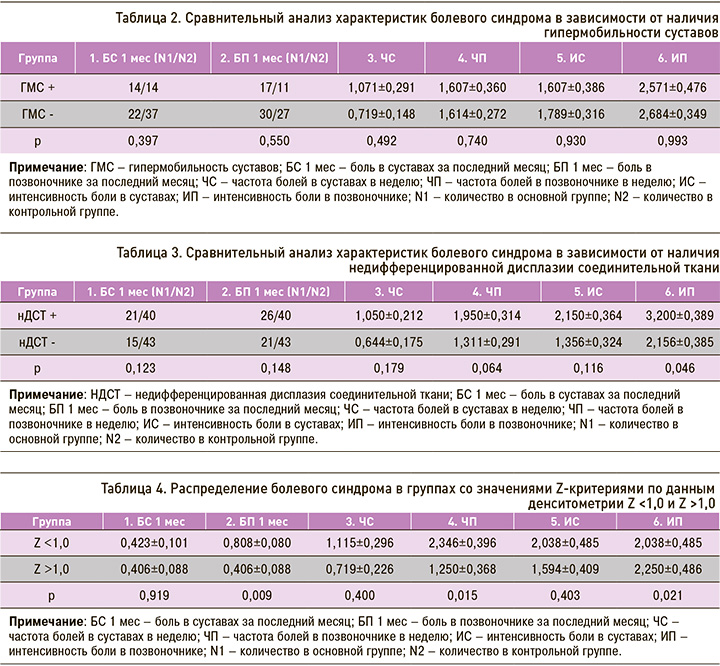
В группе лиц с ГМС отмечается более высокая частота встречаемости болевого синдрома в суставах и позвоночнике за последний месяц, частота болей в суставах в неделю, однако различия не достигли уровня статистической значимости. В группе нДСТ все характеристики болевого синдрома превышали таковые в контрольной группе, различия в интенсивности болей в позвоночнике достигли уровня статистической значимости (p=0,046; U=673,5).
Было проведено исследование МПКТ с определением Z-критерия у ряда пациентов в сформированных группах (n=58). Вопреки многим литературным данным, значения Z-критерия значимо не различались у лиц с ГМС, нДСТ и у лиц без этих клинических состояний. Медиана Z-критерия (M) в группе нДСТ составила М=1,100, в группе контроля – М=1,100, в группе ГМС – М=0,950, в группе контроля – М=1,100.
Однако при проведении анализа по Спирмену для всей выборки (n=58) была обнаружена слабая положительная корреляция между ГМС и значением Z-критерия (r=0,290; p <0,05). Несмотря на сопоставимые уровни МПКТ у обследованных, обращает на себя внимание снижение значения Z-критерия у ряда лиц. Были сформированы две группы: в первую вошли лица со значением Z-критерия по данным денситометрии Z <1,0 (n=14), во вторую – Z >1,0 (n=44). Была выполнена оценка характеристик болевого синдрома в данных группах (табл. 4). Выявлены статистически значимые ассоциации снижения Z-критерия менее 1,0 с болью в позвоночнике за последний месяц (р=0,009; U=249,0), с частотой боли в позвоночнике в неделю (p=0,015; U=259,5) и ее интенсивностью (p=0,021; U=268,0).
Болевой синдром, локализующийся главным образом в позвоночнике, можно объяснить несколькими способами. Во-первых, с позиции особенностей костного метаболизма у лиц с нДСТ-ассоциированной остеопенией, причинами которой могут являться недостаточная эффективность витамина D [13, 14], и относительно низкой активности остеобластов (сниженное содержание в сыворотке крови маркеров костеобразования (PINP- procollagen type I N propeptide и остеокальцина)) при нормальном уровне маркера разрушения кости CrossLaps с относительным преобладанием резорбции костной ткани [15]. Во-вторых, с позиции присутствующей при нДСТ ГМС, субстратом которой является несовершенство соединительнотканных элементов – связочного аппарата, сухожилий, которые провоцируют нестабильность и гипермобильность в различных отделах позвоночника. Нестабильность в одном отделе позвоночного столба компенсируется мышечным гипертонусом и гипомобильностью в других отделах, что приводит к функциональным блокадам и дегенеративно-дистрофическим процессам [16], сопровождающимися болевым синдромом.
ЗАКЛЮЧЕНИЕ
Таким образом, не было выявлено различий в МПКТ у лиц с нДСТ, ГМС и контрольной группы. Среди молодых людей с признаками нДСТ чаще встречается болевой синдром, локализующийся в позвоночнике, интенсивность его значимо превышает таковую в группе контроля. Остеопении среди обследованных лиц выявлено не было, тем не менее значение Z-критерия <1,0 значимо ассоциировано с частотой и интенсивностью болевого синдрома в позвоночнике.



