ВВЕДЕНИЕ
За последнее десятилетие в России значительно снизилась смертность от сердечно-сосудистых заболеваний. Широкое внедрение в этот период эндоваскулярных методов реваскуляризации миокарда позволило существенно улучшить результаты лечения инфаркта миокарда (ИМ) и других форм ишемической болезни сердца (ИБС) [1]. Отметим, что количество операций коронарного стентирования возрастает во всем мире: например, в Германии выполняется 350 тыс таких операций в год [2], а в США – более 2 млн [3]. В нашей стране число таких вмешательств также увеличивается: так, если в 2016 г. было проведено 107 тыс. операций по установке сосудистых стентов в рамках высокотехнологичной медицинской помощи, то в 2017 г. – уже 110 тыс. [4].
Вместе с тем одним из осложнений, ограничивающих клиническую эффективность чрескожных коронарных вмешательств (ЧКВ), является развитие рестенозов стентов, частота которых может достигать 30–42% [5]. Механическая травма сосудистой стенки может индуцировать воспалительные, пролиферативные процессы и ремоделирование внеклеточного матрикса. Если в первые дни после ЧКВ стеноз стента возникает, как правило, вследствие тромботической окклюзии стентированного сегмента, то в поздние сроки наибольшую роль в развитии нарушений проходимости коронарных артерий (КА) играет неоинтимальная гиперплазия [6–8].
Уровень летальности вследствие повторных ИМ среди больных всех возрастов составляет в среднем 18,5%. При этом была обнаружена статистически значимая, сильная прямая корреляционная зависимость частоты летальных исходов от возраста пациентов [9].
Способность предсказать вероятность рестеноза представляется полезной как для выявления регулируемых факторов риска, так и возможности предупреждения этого грозного осложнения.
Цель исследования – сравнить особенности клинического течения повторного ИМ у пациентов с тромбозом/стенозом в ранее установленном стенте и нарушением проходимости КА вне его на фоне прогрессирования атеросклероза.
МАТЕРИАЛ И МЕТОДЫ
Было обследовано 212 пациентов, лечившихся по поводу повторного ИМ в Санкт-Петербургском НИИ скорой помощи им. И.И. Джанелидзе в 2018–2021 гг. Все больные получали терапию ИМ в соответствии с национальными рекомендациями. Пациентам проводилось стентирование инфаркт-зависимой КА в экстренном порядке в предыдущую и настоящую госпитализации. Использовались голометаллические стенты (22,8%) и стенты с лекарственным покрытием (77,2%). В рамках исследования участникам выполнялись стандартные электрокардиографические, эхокардиографические, рентгенографические, лабораторные исследования.
Все пациенты были разделены на две выборки. В 1-ю группу вошли 110 человек с тромбозом/стенозом в стенте – 88 (80,0%) мужчин и 22 (20,0%) женщины (средний возраст 64,3±1,1 года). Среди них ИМ с подъемом сегмента ST (ИМспST) был диагностирован у 72 человек, без подъема сегмента ST (ИМбпST) – у 38. 2-ю группу составили 102 пациента со стенозом вне стента, установленного ранее, – 64 (62,7%) мужчины и 38 (37,3%) женщин (средний возраст 66,4±1,2 года). ИМспST был выявлен у 66 человек, у 36 – ИМбпST.
Материалы исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (разработчик – IBM Corporation).
Количественные показатели оценивались на предмет соответствия нормальному распределению, для чего применялся критерий Колмогорова–Смирнова (при числе исследуемых более 50). При сравнении средних величин в нормально распределенных совокупностях количественных данных рассчитывался t-критерий. Сравнение номинальных данных выполнялось при помощи критерия χ2 Пирсона. Различия показателей считались статистически значимыми при уровне p <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Нами был проанализирован срок наступления повторного ИМ у исследованных пациентов. У больных в 1-й группе это событие случалось в среднем через 3,9 лет, во 2-й – через 5,5 лет (p=0,04).
У большинства участников обеих групп в анамнезе на догоспитальном этапе регистрировалась хроническая сердечная недостаточность (ХСН) II–III функциональных классов (ФК) по Нью-Йоркской классификации (NYHA) (рис. 1): у 68,2% (n=75) и 53,9% (n=55) человек соответственно (p=0,73).

Наряду с этим в обеих группах часто встречалась гипертоническая болезнь, но по этому показателю также не было выявлено статистически значимых отличий. Сахарный диабет 2-го типа преобладал в 1-й группе, где отмечался в 4 раза чаще, чем во 2-й. Это же касается и хронической болезни почек (ХБП), которая существенно чаще наблюдалась среди пациентов 1-й группы (p=0,03). В связи с этим подчеркнем, что в литературе ряд авторов указывает на взаимосвязь поражения КА с ХБП [4, 8, 10]. Нами было доказано, что данная ситуация чаще имеет место у пациентов с тромбозом/стенозом стента.
При сравнении состояния коронарного русла было выявлено, что у 90,8% пациентов общей выборки стенозируются такие крупные артерии, как передняя межжелудочковая ветвь (ПМЖВ) и правая коронарная артерия (ПКА), причем между подгруппами статистически значимая разница в этом плане не определялась (табл. 1).
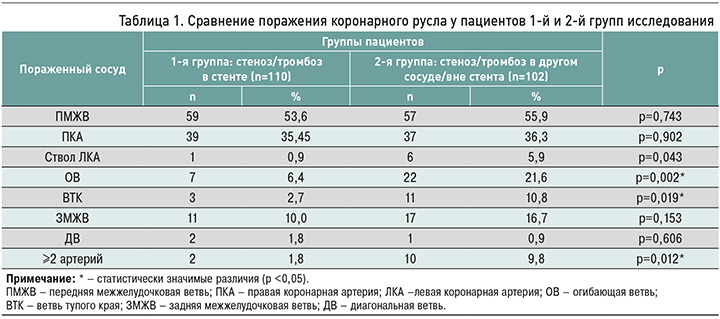
В индексную госпитализацию чаще происходил ИМ передней стенки левого желудочка. Если он развивался в связи со стенозом/тромбозом в ранее установленном стенте, то достоверно реже нарушалась проходимость в более мелких артериях, таких как огибающая ветвь и ветвь тупого края. Для пациентов 2-й группы было характерно многососудистое поражение коронарного русла (р=0,03).
При анализе течения ИМ в индексную госпитализацию мы установили, что фракция выброса левого желудочка (ФВ ЛЖ) у пациентов со стенозом/тромбозом стента оказалась существенно ниже по сравнению с больными, у которых ИМ был связан с тромбозом/стенозом вне его (рис. 2). Средние значения в 1-й группе находились в диапазоне умеренно сниженной ФВ ЛЖ против сохранной ФВ ЛЖ во 2-й: 42,90±1,01 и 51,40±1,26% соответственно (р <0,05).
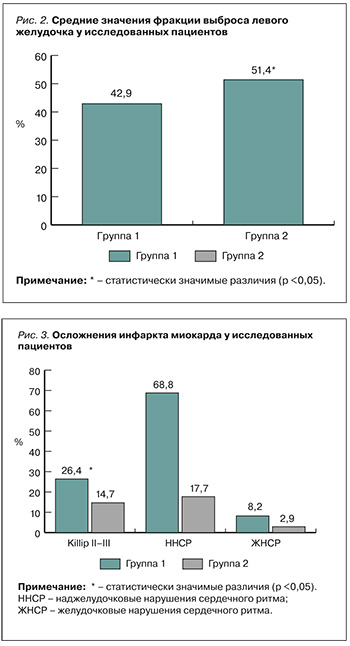
Острая сердечная недостаточность (ОСН) по классификации Killip II–III класса диагностировалась у пациентов обеих групп, однако в 1-й группе она встречалась достоверно чаще (р <0,05; рис. 3). Наджелудочковые нарушения сердечного ритма также существенно чаще регистрировались в 1-й группе (р <0,05), кроме того, в ней было в 2,8 раза больше желудочковых нарушений сердечного ритма по сравнению со 2-й группой (р <0,05).
По результатам лабораторных исследований также были выявлены различия между группами (табл. 2).

Тромбоцитарное звено гемостаза вносит свой вклад в рестеноз ранее установленного стента. Травма сосудистой стенки во время ЧКВ приводит не только к развитию местной воспалительной реакции, но и к адгезии, активации и агрегации тромбоцитов с образованием пристеночного тромба, а затем к миграции и пролиферации гладкомышечных клеток и реэндотелизации [4]. При анализе данных были обнаружены достоверные отличия между исследованными группами пациентов по уровню содержания крупных тромбоцитов и тромбокрита: в 1-й группе эти показатели были существенно выше, чем во 2-й. Лейкоцитоз в группах не достиг статистических различий, однако уровень C-реактивного белка в крови, как маркера системного воспаления, оказался значимо выше у больных в выборке с тромбозом/стенозом стента, что могло указывать на вклад более выраженной системной воспалительной реакции при стенозировании ранее установленного стента. Действительно, в литературе есть данные, демонстрирующие значение системного воспаления в развитии повторного ИМ [10]; согласно полученным нами данным, больший вклад оно вносит при ИМ на фоне тромбоза/стеноза стента. Сложные патогенетические механизмы кардиоренального взаимодействия тесно взаимосвязаны и влияют на прогноз. Статистически более высокий уровень азотемии у пациентов 1-й группы подтверждает ее неблагоприятное воздействие на эндотелий коронарных артерий [4, 11].
Важная роль в прогрессировании атеросклеротического процесса и развитии рестеноза после ЧКВ отводится содержанию в крови пациентов холестерина и его фракций (табл. 3). Показатели общего холестерина в исследованных нами группах существенно не отличались. В то же время высокий уровень холестерина липопротеидов низкой плотности как маркера прогрессирования атеросклероза и достоверно более низкие концентрации холестерина липопротеидов высокой плотности на момент интервенции и в последующем указывали на более активный процесс развития атеросклероза именно в месте имплантации стента, что, по мнению ряда авторов, увеличивает частоту возникновения этого осложнения [6, 9, 12–14].
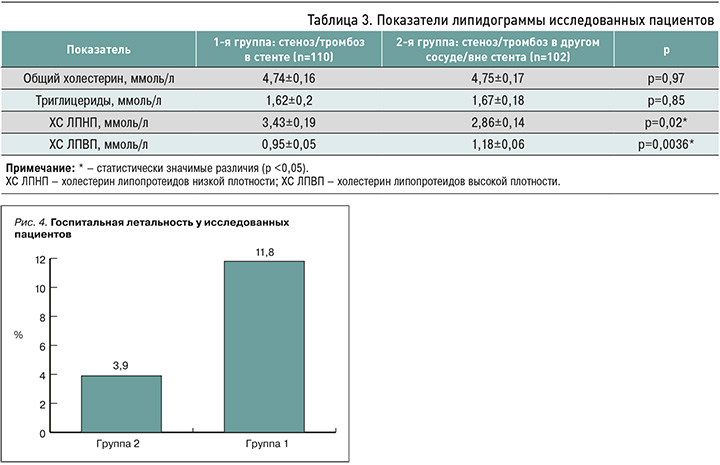
Летальность в стационаре по группам также существенно отличалась (рис. 4). Она оказалась в 3 раза выше у пациентов с тромбозом/стенозом стента по сравнению с больными, у которых катастрофа произошла на фоне обструкции КА вне его. В литературе представлены сведения, свидетельствующие о высокой летальности среди пациентов с повторными ИМ [15–17]. В нашем исследовании установлено, что это преимущественно касается пациентов, у которых произошел тромбоз/стеноз в стенте.
ЗАКЛЮЧЕНИЕ
1. Повторное коронарное событие наступает достоверно быстрее у пациентов с нарушенной проходимостью стента.
2. Наличие ХБП, сахарного диабета может способствовать нарушению проходимости установленного стента.
3. При повторном ИМ на фоне тромбоза/стеноза стента достоверно реже нарушалась проходимость более мелких артерий, таких как огибающая ветвь и ветвь тупого края, при этом реже наблюдалось многососудистое поражение коронарных артерий.
4. Снижение ФВ ЛЖ, а также такие осложнения ИМ, как острая сердечная недостаточность, наджелудочковые и желудочковые нарушения сердечного ритма, достоверно чаще развивались в группе больных со стенозом/тромбозом стента.
5. Более выраженные активация тромбоцитарного звена, системное воспаление и прогрессирование атеросклероза отмечались у пациентов с ИМ на фоне обструкции стента.
6. Летальность в стационаре у больных ИМ с тромбозом/стенозом стента была в 3 раза выше по сравнению с группой, где ИМ развился в связи с нарушением проходимости КА вне стента.



