ВВЕДЕНИЕ
Поражение кожи и ее придатков является значимой медико-социальной проблемой, поскольку оказывает негативное влияние как на физическое, так и психоэмоциональное и социальное благополучие пациентов. Очень часто хронические дерматозы протекают на фоне соматической патологии [1]. При обследовании группы пациентов дерматологического стационара коморбидность была выявлена у 29,5% больных [2]. Спектр заболеваний, для которых характерно поражение кожи, очень широк, часть из них описана в наших предыдущих работах [3–5]. Кожные проявления при патологии органов пищеварения разнообразны, они могут быть специфическими и присущими только определенному заболеванию или же иметь неспецифический характер и выступать осложнением лекарственной терапии, следствием снижения иммунной реактивности организма, нарушения всасывания питательных веществ, электролитов и витаминов [6–9].
В представленном обзоре рассмотрены изменения кожи и ее придатков при патологии желудочно-кишечного тракта (ЖКТ), гепатобилиарной системы, поджелудочной железы и синдроме мальабсорбции, сопутствующем многим заболеваниям. В практике нередко наблюдается снижение осведомленности врачей о кожных проявлениях соматических заболеваний, с одной стороны, и о сопутствующей соматической патологии при кожных заболеваниях – с другой, что ухудшает качество диагностики и лечения пациентов [10].
Адекватная оценка кожных проявлений зачастую позволяет своевременно выявить и начать лечить основное заболевание, избежать необоснованного назначения лабораторно-инструментальных исследований и лекарственных препаратов, что может существенно улучшить клинический исход заболевания и качество жизни пациента.
Цель обзора – рассмотрение изменений кожи и ее придатков при заболеваниях, сопровождающихся синдромом мальабсорбции, и повышение осведомленности терапевтов, педиатров, врачей общей практики, дерматологов и косметологов, а также других специалистов в этом вопросе. При написании работы изучены материалы зарубежных и отечественных исследований, использованы данные литературы преимущественно за последние 1–7 лет.
КОЖНЫЕ ПРОЯВЛЕНИЯ ПРИ ПАТОЛОГИИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
При язвенной болезни наряду с другими признаками ваготонии могут отмечаться холодные, влажные ладони, мраморность кожи кистей и стоп. При декомпенсированном пилородуоденальном стенозе возможно снижение тургора и эластичности кожи. В последние десятилетия накапливается все больше данных, свидетельствующих о вовлеченности Helicobacter pylori в развитие таких хронических заболеваний кожи, как атопический дерматит, крапивница, розацеа, розовые угри и др. [11]. По данным одних авторов, доказана роль H. pylori в патогенезе хронической идиопатической крапивницы (увеличение проницаемости сосудов желудка на фоне хеликобактерного гастрита и, как следствие, избыточное всасывание аллергенов) [12], по данным других исследователей, воспалительные заболевания верхних отделов ЖКТ способны вызывать идиопатическую крапивницу или провоцировать ее обострения независимо от H. pylori [13, 14].
В ряде работ сообщается, что розацеа связана с различными желудочно-кишечными заболеваниями, включая воспалительные заболевания кишечника (ВЗК), целиакию, синдром раздраженного кишечника, гастроэзофагеальную рефлюксную болезнь, инфекцию H. pylori и синдром избыточного бактериального роста [15]. Розацеа является распространенным хроническим воспалительным заболеванием, которое в основном поражает центральную часть лица и проявляется гиперемией, стойкой эритемой, папулами и пустулами, телеангиэктазиями с ощущением жжения или покалывания либо без них, сухим и шероховатым внешним видом, бляшками или отеком лица, фиматозными изменениями. Существует достаточно доказательств, подтверждающих мнение о том, что микробиом кишечника играет роль в воспалительной кожной реакции. Дисбиотический микробиом и нарушение регуляции иммунной системы вносят свой вклад в патофизиологию розацеа, псориаза, а также гнойного гидраденита [16–18].
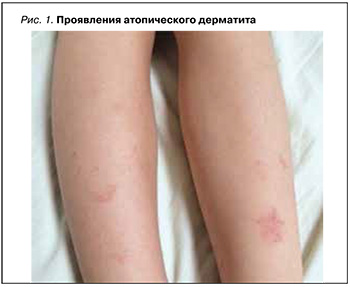
Атопический дерматит (АтД) – хроническое заболевание, сопровождающееся зудом, которое в типичных случаях начинается в раннем детстве, часто продолжается и рецидивирует в зрелом возрасте, значительно нарушая качество жизни больного (рис. 1). Сопутствующие заболевания органов ЖКТ, такие как гастрит, ассоциированный с H. pylori, язвенная болезнь желудка или двенадцатиперстной кишки, кандидозы слизистой оболочки ротовой полости и кишечника, дисфункция желчного пузыря и желчевыводящих протоков, в той или иной степени определяются у 70–90% больных АтД [19–22].
Воспалительные заболевания кишечника (ВЗК) – хронические воспалительные заболевание ЖКТ с неизвестной этиологией и патогенезом. К основным подтипам ВЗК относят болезнь Крона и неспецифический язвенный колит. Болезнь Крона часто вызывает инфильтрацию и разрушение всех слоев кишечной стенки вдоль пищеварительного тракта, в то время как язвенный колит в первую очередь поражает толстую и прямую кишку с инвазией слизистой и подслизистой оболочек. ВЗК клинически проявляются снижением аппетита, рвотой, диареей, болью в животе, кровотечением и потерей массы тела. Примерно у одной трети пациентов с ВЗК появляются внекишечные проявления, причем кожа становится одним из наиболее часто поражаемых органов. Эти проявления могут предшествовать, возникать одновременно или следовать за диагнозом ВЗК [23, 24].
По данным метаанализа Sun Y. et al., у пациентов с псориазом в 2,53 раза повышен риск развития болезни Крона и в 1,71 раза – язвенного колита [25]. В свою очередь, в эпидемиологических исследованиях, проведенных Bao B. et al., было установлено, что ВЗК и его подтипы могут способствовать развитию гнойного гидраденита [26].
Болезнь Крона – воспалительное заболевание кишечника, которому сопутствуют многие внекишечные проявления, затрагивающие несколько органов, включая кожу, глаза, печень и суставы [27]. К наиболее известным его системным симптомам относится поражение кожи в виде узловатой эритемы, гангренозной пиодермии (воспалительный нейтрофильный дерматоз с явлениями хронической очаговой гангрены кожи). Сообщалось и о более редких кожных проявлениях болезни Крона – приобретенном буллезном эпидермолизе, васкулите мелких сосудов, некротизирующем и лейкоцитокластическом васкулите, узелковом полиартериите и синдроме Свита [28].
Типичным поражением кожи при неспецифическом язвенном колите является узловатая эритема, локализующаяся на передней поверхности голеней, реже на лице и туловище и сопровождающаяся лихорадкой и болевым синдромом. Достаточно часто при этом заболевании развиваются пиодермия, фурункулез, некроз кожи, трофические язвы [29, 30].
Глютеновая болезнь (целиакия) представляет собой иммуноопосредованную энтеропатию, вызванную употреблением в пищу глютена и поражающую предрасположенных к ней людей всех возрастов. От этого заболевания страдает примерно 1% населения мира. Многие пациенты с целиакией не сообщают о желудочно-кишечных симптомах, что затрудняет раннюю диагностику. При этом глютеновая болезнь протекает с целым рядом дерматологических проявлений, таких как герпетиформный дерматит, очаговая алопеция, атопический дерматит, кожный васкулит, псориаз, розацеа, крапивница, которые могут быть ключом к постановке диагноза [31–34].
Болезнь Уиппла – редкое системное заболевание, которое сопровождается мальабсорбцией, мезентериальной лимфаденопатией, артралгиями и пигментацией кожи [35]. Она развивается на 4–5 десятилетии жизни, причем в 10 раз чаще у мужчин, чем у женщин. В основном болезнь Уиппла поражает кишечник, вызывая хроническую диарею с нарушением всасывания, а также центральную нервную систему и суставы. Диагноз подтверждается специфическими эндоскопическими и гистопатологическими данными верхних отделов ЖКТ [36]. В литературе описаны случаи появления при этом заболевании эритематозных подкожных узелков, подобных узловатой эритеме [37].
Синдром Сатоеси (Satoyoshi syndrome) — мультисистемное заболевание с вероятной аутоиммунной природой, основные симптомы которого включают диарею, судороги в мышцах, изменения скелета, а также алопецию. Хроническая диарея при этой патологии может быть тяжелой и приводить к истощению, анемии, задержке роста, кахексии, инвалидизации и даже фатальному исходу. Синдром в первую очередь поражает девочек и молодых женщин. Состояние может быть ошибочно расценено как очаговая алопеция. Раннее распознавание этого заболевания имеет важное значение, так как требует назначения иммуносупрессивных препаратов [38, 39].
Болезнь Лейнера представляет собой редкий и серьезный синдром с тяжелым и прогрессирующим генерализованным себорейноподобным дерматитом, упорной диареей, мальабсорбцией и истощением, а также рецидивирующими местными и системными инфекциями. Механизмы, лежащие в основе этого болезненного состояния, не выяснены [40].
Аутоиммунная энтеропатия также может сопровождаться клиническими проявлениями мальабсорбции и развиваться у больных с аутоиммунной патологией. Ограниченная осведомленность врачей лечебных специальностей об аутоиммунной энтеропатии, вызванной разрушением эндокринных клеток кишечника, задерживает диагностику и назначение соответствующей терапии. В работе Halabi I. et al. описан клинический случай развития тяжелой гипокальциемии при аутоиммунном полигландулярном синдроме 1-го типа у молодой женщины с клиническими проявлениями в виде гипопаратиреоза, кандидоза полости рта, витилиго и последующим присоединением тиреоидита Хашимото, болезни Аддисона, сахарного диабета 1-го типа и первичной недостаточности яичников [41].
КОЖНЫЕ ПРОЯВЛЕНИЯ ПРИ ПАТОЛОГИИ ПЕЧЕНИ И ЖЕЛЧЕВЫВОДЯЩИХ ПУТЕЙ
Желтуха – желтушное окрашивание кожи и слизистых оболочек, обусловленное нарушением метаболизма билирубина и повышением его концентрации в плазме крови, которое, наряду с гепатомегалией, относится к большим «печеночным» признакам. Диагностическое значение имеет оттенок желтухи: лимонно-желтый свидетельствует о надпеченочной (гемолитической), шафраново-желтый оттенок – о печеночной (паренхиматозной), оливково-желтый – о подпеченочной (механической) желтухе. Желтуха, особенно механическая и в меньшей степени паренхиматозная, часто сопровождается выраженным кожным зудом, приводящим к появлению следов расчесов на теле, с последующей лихенификацией и гиперпигментацией соответствующих участков кожи.
Заболеваниям печени и билиарного тракта сопутствуют нарушения со стороны сосудов, включающие варикозное расширение кожных вен, звездчатые ангиомы и пальмарную эритему ладоней. Повышение давления в системе портальной вены, обусловленное хроническим заболеванием печени, ведет к развитию коллатерального кровообращения, которое на коже проявляется расширением вен брюшной стенки («голова медузы»). Сосудистые телеангиэктазии, «звездочки» состоят из извитой центральной артериолы с более мелкими сосудиками, расходящимися радиально и напоминающими лучи; чаще они располагаются на лице, шее, верхней части груди, плечах и предплечьях. По данным Silverio Ade O. et al., звездчатые ангиомы могут свидетельствовать о развитии гепатопульмонального синдрома у больных с циррозом печени [42].
Телеангиэктазии в виде множественных мелких, стойко расширенных ветвящихся капилляров, расположенных на ладонях в области возвышения большого пальца и возвышения мизинца, обусловливают неравномерную синюшно-розовую окраску кожи – «печеночные ладони». У пациентов отмечается повышение местной температуры ладоней (иногда и ступней). Появление звездчатых ангиом (сосудистых «звездочек») и пальмарной эритемы связано с избытком оказывающих дилатирующее действие на артериолы эстрогенов, которые у здоровых лиц метаболизируются в печени. К другим проявлениям гиперэстрогенемии относятся гинекомастия, выпадение волос на туловище, в подмышечных впадинах, т.е. формирование оволосения по женскому типу [43].
Атрофические полосы на бедрах, ягодицах, в нижней части живота являются следствием гормональных нарушений при патологии печени. При хронических диффузных заболеваниях печени часто наблюдаются изменения со стороны ногтей: они становятся белыми (лейконихии, ногти Терри и ногти Линдсея), с поперечными бороздами («линии Бо»), в виде «часовых стекол». Геморрагический синдром проявляется возникновением на коже пурпуры, петехий, экхимозов и свидетельствует о снижении синтеза плазменных факторов свертывания крови при развитии печеночно-клеточной недостаточности, повышении функциональной активности селезенки (гиперспленизм) и тромбоцитопении [44–46]. Криоглобулинемический васкулит и узелковый полиартериит часто сопутствуют хроническим вирусным гепатитам [47].
Кожные симптомы первичного билиарного цирроза включают ксантомы и ксантелазмы, а также желтуху и следы расчесов на теле. Зуд кожи, порой мучительный и рефрактерный к терапии, обусловлен накоплением в коже желчных кислот и раздражением ими нервных окончаний [48].
Гиперпигментация кожи, acanthosis nigricans и голубые лунки у ногтевого ложа относятся к редким, но характерным изменениям при болезни Вильсона– Коновалова (гепатоцеребральной дегенерации). Гемохроматоз характеризуется бронзовым цветом кожи. Гиперпигментация обычно имеет грязносерый цвет и занимает обширные участки кожного покрова. Наиболее она выражена на открытых участках кожи. У женщин гиперпигментация может проявляться на лице в виде хлоазмы (периорбитальная и периоральная пигментация) [49].
КОЖНЫЕ ПРОЯВЛЕНИЯ ПРИ ПАТОЛОГИИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
При остром панкреатите наблюдаются кожные кровоизлияния в области пупка, ягодиц, бедер, сетчатое ливедо в виде синюшно-розовой пятнистой сети, локализующейся на коже живота и верхней части бедер, а также узловатый панникулит и черный акантоз. У больных хроническим панкреатитом отмечается атрофия подкожножировой клетчатки в области проекции поджелудочной железы, нередко выявляются бугорчатые ксантомы и признаки гипополивитаминоза, обусловленные синдромом мальдигестии (нарушенного пищеварения) и мальабсорбции (нарушенного всасывания). «Кровяные (рубиновые) капельки» также являются признаком хронического панкреатита. Недостаток панкреатических ферментов закономерно приводит к дефициту жизненно важных нутриентов, электролитов и витаминов.
Для синдрома мальдигестии и мальабсорбции характерны неспецифические (приобретенный ихтиоз, изменения волос, ногтей, гиперпигментация, атрофия кожи, экзематозные и псориазиформные сыпи) и специфические (энтеропатический акродерматит, дефицит витаминов А, В, С и К, дефицит фолиевой кислоты и железа) и другие проявления (рис. 2–5) [50].

Szabo C.E. et al. описан клинический случай дефицита витамина К, обусловленного синдромом мальабсорбции на фоне внешнесекреторной недостаточности поджелудочной железы в детском возрасте и дебютировавшего клиникой геморра гического синдрома в виде экхимоза (синяка). При дальнейшем обследовании у наблюдавшегося пациента были выявлены стеаторея, железодефицитная анемия и гиповитаминоз D [51].
Изменения волос при патологии поджелудочной железы характеризуются уменьшением их длины, истончением, сухостью и поредением. Ногтевые пластинки характеризуются атрофичностью, ломкостью, замедлением роста, появлением «линии Бо-Рейля». В результате потери жировой ткани и коллагена кожа становится истонченной, а вследствие дефицита эластичных свойств – морщинистой, не расправляется после взятия в складку (атрофия кожи). На различных участках кожного покрова могут возникать очаги гиперемии, инфильтрации, шелушения и зуда, напоминающие высыпания при хронической экземе или псориазе. Проявлением дефицита витамина В2 (рибофлавина) выступают себорейный фолликулярный кератоз кожи лба, крыльев носа, дерматит половых органов [52–54].
Внешнесекреторная недостаточность поджелудочной железы может развиваться и вследствие других, более редких заболеваний, таких как муковисцидоз, синдром Швахманда–Даймонда и др., и проявляться диареей, стеатореей и мальабсорбцией [55, 56]. Со снижением всасывания жирорастворимых витаминов А и Е связывают увеличение частоты обострений заболеваний легких у больных с муковисцидозом [57], а дефицит витамина А, как известно, сопровождается шелушением кожи, шершавостью коленей, локтей, повышенной ломкостью ногтей, истончением и выпадением волос, появлением перхоти.
Отдельную группу составляют пациенты, оперированные по поводу заболеваний ЖКТ. Так, в работе Morfin-Maciel B.M. et al. сообщается о высокой распространенности аллергических заболеваний у детей с синдромом короткой кишки [58]. Этот патологический клинический синдром обусловлен уменьшением всасывательной поверхности тонкой кишки, снижением функции кишечника ниже того минимума, который необходим для всасывания макронутриентов и/или воды и электролитов и поддержания здоровья и/или роста организма [59, 60].
Бариатрическая хирургия представляет собой наиболее эффективный метод лечения морбидного ожирения и связанных с ним осложнений. Пациенты после бариатрической операции образуют особую подгруппу пациентов, требующую индивидуального клинического ведения. По данным ряда исследований, такие пациенты имели множественный дефицит микронутриентов (витаминов А, D и В12, цинка, железа). Было обнаружено, что у пациентов с гнойным гидраденитом после бариатрической операции уровень цинка в сыворотке был значительно ниже по сравнению с аналогичными пациентами, не подвергавшихся такому вмешательству [61]. В другом исследовании сообщалось о тяжелом дефиците витамина А вплоть до слепоты после билиопанкреатического отведения [62].
ЗАКЛЮЧЕНИЕ
Своевременное выявление и правильная оценка кожных симптомов патологий пищеварительной системы и синдрома мальабсорбции имеет важное значение в связи с их негативным влиянием на активность заболевания, физический и психологический статус пациента. При ведении пациентов очень важен мониторинг результатов физикального обследования и лабораторных параметров, которые указывают на мальабсорбцию и недостаточность питания. Основой терапии в этих случаях служит лечение основного заболевания. Ключевое звено в ведении таких пациентов – назначение экзогенных ферментов поджелудочной железы для облегчения пищеварения и всасывания, пробиотиков, витаминных и витаминно-минеральных комплексов с целью компенсации гиповитаминоза и дефицита макро и микронутриентов.



