Сахарный диабет 2 типа (СД) является одним из наиболее распространенных и значимых неинфекционных заболеваний [1]. Ведущим патогенетическим механизмом СД выступает гипергликемия, на фоне которой развивается оксидативный стресс с продукцией активных форм кислорода (АФК) [2, 3]. Избыток последних приводит к активации перекисного окисления липидов (ПОЛ), продукты которого относятся к токсичным метаболитам, оказывающим повреждающее действие на липопротеиды, белки, ферменты и нуклеиновые кислоты скелетной мускулатуры, в том числе дыхательных мышц [2, 4]. Установлено, что для больных СД характерно снижение силы дыхательных мышц [5]. В то же время в литературе недостаточно данных о взаимосвязи изменений свободно-радикальных процессов и функционального состояния дыхательной мускулатуры при СД.
Цель исследования – выявить особенности изменения процессов ПОЛ, состояния антиоксидантной системы и установить их взаимосвязь с показателями силы дыхательных мышц у больных СД 2 типа.
МАТЕРИАЛ И МЕТОДЫ
Исследование было одобрено локальным этическим комитетом ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России. Согласно критериям включения, были обследованы 48 мужчин, подписавших информированное добровольное согласие, в возрасте от 45 до 65 лет, которые были разделены на 2 группы:
- основная группа – 19 пациентов с СД со средней длительностью заболевания 4,8 лет;
- группа сравнения (рандомизированная с основной по возрасту) – 29 больных без нарушений углеводного обмена.
Критериями исключения из исследования были отказ от участия в исследовании; заболевания органов дыхания; сердечная недостаточность; дыхательная недостаточность, почечная недостаточность, перенесенный инфаркт миокарда; острое нарушение мозгового кровообращения в анамнезе; ожирение 3 степени; цирроз печени; злокачественные опухоли; аутоиммунные заболевания; острые и хронические заболевания в стадии обострения.
Диагноз СД устанавливался согласно Алгоритмам специализированной медицинской помощи больным сахарным диабетом (9-й выпуск, 2019 г.).
Сила дыхательной мускулатуры оценивалась по показателям максимального инспираторного давления (MIP) и максимального экспираторного давления (MEP) на уровне ротовой полости с помощью прибора MicroRPM (MicroMedicalLtd., Великобритания). Осуществлялось не менее трех маневров максимального вдоха и максимального выдоха до получения трех значений с разницей не более 20% с регистрацией лучшего результата. Должными считались значения МIP и MEP ≥80 см вод.ст.
Оценка процессов ПОЛ проводилась с помощью определения малонового диальдегида (МДА) и диеновых конъюгат (ДК) в сыворотке крови обследуемых. Концентрация МДА определялась методом Ohkawa H. et al. [6], содержание ДК – на основании классического метода Placer Z. [7]. Состояние антиоксидантной системы оценивалось по изменению активности супероксиддисмутазы (СОД) [8] и каталазы (КАТ) [9] в гемолизате эритроцитов.
Статистический анализ материала осуществлялся с использованием непараметрических методов в пакете прикладных программ STATISTICA 10.0 (StatSoft, Russia), достоверными считались показатели при р <0,05. Данные представлены в виде Me (Q1; Q3). Для оценки достоверности различий между группами применялся критерий Манна–Уитни, корреляционный анализ проводился с помощью коэффициента корреляции Спирмена (r).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Обследованные пациенты относились к средней возрастной группе. Сопутствующая терапевтическая патология была представлена пропорционально в обеих группах артериальной гипертонией (АГ) 2 степени. Показатель индекса массы тела (ИМТ) свидетельствовал о наличии ожирения у всех обследованных пациентов с превышением этого показателя у больных СД относительно группы сравнения на 7,3% (табл.).
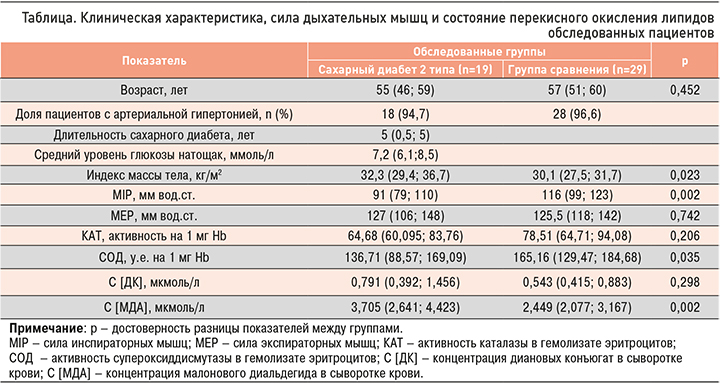
Сила инспираторных мышц (MIP) у больных СД была ниже по сравнению с пациентами без нарушений углеводного обмена на 21,6%. Сила экспираторных мышц (MEP) у пациентов обеих групп находилась на одном уровне. У больных диабетом был выявлен достоверно более высокий относительно группы сравнения уровень содержания МДА (продукта ПОЛ) – на 51,3%. Активация процессов ПОЛ сопровождалась у больных СД снижением активности антиоксидантной системы крови, что выражалось в более низких значениях СОД в основной группе – на 17,2% меньше, чем в группе сравнения. Установлено, что длительность заболевания не оказывает влияния на активность ПОЛ и антиоксидантной системы крови.
При выполнении корреляционного анализа был установлен средний уровень положительной связи между показателем MIP и уровнем активности КАТ (r=0,35, р ≤0,05) у обследованных пациентов в обеих группах.
Таким образом, у больных СД имеет место более высокая активность процессов ПОЛ, характеризующаяся высокой концентрацией МДА при одновременном снижении активности СОД. Другими словами, полученные данные свидетельствуют о наличии дисбаланса между прооксидантной и антиоксидантной системами у больных СД, установленного ранее [10, 11]. Предполагается, что в основе снижения силы дыхательных мышц при СД лежат не только микроциркуляторные и нейропатические изменения, но и метаболические нарушения. Выявленная корреляционная связь между силой инспираторных мышц и уровнем активности КАТ указывает на наличие взаимосвязи между функциональным состоянием дыхательной мускулатуры и процессами ПОЛ, а также о возможном влиянии дисбаланса про- и антиоксидантной системы на развитие слабости дыхательных мышц при СД.
ЗАКЛЮЧЕНИЕ
1. У больных СД 2 типа снижена сила инспираторных дыхательных мышц.
2. Состояние прооксидантно-антиоксидантой системы у больных СД 2 типа характеризуется увеличением уровня МДА и снижением активности СОД.
3. Выявлена положительная взаимосвязь между изменением силы инспираторных мышц и активностью КАТ в гемолизате эритроцитов.f Healthcare of Russia. Address: 460014, Orenburg, 6 Sovetskaya Str. Tel.: +7 (912) 355-56-55. E-mail: k_normphys@orgma.ru



