ВВЕДЕНИЕ
Кардиальные проявления злокачественных новообразований могут быть связаны не только с первичным опухолевым ростом в тканях сердца или поражением метастазами, но и с неспецифическими (опосредованными) реакциями на опухоль со стороны сердца, представляющими собой один из этиологических вариантов неинфекционного (небактериального, асептического) тромботического эндокардита (НБТЭ), получившего название паранеопластического.
Свойственные опухоли системные или локальные неспецифические реакции могут быть связаны с действием опухолевых клеток на метаболизм, иммунитет, эктопическую продукцию биологически активных веществ. При этом паранеопластические реакции обычно развиваются в отдалении от опухоли и ее метастазов. По времени они могут предшествовать манифестации опухолевого процесса, развиваться одновременно с ним либо возникать на этапе быстрого роста и метастазирования опухоли [1–3].
Патогистологические исследования свидетельствуют, что, по разным данным, злокачественные новообразования осложняются НБТЭ в 9–20% случаев, чаще при опухолях легких, поджелудочной железы, желудка, прямой кишки; наиболее частый гистологический тип опухоли – аденокарцинома [4–6]. НБТЭ часто встречается при аденокарциномах яичника и молочной железы, также он был описан при лимфоме, генерализованной плазмоцитоме, других лейкозах [7]. Из 200 отобранных случайным образом амбулаторных больных со злокачественными опухолями у 38 (19%) были выявлены вегетации на клапанах: митральном (19 случаев), аортальном (18) и трехстворчатом (1).
В числе причинных заболеваний чаще всего встречались лимфома (10 случаев), опухоли легких (9), поджелудочной железы (3). К сожалению, истинная частота этого осложнения опухолевых процессов остается неизвестной в связи с отсутствием результатов целенаправленного изучения секционных случаев, однако в целом, как полагают, злокачественными опухолями обусловлена почти половина всех случаев НБТЭ [8].
При этом следует указать, что стерильные вегетации на створках клапанов сердца и их опорных конструкциях (хордах, папиллярных мышцах), состоящие из фибрина, тромбоцитов и эритроцитов и не содержащие бактерий, могут развиваться у больных с различными гиперкоагуляционными состояниями и аутоиммунными заболеваниями (коллагенозами, васкулитом, псориатическим артритом, болезнью Стилла у взрослых, панникулитом, антифосфолипидным синдромом и др.) [9]. Известны случаи НБТЭ у истощенных больных и пациентов с циррозом печени, сахарным диабетом (сенильный, кахектический эндокардит) [10]. Помимо структур клапанного аппарата сердца, вегетации способны локализоваться на свободном эндокарде и на имплантируемом материале – искусственных клапанах, электродах кардиостимуляторов и т.д.
Заболеваемость и смертность при НБТЭ во многом связаны с системными эмболиями, частота которых у больных с вегетациями на клапанах (38%) существенно выше, чем без таковых (8%) [11]. Большие эмболоопасные вегетации на клапанах нередко развиваются у больных с муцин-продуцирующими карциномами на этапе метастазирования процесса. Ведущую роль в возникновении тромботических осложнений, включая НБТЭ, при опухолевых заболеваниях играют сдвиги в системе гемостаза. Онкоассоциированная гиперкоагуляция может быть представлена мигрирующим тромбофлебитом, артериальными тромбозами, синдромом диссеминированного внутрисосудистого свертывания (ДВС) [4, 12]. При этом тромботическим процессом осложняются не только злокачественные, но и доброкачественные опухоли, такие как миксома [13], предположительно за счет избыточного синтеза опухолью интерлейкина 6. Выделяемые опухолевыми клетками высокоактивный тканевой коагуляционный фактор и специфический раковый прокоагулянт активируют фактор Х [14], стимулируют гемостаз и поступающие в кровоток в процессе роста опухоли цитокины [15]. Кроме гиперкоагуляции, это может вызвать повреждение клапанного эндотелия, разрушение клапанов, формирование вегетаций [16, 17]. Небактериальный тромбэндокардит может развиваться при опухолях, осложненных вторичным антифосфолипидным синдромом (аФЛ-ассоциированное поражение клапанов) [9]. Одной из причин опухолевого НБТЭ может выступать синдром гипервязкости крови в случаях парапротеинемии, включая множественную миелому, при эссенциальной полицитемии, гипертромбоцитозе у больных с миелопролиферативным процессом, при выраженном лейкоцитозе у больных лейкозом.
Мы наблюдали три случая НБТЭ, развившегося у больных с опухолями желудка.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ № 1
Больной С., 53 лет, поступил в хирургическую клинику с диагнозом: язвенная болезнь желудка, состоявшееся желудочно-кишечное кровотечение, анемия. Предъявлял жалобы на общую слабость, головокружение. Общее состояние тяжелое, в сознании, возбужден.
Данные анамнеза: слабость, повышенная утомляемость, одышка при ходьбе и сердцебиение на момент поступления беспокоили пациента около 1 мес. Две недели назад возникли и неоднократно возобновлялись носовые кровотечения, имел место стул с калом черного цвета. На предшествующем этапе наблюдения больному дважды выполнялась гастроскопия, была диагностирована язва желудка в области большой кривизны, биопсия слизистой опухолевого роста не выявила.
Данные объективного осмотра: масса тела сохранена, рост 175 см, вес 78 кг. Частота сердечных сокращений (ЧСС) 104/мин, артериальное давление (АД) 110/70 мм рт.ст. Кожные покровы бледные, на коже лица, верхних конечностей и на одежде больного – множественные кровяные помарки. Признаков продолжающегося желудочно-кишечного кровотечения (после ректального исследования) не выявлено. Живот не вздут, мягкий, безболезненный, симптомов раздражения брюшины нет. Печень, селезенка, доступные пальпации лимфатические узлы не увеличены.
Анализ крови: эритроциты – 1,07×1012/л; гемоглобин (Hb) – 32 г/л; гематокрит (Ht) – 11,3%; лейкоциты – 6,88×109/л (с. – 47%, э. – 2%, лимф. – 39%, м. – 12%); тромбоциты – 194×109/л; скорость оседания эритроцитов (СОЭ) 90 мм/ч; анизоцитоз, пойкилоцитоз, гипохромия эритроцитов, токсическая зернистость нейтрофилов.
Анализ мочи: относительная плотность 1025, рН 5,5, лейкоциты – 0–1–2 в поле зрения, слизь (+), эпителий переходный 0–2 в поле зрения, белок Бенс–Джонса (многократно) не определяется.
Общий белок – 106,0 г/л; альбумин – 16,4 г/л; сывороточное железо – 3,96 мкмоль/л; фолиевая кислота – 4,63 нг/мл; кальций – 2,19 ммоль/л. Протромбиновый индекс – 78%; протромбиновое время – 17,6 с; активированное частичное тромбопластиновое время (АЧТВ) – 34,1 с; фибриноген – 6,12 г/л; антитромбин III – 107%. Агрегационная активность тромбоцитов в плазме крови, стимулированная адреналином, коллагеном, ристомицином, различными концентрациями АДФ, значительно снижена, больше всего к адреналину (в 20 раз) и к коллагену (в 9,4 раза). Щелочная фосфатаза – 250,0 Ед/л; билирубин общий – 18,6 мкмоль/л; билирубин прямой – 12,05 мкмоль/л; аспартатаминотрасфераза (АСТ) – 35,1 Ед/л; аланинаминотрансфераза (АЛТ) – 69,2 Ед/л, глюкоза крови – 5,3 ммоль/л; креатинин – 105,0 мкмоль/л; мочевина – 16,1 ммоль/л; альфа-амилаза крови общая – 28 Ед/л. Уровень основных онкомаркеров – в пределах нормы.
Белковые фракции крови: снижение уровня альбумина и бета-глобулина, значительное повышение гамма-глобулина, определяется фракция парапротеинов.
В прямой пробе Кумбса обнаружены антиэритроцитарные антитела.
Пунктат костного мозга богат клеточными элементами. Плазматических клеток – 3%.
Электрокардиография (ЭКГ): ритм синусовый 110/мин, горизонтальное положение электрической оси сердца, нарушение внутрижелудочковой проводимости, процессов реполяризации в миокарде левого желудочка (ЛЖ).
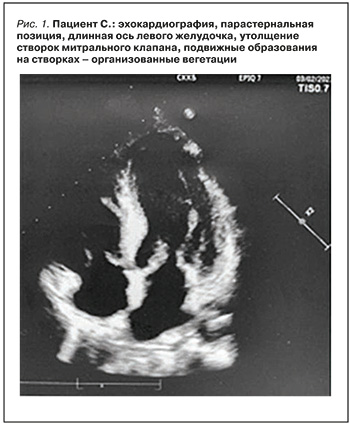
Эхокардиография (ЭхоКГ) с допплер-анализом: полости сердца дилатированы, гипертрофия межжелудочковой перегородки и задней стенки ЛЖ. Створки митрального и трикуспидального клапанов уплотнены, утолщены, содержат мелкие подвижные образования – организованные вегетации (рис. 1). Недостаточность митрального клапана (регургитация 2–3-й степени) и трикуспидального клапана (регургитация 2-й степени), уплотнение створок и умеренная недостаточность аортального клапана, дисфункция клапана легочной артерии. Фракция выброса ЛЖ (ФВ ЛЖ) 56%, систолическое артериальное давление в легочной артерии (СДЛА) 30 мм рт.ст.
Рентгенография костей таза, черепа, голеностопных суставов: патологические и костно-деструктивные изменения не выявлены.
Рентгенография органов грудной полости: легкие без очаговых и инфильтративных теней, в нижних легочных полях с обеих сторон – тени дисковидных ателектазов.
Ультразвуковое исследование (УЗИ): увеличение обеих долей печени, повышение эхоплотности стенок и деформация желчного пузыря перегибом в области тела, селезенка не увеличена. В плевральных полостях с обеих сторон свободная жидкость, слева – неоднородная, с нитями фибрина и изоэхогенным компонентом.
Эзофагогастродуоденоскопия (ЭГДС): в средней трети тела желудка – участок измененной слизистой размером до 0,5 см, который на 1–2 мм возвышается над поверхностью, складчатость обычная, перистальтика не изменена. Выполнена биопсия: без патологии. При повторном (четвертом по счету) исследовании с множественной (3 фрагмента) биопсией слизистой тела желудка по большой кривизне была диагностирована высокодифференцированная аденокарцинома.
Для коррекции анемии больному проводились инфузии эритромассы (дважды), которые были затруднены в связи с проблемой индивидуального подбора на совместимость обусловленной, предположительно наличием неспецифических антител IgM (++) к эритроцитам в непрямой реакции Кумбса. Был установлен венозный катетер в подключичную вену справа, однако вскоре появились клинические признаки тромбоза правых подключичной и брахиоцефальной вен: боль, гипертермия до 39–40 °С, лейкоцитоз, палочкоядерный сдвиг, появление единичных миелоцитов и плазматических клеток. Была осуществлена катетеризация левой подключичной вены, однако на третий день возникли боль в области катетера слева и припухлость левого плеча, что было расценено как признак формирующегося подключичного тромбоза слева, а через несколько дней возникли боль в грудной клетке, повторный эпизод фебрилитета, гипертромбоцитоз до 535×109/л. Катетер был удален.
Дуплексное сканирование подключичной вены справа показало наличие пристеночных, фиксированных тромбомасс в проксимальном сегменте, проекции терминального клапана, стенозирующих просвет на 50%; в правой брахиоцефальной вене тромбомассы с округлой головкой тромба без признаков флотации занимали до 80% просвета
Рентгенологически было отмечено появление инфильтрации легочной ткани в S3 правого легкого с нечеткими контурами. Диагностирована правосторонняя сегментарная (S3) пневмония. При повторном исследовании через 10 дней инфильтрация легочной ткани в S3 правого легкого сохранялась.
Заключительный диагноз: рак тела желудка (высокодифференцированная аденокарцинома) Т3NХМ0, клиническая группа 4. Состоявшееся желудочно-кишечное кровотечение. Рецидивирующие носовые кровотечения. Хроническая железодефицитная анемия тяжелой степени. Паранеопластический синдром: тромботический эндокардит c поражением митрального и трикуспидального клапанов, тромбоз правой подключичной, правой брахиоцефальной и левой подключичной вен на фоне катетеризации. Парапротеинемия, парапротеинемическая тромбоцитопатия тяжелого течения. Кумбс-позитивная реакция на эритроциты крови. Правосторонняя S3 пневмония, возможно, инфарктная, экссудативный плеврит.
Пациенту проводились антибактериальная и гемостатическая терапия, инфузии свежезамороженной плазмы. Применялись препараты железа, антисекреторные средства. Трансфузии эритроцитарной массы были ограничены проблемой индивидуального подбора образцов донорских клеток в связи с присутствием антиэритроцитарных антител, что вынудило отложить принятие решения об оперативном лечении опухоли.
В ходе лечения было установлено небольшое увеличение показателей красной крови. Однако состояние больного оставалось тяжелым. Для дальнейшего лечения он был переведен в онкологический диспансер.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ № 2
Больная П., 73 лет, поступила с жалобами на повышение температуры тела до 39 °С, выраженную слабость, одышку при небольшой физической нагрузке, отек нижних конечностей.
Данные анамнеза: примерно за 9 мес до поступления пациентка лечилась у стоматолога, после чего у нее отмечалось повышение температуры, увеличение подчелюстных лимфатических узлов. На фоне антибактериальной терапии per os (3-дневный курс) температура нормализовалась. Ухудшение наступило через 3 мес в виде появления одышки и повышения температуры. Больная лечилась стационарно по поводу левостороннего пульмонита, левосторонней нижнедолевой пневмонии без заметного эффекта. Много лет страдает гипертонической болезнью.
Данные объективного осмотра: состояние средней тяжести. Индекс массы тела (ИМТ) 26 кг/м2. Кожные покровы обычной окраски. Доступные пальпации лимфатические узлы отчетливо не увеличены. Голени и стопы пастозны. Над легкими определяется перкуторный легочный звук, дыхание везикулярное, ослабленное в нижних отделах слева. Границы относительной сердечной тупости расширены, тоны сердца глухие ритмичные, короткий систолический шум во II межреберье справа у края грудины. ЧСС 90/мин, АД 140/100 мм рт.ст. Живот без особенностей.
Было высказано предположение о сепсисе, возможно, одонтогенном, инфекционном эндокардите.
Анализ крови: эритроциты – 3,05×1012/л; Hb – 81 г/л; Ht – 32,1%; лейкоциты – 8,63×109/л (с. – 89%, э. – 1%, лимф. – 9%, м. – 1%), тромбоциты – 149×109/л. СОЭ 60 мм/ч.
Анализ мочи: относительная плотность 1025, рН 5,5, лейкоциты – 3–3–5 в поле зрения, эпителий плоский – 2–3–2 в поле зрения, слизь (++), бактерии (+).
Билирубин общий – 11,26 мкмоль/л; билирубин прямой – 3,2 мкмоль/л; АСТ – 15 Ед/л; АЛТ – 12 Ед/л; С-реактивный белок – 171,4 мг/л; общий белок – 64 г/л; мочевина – 3,9–16,8 ммоль/л; креатинин крови – 64–180 мкмоль/л; глюкоза – 9,07 ммоль/л; железо – 7,37 мкмоль/л. Протромбиновый индекс – 88%; протромбиновое время – 15 с; АЧТВ – 37 с; фибриноген – 8,26 г/л; D-димер – 0,68 мкг/мл.
Посев крови (шестикратно), посев мочи – роста микрофлоры не выявлено.
ЭКГ: синусовая тахикардия (100/мин), единичная предсердная экстрасистола, нарушение внутрижелудочковой проводимости.
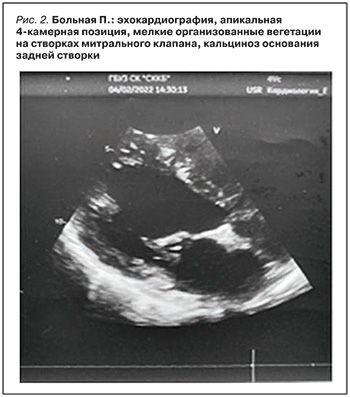
ЭхоКГ с допплер-анализом: дилатация всех полостей сердца. Миокард ЛЖ, межжелудочковой перегородки неоднородной эхоструктуры с участками повышенной эхогенности. Гипертрофия миокарда межжелудочковой перегородки. Створки митрального клапана изменены, фиброз створок и подклапанных структур, склеротические изменения левого атриовентрикулярного кольца, кальциноз основания задней створки митрального клапана, трикуспидального клапана, мелкие организованные вегетации на створках митрального клапана (рис. 2). Недостаточность митрального (2 ст.) и трикуспидального (2 ст.) клапанов. Склеротические изменения стенок аорты и аортальных клапанов, недостаточность аортального клапана (2 ст.), наличие организованных вегетаций на створках аортального клапана. Дисфункция клапана легочной артерии. Легочная гипертензия (СДЛА 54 мм рт.ст.).
ФВ ЛЖ – 73%. Диастолическая дисфункция левого желудочка.
УЗИ: печень слегка увеличена за счет правой доли, незначительно увеличены головка и тело поджелудочной железы с повышенной эхогенностью. Селезенка не увеличена, в забрюшинном пространстве дополнительные образования не обнаружены. Выявлены микролиты в обоих почечных синусах, полип мочевого пузыря. Малый таз, молочные железы – без патологии.
Рентгенография органов грудной полости: признаки хронического бронхита, пневмосклероза; изменения конфигурации сердца и аорты, характерные для гипертонической болезни, состояние после перенесенного туберкулеза легких.
УЗИ мягких тканей шеи: по ходу нижней челюсти определяются множественные гипоэхогенные структуры от 24×8 мм и меньше, идущие цепочкой к надключичной области; в правой надключичной области визуализируется аналогичная структура 12×8 мм, в зоне бифуркации общей сонной артерии слева также определяются гипоэхогенные структуры ≤15×8 мм (лимфоузлы?).
Мультиспиральная компьютерная томография (МСКТ) шеи, средостения: увеличение лимфоузлов справа в поднижнечелюстной области 19×15 мм, справа по заднему краю кивательной мышцы – 13×10 мм, увеличение паратрахеальных, трахеобронхиальных, бифуркационных, бронхопульмональных лимфоузлов слева до 23×22–35×21 мм. Сердце, аорта, легочная артерия без особенностей, деструкции костного скелета нет. Осумкование жидкости в плевральных полостях, больше слева, в том числе по ходу междолевой щели. Перилимфатические очаги в обоих легких, апикальный пневмоплеврофиброз, диффузный легочный пневмофиброз, утолщение междольковых перегородок. Заключение: картина шейной, внутригрудной лимфаденопатии, диффузный пневмофиброз, очаговые изменения в обоих легких (дифференцировать с саркоидозом, лимфогранулематозом, лимфогенным канцероматозом). Двусторонний осумкованный малый гидроторакс.
Пациентке была выполнена биопсия опухолевидного образования шеи, которая оказалась неинформативной. В послеоперационном периоде наблюдались носовое кровотечение, повышение температуры до высоких цифр, нарастание одышки, снижение АД, появление васкулитоподобной мелкоточечной кожной геморрагической сыпи, повышение уровней креатинина и мочевины в крови. После дезинтоксикационной терапии, инфузий глюкокортикостероидов температура нормализовалась, уменьшилась одышка. От повторной биопсии больная отказалась.
Клинический диагноз: лимфопролиферативное заболевание неуточненное с поражением шейных, внутригрудных лимфоузлов. Тромбэндокардит неинфекционный с поражением митрального и аортального клапанов, недостаточность митрального, аортального и трикуспидального клапанов, склероз аорты. Хроническая сердечная недостаточность IIA, функциональный класс III. Легочная гипертензия. Гипертоническая болезнь 3-й стадии, 3-й степени, риск 4. Сахарный диабет 2-го типа. Полип мочевого пузыря.
С учетом неясности происхождения лимфаденопатии пациентка была переведена в краевой онкологический диспансер, где ей диагностирована аденокарцинома желудка.
ОПИСАНИЕ КЛИНИЧЕСКОГО НАБЛЮДЕНИЯ № 3
Больной К., 60 лет, был доставлен в стационар по экстренным показаниям с жалобами на выраженную одышку в покое, усиливающуюся при малейшей физической нагрузке, перебои в работе сердца, боль в левой половине грудной клетки, повышение АД, шаткость походки.
Данные анамнеза: три года назад перенес инфаркт миокарда. Одышка и перебои в работе сердца значительно усилились за сутки до госпитализации. В течение нескольких последних месяцев имеет постоянную форму фибрилляции предсердий. Более подробно собрать анамнез не удалось из-за тяжести состояния пациента.
Данные объективного осмотра: общее состояние тяжелое, в сознании. Подкожная жировая клетчатка развита избыточно. Положение в постели вынужденное – сидя, выраженная одышка, кожные покровы бледно-цианотичные, умеренной влажности. Границы относительной сердечной тупости расширены в обе стороны, тоны глухие, аритмичные, 145/мин, пульс – 35, дефицит пульса – 106. АД на обеих руках 150/100 мм рт.ст. Над легкими – укорочение перкуторного звука в нижних отделах с обеих сторон, обилие влажных хрипов. Частота дыхательных движений 28–36/мин. Живот умеренно вздут, печень выступает из-под края реберной дуги на 4–5 см, плотной консистенции. Умеренные отеки на голенях.
В связи с тяжестью состояния, тяжелой дыхательной недостаточностью пациент в первые часы пребывания в отделении реанимации был переведен на управляемое дыхание.
Общий анализ крови: эритроциты – 5,0–4,27×1012/л; Hb – 137–124 г/л; Ht – 40,5–34,2%; лейкоциты – 7,9–11,8×109/л (с. – 76%, п. – 4%, лимф. – 16%, м. – 4%); тромбоциты – 303–136×109/л; СОЭ 4–13 мм/ч.
Общий анализ мочи: относительная плотность 1030, рН 5,0, белок – 1000 мг/дл, лейкоциты – 6–8 в поле зрения, цилиндры зернистые – 0–1–1 в поле зрения, слизь +++, бактерии +.
Протромбиновый индекс – 85–70%; протромбиновое время – 17,7–15,6 с; АЧТВ – 45–31 с; АЛТ – 578,6 Ед/л; АСТ – 594,5 Ед/л; креатинкиназа (КФК) общая – 157 Ед/л; лактатдегидрогеназа – 1182 Ед/л; общий белок – 55,8 г/л; билирубин общий – 54,6 мкмоль/л; билирубин прямой – 24,3 мкмоль/л; глюкоза – 4,74 ммоль/л; креатинин – 110,0 мкмоль/л; мочевина – 7,8–30,3 ммоль/л; С–реактивный белок – 20,97–159,12 мг/л; D–димер – 7,14 мкг/мл; К+ – 4,61 ммоль/л; Nа+ – 129 ммоль/л. Уровни тропонина Т, МВ КФК, миоглобина – в пределах нормы.
Фибробронхоскопия: отек и гиперемия слизистой оболочки, умеренное количество слизисто-гнойной мокроты.
МСКТ легких: заднебазальные сегменты уплотнены с обеих сторон за счет пневмонической инфильтрации, легочный рисунок перибронхиально усилен, жидкости в плевральных полостях нет, в системе легочной артерии дефектов наполнения крупных и мелких ветвей не выявлено – картина двусторонней гипостатической пневмонии.
МСКТ-томография головного мозга: признаков острого нарушения мозгового кровообращения не выявлено, постинсультная киста левой теменной доли, умеренные атрофические измерения обоих полушарий, общая сообщающаяся гидроцефалия.
УЗИ: увеличение размеров печени с диффузно неоднородной структурой и повышенной эхогенностью, утолщение стенок желчного пузыря, метеоризм, свободная жидкость в плевральных полостях.
ЭКГ: фибрилляция предсердий, неполная блокада левой ножки пучка Гиса, очаговые изменения рубцового характера переднеперегородочно-верхушечной области ЛЖ.
ЭхоКГ: снижение глобальной сократительной функции миокарда ЛЖ (ФВ ЛЖ – 36–29%). Гипертрофия миокарда задней ЛЖ и межжелудочковой перегородки. Гипоакинез миокарда переднесептального и апикального сегментов ЛЖ с истончением миокарда; аневризма верхушки с наличием пристеночного тромбоза, гипокинез задней и нижней стенок левого желудочка. Дилатация всех камер сердца, относительная недостаточность клапанов, особенно митрального и трикуспидального. Фиброз и кальциноз створок митрального клапана и подклапанных структур, склероз и кальциноз аорты, дилатация аорты на уровне восходящего отдела, легочная гипертензия (САД 52 мм рт.ст., ДАД 12 мм рт.ст.). Диастолическая дисфункция ЛЖ.
За все время пребывания в стационаре состояние пациента оставалось крайне тяжелым, смерть наступила при нарастании полиорганной недостаточности.
Заключительный клинический диагноз включил ишемическую болезнь сердца, постинфарктный кардиосклероз с аневризмой ЛЖ и пристеночным тромбозом, постоянную форму фибрилляции предсердий, вторичную кардиомиопатию (ишемическую, алкогольную), последствия перенесенного инсульта неизвестной давности.
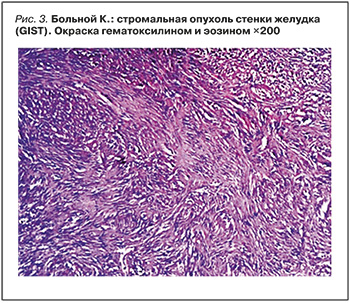
При патологоанатомическом исследовании был подтвержден клинический диагноз постинфарктного кардиосклероза с аневризмой и тромбозом, коронаросклероза, гипертрофии стенок сердца и дилатации полостей. Обнаружен флотирующий смешанный тромб на створке митрального клапана. Выявлены микроочаговый инфаркт одной из почек, микрокисты в подкорковых образованиях головного мозга (последствия перенесенного инсульта), диффузно-узелковая гиперплазия надпочечников, обструктивный бронхит. Также диагностирована гастроинтестинальная стромальная опухоль – GIST стенки желудка, веретеноклеточный вариант с опухолевыми клетками характерной веретенообразной формы, мономорфными палочковидными ядрами, перинуклеарной вакуолизацией, формирующая хаотично расположенные пучки и ритмические структуры (рис. 3). Метастатическое поражение органов не обнаружено.
ОБСУЖДЕНИЕ
Как следует из данных, представленных в клиническом наблюдении № 1, у больного с эндоскопическими проявлениями высокодифференцированной аденокарциномы желудка развилась М-протеинемия, предположительно за счет клональной стимуляции пула неопухолевых плазматических/лимфоидных клеток активными компонентами самой опухоли на фоне иммунодефицита и Т/В-клеточного дисбаланса. Между тем известно, что при моноклональных гаммапатиях продуцирующие парапротеин опухолевые клетки частично сохраняют фенотипические свойства здоровых плазматических клеток [18], их иммунологический изотип IgG и IgA и способность проявлять активность антител против ряда антигенов [19]. Сохраненные иммуногенные свойства иммуноглобулинов, входящих в состав парапротеинов, могли быть причиной образования антиэритроцитарных антител, создавших проблему в трансфузии эритромассы. К сожалению, другие антитела, в том числе к фосфолипидам, у данного пациента определены не были.
Параллельно с этим у больного клинически манифестировали два коагулопатических синдрома противоположной направленности – тромботический и геморрагический.
Парапротеинемия как известный фактор риска венозного тромбоза могла иметь отношение к развитию у больного тромботического синдрома (в виде НБТЭ с поражением двух клапанов, катетер-индуцированного венозного тромбоза) за счет формирования гипервязкости крови, низкого уровня сывороточного альбумина, возможного присутствия волчаночного антикоагулянта, повышения плазменного фактора VIII и приобретенной устойчивости активированного протеина С, характерной как для онкологических больных, так и для больных с парапротеинемией [20, 21].
Причиной возникновения геморрагического синдрома могла быть аномальная агрегация, обусловленная, как полагают, «обволакиванием» (изоляцией) парапротеином тромбоцитов и неспецифическим блокированием тромбоцитарных рецепторов IIb/IIIa, а также прямым угнетением их функции вследствие специфического связывания фактора Виллебранда с рецептором Ib гликопротеина [22] и формированием приобретенного синдрома Виллебранда. Многократное (в десятки раз) снижение показателей стимулированной агрегации тромбоцитов сочеталось у пациента С. с геморрагическим синдромом, которым дебютировала опухоль.
Клиническое наблюдение № 2 посвящено случаю опухоли желудка, метастазирующей в лимфатические узлы шеи и средостения, осложненной НБТЭ c наличием псевдовегетаций на митральном и аортальном клапанах и вызвавшей на начальном этапе (девятью месяцами ранее) трудности в дифференциальном диагнозе с инфекционным эндокардитом с учетом наличия возникших после стоматологических процедур подчелюстной и шейной лимфаденопатии, гипертермии, присоединения одышки, слабости, развития анемического синдрома.
В исключении инфекционного эндокардита большую роль сыграли многократно отрицательные результаты посевов крови и выявление опухолевой лимфаденопатии подчелюстной области, шеи, внутригрудных узлов, специфическое поражение легочной ткани.
При анализе клинической картины обращали на себя внимание возникновение мелкоточечной геморрагической кожной сыпи, развитие носового кровотечения и одновременное возрастание уровня сывороточных креатинина и мочевины, спровоцированных попыткой операционной биопсии шейного узла и рассматриваемых как вероятный дебют геморрагического васкулита – еще одного проявления паранеопластического синдрома, обусловленного активацией аутоиммунных механизмов в ответ на опухолевые аутоантигены.
Тяжесть состояния больного К. (клиническое наблюдение № 3) была обусловлена декомпенсацией сердечной недостаточности, вызванной тяжелым поражением сердца, что нашло подтверждение на секции. Стромальная опухоль стенки желудка оказалась случайной находкой, тем более интересной, что GIST представляет собой редкую потенциально злокачественную опухоль отдельной нозологической группы, составляющую 1% от всех злокачественных опухолей желудочно-кишечного тракта и 89% – от сарком данной локализации.
Учитывая способность многих опухолей (вне зависимости от гистологического типа, степени злокачественности, наличия метастазов) продуцировать биоактивные субстанции, в том числе коагулоактивные [4, 12, 13], а также принимая во внимание медленный в ряде случаев рост опухоли, особенно на начальных этапах ее развития, можно допустить причастность GIST стенки желудка к большинству тромботических проявлений болезни у пациента К., начиная с инфаркта миокарда трехлетней давности (возможно, эмболического), перенесенных (постэмболических) инсультов (по данным секции и магнитно-резонансной томографии) и микроинфаркта почки, а также тромботического эндокардита с локализациями тромбов в аневризматическом мешке и на одной из створок митрального клапана. Иными словами, потенциально злокачественная, медленно растущая стромальная опухоль стенки желудка в течение ряда лет проявляла себя неспецифическим (паранео-пластическим) гиперкоагуляционным синдромом, осложненным множественными эмболиями в сосуды сердца, мозга, почек и тромботическим эндокардитом. Примеры такого «поведения» опухолей описаны в литературе [1], особенно часто они встречаются в практике неврологов, ревматологов, дерматологов.
ЗАКЛЮЧЕНИЕ
Анализируя приведенные клинические случаи, следует обратить внимание на то, что в двух наблюдениях у пациентов имели место клинические проявления тромботического и геморрагического синдромов (вариант ДВС?) в сочетании с иммунологическими расстройствами в виде выявления антиэритроцитарных антител в одном случае и васкулитоподобной кожной геморрагической сыпи с одновременным ростом креатинина и мочевины сыворотки крови – в другом. В двух анализируемых случаях НБТЭ протекал при отсутствии явных метастазов, что не соответствует представлениям о его развитии исключительно у пациентов с опухолью на этапе метастазирования [3]. Одно из представленных клинических наблюдений продемонстрировало возможность длительного течения опухолевого процесса, проявляющегося паранеоплазией.
Таким образом, сочетание опухоли желудка и неинфекционного (асептического) тромботического эндокардита представляет клинический интерес в плане активного поиска НБТЭ у больных с опухолью желудка, а также и необходимости эндоскопического обследования при «случайном» обнаружении клапанных тромбов, особенно у пациентов с клиническими или лабораторными признаками гипокоагуляции и/или сопутствующими аутоиммунными и аллергическими проявлениями, как длительно существующими, так и транзиторными.



