В последних версиях международных и национальных рекомендаций по артериальной гипертонии (АГ) значительную эволюцию претерпели диагностические критерии субклинического поражения почек [1, 2]. Отчетливо обозначился вектор к снижению критериев поражения органов-мишеней (ПОМ) и повышению важности суррогатных критериев оценки эффективности антигипертензивной терапии. Цель нововведений — раннее выявление пациентов с высоким риском для раннего осуществления эффективной профилактики сердечно-сосудистых осложнений.
Наличие сахарного диабета (СД) 2-го типа является критерием отнесения пациента с АГ к категории высокого/очень высокого риска развития сердечно-сосудистых осложнений, и выявление субклинического ПОМ у этих пациентов важно для определения терапевтических целей и мониторирования эффективности антигипертензивной и антидиабетической терапии [3, 4].
Установлено, что микроальбуминурия (МАУ), протеинурия и снижение скорости клубочковой фильтрации (СКФ) являются независимыми предикторами сердечно-сосудистой заболеваемости и смертности. Активно изучается роль нефропротекции как гаранта улучшения прогноза сердечно-сосудистых заболеваний (ССЗ).
Цель исследования — сопоставить значение разных методов оценки функционального состояния почек (микроальбуминурии, креатинина, расчета клиренса креатинина и СКФ) для выявления субклинического поражения почек и оценки риска развития ССЗ в группах больных АГ с СД и без него.
Материал и методы
Обследованы 734 пациента с АГ без ССЗ и заболеваний почек (на основании анамнеза и данных обязательного обследования). Среди них на основании анамнеза, обследования с выполнением перорального теста на толерантность к глюкозе 158 больных образовали группу АГ с СД (см. таблицу).
Таблица. Клинико-демографическая характеристика больных АГ
Примечание. Данные представлены в виде абсолютного числа больных (%), если не указано другое; * — данные представлены в виде МЃ}δ. АГ — артериальная гипертония; СД — сахарный диабет; ИМТ — индекс массы тела; САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление; СКФ — скорость клубочковой фильтрации; ККр. — клиренс креатинина; ХС — холестерин; ЛНП — липопротеиды низкой плотности; ЛВП — липопротеиды высокой плотности.
Регулярную антигипертензивную терапию получали 324 (44,1%) пациента.
Для оценки функционального состояния почек исследовали креатинин сыворотки, рассчитывали клиренс креатинина (ККр.) по формуле Кокрофта—Гаулта [5], СКФ — по сокращенной формуле MDRD (Modification of Diet in Renal Disease) [6]. В образце утренней мочи определяли отношение концентрации альбумина и креатинина (А/Кр.), критерием микроальбуминурии (МАУ) считали его значение ≥22 мг/г для мужчин и ≥31 мг/г для женщин, подтвержденное в 2 из 3 анализов с интервалом 7—10 дней в отсутствие повышения температуры тела и признаков инфекции мочевыводящих путей. Признаками субклинического поражения почек считали креатинин сыворотки 107—124 мкмоль/л у женщин и 115—133 мкмоль/л у мужчин, МАУ, снижение ККр.<60 мл/мин или СКФMDRD <60 мл/мин/1,73 м2 [1, 2].
Статистическую обработку полученных данных исследования проводили с использованием пакета прикладных статистических программ SAS (Statistical Analysis System, SAS Institute Inc., США) с применением стандартных алгоритмов вариационной статистики.
Результаты
Определение только концентрации креатинина сыворотки дает ограниченную информацию для оценки функции почек. Среди больных АГ без СД небольшое повышение уровня креатинина сыворотки, соответствующее категории ПОМ, выявлено у 90 (15,6%). Использование различных расчетных методик вычисления СКФ для оценки функционального состояния почек существенно изменяет пропорцию пациентов с признаками субклинического поражения почек как органа-мишени.
Среди пациентов с АГ без СД у 34 (5,9%) обнаружено снижение ККр.<60 мл/мин, в то время как снижение СКФMDRD <60 мл/мин/1,73 м2 выявлено у 162 (28,1%) (рис. 1).
Рис. 1. Распределение больных АГ без СД в зависимости от клиренса креатинина, рассчитанного по формуле Кокрофта—Гаулта, и СКФ, рассчитанной по уравнению MDRD (n=576).
АГ — артериальная гипертония; СД — сахарный диабет; СКФ — скорость клубочковой фильтрации.
Наряду с небольшим повышением уровня креатинина сыворотки и снижением ККр.<60 мл/мин или СКФ <60 мл/мин/1,73 м2 признаком субклинического поражения почек является МАУ. На основании определения отношения А/Кр. в утренней порции мочи МАУ была диагностирована у 41 (7,1%) пациента с АГ без СД. Сочетание определения креатинина, МАУ, расчета СКФMDRD позволило обнаружить субклиническое поражение почек у 216 (37,5%) пациентов, в то время как результаты расчета ККр. по формуле Кокрофта—Гаулта вместо СКФMDRD указывали на субклиническое поражение почек только у 129 (22,4%) больных АГ без СД (рис. 2).
Рис. 2. Частота выявления субклинического поражения почек у больных АГ без СД в зависимости от методов исследования и их сочетания.
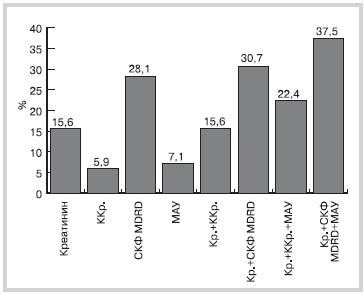
АГ — артериальная гипертония; СД — сахарный диабет; ККр. — клиренс креатинина; СКФ — скорость клубочковой фильтрации; МАУ — микроальбуминурия.
В группе больных АГ с СД не выявлено пациентов с повышением уровня креатинина сыворотки, соответствующим категории ПОМ. Использование формулы MDRD по сравнению с расчетом ККр. по формуле Кокрофта—Гаулта позволяло обнаружить почти в 2 раза больше пациентов с уровнем СКФ, соответствующим категории субклинического ПОМ: 13 (8,2%) и 7 (4,4%) соответственно.
Диагностически значимое (<60 мл/мин/1,73 м2) снижение СКФMDRD очень редко сочеталось с МАУ у больных АГ вне зависимости от наличия СД (рис. 3). Только у 7 (0,9%) пациентов с АГ без СД и у 2 (1,3%) больных АГ и СД снижение СКФMDRD <60 мл/мин/1,73 м2 выявлялось одновременно с МАУ.
Рис. 3. Независимое значение МАУ и расчетной СКФ для выявления субклинического поражения почек у больных АГ.
МАУ — микроальбуминурия; СКФ — скорость клубочковой фильтрации; СД — сахарный диабет; АГ — артериальная гипертония.
Не выявлено различий по уровню креатинина, ККр. или СКФMDRD в зависимости от наличия МАУ, а также корреляции между экскрецией альбумина с мочой и ККр. или СКФMDRD.
Обсуждение
Оценка СКФ позволяет выявить субклиническое поражение почек вне зависимости от наличия микро- или макроальбуминурии. Скрининговое обследование больных для обнаружения альбуминурии дает возможность выявлять пациентов с субклиническим поражением почек в отсутствие снижения СКФ [7].
При использовании только одного из методов значительно занижается возможность выявления субклинического поражения почек, что было продемонстрировано в настоящем исследовании и согласуется с результатами более крупных исследований в разных популяциях больных. В США в скрининговой программе KEEP (Kidney Early Evaluation Program) у лиц в возрасте 18 лет и старше с СД, АГ или семейным анамнезом АГ, СД или хронической болезни почек (ХБП) определяли отношение А/Кр. в моче и рассчитывали СКФMDRD [8]. По данным KEEP, из 69 244 человек (53,4±15,7 года, 68,3% женщины, 33,0% негроидной расы, 27,6% c СД) у 26,8% имелась ХБП. Альбуминурия была определяющим тестом для диагностики ХБП у молодых, расчетная СКФ — в старших возрастных группах.
По данным популяционного исследования, выполненного в Великобритании на основании расчета СКФMDRD, из 5072 пациентов с СД у 31% диагностирована клинически значимая ХБП (СКФ <60 мл/мин/1,73 м2). Среди пациентов с СД и ХБП III стадии только у 33% больных уровень креатинина сыворотки был >120 мкмоль/л и у 37% выявлялась МАУ [9].
В крупном исследовании с участием 7596 больных СД в возрасте 62,6±14,8 года с уровнем гликированного гемоглобина 7,9±1,7 %, креатинина 88 (77—103) мкмоль/л, альбуминурией у 30,5% для выявления ХБП повышенный уровень креатинина >120 мкмоль/л обладал чувствительностью 45,3% и специфичностью 100%, альбуминурия — 51,2 и 75,5% соответственно. Сочетанное определение повышенного уровня креатинина или альбуминурии улучшало диагностику, но оставалось много пациентов с невыявленной ХБП (чувствительность 82,4% и специфичность 75,4%) [10].
Важными с практической точки зрения представляются полученные нами данные о самостоятельном диагностическом значении МАУ и сниженной СКФ, поскольку они позволяют выявлять группы больных с патогенетически разным поражением почек. Перекрест в выявлении МАУ и снижения СКФ составил лишь 3,6% у больных АГ без СД и 8,7% — с СД. Не выявлено взаимосвязи между экскрецией альбумина с мочой и СКФMDRD или ККр.
Эти результаты согласуются с активно обсуждаемой в последние годы концепцией протеинурического и непротеинурического пути повреждения почек [11—14]. Представления о двух независимых путях нарушения функционального состояния почек являют собой смену парадигмы о строгой стадийности развития диабетической нефропатии, включающей гиперфильтрацию, микроальбуминурическую стадию без снижения СКФ, протеинурическую стадию со снижением СКФ, почечную недостаточность [15—18]. Традиционный взгляд не предполагает снижение СКФ на допротеинурической стадии.
Однако результаты исследований, в том числе нашего, свидетельствуют о различных, не связанных друг с другом, механизмах развития нефропатии: возможности развития макроальбуминурии при нормальной СКФ и, наоборот, снижения СКФ <60 мл/мин/1,73 м2 при нормоальбуминурии [13, 19—22].
Еще в 90-х годах XX века у молодых больных с СД 1-го типа, в основном женщин, было продемонстрировано снижение СКФ при нормоальбуминурии [23]. Впоследствии эти данные были подтверждены не только у больных с СД 1-го типа [19], но и у пациентов с СД 2-го типа [21, 22], причем у последних сниженная СКФ при нормоальбуминурии регистрировалась чаще. В исследовании с использованием методики «золотого стандарта» определения СКФ (99mTc-DTPA) нормоальбуминурическая почечная недостаточность выявлялась у 23% пациентов с СД 2-го типа даже после учета терапии блокаторами ренин-ангиотензиновой системы (РАС) [13].
Развитие почечной недостаточности в отсутствие альбуминурии и ретинопатии у больных с СД 2-го типа также продемонстрировано в популяционном исследовании NHANES III [24, 25]. У пациентов с СД 2-го типа с нормоальбуминурией (возраст 60—79 лет) частота выявления СКФ <30 мл/мин/1,73 м2 составила 34%, а СКФ 30—60 мл/мин/1,73 м2 — 47%. При интерпретации данных этого исследования следует подчеркнуть, что терапия блокаторами РАС не принималась во внимание. В популяции потомков участников Фрамингемского исследования обнаружена диссоциация между сниженной СКФ и МАУ, но каждый из этих показателей был предиктором неблагоприятного прогноза ССЗ [26].
МАУ является общепризнанным маркером генерализованной дисфункции эндотелия, свидетельствует о структурно-функциональном нарушении клубочкового аппарата почек [15, 18, 27, 28]. Патогенез неальбуминурического пути развития нефропатии остается неясным. В отсутствие морфологических данных многие гипотезы носят спекулятивный характер. В частности, предполагалось, что снижение СКФ у пациентов с нормоальбуминурией развивается вследствие атеросклеротического поражения внутрипочечных артерий, в отличие от хорошо известной гломерулопатии у больных со сниженной СКФ в сочетании с альбуминурией. Однако в исследовании с использованием дуплексного сканирования почечных артерий показано, что нормоальбуминурическое снижение СКФ у больных с СД 2-го типа не связано с изменением индекса резистентности почечных артерий и внутрипочечной васкулопатией [29]. Необходимо учитывать влияние возраста на СКФ. Среди пациентов с СД 2-го типа старше 70 лет 30% со сниженной СКФ <60 мл/мин/1,73 м2 оставались с нормоальбуминурией.
Обсуждается роль мочевой кислоты и α-фактора некроза опухоли (ФНО-α) в патогенезе непротеинурической нефропатии у пациентов с СД. Повышенный уровень мочевой кислоты ассоциирован с нарушениями функции почек, является предиктором почечной дисфункции в общей популяции [30—36]. У пациентов с СД снижение расчетной СКФ, основанной на цистатине С, независимо связано с повышением концентрации мочевой кислоты, причем уровень мочевой кислоты был в пределах нормы.
В нашем исследовании у больных АГ с СД 2-го типа выявлена прямая связь цистатина С с мочевой кислотой (r=0,48; p<0,001) и обратная связь СКФMDRD и СКФcys с мочевой кислотой (r=–0,30; p<0,001 и r=–0,48; p<0,001 соответственно). Механизмы независимой взаимосвязи концентрации мочевой кислоты с СКФ не определены. Предполагается, что мочевая кислота подавляет продукцию эндотелием оксида азота и оказывает прямое повреждающее действие на эндотелий, активирует образование оксидантов, нарушает активность РАС [37—40]. Кроме того, не исключаются активация мочевой кислотой системы комплемента, запуск воспалительных реакций, что может привести к повреждению почечных сосудов и интерстициальной ткани [41]. Экспериментальные данные свидетельствуют о роли гиперурикемии в развитии гломерулосклероза и интерстициального фиброза [42].
Возможная роль воспалительных цитокинов, в частности ФНО-α, в патогенезе непротеинурической нефропатии подтверждается рядом клинических исследований [43—46]. Экспериментальные данные также свидетельствуют о роли ФНО-α в развитии тубулоинтерстициального апоптоза [47, 48]. В настоящем исследовании на всем протяжении концентрации цистатина С выявляется независимая положительная связь с ФНО-α (r=0,27; p<0,05). Только для значений СКФMDRD <60 мл/мин/1,73 м2 выявляется отрицательная взаимосвязь с ФНО-α.
Вполне возможно, что мочевая кислота и ФНО-α отражают роль каких-то других, неустановленных этиологических факторов в патогенезе нефропатии. Наряду с этим наличие взаимосвязи мочевой кислоты и ФНО-α с цистатином и СКФcys даже у пациентов с ненарушенной функцией почек могут свидетельствовать об их самостоятельном значении. Влияют ли мочевая кислота и ФНО-α на раннее снижение СКФ, является ли это влияние независимым, предстоит выяснить в проспективных клинических исследованиях.
Признав роль маркеров функционального состояния почек для оценки риска развития ССЗ и прогноза у больных АГ, следует рассматривать их как особую терапевтическую мишень и суррогатный критерий эффективности антигипертензивной терапии. Определение механизмов непротеинурической нефропатии крайне важно для выбора и оценки эффективности нефропротективных стратегий. Для изучения взаимосвязи экскреции альбумина с мочой с СКФ выполнен анализ 33 исследований по оценке антигипертензивной терапии у пациентов с СД 1-го и 2-го типов [49]. В каждой из 69 групп лечения сопоставлялось влияние терапевтического вмешательства на экскрецию альбумина с мочой и скорость снижения СКФ в различные периоды наблюдения от 2 до 8 лет. Влияние на экскрецию альбумина с мочой оценивалось как относительное изменение через год по сравнению с исходным уровнем, а изменения СКФ — за весь период исследования. Показано, что изменения экскреции альбумина с мочой в течение первого года антигипертензивной терапии у больных с I и II стадиями ХБП не являются предиктором динамики СКФ. Взаимосвязь первоначальной динамики экскреции альбумина с мочой с динамикой СКФ на протяжении всего периода наблюдения выявлена только у пациентов с исходно сниженной СКФ.
Данные о динамике экскреции альбумина с мочой и СКФ подтверждались как в ранних исследованиях с традиционными антигипертензивными препаратами [50, 51], так и в более поздних с использованием блокаторов РАС [49]. Эти результаты свидетельствуют о том, что при оценке нефропротективной эффективности терапевтических стратегий определение СКФ не менее, а может быть, и более важно, чем определение экскреции альбумина с мочой, особенно у пациентов с ХБП I и II стадии [52].
Таким образом, определение МАУ и расчет СКФMDRD имеют самостоятельное и взаимодополняющее диагностическое значение, позволяют выявлять больных с патогенетически разным поражением почек, отражают протеинурический и непротеинурический механизмы прогрессирования нефропатии при АГ с СД и без него.
Независимое значение МАУ и СКФMDRD делает необходимым поиск нефропротективных стратегий, эффективных в отношении не только замедления прогрессирования протеинурии, но и интерстициального повреждения, сопровождающегося снижением СКФ.



