ВВЕДЕНИЕ
Хронический аутоиммунный тиреоидит (АИТ) является одним из наиболее распространенных аутоиммунных заболеваний человека [1]. Заболевание характеризуется лимфоцитарной инфильтрацией и деструкцией ткани щитовидной железы (ЩЖ) с развитием прогрессирующего фиброза [2]. Основным клиническим проявлением АИТ выступает первичный гипотиреоз, обусловленный аутоиммунным поражением ЩЖ. Он сопровождается увеличением массы тела, запорами, повышенной чувствительностью к холоду, сухостью кожи. Кроме того, АИТ может провоцировать возникновение сердечно-сосудистой патологии [3] и выступает фактором риска развития рака ЩЖ [4].
В патогенез АИТ вовлечены как гуморальные, так и клеточные факторы иммунитета [5]. При этом важная роль в развитии заболевания отводится цитокиновой сети, в частности провоспалительным интерлейкинам 1β и 23 (ИЛ-1β и ИЛ-23), а также интерферону-γ [6].
В основе терапии синдрома гипотиреоза, в том числе при АИТ, лежит замещение функции ЩЖ. Это достигается систематическим приемом препаратов тиреоидных гормонов. Следует подчеркнуть, что эффектом заместительной гормонотерапии является не только устранение гипотиреоза, а но и предотвращение его долгосрочных осложнений [7]. В то же время достигаемая таким образом нормализация гормонального фона даже с учетом сопутствующей коррекции неврологических, иммунных нарушений при АИТ с гипотиреозом не всегда обеспечивает нормализацию состояния пациентов в достаточной мере и не препятствует прогрессированию болезни. В связи с этим актуальность приобретает разработка и внедрение в клиническую практику инновационных способов лечения АИТ с гипотиреозом.
Среди перспективных методов немедикаментозного лечения в настоящее время получает распространение интервальная гипоксическая терапия (ИГТ).
Снижение содержания кислорода (гипоксия) может оказывать негативное влияние на клеточную адаптацию и выживание клеток [8]. Хроническое воздействие тяжелой гипоксии приводит к усилению окислительного стресса, активации вазоконстрикторов, системному воспалению, гипоксемии, легочной гипертензии и ишемии миокарда [9]. И, наоборот, периодическое воздействие умеренной гипоксии может оказывать благотворное влияние на состояние как здоровых, так и людей с различной патологией [10–13]. Перемежающаяся гипоксия, определяемая как короткие чередующиеся воздействия гипоксии и нормоксии, сопровождается улучшением толерантности к физической нагрузке, метаболизма и системного артериального давления [14]. Данный вид терапии также рассматривается как многообещающий инструмент для благотворного воздействия на костный метаболизм [15]. ИГТ позволяет модулировать и стабилизировать фактор, индуцируемый гипоксией-1 альфа (HIF-1α), который участвует в экспрессии факторов, связанных с ангиогенезом, остеогенезом, липолизом и регуляцией воспалительного ответа [15, 16].
На фоне сообщений об эффективности ИГТ в комплексном лечении различной соматической патологии [17] сведения о применении гипокситерапии в лечении АИТ немногочисленны. Приводятся данные, что на фоне ИГТ наблюдается улучшение клинической картины АИТ, нормализация гормонального фона [18] и отдельных показателей иммунного статуса [19].
Вместе с тем в доступной литературе мы не обнаружили данных о влиянии гипокситерапии на динамику цитокинового профиля, в том числе на такие медиаторы межклеточного взаимодействия, как остеопротегерин (OPG) и лиганд активатора рецептора ядерного фактора κВ (RANKL).
В связи с вышеизложенным целью нашей работы стало исследование эффектов интервальной гипокситерапии на показатели ИЛ-1β, ИЛ-23, OPG, RANKL у женщин с АИТ и гипотиреозом.
МАТЕРИАЛ И МЕТОДЫ
В работу были отобраны 136 женщин с АИТ и гипотиреозом. На подготовительном этапе все они в течение 6 мес принимали препараты левотироксина натрия с целью индивидуального подбора дозы гормональной заместительной терапии. К концу наблюдения для всех обследованных лиц были обеспечены целевые уровни тиреотропного гормона (ТТГ) в диапазоне 0,23–3,40 мМЕ/л. При этом подобранная для пациентов доза левотироксина натрия колебалась в пределах от 25 до 150 мг/сут внутрь.
После этого все обследованные лица были распределены в 2 равноценные группы. Основную группу I составили 68 женщин, которые в течение 12 мес продолжили получать стандартную заместительную гормонотерапию левотироксином натрия. В основную группу II были включены остальные 68 пациентов, которые, наряду с аналогичным 12-месячным курсом заместительной гормонотерапии, получали гипокситерапию.
В качестве группы сравнения были обследованы 63 условно здоровые женщины без заболеваний ЩЖ.
В исследование были включены лица, соответствующие следующим критериям: женский пол, возраст от 31 до 47 лет, впервые установленный на основании лабораторных, инструментальных и клинических данных АИТ с гипотиреозом, подписание письменного добровольного информированного согласия.
Критерии исключения: выявленные ранее аутоиммунная или эндокринная патология, острые соматические и инфекционные заболевания, метаболические расстройства, хронические заболевания почек и печени, хронические воспалительные заболевания, онкологические, гематологические или психические заболевания, хронические заболевания в стадии декомпенсации, применение иммунодепрессантов или гормональных препаратов (глюкокортикоидов и др.), а также индивидуальная непереносимость гипокситерапии.
Биологическим материалом для лабораторных исследований служила сыворотка крови, в которой определяли уровни ИЛ-1β, ИЛ-23, OPG, RANKL. Для этого использовались иммуноферментные тест-системы производства «Вектор-Бест» (РФ), Invitrogen Corporation (Frederick, США), Biomedica Medizinprodukte (GmbH & Co KG, Австрия). Методики выполнялись в строгом соответствии с прилагающимися к наборам инструкциями. Для оценки функции ЩЖ, а также выраженности аутоиммунного ответа на ее специфические антигены методом иммуноферментного анализа с применением соответствующих наборов реактивов производства «Алкор-Био» (РФ) исследовались количественные показатели в сыворотке крови свободного трийодтиронина (FT3), свободного тироксина (FT4), ТТГ, антител к тиреопероксидазе и тиреоглобулину.
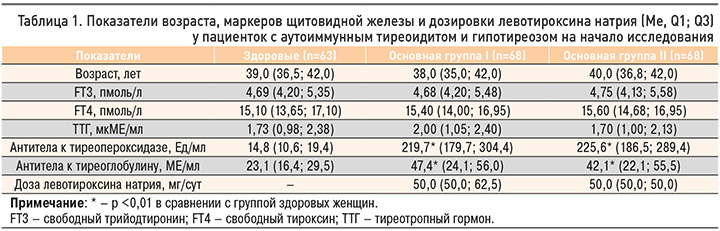
Как видно из таблицы 1, на момент инициации лечения женщины с АИТ и гипотиреозом из основных групп I и II существенно не отличались как между собой, так и группой здоровых лиц, по возрасту, сывороточным концентрациям FT3, FT4 и ТТГ (р >0,05). При этом у женщин обеих основных групп было зарегистрировано одинаково выраженное повышение содержания специфических аутоантител к антигенам ЩЖ (р <0,01). Одинаковой была и доза левотироксина натрия, принимаемая участницами двух основных групп (р >0,05).
Сравнение сывороточного содержания исследуемых цитокинов, а также значений индекса OPG/RANKL у женщин с АИТ и гипотиреозом также продемонстрировало отсутствие достоверной разницы (р >0,05) между основными группами I и II по всем исследуемым показателям перед началом 12-месячного курса терапии (табл. 2). При этом пациентки с аутоиммунным поражением ЩЖ и снижением ее функции характеризовались статистически достоверным (р <0,001) повышением в сыворотке крови концентраций ИЛ-1β и ИЛ-23. При этом степень увеличения содержания вышеуказанных цитокинов была равнозначной в двух основных группах обследуемых.

Процедура ИГТ с использованием установки для гипокситерапии «БИО-НОВА-204» (Россия) проводилась пациенткам каждые 3 мес по 10 дней.
Перед началом процедуры ИГТ пациенткам выполняли пробу Штанге с целью определения продолжительности компонентов гипоксического цикла. В случае если продолжительность задержки дыхания составляла до 10 с, длительность одного гипоксического цикла составляла 2 мин, от 10 до 20 с – 3 мин, от 20 до 30 с – 4 минуты. Пациенткам с задержкой дыхания более чем на 30 с назначались 5-минутные циклы гипоксии.
После этого проводился трехступенчатый гипоксический тест, который включал на первой ступени дыхание в течение 5 мин газовой смесью с 16% насыщением кислородом, на второй – с 14% О2, а на третьей ступени, в случае удовлетворительной переносимости (сатурация кислорода выше 86%) – с 12% насыщением О2. Нормоксический интервал между вдыханием газовой смеси с различным содержанием О2 должен составлять не менее 10 мин. Если при дыхании газовой смесью на первой или второй ступени концентрация кислорода была ниже 86%, то следующая ступень не выполнялась.
В процессе проведения острого гипоксического теста осуществлялся анализ симптомов непереносимости гипоксии: внезапного появления одышки, учащения дыхательных движений до значений более 24/мин, возрастания частоты сердечных сокращений до значений более 129/мин, выраженного повышения или снижения артериального давления (АД) в пределах 30 мм рт.ст. по сравнению с показателем до процедуры, возникновения интенсивного гипергидроза, головокружения или рвоты. Указанные симптомы расценивались как непереносимость гипоксии, что служило критерием исключения из исследования.
В случае незначительного снижения АД продолжительность компонентов гипоксического цикла корректировалась в сторону уменьшения длительности дыхания гипоксической смесью, или же применялись так называемые облегченные сеансы гипокситерапии – дыхание газовой смесью с 13–15% содержанием О2.
В процессе вдыхания гипоксической смеси колебания оксигенации крови составляли от 85 до 80%, что соответствовало показателю оптимальной продолжительности компонентов цикла гипоксии. В период нормоксии (при дыхании атмосферным воздухом) значения сатурации возвращались к исходным значениям (95–100%).
Проведение лечебных сеансов гипокситерапии осуществлялось в циклично-фракционированном режиме с оптимальным режимом гипоксической стимуляции на формуле 5-5-5: один сеанс включал 5 повторных серий, состоящих из гипоксической экспозиции продолжительностью 5 мин и паузы нормобарической респирации длительностью также 5 мин.
При необходимости длительность непрерывного дыхания газовой смесью сокращали до 4, 3 и 2 мин (в зависимости от показателей пробы Штанге и острого гипоксического теста) с последующим постепенным увеличением длительности сеансов до 5 мин и снижением концентрации кислорода во вдыхаемой смеси до 12%.
Спустя 12 мес лечения под наблюдением осталось 109 женщин – 51 женщина основной группы I и 58 женщин основной группы II.
В процессе статистической обработки полученных результатов использовались электронные таблицы OpenOffice Calc и статистические пакеты программ MedStat и MedCalc V.20. Для всех исследованных показателей вычислялись значения медианы (Me) и первого–третьего квартилей (Q1; Q3). Для сравнения результатов обследования женщин основных групп до и после прохождения описанного выше курса лечения с результатами здоровых женщин использовался ранговый однофакторный анализ Крускала–Уоллиса. Если значение уровня значимости составляло <0,05, то проводились парные сравнения выборок с помощью критерия Данна. Для сравнения двух связанных выборок (начало и конец исследования) применялся T-критерий Вилкоксона. Оценка вариационных рядов на нормальность распределения результатов осуществлялась на этапе математической обработки количественных признаков с использованием критерия χ2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Как изолированная заместительная гормонотерапия, так и сочетание ее с гипокситерапией у женщин с АИТ и гипотиреозом не приводили к достоверным изменениям сывороточных концентраций OPG, RANKL и величины соотношения OPG/RANKL (табл. 3). Уровни указанных маркеров, не отличавшиеся (р >0,05) от аналогичных показателей группы условно здоровых женщин перед началом терапии, оставались на прежних значениях и по истечении 12 мес лечения (р >0,05). При этом показатели, зарегистрированные в двух вышеописанных основных группах, статистически значимо не различались и между собой (р >0,05).

В то же время заместительная гормонотерапия, как самостоятельно, так и в сочетании с гипокситерапией, обусловливала статистически значимое снижение (р <0,001) исходно увеличенной концентрации ИЛ-1β (рис. 1). Значения этого цитокина, зарегистрированные через 12 мес лечения в основных группах I и II, составили 1,8 (1,5; 2,3) и 1,8 (1,2; 2,1) пг/мл; при этом они достоверно не отличались друг от друга и от показателя у условно здоровых женщин (р >0,05).
Следует отметить, что независимо от использования ИГТ в терапии пациенток с АИТ и гипотиреозом также наблюдалась и динамика снижения (р <0,0001) исходно повышенных концентраций ИЛ-23 (рис. 2). При этом необходимо подчеркнуть, что в группе женщин, у которых заместительная гормонотерапия сочеталась с гипокситерапией, имело место снижение уровня этого маркера до показателя условно здоровых женщин – 19,2 (15,0; 25,5) пг/мл. В группе же лиц с аутоиммунным поражением ЩЖ, изолированно принимавших препарат левотироксина натрия, сывороточное содержание ИЛ-23 в конце исследования все еще статистически значимо превышало значение контрольной группы (р <0,01) –23,8 (18,2; 28,0) пг/мл.
Таким образом, согласно полученным нами результатам, как изолированная заместительная гормонотерапия, так и сочетание ее с гипокситерапией у женщин с АИТ и гипотиреозом не приводят к достоверным изменениям сывороточной концентрации OPG, RANKL и величины соотношения OPG/RANKL. В то же время заместительная гормонотерапия как самостоятельно, так и в сочетании с гипокситерапией обусловливает снижение исходно увеличенных концентраций ИЛ-1β и ИЛ-23. В результате пройденного лечения нормализация уровней ИЛ-1β наблюдалась в обеих основных группах, а ИЛ-23 – только у больных, получавших наряду с заместительной терапией сеансы ИГТ. При этом у пациентов основной группы I, которым не назначалась гипокситерапия, по истечении 12 мес концентрации ИЛ-23 оставались повышенными.
ИЛ-23 является цитокином из семейства ИЛ-12, который продуцируется макрофагами и дендритными клетками. Установлено, что ИЛ-23, стимулирующий выработку ИЛ-17, связан с развитием ряда аутоиммунных заболеваний человека. Повышенные его концентрации при тиреоидите Хашимото вызывают длительную и повышенную дифференцировку и пролиферацию Т-хелперов 17-го типа и усиление аутоиммунного воспаления [20]. При этом содержание ИЛ-23 в сыворотке выше у пациентов с более высокими уровнями ТТГ [21].
Следует добавить, что данные о влиянии интервальной гипокситерапии на сывороточную концентрацию ИЛ-23 в доступной литературе нами обнаружены не были. Установленный в нашем исследовании эффект от применения ИГТ в лечении АИТ и гипотиреоза, который заключался в снижение уровня ИЛ-23, по всей вероятности, опосредуется через стабилизацию HIF-1α. HIF представляет собой гетеродимерный фактор транскрипции, состоящий из кислородонестабильных α-субъединиц (HIF-1α, HIF-2α, HIF-3α) и конститутивно экспрессируемой β-субъединицы (HIF-1β) [22]. HIF-1β экспрессируется в ядре, и на его активность не влияет гипоксия, тогда как субъединица HIF-1α имеет короткий период полураспада (5 мин), и ее стабильность регулируется напряжением кислорода [23]. Внутриклеточный HIF-1α нестабилен в нормоксических условиях и быстро расщепляется ферментами пролилгидроксилазы [24]. Эти ферменты инактивируются при низком уровне кислорода, что объясняет, почему HIF-1α стабилизируется под воздействием гипоксии.
Согласно немногочисленным исследованиям, стабилизация HIF-1α в дендритных клетках сопровождается снижением синтеза ИЛ-23 [25]. Также показано, что нокаут HIF-1α в дендритных клетках влечет за собой усиление воспаления и повышение уровня провоспалительных цитокинов, таких как ИЛ-6 и ИЛ-23, а также снижение экспрессии ИЛ-10 и трансформирующего фактора роста бета (TGF-β) [26]. Указанные изменения цитокинового профиля ведут к нарушению индукции регуляторных Т-лимфоцитов, которые опосредуют иммуносупрессивный эффект для ряда субпопуляций T-лимфоцитов, ответственных за развитие аутоиммунного воспаления при АИТ.
ЗАКЛЮЧЕНИЕ
При обследовании 136 женщин с АИТ и гипотиреозом установлено, что 12-месячный курс лечения препаратом левотироксина натрия как в виде самостоятельной терапии, так и в комплексе с интервальной гипокситерапией сочетается с отсутствием изменений в продукции цитокинов OPG и RANKL. При этом вне зависимости от назначения гипокситерапии у женщин происходит снижение концентраций ИЛ-1β и ИЛ-23 (р <0,001). В результате у пациентов с АИТ и гипотиреозом отмечается нормализация концентраций ИЛ-1β как в группе женщин, получающих монотерапию левотироксином натрия, так и при лечении вышеуказанным препаратом в комплексе с сеансами ИГТ. Уровни же ИЛ-23 достигают контрольных значений только у больных, применяющих, наряду с заместительной терапией, сеансы ИГТ. Лицам с первично выявленным АИТ в сочетании с гипотиреозом, кроме индивидуально подобранной заместительной гормонотерапии, целесообразно рекомендовать сеансы нормобарической интервальной гипокситерапии по представленной выше схеме.



