Фибрилляция предсердий (ФП) является одним из наиболее часто встречающихся нарушений ритма сердца. В США и Европе частота данной формы аритмии выявлена соответственно у 2,2 и 4,5 млн жителей [1, 2], и предполагается, что к 2050 г. количество больных ФП удвоится или значительно возрастет в основном за счет старения населения [3].
Интересно отметить, что, с одной стороны, «повышение эффективности лечения сердечно-сосудистых заболеваний будет способствовать увеличению продолжительности жизни пациентов, а с другой, – повышению частоты ФП» [4].
ФП является независимым фактором риска развития инсульта, частота которого при наличии аритмии возрастает в 4–5 раз, в 3 раза увеличивает частоту сердечной недостаточности, на 10–25% повышает летальность и является наиболее частой причиной госпитализации больных [5], что существенным образом отражается на качестве их жизни. Эта проблема стала не только медицинской, но и социальной; прямые затраты на нее составляют ежегодно 7 млрд долларов США [6]. Некоторые исследователи сегодня рассматривают ФП как сердечно-сосудистую эпидемию [7].
Несмотря на то что известными факторами риска развития ФП являются заболевания сердечно-сосудистой системы, возраст, а также сахарный диабет 2 типа, некоторые больные не соответствуют ни одному критерию риска. Поэтому продолжаются исследования по выявлению новых возможных причин ФП, что позволит разработать и значительно улучшить профилактические меры. В частности, к новым факторам риска относят наследственность [8], метаболический синдром [9], ожирение [10], апноэ во время сна [11], интенсивную физическую нагрузку [12], высокий уровень витамина D [13]. Кроме того, была выявлена взаимосвязь между уровнем В-натрийуретического пептида, N-концевой части про-В-натрийуретического пептида и развитием ФП [14, 15]. Хотя данные в отношении возможной связи указанных факторов с ФП противоречивы, их все же следует учитывать при оценке каждого пациента.
B патогенезе ФП имеют значение два основных фактора – появление эктопического очага (чаще в устье легочных вен) и механизм повторного входа возбуждения, при этом в развитии ФП участвуют оба механизма, т.е. они сосуществуют, оказывая влияние друг на друга на разных этапах развития аритмии и способствуя ее прогрессированию. Изменения электрофизиологических свойств миокарда предсердий связаны с различными причинами, с такими, например, как заболевания сердца, внесердечные факторы, нерегулярный частый желудочковый ритм, естественное «старение сердца», которые приводят к структурным изменениям предсердий (ремоделирование), способствующим нарушению процессов возбуждения. В свою очередь, изменение электрофизиологических свойств предсердий способствует структурным изменениям и также ведет к ремоделированию. Таким образом, развитию ФП способствуют как нарушение электрофизиологических свойств, так и структурные изменения миокарда предсердий, и, по образному выражению M.C. Wijffels и соавт. [16], «ФП порождает ФП». Сохраняющийся процесс ремоделирования способствует прогрессированию ФП (становлению перманентной формы), изменению электрических свойств миокарда предсердий и, как следствие, изменению эффективности антиаритмических средств (ААС). Нужно отметить, что ремоделирование предсердий может происходить независимо от ремоделирования желудочков, что позволяет целенаправленно разрабатывать принципы терапии «вверх по течению» [17, 18].
Выявлены и другие факторы, способствующие развитию ФП, среди которых имеют значение активность ангиотензина II, транформирующего фактора роста-β1, митоген-активированных протеинкиназ, тромбоциторного фактора роста, матричных металлопротеиназ и др. [19–22].
Антиаритмические средства в лечении ФП
Несмотря на достижения интервенционной терапии, кардиохирургии и имеющиеся ограничения по применению ААС в лечении различных форм нарушений ритма сердца (невысокая эффективность, наличие побочных эффектов), все же эти препараты остаются неотъемлемой частью лечения больных ФП, независимо от принципа терапии «ритм–контроль» или «частота–контроль»[23].
Механизм действия ААС связан с их влиянием на функцию ионных каналов, что и обусловливает их антиаритмический эффект, приводя к подавлению аритмии. Однако изменяя функцию ионных каналов, ААС не оказывают влияния на другие возможные причины ФП, поэтому они не всегда оказывают желаемый эффект.
Для фармакологической кардиоверсии или поддержания нормосистолии при ФП используют ААС разных фармакологических групп. Согласно российским рекомендациям [24], а также согласованным рекомендациям, выработанным европейскими и американскими специалистами [2], для фармакологической кардиоверсии недавно возникшей ФП в качестве средств первого выбора следует использовать ибутилид, дофетилид, флекаинид, пропафенон, амиодарон, прокаинамид. Эффективность этих средств зависит от длительности аритмии: как правило, эффект выше в первые 7 дней от начала аритмии, вместе с тем следует отметить, что отечественный препарат нибентан (III класс ААС) способен восстанавливать синусовый ритм (СР) при ФП, сохраняющейся в течение нескольких месяцев и даже более года [25]. Однако ААС не всегда приводят к желаемому эффекту, а в некоторых случаях эти средства небезопасны. Так, в исследованиях CAST [26], SWORD [27], C. Lafuente и соавт [29] и др., а также в мета-анализе Coplen и соавт.[28] показано, что лекарственные средства 1С класса и хинидин с большей частотой по сравнению с плацебо повышали летальность вследствие развития желудочковых аритмий. Нередко вынужденная отмена амиодарона (III класс ААС, препарат, широко применяемый для предупреждения рецидивов ФП) связана с развитием серьезных побочных эффектов, что значительно ограничивает его применение [30, 31].
При наличии сердечной недостаточности соталол [27] и новый препарат дронедарон [32, 33] также повышали летальность больных. Кроме того, ААС могут вызывать выраженную гипотензию, что также существенным образом ограничивает их применение [34, 35]. Не предсказуемо и время восстановления СР после введения АРС, которое может быть достаточно длительным, особенно после приема препарата внутрь [36]. Однако, несмотря на то что медикаментозная кардиоверсия менее эффективна по сравнению с электрической [37], следует учитывать некоторые трудности, связанные с выполнением последней (требует проведения наркоза, применения седативных средств), что может удлинять сроки госпитализации, увеличивать затраты и ограничивать применение данного метода [2]. Это свидетельствует о необходимости разработки и внедрения в клиническую практику новых лекарственных средств, способных быстро и эффективно восстанавливать СР при ФП, которые могут стать хорошей альтернативой уже существующим методам, используемым для нормализации ритма сердца. Поэтому трудно согласиться с мнением Khaykin и Shamiss, считающих, что «медикаментозная терапия в отношении двух стратегий – «ритм–контроль» или «частота–контроль» – в равной степени неэффективна» [38].
При разработке новых ААС основное внимание уделяется вопросам безопасности (создание препаратов с меньшей проаритмической активностью) и эффективности, а также их способности предупреждать или вызывать обратное развитие ремоделирования, в частности, при ФП. Как указывалось выше, фармакологический эффект практически всех ААС связан с их влиянием на активность ионных каналов, плотность которых в миокарде предсердий и желудочков различна. Экспериментальные исследования показали, что в предсердиях и желудочках в формировании мембранного потенциала, в частности, в фазу реполяризации, участвуют разные ионные каналы [39]. Установлено, что в предсердиях за формирование реполяризации ответственны, как правило, калиевые каналы (IKur, Ito, IKAch), не оказывающие большого влияния на реполяризацию желудочков [40, 41]. Результаты этих исследований позволяют разрабатывать лекарственные средства, селективно ингибирующие предсердные калиевые каналы, не влияя на аналогичные каналы желудочков, что в значительной степени способствует повышению эффективности антиаритмической терапии наджелудочковых аритмий, в частности, ФП, и снижает риск развития проаритмического эффекта [42].
Одним из таких новых ААС является вернакалант (лекарственная форма – раствор для внутривенного введения).
Механизм действия и электрофизиологические эффекты вернакаланта
Механизм антиаритмического действия вернакаланта связан с селективным угнетением преимущественно предсердных потенциал-зависимых калиевых каналов, особенно каналов калиевого тока задержанного выпрямления (IКur) и каналов, активируемых ацетилхолином (КАсh). Это первый препарат подобного действия и, как отмечают J.W.M. Cheng и I. Rybak, «среди имеющихся в настоящее время антиаритмиков нет препаратов, селективно ингибирующих IКur» [43]. Данные калиевые каналы локализуются «исключительно или почти исключительно в предсердиях, поэтому их обозначают как предсердно-специфические каналы» [44]. Кроме того, вернакалант ингибирует частотно-зависимые и вольтажзависимые натриевые каналы, также локализованные в предсердиях. При низкой частоте сердечных сокращений (ЧСС) и негативном значении мембранного потенциала покоя вернакалант оказывает незначительное влияние на натриевые каналы. Вместе с тем при повышении ЧСС и изменении мембранного потенциала аффинность ВК к предсердным натриевым каналам возрастает [45]. Это сродство особенно выражено при ФП, т.к. при данной аритмии частота сокращений предсердий существенно выше частоты сокращений желудочков. Препарат удлиняет реполяризацию и тем самым увеличивает эффективный рефрактерный период предсердий, не оказывая существенного влияния на рефрактерный период желудочков и интервал QT, оказывает незначительное влияние на время восстановления синусового узла и внутрижелудочковую проводимость [46]. Проведенные экспериментальные исследования показали, что вернакалант удлиняет потенциал действия в значительно большей степени, чем ранолазин или соталол [47]. Более того, в эксперименте на волокнах Пуркинье кролика было показано, что вернакалант, ингибируя поздний натриевый ток в период реполяризации, может подавлять, подобно ранолазину, развитие проаритмического эффекта препаратов III класса, например, дофетилида [48].
Электрофизиологические эффекты ВК были изучены у 10 здоровых добровольцев, которым вводили препарат внутривенно в дозе 2 мг/кг в течение 10 мин с последующим введением в течение 35 мин в дозе 0,5 мг/кг/ч [49]. Препарат удлинял рефрактерный период предсердий и замедлял проводимость в области АВ-соединения, при этом рефрактерность желудочков не изменялась. В другом исследовании у 19 больных аритмиями изучали электрофизиологические эффекты вернакаланта, дозы которого составляли 2 или 4 мг/кг внутривенно, затем 0,5 или 1 мг/кг/ч в течение 35 мин [46]. Как и в предыдущем исследовании, вернакалант удлинял эффективный рефрактерный период предсердий и не оказывал влияния на рефрактерность желудочков. Вместе с тем, вернакалант существенно удлинял у больных рефрактерность области АВ-соединения. Замедление проводимости в предсердиях, области АВ-соединения и на уровне системы Гиса–Пуркинье наблюдали только при введении большой дозы вернакаланта, однако этот феномен не достигал статистически значимого уровня.
Фармакокинетический профиль и фармакодинамические эффекты вернакаланта
Фармакокинетика различных доз вернакаланта изучена как у здоровых добровольцев, так и больных ФП или трепетанием предсердий (ТП). В рамках I фазы клинических исследований фармакокинетика вернакаланта определялась у 29 здоровых волонтеров [50]. Исследование выполнено простым слепым плацебо-контролируемым методом (использовали физиологический раствор), дозы препарата составляли 0,1–5 мг/кг, которые вводили внутривенно в течение 10 мин. Максимальная концентрация вернакаланта в плазме возрастала линейно в зависимости от дозы и колебалась от 0,08 до 4 мкг/мл, однако площадь под кривой концентрации при использовании разных доз изменялась незначительно, что являлось следствием одинакового периода полувыведения – 2 ч.
Mao и соавт. изучили фармакокинетику вернакаланта у 128 больных ФП или ТП [51]. У 20% больных в анамнезе имелась хроническая сердечная недостаточность, у 37% пациентов выявлена легкая почечная недостаточность, у 12% – выраженная (клиренс креатинина 50–79 и 30–49 мл/мин соответственно). Вернакалант вводили внутривенно в начальной дозе 3 мг/кг в течение 10 мин, если через 15 мин СР не восстанавливался, то повторно вводили вернакалант в дозе 2 мг/кг. Начальный период полувыведения (Т1/2α) составил 3–6 мин, максимальная концентрация вернакаланта в плазме, площадь под кривой концентрации и терминальный период полувыведения (Т1/2β) составили соответственно для мужчин – 3,29 мкг/мл, 11,64 мкг × ч/мл и 3,1 ч, для женщин – 4,57 мкг/мл, 11,64 мкг × ч/ мл и 2,9 ч. Как показали результаты исследования, экскретируется вернакалант через почки и печень (почечный и печеночный клиренс раздельно не определялись).
В другом мультицентровом рандомизированном двойном слепом исследовании фармакокинетика вернакаланта изучалась у 56 больных ФП, длительность которой составляла от 3 до 72 ч [52]. В зависимости от применяемой дозы больные были распределены на две группы: 1-ю группу составили пациенты, которым вводили препарат в дозе 3 мг/кг внутривенно в течение 10 мин, в последующем, если СР не восстанавливался, дополнительно вводили 2 мг/кг в течение 15 мин; 2-й группе больных вводили 1 мг/кг, затем 0,5 мг/кг в случае невосстановления СР. Пиковая плазменная концентрация вернакаланта в 1-й группе составляла в среднем 5,8 мкг/мл, во 2-й группе – 1,9 мкг/мл. Т1/2β в среднем составлял 3,1 ч с колебаниями 1,7–5,4 ч. Таким образом, в исследованиях фармакокинетики установлено, что концентрация вернакаланта в плазме крови зависит от применяемой дозы.
В метаболизме вернакаланта участвует в основном изофермент CYP2D6 с образованием неактивного метаболита [53]. В табл. 1 представлены параметры фармакокинетики вернакаланта.
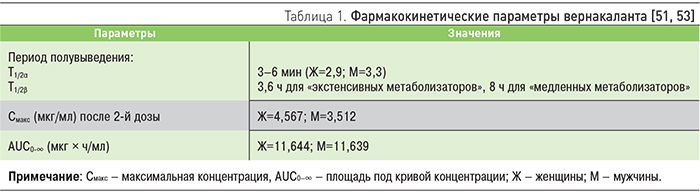
На основании проведенных исследований сделан вывод, что вариабельность фармакокинетики вернакаланта в основном зависит от пола, тогда как возраст, нарушение почечной или печеночной функции, наличие сердечной недостаточности, сопутствующее лечение β-адреноблокаторами не оказывают существенного влияния на фармакокинетический профиль препарата. Вместе с тем период полувыведения и объем распределения вернакаланта в значительной степени зависят от активности изофермента CYP2D6 – у лиц с его высокой активностью («экстенсивные метаболизаторы») значения этих показателей существенно меньше по сравнению с лицами, у которых выявляется низкая активность изофермента («медленные метаболизаторы»).
Вернакалант оказывал очень слабое влияния на активность изоферментов цитохрома Р450 – 1А2, 2С9, 2С19, 2Е1 и 3А4 [53]. Результаты исследований фармакодинамики вернакаланта показали, что препарат, независимо от дозы, не изменял артериальное давление и ЧСС, однако приводил к изменению показателей ЭКГ, особенно в высоких дозах, что выражалось в удлинении интервала PR (на 23 мс после введения 4 мг/кг и на 28 мс после 5 мг/кг) и QT (на 48 мс при введении 4 мг/ кг и на 63±10 мс в конце инфузии 5 мг/кг), уширении QRS (максимально на 11 мс) [53]. В другом исследовании показано, что восстановление до исходного значения интервала QTс, удлиненного на фоне введения вернакаланта в дозе 3 мг/ кг, наступало после окончания инфузии к 6-му часу у «экстенсивных метаболизаторов» и к 12-му часу – у «медленных метаболизаторов». При использовании 3 мг/кг с последующим введением 2 мг/кг восстановление исходного значения интервала QTc у этих групп пациентов наступало к 12-му и 24-му часу соответственно [53]. Т.к. в обычной клинической практике не проводятся исследования, отражающие активность изофермента CYP2D6, рекомендовано мониторировать ЭКГ на протяжении 12 ч. Вместе с тем, как отмечает D. Fedida, изменения ЭКГ были выявлены не во всех исследованиях [45].
При проведении исследований по оценке взаимодействия вернакаланта с другими лекарственными средствами (β-адреноблокаторами, антагонистами кальция и ингибиторами изофермента CYP2D6) не выявлено изменений параметров фармакокинетики препарата [52]. Т.к. связь вернакаланта с белками незначительна, то не ожидается конкурентного взаимодействия с лекарственными средствами (амиодарон, варфарин, пропранолол, дилтиазем, верапамил), у которых подобная связь значительна.
При сочетанном применении вернакаланта с другими ААС I, III классов или дигоксином не наблюдали различий в частоте восстановления СР при данных комбинациях и при монотерапии вернакалантом [54].
Клинические исследования
Антиаритмическая активность вернакаланта изучена на разных этапах дорегистрационных клинических исследований, первым из которых стало мультицентровое рандомизированное исследование CRAFT, выполненное двойным слепым плацебо-контролируемым методом с наращиванием дозы у 56 больных ФП (впервые возникшей или при очередном пароксизме) длительностью от 3 до 72 ч [55]. В зависимости от применяемой дозы выделены три группы больных. 1-ю группу составили пациенты, которым вернакалант вводили внутривенно в виде инфузий в дозе 0,5 мг/кг, если через 30 мин СР не восстанавливался, то дополнительно вводили препарат в дозе 1 мг/кг; пациентам 2-й группы вначале вводили 2 мг/кг и при отсутствии восстановления СР через 30 мин дополнительно вводили 3 мг/кг; больные 3-й группы получали плацебо. Каждую дозу вводили в течение 10 мин. С целью контроля за ЧСС, который проводился до включения больных в исследование, допускался прием β-адреноблокаторов, антагонистов кальция или дигоксина; прием ААС I или III классов до включения в исследования служил критерием исключения, вместе с тем, прием этих препаратов допускался при необходимости через 12 ч после применения вернакаланта. Первичной конечной точкой эффективности вернакаланта было восстановление СР в течение введения препарата или 30 мин после окончания инфузии последней дозы. Результаты исследования показали, что восстановление СР к 30-й минуте после окончания инфузии отмечали в 56% случаев во 2-й группе (10 из 18 пациентов), в 11% – в 1-й группе (2 из 18) и у 5% – в 3-й группе (1 из 20). Через 24 ч после окончания инфузии СР сохранялся у 79% больных 2-й группы (11 из 14 пациентов), у 56% – 1-й группы (5 из 9) и у 45% – 3-й группы (5 из 11). Время восстановления СР у больных 2-й группы составляло в среднем 14, в 1-й – 166, в 3-й – 162 мин. Сделан вывод, что вернакалант в дозе 2 мг/кг + 3 мг/кг оказывает более выраженный эффект в отношении восстановления СР при недавно возникшей ФП по сравнению с меньшей дозой – 0,5 + 1 мг/кг. Препарат не вызывал гемодинамических нарушений и изменений ЭКГ, ни в одном случае не регистрировали проаритмического эффекта вернакаланта.
В рамках программы АСТ (The Atrial Arrhythmia Conversion Trials) III фазы испытаний выполнено 4 клинических исследования АСТ 1–4 по оценке эффективности и безопасности вернакаланта. Как и в предыдущем исследовании, задачей исследования АСТ 1 была сравнительная оценка эффективности и безопасности вернакаланта и плацебо у 336 больных ФП при разной длительности аритмии [54]. В зависимости от этого были выделены две группы больных: 1-ю группу составили 220 пациентов с длительностью аритмии от 3 ч до 7 дней, 2-ю группу (116 больных) – от 8 до 45 дней (в этой группе чаще отмечали сопутствующие заболевания – ИБС, перенесенный инфаркт миокарда, сахарный диабет и сердечную недостаточность). Вернакалант вводил внутривенно в начальной дозе 3 мг/кг в течение 10 мин, затем, если СР не восстанавливался через 15 мин, вводили 2 мг/кг дополнительно. За 2 ч до исследования отменяли β-адреноблокаторы, антагонисты кальция и дигоксин и за 24 ч отменяли ААС I или III классов. Первичной конечной точкой оценки эффективности было восстановление и сохранение CР продолжительностью не менее 1 мин, которые регистрировали в течение 90 мин после начала введения вернакаланта. Вторичными точками оценки эффективности являлись время восстановления СР у больных 1-й группы; количество больных этой группы, у которых СР сохранялся на протяжении 24 ч, и количество больных 2-й группы, у которых восстанавливался СР. Купирование аритмии в течение 90 мин от начала введения вернакаланта отмечали у 75 из 145 больных 1-й группы (52%) и у 3 из 75 пациентов после плацебо (4%). У 57 из 75 пациентов (76%) СР восстанавливался после 1-й дозы вернакаланта. Восстановление СР наступало у больных 1-й группы в среднем через 11 мин после начала введения препарата. Через 24 ч после введения вернакаланта у 1 из 75 больных вновь возник пароксизм ФП. Во 2-й группе восстановление СР регистрировали у 6 из 76 больных (8%), оно не происходило ни у одного из 40 пациентов, получавших плацебо. В целом по группам больных, которым вводили вернакалант, ритм нормализовался у 83 из 221 пациента (38%) и только у 3 из 115 больных (3%) на фоне плацебо.
Другое исследование – АСТ III, дизайн которого был подобен исследованию АСТ I, выполнено у 276 пациентов с ФП (сформированы такие же группы больных и использованы аналогичные дозы вернакаланта) [53]. Восстановление СР у больных 1-й группы (длительность ФП 3 ч – 7 дней) отмечали у 44 из 86 пациентов (51%, время восстановления в среднем 8 мин), после плацебо – у 3 из 84 больных (4%). При длительности аритмии от 8 до 45 дней (2-я группа) восстановление СР регистрировали у 3 из 32 пациентов (9%) и у 1 из 37 после плацебо. В это исследование были включены 23 больных ТП, при этом только у 1 из 14 (7%) отмечали восстановление СР, ни в одном случае из 9 этого не происходило на фоне плацебо.
Эффективность вернакаланта подтверждена в исследовании АСТ IV, включавшем 236 больных ФП, из которых у 167 пациентов длительность аритмии составляла от 3 ч до 7 дней [53]. Как и в предыдущих исследованиях, использовался известный режим дозирования – 3 мг/кг, затем при необходимости 2 мг/кг. После введения препарата СР восстанавливался у 85 больных (51%).
Нередко ФП возникает после кардиохирургических операций, при этом по некоторым данным у 40% больных аритмия развивается после аортокоронарного шунтирования или после операций на клапанах сердца и у 60% – после одновременного выполнения этих операций [56, 57]. В связи с этим P.R. Kowey и соавт. оценили способность вернакаланта восстанавливать СР у 161 пациента в возрасте от 18 до 76 лет (107 больных получали вернакалант, 54 – плацебо) после операций на сердце – аортокоронарном шунтировании (108 больных, 67%), на клапанном аппарате (39 больных, 24%) или при одновременном выполнении указанных операций (14 больных, 9%) [58]. Исследование было двойным слепым рандомизированным плацебо-контролируемым и проводилось в 43 центрах – в Канаде, США, Дании, Италии, Польше, Аргентине и Индии. У всех пациентов наджелудочковые нарушения ритма – ФП (150) или ТП (9) – выявляли через сутки или на 7-й день после операции. В исследование не включали больных, у которых регистрировали некоррегированный QT более 500 мс, интервал QRS более 140 мс, брадиаритмию (ЧСС менее 45 в мин), наличие в анамнезе желудочковой тахикардии типа «пирует», застойной сердечной недостаточности IV класса (NYHA), выраженной печеночной или почечной недостаточности, гипертиреоидизма, эмболии легочной артерии, нарушения электролитного баланса; а также пациентов, которые в предыдущие 3 мес, получали внутрь амиодарон или в течение последних суток до операции амиодарон внутривенно. Вернакалант вводили внутривенно, в начальной дозе 3 мг/кг в течение 10 мин; если через 15 мин СР не восстанавливался, то повторно вводили вернакалант в дозе 2 мг/кг в течение 10 мин. Первичной конечной точкой эффективности было восстановление СР в течение 90 мин после введения препаратов при сохранении, по крайней мере, в течение 1 мин после первой дозы вернакаланта, этих больных расценивали как «респондеров»; вторичными точками были время восстановления СР среди «респондеров», а также процент «респондеров» с ФП или ТП. Восстановление СР после первого введения вернакаланта регистрировали у 48 (44,9%) и у 8 из 54 больных после плацебо (14,8 %). При ФП восстановление СР отмечали у 47 из 100 больных (47%; время восстановления составляло в среднем 12,4 мин), при этом у большинства пациентов (36, 75%) восстановление СР наблюдалось после первой дозы. При введении плацебо восстановление СР регистрировали у 7 из 50 больных (14%). При ТП на фоне введения вернакаланта восстановление СР не наблюдали ни в одном случае (6 пациентов), тогда как после плацебо СР восстановился у 1 из 4 больных.
Таким образом, проведенное исследование показало, что эффективность вернакаланта в плане восстановления СР у больных после операций на сердце составила 47%, тогда как у плацебо – 14%. Вернакалант быстро восстанавливал нормальный ритм, время (в среднем за 12 мин), при этом 75% пациентов достаточно было одной дозы препарата. Авторы подчеркивают, что с учетом небольшого количества больных ТП, окончательный вывод в отношении эффективности вернакаланта при данной форме предсердной аритмии сделать трудно, вместе с тем, при ФП вернакалант является эффективным и безопасным ААС, способствующим восстановлению СР в кардиохирургии.
Побочные эффекты
При анализе результатов клинических исследований были выявлены следующие побочные эффекты вернакаланта [43, 53]: нарушение вкуса (20,4–21,1%), чихание (13,6–15,0%), парестезии (8,8–9,5%), тошнота (6,5–6,8%), гипотония (5,8%), зуд (3,5), головная боль (4,9%), головокружение (4,6%), гипергидроз (3,6%), кашель (4,1%), слабость (3,2%), ощущение жара (3,0%), брадикардия (3,3%, чаще в течение первых 2 ч от начала инфузии), ТП (2,1%), раздражение слизистой оболочки носа (1,9%), рвота (1,7%), одышка (1,7%).
Среди серьезных побочных явлений отмечали рецидивы пароксизмов ФП, что требовало госпитализации, гипотензию и полную атриовентрикулярную блокаду, которые расценивали как возможные или вероятные следствия применения вернакаланта [54]. Неустойчивая желудочковая тахикардия (от 3 до 12 желудочковых комплексов) редко возникала в первые 2 ч от момента введения вернакаланта. В отдельных случаях зарегистрирована желудочковая тахикардия типа «пирует» (хотя трудно связать ее развитие с введением вернакаланта). Однако в целом исследователи указывают на хорошую переносимость вернакаланта.
Заключение
Оценивая результаты многочисленных клинических исследований, можно заключить, что новый препарат вернакалант является эффективным и безопасным средством в купировании ФП, длительность которой составляет от 3 ч до 7 дней. Начальная доза препарата составляет 3 мг/кг и вводится внутривенно в течение 10 мин, при отсутствии эффекта через 15 мин возможно повторное введение в дозе 2 мг/кг. Однако вероятность восстановления CР при отсутствии эффекта от первой дозы существенно снижается. При более длительном периоде ФП или при ТП эффективность препарата крайне незначительна. Хороший клинический эффект вернакалант оказывает и при ФП, возникшей после кардиохирургических вмешательств, однако при развитии ТП препарат в этих условиях также малоэффективен. Эффективность вернакаланта сохраняется у пациентов с сопутствующими заболеваниями – ИБС, артериальной гипертензией, нарушениями печеночной функции. Следует отметить, что у больных старше 75 лет с сердечной или почечной недостаточностью эффект менее выражен.
Способность вернакаланта вызывать желудочковые аритмии (фибрилляцию желудочков, желудочковую тахикардию типа «пирует»), по-видимому, минимальна. Следует учитывать возможность развития гипотензии при введении вернакаланта, особенно у больных с симптоматической левожелудочковой недостаточностью. В связи с этим вернакалант противопоказан больным с артериальной гипотензией (систолическое АД ≤100 мм рт. ст.), недавно перенесенным острым коронарным синдромом (в пределах 30 дней), острым инфарктом миокарда, застойной сердечной недостаточностью III или IV класса (NYHA), выраженным аортальным стенозом и удлиненным интервалом QT (0,440 мс, некоррегированный). Несмотря на то что при ФП прямых сравнительных исследований, в которых оценивалась антиаритмическая активность различных ААС и вернакаланта, не проводилось, имеющиеся отдельные данные свидетельствуют о более высокой эффективности последнего по сравнению с ибутилидом и амиодароном.
Учитывая хороший эффект вернакаланта при внутривенном ведении, разработана новая лекарственная форма препарата для приема внутрь с целью профилактики пароксизмов ФП, эффективность которой оценивается в настоящее время в клинических исследованиях.



