Гиперкалорийность и избыток простых сахаров – характерная черта современного массового питания, стимулирующего развитие разнообразных метаболических нарушений. Хроническое повышение концентрации глюкозы в крови на фоне гиподинамии и хронического воспаления приводит к развитию ожирения, стеатогепатита, сердечно-сосудистой патологии, сахарного диабета и др.
Метаболический синдром (МС; 277.7 по МКБ- 9, E88.81 по МКБ-10) сопряжен с увеличением массы висцерального жира, формированием проатерогенного липидного профиля крови, артериальной гипертензией и снижением чувствительности клеток к инсулину. По критериям Международной федерации по диабету (2006), МС диагностируется при наличии центрального ожирения (определяемого по окружности талии, табулированной в соответствии с этнической группой, или индексу массы тела >30 кг/м2) и любых двух из нижеперечисленных признаков:
- уровня триглицеридов >150 мг/дл (1,7 ммоль/л);
- уровня холестерина липопротеидов высокой плотности (ЛПВП) <40 мг/дл (1,03 ммоль/л) у мужчин и <50 мг/дл (1,29 ммоль/л) у женщин;
- повышенного артериального давления (АД): систолического >130 или диастолического >85 мм рт. ст.;
- гипергликемии >100 мг/дл (5,6 ммоль/л).
Таким образом, МС представляет собой своеобразный «кластер» нарушений обмена веществ, которые связаны, прежде всего, с нарушениями метаболизма жировой ткани. Наряду с нарушением толерантности к глюкозе и резистентностью к инсулину наличие МС у пациента характеризуется повышенным АД, центральным ожирением и атерогенной дислипидемией. Эти патологические явления, в свою очередь, связаны с жировой инфильтрацией и дисфункцией печени, нарушениями распределения макро- и микроэлементов в организме (например, накоплением железа в печени), наличием хронического воспаления, повышенной свертываемостью крови, снижением антиоксидантного ресурса организма.
Отметим, что перечисленные выше патофизиологические процессы также являются неотъемлемыми составляющими процесса патологического старения. Поэтому использование геропротекторных препаратов может являться эффективным методом терапии МС, а противодействие развитию МС немедикаментозными методами (нормализация двигательного режима, макро- и микронутриентного состава диеты) будет тормозить процессы старения.
Препарат Лаеннек, изготовляемый на основе высокоочищенного гидролизата плаценты человека (ГПЧ), является перспективным геропротекторным препаратом, осуществляющим гепатопротекцию, иммунокоррекцию и регенерацию поврежденных тканей [1]. ГПЧ в составе Лаеннека оказывает воздействие на маркеры старения in vitro (накопления β-галактозидазы в фибробластах человека) и in vivo (гистоморфологические проявления регенерации тканей кожи, печени и других органов). В частности, Лаеннек способствует снижению воспалительно-клеточной инфильтрации, жировой инфильтрации, накопления билирубина в клетках печени, почек и миокарда [2]. Геропротекторные свойства Лаеннека были подтверждены в экспериментах на модельном организме Caenorhabditis elegans: в условиях теплового, токсического и оксидантного стресса Лаеннек увеличивал продолжительность жизни популяции C. elegans в 1,5–2 раза [3].
Экспериментальные и клинические исследования демонстрируют перспективность использования Лаеннека для восстановления паренхимы и детоксикационной активности печени [4]. Внутривенное введение ГПЧ вызывает активную регенерацию клеток печени и способствует улучшению функционального состояния печени в соответствии с динамикой таких маркеров, как аланинаминотрансфераза, щелочная фосфатаза, γ-глутамилтраспептидаза и билирубин [5]. Внутривенное или внутримышечное введение препарата Лаеннек увеличивает скорость регенерации печени после частичной гепатэктомии и ее химического поражения тетрахлоруглеродом, парацетамолом или алкоголем. Внутривенное введение Лаеннека позволило минимизировать патологические изменения печени (некроз гепатоцитов, жировую инфильтрацию) [6, 7]. Гепатопротекторное действие препарата сопровождается нормализацией гомеостаза железа – происходит уменьшение гемосидероза, т.е. отложений железа в ткани печени [8].
Разносторонние клинические эффекты Лаеннека являются следствием сложнейшего молекулярного состава этого препарата. В составе плаценты найдено более 4000 различных белков, включая различные факторы роста, цитохромы, факторы фибринолиза, ферменты энергетического метаболизма, многие из которых входят в состав ГПЧ препарата Лаеннек. В настоящей работе представлены результаты анализа пептидного состава препарата Лаеннек с точки зрения молекулярных механизмов его действия, способствующих торможению патофизиологических механизмов развития МС.

РЕЗУЛЬТАТЫ ИЗУЧЕНИЯ ПЕПТИДНОГО СОСТАВА ПРЕПАРАТА ЛАЕННЕК
Геропротекторный, регенеративный, противовоспалительный и другие эффекты ГПЧ обусловлены его пептидными компонентами. В частности, в составе препарата Лаеннек были обнаружены дипептид JBP485 (цитопротекция, противовоспалительное действие), биологически активный пептид нейромедина N (активирует внутриклеточные пути выживания клетки), пептидные фрагменты (такие как пептид SRLL) инсулиноподобных факторов роста (ИФР) и др. [9].
Количественное определение в составе Лаеннека различных пептидов методом иммуноферментного анализа ELISA обнаружило в нем значительное содержание ИФР-1 (4100 пг/ мл), лептина (1200 пг/мл), трансформирующего фактора роста β1 (500 пг/мл), фактора роста гепатоцитов (130 мг/мл) и следовых количеств ряда других ростовых факторов [8, 9].
Из представленного выше краткого анализа патофизиологии МС следует, что противодействие формированию МС должно осуществляться путем нормализации метаболизма жировой ткани посредством: 1) повышения выживаемости клеток (цитопротекция), 2) восстановления чувствительности клеток к глюкозе и устранения инсулинорезистентности, 3) снижения повышенного АД, 4) устранения дислипидемии, 5) снижения жировой инфильтрации и восстановления функции печени, 6) противовоспалительного, 7) антитромботического и 8) антиоксидантного действия. Рассмотрим результаты анализа пептидного состава Лаеннека по отношению к профилактике и терапии МС.
Пептиды в составе Лаеннека, обнаруженные посредством масс-спектрометрического de novo секвенирования
Согласно опубликованным ранее результатам масс-спектрометрического анализа пептидного состава Лаеннека, в нем было обнаружено более 10 000 пептидных фрагментов [9]. С использованием стандартного программного обеспечения (программный пакет и сервер MASCOT) было возможным установление аминокислотных последовательностей всего лишь 47 пептидов.
Для получения более подробной информации об аминокислотных последовательностях пептидов Лаеннека (в отношении которых в работе [9] были определены только масса, заряд и время хроматографического удержания пептида) нами был разработан комплекс программ DNVSEQP для проведения de novo секвенирования пептидов аминокислотных последовательностей на основании масс-спектрометрических данных. Эти программы основаны на применении метрического анализа данных [10] и теории классификации значений признаков [11] к задачам идентификации аминокислотных последовательностей.

С использованием разработанного программного обеспечения стало возможным определение около 5200 (т.е. более половины) аминокислотных последовательностей пептидов в составе Лаеннека и их идентификация с использованием базы данных UNIPROT и других баз данных протеома человека. Идентификация этих пептидов позволяет в значительной мере уточнить механизмы молекулярного действия Лаеннека.
В частности, посредством автоматизированного анализа аннотаций белков протеома, которые соответствуют 5200 пептидам, определенным в результате de novo секвенирования, в составе препарата Лаеннек были идентифицированы функционально активные пептидные фрагменты, которые могут способствовать профилактике и терапии ожирения и МС (табл. 1).
Функциональная активность пептидов, найденных методом масс-спектрометрического анализа «легкой» (до 1200 Да) пептидной фракции препарата, была установлена посредством биоинформационного анализа аннотаций аминокислотных последовательностей белков протеома человека, представленного в табл. 2.
Например, пептид GSLLGA, найденный в составе Лаеннека, соответствует аминокислотным остаткам 149-165 биологически активного пептида орфанина-FQ2, который модулирует ноцицептивное и локомоторное поведение, участвует в дифференцировке и развитии клеток, проявляя цитопротекторный и анальгетический эффекты.
Многие из пептидов, перечисленных в табл. 1, 2, могут ингибировать специфические таргетные белки протеома человека. Пептид LAGSGPAG, соответствующий аминокислотным остаткам 1005-1011 ингибитора тирозинкиназы BTK (Bruton tyrosine kinase), расположен в непосредственной близости от сайта фосфорилирования BTK (фосфосерин-1004) [12]. Данный пептид не содержит серина в позиции, соответствующей фосфосерину-1004, и поэтому может являться ингибитором активности BTK. Ингибирование этого фермента пептидом, содержащимся в Лаеннеке, вызывает противовоспалительный эффект за счет снижения активности провоспалительного фактора транскрипции NF-κB. Напомним, что избыточная активация NF-κB – неотъемлемая часть патофизиологии хронического воспаления, клеточного старения и ожирения [13].
Сходным образом действуют пептид VGPLGPLGPAG (ингибирующий тирозинкиназы CSK и TNK2 [14, 15] и оказывающий иммуномодулирующий эффект) и спиралеобразный пептид DLGLPGAPGAP (ингибирует сигнальный белок MAPKAPK2 [16], оказывая противовоспалительный эффект [17], спираль 273-278 в PDB файле 3V98).
Особо следует выделить пептид QLLGLLG, соответствующий аминокислотным остаткам 904-909 фактора транскрипции NF-κB. В позиции 903 его аминокислотной последовательности, т.е. непосредственно перед данным пептидом, расположен сайт фосфорилирования (фосфосерин-903) киназы гликогенсинтетазы 3β (GSK3β) [18, 19]. Данный пептид, не содержащий серина, является потенциальным ингибитором GSK3β.
Ингибиторы GSK3β исследуются в процессе поиска терапевтических средств и проявляют антидиабетические, противовоспалительные, гепатопротекторные и многие другие свойства. GSK3β фосфорилирует более 40 белков, среди которых β-катенин, аксины (модулируют взаимодействия β-катенина [20]), сигнальные белки MAP1B, CREB, MAP2, транскрипционный фактор AP-1 (Jun), NCAM, протеинкиназа А, фактор ответа на гипоксию HIF-1, HSF-1, тау-белок, субстрат рецептора инсулина IRS1, основной белок миелина, фактор роста нервов NGF, рецептор провоспалительного фактора транскрипции NF-κВ (p65 и p105), сигнальный белок Notch [21]. GSK3B также подавляет активацию рецептора андрогенов [22].
При инактивации GSK3β происходит ингибирование сигнального белка SMAD3 [23], отмечается снижение экспрессии провоспалительного фактора транскрипции NF-κВ, фермента биосинтеза провоспалительных простагландинов циклооксигеназы-2 в ЦНС [24] и др. GSK3β – негативный регулятор каскада Wnt, который необходим для регенерации тканей, так что ингибирование GSK3β способствует активации каскада Wnt.
 Соответственно пептид QLLGLLG, найденный в составе препарата Лаеннек, может проявлять антидиабетический, противоопухолевый, противовоспалительный эффекты за счет ингибирования GSK3β [25]. В частности, гепатопротекторный эффект данного пептид может осуществляться посредством активации сигнального каскада Wnt, который стимулирует дифференциацию адипозных стволовых клеток в гепатоциты, что усиливает регенерацию печени [27].
Соответственно пептид QLLGLLG, найденный в составе препарата Лаеннек, может проявлять антидиабетический, противоопухолевый, противовоспалительный эффекты за счет ингибирования GSK3β [25]. В частности, гепатопротекторный эффект данного пептид может осуществляться посредством активации сигнального каскада Wnt, который стимулирует дифференциацию адипозных стволовых клеток в гепатоциты, что усиливает регенерацию печени [27].
Пептид JBP485
В эксперименте показано, что найденный в составе Лаеннека пептид JBP485 принципиально важен для выживания клеток, значительно усиливая их деление и миграцию. В частности, пептид JBP485 ускоряет заживление повреждений эпителия, не вызывая при этом избыточного воспаления и неоваскуляризации [28]. Несмотря на выраженный цитопротекторный эффект пептида JBP485 в составе Лаеннека, точные молекулярные механизмы его действия до сих пор не установлены.
Тем не менее известно, что пептид JBP485 повышает экспрессию белков белков-транспортеров органических анионов (OAT1, OAT3), которые необходимы для транспорта внутрь клеток короткоцепочечных органических кислот (глутаровой, кетоглутаровой и др.), которые участвуют в цикле Кребса и синтезе АТФ, а также необходимы для выведения токсических веществ почками [29].
Действие пептида JBP485, кроме того, связано с антиапоптотическим эффектом: под его влиянием снижались уровень и активность каспазы-3 – фермента-активатора апоптоза клеток [30], уменьшалась фрагментация ДНК, увеличивался уровень экспрессии гена антиапоптотического белка bcl-2 на фоне снижения экспрессии гена проапоптотического белка bax [31]. Возможные молекулярные механизмы действия данного пептида могут быть установлены посредством хемореактомного анализа структуры молекулы JBP485 с использованием новейших методов хемоинформатики.
ИФР-1 как основное действующее начало Лаеннека
Иммуноферментный анализ показал, что в составе Лаеннека содержатся значительные количества ИФР-1 (4100 пг/мл). ИФР-1 (соматомедин С) осуществляет эндокринную, аутокринную и паракринную регуляцию процессов роста, развития и дифференцировки клеток и тканей организма. Он продуцируется гепатоцитами в ответ на стимуляцию их соматотропиновых рецепторов и способствует реализации физиологических эффектов соматотропного гормона. Уровень ИФР-1 в крови зависит от действия на печень не только соматотропного гормона, но и половых стероидов и тиреоидных гормонов, глюкокортикоидов и инсулина. ИФР-1 синергичен с инсулином и соматотропином по отношению к процессам роста и развития тканей.
ИФР-1 связывается с одноименным рецептором, который был обнаружен во многих тканях. При связывании ИФР-1 тирозинкиназный домен его рецептора активируется и, в свою очередь, инициирует передачу внутриклеточного сигнала по каскаду AKT, стимулирующему рост и воспроизводство тканей, в частности, скелетных мышц, соединительной ткани, печени, почек, нервов, кожи и легких.
Печень является основным источником циркулирующего в крови ИФР-1, уровни которого уменьшаются при циррозе печени. Снижение содержания ИФР-1 отмечено в сыворотке крови пациентов с хроническими заболеваниями печени [32]. Показано, что ИФР-1 стимулирует процессы регенерации печени. Введение в печень активного гена ИФР-1 посредством вирусного вектора уменьшает повреждение печени и тормозит развитие фибротических поражений на моделях ее цирроза [33]. В модели цирроза, индуцированного четыреххлористым углеродом, повышение уровней экспрессии гена ИФР-1 у трансгенных животных вызывает фибролиз и регенерацию печени. В моделях цирроза рецептор ИФР-1 преимущественно экспрессировался на фиброзных перегородках, окружающих нодулы (узелки) печени. Под воздействием ИФР-1 отмечено улучшение функции печени, понижение степени фиброза и уровней профиброгенных молекул трансформирующего фактора роста β, тромбоцитарного фактора роста, факторов роста соединительной ткани и эндотелия сосудов; отмечено повышение экспрессии антифиброгенного и цитопротекторного фактора роста гепатоцитов [34].

ИФР-1 значительно увеличивал уровни альбумина и фактора роста гепатоцитов в сыворотке крови. На фоне его совместного использования с препаратами интерферона отмечено улучшение функции печени, снижение печеночного перекисного окисления липидов и степени фиброза [35]. Повышение экспрессии гена ИФР-1 в активированных звездчатых клетках печени ослабляет фиброз и увеличивает скорость регенерации печени после повреждения.
В эксперименте ИФР-1 стимулирует эритропоэз [36], что способствует более активному выведению железа из печени [37]. Он регулирует экспрессию рецепторов трансферрина и уменьшает скорость эндоцитоза ионов железа. Применение ИФР-1 приводило к значительному снижению (р<0,05) повышенных уровней железа в печени, содержания в ней ферритина, трансферрина (р<0,01) и меди [38].
Помимо гепатопротекции, ИФР-1 способствует преодолению инсулинорезистентности [39], предотвращает подъемы систолического и диастолического давления крови, поддерживает чувствительность клеток к адреналину и участвует в регуляциии АД [40], тормозит развитие атеросклероза [41], оказывает антиоксидантное и противовоспалительное действие [42].
Активный пептид нейромедина N
В составе препарата Лаеннек обнаружено присутствие аминокислотной последовательности KIPYI, соответствующей биологически активному пептиду нейромедина N, который характеризуется цитопротекторным и анальгетическим эффектами, регулирует дофаминовую и опосредованную ГАМК нейротрансмиссию [43]. Низкоаффинные рецепторы типа NTS2 играют важную роль в осуществлении цитопротекторных свойств нейромедина. В экспериментальном исследовании [44] было показано, что связывание NTS2-рецепторами его активного пептида приводит к интернализации рецептора с последующей активацией внутриклеточного сигнального каскада внеклеточно регулируемых киназ ½, который, как известно, вовлечен в поддержание жизнеспособности клеток (гепатоцитов, клеток эндотелия и др.).
Фрагмент активного пептида кокальцигенина
В составе последовательности RQQKRACSLLE присутствует пептид QKRAC, соответствующий фрагменту 79-83 активного пептида кокальцигенина. Хотя QKRAC находится в составе более длиной последовательности, он все же может оказывать кросс-реактивное положительное воздействие, являясь пептидом-миметиком кокальцигенина. Делеции гена CGRP приводили в эксперименте к снижению скорости заживления ран и качества образующегося рубца [45]. Пептид проявляет регенераторный эффект, что способствует ускорению процессов заживления тканей путем снижения уровня провоспалительного фактора некроза опухоли α [46]. Следует отметить, что при быстром нарастании жировой массы отмечается возрастание концентрации этого фактора и других маркеров воспаления.
Пептид G-белка Rac2
В составе препарата Лаеннек установлено присутствие пептида RQQKRACSLLE, соответствующего фрагменту 183-192 малого G-белка Rac2 – молекулы внутриклеточной сигнализации, взаимодействующей со многими другими сигнальными белками в рамках многочисленных сигнальных каскадов.
Малый G-белок Rac2 участвует более чем в 20 сигнальных каскадах, обеспечивающих процессы физиологического роста, дифференциации, выживания клеток, нейротрофических эффектов, углеводного метаболизма и т.д. В частности, белки типа Rac участвуют в передаче сигнала от рецептора инсулина, что способствует снижению инсулинорезистентности.
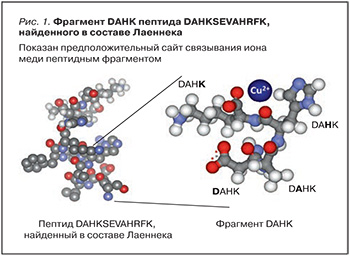
Пептидный фрагмент DAHKSEVAHRFK
Данная структура является N-концевым пептидом альбумина и имеет конформацию α-спирали. Пептид DAHKSEVAHRFK и такие его фрагменты, как DAHK (т.е. Asp-Ala-His-Lys), проявляют выраженные антиоксидантные свойства. Было установлено, что фрагмент DAHK в составе пептида формирует устойчивый сайт связывания ионов меди [47]. В составе Лаеннека обнаружены следовые количества ионов меди (1,16±0,06 мкг/ кг), причем в достаточно узком диапазоне концентраций (стандартное отклонение составило 5%), что указывает на возможность специфического связывания ионов меди теми или иными пептидами. В сочетании с ионом меди пептид DAHKSEVAHRFK формирует пептидный аналог супероксиддисмутазы (СОД) – известного антиоксидантного фермента (рис. 1).
Антиоксидантный эффект фрагментов DAHKSEVAHRFK зависит от наличия иона меди в структуре пептида. Без него антиоксидантные свойства этих фрагментов, выражающиеся ингибированием формирования прооксидантных радикалов, реагирующих с тиобарбитуровой кислотой, были крайне незначительными. Добавление к пептидам ионов меди существенно повышало их антиоксидантные свойства. Например, комплекс DAHK/Cu (соотношение 2:1) ингибировал формирование указанных радикалов на 95,4%, а комплекс DAHKSEVAHRFK/Cu (соотношение 2:1) – на 95,8%. В комплексе с медью исследуемые пептиды также снижали перекисное окисление липидов (рис. 2) [47]. Таким образом, пептид DAHKSEVAHRFK в составе Лаеннека проявляет заметные антиоксидантные свойства, что снижает интенсивность оксидативных процессов в печени и жировой ткани.
Пептид GEAGAAGPAGPAGPR коллагена Iα2
В составе Лаеннека было найдено несколько пептидов коллагенов различных типов (Iα2, Vα2 и XIXα1). Аминокислотная последовательность, известная как GVMGFO («О» – гидроксипролин) и соответствующий фрагменту GAAGPA в пептиде GEAGAAGPAGPAGPR, является основным сайтом связывания рецепторов дискоидиновых доменов [48]. Рецепторы дискоидиновых доменов DDR1 и DDR2 представляют собой повсеместно распространенные тирозинкиназные рецепторы, активируемые за счет связывания с коллагеном. Пептид GEAGAAGPAGPAGP непосредственно участвует в связывании DDR-рецепторов (рис. 3) [49]. Он вызывает медленное и устойчивое фосфорилирование указанных рецепторов, регулирующих адгезию, рост, миграцию и деление клеток, происходящие при регенерации тканей [50].
ЗАКЛЮЧЕНИЕ
Избыточному накоплению висцерального жира способствуют недостаточная физическая активность, избыточная калорийность и микронутриентная неполноценность потребляемой пищи. Поэтому лечение ожирения должно включать немедикаментозные методы: необходимо увеличить двигательную активность, уменьшить калорийность питания и оптимизировать состав потребляемой пищи [51]. В комплексной терапии ожирения также применяются гепатопротекторы, антиоксиданты, противовоспалительные, сахароснижающие и некоторые другие средства.
Пептиды, идентифицированные в составе препарата Лаеннек, воздействуют на ряд ключевых молекулярно-физиологических процессов, нарушенных при ожирении и МС (в частности, активность каскадов NF-kB, MAPKAPK2, GSK3β и Wnt, каспазы-3, рецептора инсулина, ИФР-1). Пептиды Лаеннека осуществляют противодействие развитию МС посредством: 1) повышения выживаемости клеток (цитопротекция), 2) восстановления чувствительности клеток к глюкозе и устранения инсулинорезистентности, 3) снижения повышенного АД, 4) снижения жировой инфильтрации и восстановления функции печени, 5) противовоспалительного и 6) антиоксидантного действия (рис. 4).



