ВВЕДЕНИЕ
Обеспеченность организма магнием имеет принципиальное значение для профилактики и терапии многочисленных хронических заболеваний. В проведенном в России в 2009–2012 гг. крупномасштабном исследовании взаимосвязь между дефицитом магния и риском развития различных патологических состояний (142 диагноза по МКБ- 10) была изучена на основе скрининга 2433 пациентов из медицинских учреждений 7 регионов России [1]. Впервые в мировой практике было показано, что сниженные уровни магния в плазме крови и эритроцитах являются патофизиологическим «ядром» коморбидных патологий.
Важно отметить, что число диагнозов по МКБ- 10, отражающее степень проявления коморбидности, показало достоверную корреляцию с уровнями магния в плазме крови и эритроцитах. Даже при наличии у пациента только одного диагноза из 142-х возможных, уровни магния были достоверно снижены (плазма 0,86±0,19 ммоль/л, эритроциты 1,74±0,57 ммоль/л). При наличии двух и более диагнозов средние уровни магния в плазме были <0,8 ммоль/л, что наглядно подтверждает взаимосвязь дефицита магния и повышенным риском коморбидных заболеваний [1].
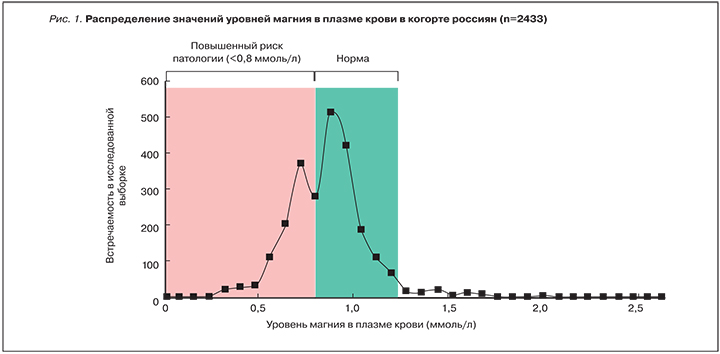
В то же время в группе здоровых (пациенты, проходившие диспансеризацию, без диагнозов по МКБ-10) средние уровни магния в плазме крови составили 0,92±0,07 ммоль/л (95% доверительный интервал [ДИ] 0,82-0,96), а в эритроцитах 2,45±0,66 ммоль/л (95% ДИ 1,71-3,56). По данным скрининга почти 50% пациентов характеризовались уровнями магния в плазме крови <0,80 ммоль/л (рис. 1) [1].
Повсеместная распространенность недостаточности магния обусловлена в первую очередь, его недостаточным содержанием в потребляемых продуктах питания и питьевой воде. Последний фактор особо важен, так как максимальное всасывание магния происходит именно из водного раствора.
Эпидемиологические исследования продемонстрировали ассоциации между уровнями магния в питьевой воде и риском смертности от ишемической болезни сердца (ИБС). Метаанализ 10 исследований (n=77821) подтвердил достоверное снижение риска смертности от ИБС на 11% при более высоких уровнях магния в питьевой воде (отношение рисков [ОР] 0,89, 95% ДИ 0,79–0,99; р <0,001) [2].
Анализ данных по 2883 муниципалитетам Словакии показал, что сниженные значения уровней магния в питьевой воде были ассоциированы с повышением риска смертности от опухолевых заболеваний. Результаты анализа 20 339 образцов питьевой воды, собранных за 10-летний период, показали, что содержание в ней магния должно быть не ниже 25–36 мг/л, в противном случае смертность от онкологических заболеваний резко возрастает. Следует отметить, что установленный в результате исследования диапазон предельно допустимых значений содержания магния в питьевой воде примерно в 2 раза выше, чем действующие в Словакии его нормы [3].
В популяциях людей, живущих в районах с низким содержанием магния в питьевой воде, но высоким содержанием хлорида натрия (Япония, Прикарпатье, Багамские острова), артериальная гипертония возникает в 3 раза чаще и сопровождается высокой летальностью [4]. В регионах, где население обеспечивается питьевой водой преимущественно в форме опресненной морской воды (с минимальным количеством всех минералов, в том числе магния), смертность от всех заболеваний была выше, чем у пациентов из других регионов (ОР 1,87, 95% ДИ 1,32–2,63; р <0,0001) [5].
В целом дефициты магния и других микронутриентов (в частности, одного из витаминов группы В, рибофлавина) оказывают существенное влияние на заболеваемость и смертность от различных заболеваний. В настоящей работе рассмотрены распространённость проблемы дефицитов магния и рибофлавина, основы молекулярной фармакологии магния и рибофлавина, данные клинико-эпидемиологических и клинических исследований. Показана перспективность использования водных растворов органических солей магния и рибофлавина для компенсации дефицитов этих микронутриентов.
ДЕФИЦИТЫ МАГНИЯ И РИБОФЛАВИНА
Крупномасштабное исследование взрослых женщин в 9 провинциях Китая, проведенное в 2000–2011 гг., показало, что рибофлавином были обеспечены только 7% участниц, а магнием – 23% [6]. Не менее проблемная ситуация наблюдается в странах ЕС: например, во французской выборке населения (n=2373, 10–92 года) недостаточность потребления магния высока как среди мужчин (72%), так и женщин (83%) [7].
Веским подтверждением полной неадекватности утверждений вроде «магния и витаминов много в овощах и фруктах» является исследование пищевых привычек и состояния питания пожилых людей (n=200, 72±7 лет), живущих в хорошо известном курортном городе в южной Испании. Город расположен на средиземноморском побережье и характеризуется весьма высоким количеством солнечных дней в году (>250), действительно высокой доступностью различных фруктов, овощей, рыбы, цельных зерновых и обезжиренных молочных продуктов [8].
Тем не менее даже в столь благоприятных условиях участники исследования едва достигали установленных норм потребления микронутриентов. Например, среднесуточное потребление рибофлавина составило 2,0±0,8 мг/сут (т. е. находилось на нижней границе нормы), а у 40% участников отмечено недостаточное его потребление. Среднее потребление магния составило 375±136 мг/сут (норма 300–400 мг/сут), у 25% участников отмечено недостаточное его потребление [8]. В северной части Испании ситуация с потреблением микронутриентов была гораздо хуже: среднее потребление рибофлавина составило 1,6±0,36 мг/сут (недостаточное потребление у 64% участников), а магния 267±42 мг/сут (недостаточное потребление у 71% участников) [9].
Содержание магния в питьевой воде в южной Испании также было достаточно низким (принимая во внимание, что во многих ее регионах используется упомянутая выше опресненная питьевая вода). Анализ образцов из 108 муниципалитетов показал, что среднее содержание магния в питьевой воде из под крана варьировало в диапазоне 15–45 мг/л и только в 7 муниципалитетах превышало 45 мг/мл. Схожая ситуация наблюдалась и при анализе содержания магния в 197 брендах бутилированной питьевой воды – средняя его концентрация составила всего лишь 16,27 мг/л (0,11–141 мг/л); только 4 бренда содержали >45 мг/л магния [10].

ОСНОВЫ ФАРМАКОЛОГИИ МАГНИЯ
Хотя количество связанного белками магния не превышает 0,1% от его общего количества в организме, магний выступает в качестве важнейшего кофактора для более чем 700 различных типов белков. С молекулярной точки зрения биохимические и физиологические эффекты магния, наряду с клиническими проявлениями его дефицита, практически полностью объясняются с точки зрения потери биологических функций этих 700 магнийзависимых белков при магнийдефицитных состояниях [4]. Дефицит магния приводит к частичной потере функции всех магнийсвязывающих белков, участвующих в следующих процессах:
- поддержании энергетических и пластических процессов;
- обмене электролитов и поддержании электрического равновесия клетки;
- гидролизе АТФ;
- гликолизе;
- окислении жирных кислот;
- биосинтезе белка (тРНК);
- синтезе цАМФ;
- синтезе оксида азота в эндотелии сосудов;
- обмене витаминов группы В;
- процессах возбуждения/торможения в ЦНС.
В целом магний необходим для нормальной работы всех 12 основных систем органов, прежде всего нервной, сердечно-сосудистой, репродуктивной, мочевой и соединительнотканной. Отклонения в функционировании нервной системы являются одним из ранних признаков недостатка магния. Дефицит магния в нервной и мышечной ткани приводит к судорогам, головокружению, головным болям, усталости, беспокойству и страху (или, наоборот, к апатии и депрессии). Одно из характерных последствий дефицита магния в нервной системе – уменьшение способности к сосредоточению и нарушение памяти.
Магний – физиологический регулятор клеточной возбудимости и совершенно необходим для деполяризации клеточной мембраны нервных и мышечных клеток. При недостатке магния клетка становится сверхвозбудимой. В осуществлении процесса нервно-мышечной проводимости ионы кальция и магния выступают в качестве естественных антагонистов. Магний – это своего рода природный изоляционный материал на пути проведения нервного импульса. Его «изоляционные» свойства объясняются специфическими взаимодействиями ионов магния, по крайней мере с тремя типами белков: NMDA-рецепторами, катехол-О-метилтрансферазой (КОМТ) и аденилатциклазами (рис. 2).
Наиболее известным молекулярным механизмом влияния магния на возбудимость нейронов является ингибирование активности NMDA-рецепторов (глутаматных рецепторов). Их активация необходима для быстрой синаптической передачи сигнала в головном мозге, происходящей в результате изменения потока натрия/калия через мембрану. Чрезмерная стимуляция NMDA-рецепторов может привести к судорогам эпилептического типа, в то время как их блокирование магнием снижает возбудимость нервных путей [4].

Дефицит магния также отражается на балансе моноаминов мозга, прежде всего катехоламинов и серотонина. Магний снижает секрецию кортиколиберина и соответственно кортизола, вызывая тем самым снижение активности по оси «гипоталамус-гипофиз-надпочечники». Это происходит в основном за счет активации КОМТ. Магний является необходимым кофактором данного фермента и образует часть активного центра КОМТ (рис. 2Б).
Обратная корреляция между уровнями магния и возбудимостью нейронов (через механизм NMDA-рецепторов), а также обратная корреляция между магнием и уровнями катехоламинов (КОМТ) подтверждаются результатами клинических исследований дефицита магния. Например, дефицит магния был обнаружен по меньшей мере у 70% детей с дефицитом внимания и гиперактивностью – расстройством, подразумевающим избыточную возбудимость нервных путей [11]. Дефицит концентрации внимания и способности его удерживать – ядерный признак этого синдрома. Дефицит магния также может негативно влиять на способность адекватного реагирования на стресс. Пациенты психологического типа «А» (агрессивное поведение) являются более чувствительными к стрессу и характеризуются более высокими уровнями катехоламинов [4]. Недостаток магния только усугубляет негативные последствия стресса. Важно отметить, что ион магния является коферментом центрального фермента биосинтеза флавинадениндинуклеотида(ФАД) – ФАД-синтетазы [12].
ОСНОВЫ ФАРМАКОЛОГИИ РИБОФЛАВИНА
Рибофлавин (витамин B2) – водорастворимый витамин, биологические роли которого определены вхождением рибофлавина в коферменты флавинмононуклеотид (ФМН) и ФАД (рис. 3), образующие активные и регуляторные сайты флавиновых ферментов.
Флавиновые ферменты принимают участие в энергетическом метаболизме (окисление углеводов, жирных кислот, пирувата, разветвленных аминокислот; поддержка «цепи переноса электронов» в митохондриях и др.), инактивируют и окисляют токсичные альдегиды, участвуют в синтезе глутатиона, образовании желчных кислот из холестерина в печени [13] и др. Важно отметить участие флавиновых ферментов с биосинтезе витамеров витамина B6, активной формы фолатов (5-метилтетрагидрофолат) посредством метилентетрагидрофолатредуктазы, ниацина (витамин РР).
Основные причины дефицита рибофлавина у человека — недостаточное потребление продуктов, содержащих этот витамин, неправильное их хранение и приготовление, вследствие чего содержание витамина резко уменьшается; хронические заболевания желудочно-кишечного тракта; прием медикаментов, являющихся антагонистами рибофлавина. Человеческий организм не накапливает рибофлавин, и любой его избыток выводится с мочой.
Внешними проявлениями недостаточности рибофлавина являются поражения слизистой оболочки губ с вертикальными трещинами и слущиванием эпителия (хейлоз), изъязвления в углах рта (ангулярный стоматит), отек и покраснение языка (глоссит), себорейный дерматит на носогубной складке, крыльях носа, ушах, веках. Часто наблюдаются изменения со стороны органов зрения: зуд, покраснение, светобоязнь, конъюнктивит, кератит. В ряде случаев при авитаминозе имеют место анемия и нервные расстройства, проявляющиеся мышечной слабостью, жгучими болями в ногах и др. Дефицит рибофлавина в диете беременных достоверно повышает риск врожденных пороков плода [14].
Данные доказательной медицины указывают на перспективность использования рибофлавина для профилактики/терапии мигрени, анемии, опухолевых заболеваний, гипергликемии и сахарного диабета, артериальной гипертонии, патологии нервной системы и депрессивных расстройств и др. [15]. В частности, метаанализ 8 исследований (n=7750) показал, что более высокое диетарное потребление витамина В2 ассоциировано со снижением риска колоректального рака на 17% (ОР 0,83, 95% ДИ 0,75–0,91) [16].
Проведенное в Японии кросс-секционное исследование подростков 12–15 лет (n=6517) показало, что более высокое потребление фолатов снижало риск депрессивной симптоматики (>16 баллов по шкале Center for Epidemiologic Studies Depression Scale) на 40% (ОР 0,60, 95% ДИ 0,45–0.79; р=0,002), витамина В6 – на 17% (ОР 0,73, 95% ДИ 0,54–0,98; р=0,02), рибофлавина – на 15% (ОР 0,85, 95% ДИ 0,67–1,08; р=0,03) [17].
Препараты рибофлавина и его кофакторов ФАД и ФМН применяют для профилактики и лечения недостаточности витамина B2, при кожных заболеваниях, вяло заживающих ранах, заболеваниях глаз, нарушении функции желудочно-кишечного тракта, сахарном диабете, анемиях, циррозе печени, для терапии желтухи новорожденных и др. В лечении роговичной эктазии (прогрессирующее истончение роговицы) перспективно топическое использование раствора рибофлавина [18].
При применении рибофлавина в терапии мигрени следует принимать во внимание фармакокинетику данного соединения. Максимальная доза рибофлавина, которую организм человека может переработать при однократном приеме, составляет 27 мг, причем при дозах >50 мг отмечено уменьшение всасывания. Период полураспада рибофлавина составляет 1–2 ч [19]. Данные по клиренсу показали, что с мочой экскретируется более 50% рибофлавина плазмы крови. Таким образом, сочетание ограниченного всасывания с достаточно коротким периодом полураспада указывает на предпочтительность использования постоянно принимаемых поддерживающих доз рибофлавина.

МАГНИЙ И РИБОФЛАВИН В ТЕРАПИИ СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ
Крупномасштабное исследование здоровья и питания (n=17 752) показало, что региональные вариации артериального давления в США связаны с региональными вариациями рациона питания. В южных регионах имел место самый высокий процент участников с повышенным артериальным давлением (р <0,005), что коррелировало не только с более высоким потреблением натрия (3,4±0,02 г/ сут), но и с меньшим потреблением калия, кальция, магния, рибофлавина, витаминов А, С и РР (р <0,005) [20].
Анализ данных крупномасштабного исследования InterMap (n=4680; возраст пациентов 40-59 лет) показал, что более высокое систолическое и диастолическое артериальное давление ассоциировано с более низким диетарным потреблением рибофлавина, витаминов B1, B6, B9, C, кальция и магния. Было установлено, что более низкий образовательный уровень участников исследования ассоциировался с более низким потреблением питательных микроэлементов как с диетой, так и в составе витаминно-минеральных комплексов [21]. При этом курильщики потребляли меньше витамина Е (-0,7 мг/сут), витамина С (-9 мг/сут), рибофлавина (-0,1 мг/сут), витамина B6 (-0,11 мг/ сут) и магния (-24 мг/сут) по сравнению с бывшими курильщиками и некурящими [22].
У пациентов с хронической стабильной сердечной недостаточностью (n=79) отмечены достоверно более низкие уровни рибофлавина, магния, витамина D, витамина А, кальция, калия, цинка, селена и йода в плазме крови [23]. Прием такими больными смеси микронутриентов, включившей магний 150 мг/сут, рибофлавин 2 мг/сута, другие витамины группы В, витамины С, Е, D и коэнзим Q10 150 мг в течение 9 мес, достоверно снижал объем гипертрофированного левого желудочка (на 13%; р <0,05) и увеличивал фракцию выброса левого желудочка (на 5,3%; р <0,05). Пациенты из группы лечения также сообщили о значительном улучшении качества жизни (на 9,5%, р <0,05), в то время как в группе плацебо было отмечено небольшое его ухудшение (на 1,1%) [24].
МАГНИЙ И РИБОФЛАВИН В ТЕРАПИИ ПАТОЛОГИЙ С ПРОВОСПАЛИТЕЛЬНЫМ КОМПОНЕНТОМ
У пациентов с хроническим панкреатитом (n=75; возраст 31±11 лет) отмечено достоверно более низкое потребление рибофлавина, холина, магния, меди, марганца и витамина Е по сравнению с контрольной группой здоровых добровольцев (n=75) [25]. Комплексная оценка нутрициального статуса пациентов с воспалительным заболеванием кишечника (n=69) указывало на более низкое суточное потребление белка, кальция и рибофлавина по сравнению с контрольной группой (n=69), причем на фоне более высокого потребления углеводов. Концентрации магния, селена и цинка в сыворотки крови были значительно ниже у больных, чем в контрольной группе [26]. В эксперименте рибофлавин, никотиновая кислота, селен, молибден, цинк и магний, ингибировали канцерогенез пищевода [27].
МАГНИЙ И РИБОФЛАВИН В ПРОФИЛАКТИКЕ И ТЕРАПИИ МЕТАБОЛИЧЕСКИХ РАССТРОЙСТВ
В эксперименте дотации магния, цинка, хрома и витаминов А, В1, В2, С, D, Е в течение 8 нед ослабляли метаболические нарушения, индуцированные диетой с высоким содержанием жиров. Дотации микронутриентов способствовали профилактике избыточной массы тела, гиперинсулинемии, повышенных уровней глюкозы, триглицеридов и холестерина в крови [28].
Дефициты магния и рибофлавина ассоциированы с более низкими уровнями соматомедина (инсулиноподобного ростового фактора 1) в плазме крови. Низкие уровни соматомедина ассоциированы с гипопитуитаризмом, гипотиреоидизмом, анорексией, гепатоцеллюлярными заболеваниями и задержкой физического развития у детей. Обследование 2109 здоровых женщин-добровольцев, включившее анализ данные дневника диеты, позволило установить корреляции между более низкими уровнями соматомедина в крови и более низким суточным потреблением магния (р=0,003), калия (р=0,002), витамина B6 (р=0,03) и рибофлавина (р=0,001) [29].
Дотации магния, рибофлавина и ряда других микронутриентов являются перспективным дополнением стандартной терапии для профилактики и лечения осложнений сахарного диабета [30]. У пациентов с метаболическим синдромом (n=103), помимо более высокого калоража питания (+400 ккал/сут; р=0,003), отмечена более высокая частота встречаемости сочетанных дефицитов витаминов и микроэлементов. Например, недостаточное потребление витамина D и кальция отмечено у более чем 80% участников исследования, рибофлавина, витамина Е, цинка и магния – у 50–75% [31].

Дефициты ряда микронутриентов, в том числе магния и витамина В2, негативно сказываются на кинурениновом пути метаболизма L-триптофана. Дефицит витамина В2 приводит к снижению активности флавинового фермента кинуренин-3-монооксигеназы. Ионы Mg2+ регулируют активность хинолинатфосфорибозилтрансферазы [32]. Нейроактивные метаболиты кинурениновго пути играют важную роль в патофизиологии нейродегенеративных заболеваний (болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона), шизофрении, эпилепсии, депрессии и т.д.
Обследование группы детей с аутизмом (n=105) в сравнении со здоровыми нормально развивающимися детьми (n=495) показал, что дети с аутизмом характеризуются достоверно более низкими уровнями потребления тиамина, рибофлавина, витамина С и кальция [33].
Дотации рибофлавина и магния нормализуют избыточную экскрецию дикарбоновых кислот с мочой, которая наблюдается при аутизме и других нейрометаболических расстройствах. Например, повышенная экскреция янтарной кислоты связана с нарушениями метаболизма 2-кетоглутарата, кетозом и ишемией тканей. Повышение экскреции с мочой адипиновой и субериновой кислот ассоциировано с кетозом, лактатацидозом, гипогликемией, недостаточной активностью ферментов 3-гидрокси-3-метилглутарил-коэнзим-А-лиазы), сукцинат-полуальдегиддегидрогеназы, карнитинпальмитоилтрансферазы II. Дотации рибофлавина (20 мг/сут), витамина B6 (50 мг/сут) и магния (200 мг/сут) в течение 3 мес эффективно снижали избыточные уровни дикарбоновых кислот в моче детей с аутизмом (n=30). После терапии уровень янтарной кислоты снизился с 42±5 до 10±8, адипиновой кислоты – с 16±15 до 3±2,4 и субериновой кислоты - с 8±6 до 2,6±3,5 мкмоль/ммоль креатинина [34].
МАГНИЙ И РИБОФЛАВИН В ЛЕЧЕНИИ МИГРЕНИ
Наиболее перспективным направлением применения сочетанных препаратов магния и рибофлавина является терапия и профилактика мигрени. Немедикаментозное лечение мигрени включает методы релаксации, аэробные упражнения, гипербаричесую оксигенацию, использование микронутриентов [35]. Дефициты рибофлавина, магния, коэнзима Q10 и омега-3 полиненасыщенных жирных кислот ассоциированы с интенсивностью мигренью [36], а дотации магния, рибофлавина, витамина B12 и коэнзима Q10 способствуют профилактике мигрени [37]. Одной из основ биологического воздействия рибофлавина и магния на патофизиологию головной боли является участие этих микронутриентов в поддержании достаточного уровня метаболической активности головного мозга. Недостаточная обеспеченность магнием и рибофлавином отрицательно влияет на энергетический метаболизм головного мозга, что приводит к нарушению тонуса сосудов [38].
Магний участвует во многих реакциях энергетического обмена и биосинтеза АТФ. Достаточные уровни Mg2+, как известно, способствуют нормализации регуляции сосудистого тонуса и артериального давления, проявляют антикоагулянтные и антиагрегантные свойства, регулируют энергетический метаболизм клеток и уровень сахара в крови.
Исследования с использованием изотопных меток кальция показали, что внеклеточные уровни Mg2+ существенно влияют на уровни и всасывание Са2+ в артериальной и венозной гладкой мускулатуре. В эксперименте показано, что отсутствие Mg2+ в среде, в которой исследуются изолированные артерии in vitro, приводит к существенному повышению интенсивности вазоконстрикторного ответа под воздействием норадреналина, ацетилхолина, серотонина и ангиотензина [39]. И наоборот, добавление Mg2+ достоверно нормализует повышенный тонус артерий [40]. Низкие уровни магния также соответствуют ингибированию COMT – фермента, участвующего в деградации норадреналина и других катехоламинов. Ионы Mg2+ также регулируют степень связывания серотонина и ангиотензина II с соответствующими белками-рецепторами [41].
Обеспеченность ионами магния способствует снижению нейрогенного воспаления, которое опосредовано субстанцией Р. Гипомагнеземия уменьшает экспрессию нейтральной эндопептидазы, что ведет к деградации активной формы субстанции P, тем самым способствуя усилению нейровоспаления [42].
Рибофлавин (витамин В2) является водорастворимым эссенциальным витамином, на основе которого синтезируются ФМН и ФАД – два кофермента, необходимых для поддержания окислительно-восстановительных реакций цикла Кребса, биосинтеза АТФ и других реакций энергетического метаболизма в цитозоле и митохондриях. Таким образом, достаточное количество рибофлавина имеет важное значение для нормального биосинтеза АТФ, в том числе в митохондриях.
Также рибофлавин снижает риск мигрени путем обезвреживания гомоцистеина и предотвращения гипергомоцистеинемии. Повышенные уровни гомоцистеина ассоциированы с нарушениями функции эндотелия сосудов и, кроме того, ассоциируются с истощением запасов Mg2+ внутри клеток, что способствует инициированию приступов мигрени [43]. Заметим, что метаболизм гомоцистеина поддерживается витаминами группы В – рибофлавином, В6, фолатами и В12. Дотации рибофлавина являются эффективным средством нормализации повышенных уровней гомоцистеина в крови, так как рибофлавин является основой кофактора метилентетрагидрофолатредуктазы – основного фермента переработки гомоцистеина [44].
Таким образом, магний и рибофлавин положительно воздействуют на синтез АТФ, блокируют NMDA-рецепторы, нормализуют сосудистый тонус при воздействии катехоламинов, регулируют сродство агонистов к рецепторам серотонина и снижают нейрогенное воспаление. Соответственно дотации магния и рибофлавина будут повышать болевой порог, тем самым снижая частоту возникновения и интенсивность приступов мигрени [45].
В рандомизированном исследовании пациентов с ≥3 приступами мигрени в месяц (n=130, возраст 18–65 лет) ослабление симптоматики было достигнуто при сочетанном приеме рибофлавина, магния и коэнзима Q10 в течение 3 мес. Отмечено достоверное снижение числа дней с мигренью (с 6,2 до 4,4 в месяц; р<0,05) и интенсивности мигрени по сравнению с плацебо (р=0,03). Сумма баллов опросника мигрени HIT-6 снижалась с 62 до 57 (на 4,8 балла) по сравнению с -2,0 баллами в группе плацебо (р=0,01) [46].
О СИНЕРГИЗМЕ МАГНИЯ, РИБОФЛАВИНА И ЦИТРАТА В ПОДДЕРЖАНИИ ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА
И магний, и цитрат-анион, и рибофлавин принципиально необходимы для поддержания энергетического метаболизма клеток – для синтеза АТФ. Ион магния необходим для поддержания активности гликолитических ферментов и цикла Кребса; цитрат анион является одним из субстратов цикла Кребса (который также называется «цитратным циклом»), рибофлавин также нужен для поддержки активности ферментов в цикле Кребса.
Магнийзависимые гликолитические ферменты енолаза (ENO1, ENO2), фосфоглюкомутазы (PGM1, PGM2, PGM3) и 6-фосфофруктокиназа (PFKP, PFKM) были найдены в значительных количествах в различных тканях организма. Магний является кофактором эти трех ключевых фермента гликолиза, при дефиците магния их активность падает в несколько раз (рис. 4).
И ион магния, и цитрат-анион, и рибофлавин являются неотъемлемыми компонентами цикла Кребса. Цитрат является центральным продуктом в цикле Кребса, в котором происходит окисление двух- и трехуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков до CO2 с одновременным синтезом универсального внутриклеточного источника энергии — молекулы АТФ.
Магний является эссенциальным кофактором двух ферментов цикла Кребса (рис. 5): изоцитратдегидрогеназы и фосфатазы пируватдегидрогеназы – регуляторной субъединицы сложной молекулярной машины цикла – пируватдегидрогеназного комплекса. Рибофлавин необходим для поддержания активности фермента сукцинатдегидрогеназы, окисляющей сукцинат-анион в фумарат-анион. Цитрат-анион окисляется в аконитат-анион и затем в изоцитрат-анион, который перерабатывается магнийзависимым ферментом изоцитратдегидрогеназой.
Помимо участия в цикле Кребса, цитрат-анион играет существенную роль в работе почек. Содержание цитрата в моче – фактор, существенно влияющий на развитие метаболической нефропатии и мочекаменной болезни. Задолго до возникновения почечных камней в крови и моче начинает снижаться уровень цитрата [47]. Экспериментальные и клинические исследования показывают, что совместный прием цитрата магния и цитрата калия – эффективное средство торможения роста почечных камней и предотвращения рецидивов камнеобразования [48].
ЗАКЛЮЧЕНИЕ
Коррекция недостаточного потребления магния и витаминов группы В важна для профилактики и терапии сердечно-сосудистой патологии, заболеваний с провоспалительным компонентом, метаболических расстройств и мигрени (рис. 6). Все большее распространение приобретают растворы для питья, приготовляемые непосредственно перед употреблением, в состав которых входят органические соли магния и высокоусвояемые формы витаминов. Такой подход к восполнению микронутриентного дефицита является наиболее естественным, так как по сути является целевым обогащением питьевой воды. Цитрат магния – одна из наиболее растворимых в воде солей магния с высокой биодоступностью. Цитрат не только эффективный транспортер магния внутрь клеток, но также оказывает самостоятельное воздействие на синтез АТФ, воспаление, избыточное тромбообразование и растворения оксалатных и уратных камней в почках. Цитрат магния наиболее правильно употреблять именно посредством приготовления водного раствора для питья. Предварительное растворение цитрата магния в воде не приводит к интенсивному выделению тепла (что наблюдается при употреблении некоторых таблеток цитрата магния). Следовательно, при предварительном приготовлении водного раствора полностью устраняются нежелательные органолептические последствия (ощущение «разогрева таблетки» во рту при попадании слюны на безводный цитрат магния, возможные ожоги пищевода и желудка, тошнота). Появившийся в РФ препарат Магнесол В2 гранулы оптимален для приготовления водного раствора магния, поскольку выпускается в саше, содержащих гранулы. Важно, что в состав препарата, помимо цитрата магния (300 мг элементного магния в одном саше), входит и рибофлавин (2,0 мг в одном саше)*.



