Практически любое встречающееся в литературе определение острой респираторной вирусной инфекции (ОРВИ) включает такую характеристику заболевания, как «самоограничивающееся» (self-limiting). Но эта характеристика никоим образом не означает, что заболевание не требует лечения, а лишь подчеркивает отсутствие в арсенале врачей специфических этиотропных средств.
Термины «простуда» и «грипп» (influenza) использовались для описания острых респираторных инфекций задолго до открытия вирусов, ответственных за их возникновение, и некоторые эксперты описывают ОРВИ как «культурно принятую совокупность респираторных симптомов» [1]. Эта совокупность делает ОРВИ уникальными среди распространенных заболеваний, поскольку никакое другое состояние не имеет такого диапазона одновременно возникающих симптомов. Как правило, это чихание, ринорея, заложенность носа, головная и мышечная боль, дискомфорт и боль в горле, дисфония, кашель и лихорадка. Не все из вышеперечисленных клинических признаков могут возникать в каждом случае ОРВИ, но в любом случае это мультисимптомное заболевание, при котором сочетание нескольких симптомов обычно сохраняется в течение всей болезни [2].
Каждый симптом можно лечить с помощью отдельного действующего вещества, однако использование комбинированных препаратов с несколькими активными ингредиентами является более рациональным подходом [3]. В руководстве Всемирной организации здравоохранения (ВОЗ) по регистрации комбинированных лекарственных препаратов говорится, что если такой препарат с фиксированными дозами активных компонентов предназначен для облегчения различных симптомов заболевания, то его применение оправдано лишь при том обязательном условии, что эти симптомы обычно возникают одновременно, с клинически значимой интенсивностью и в течение такого периода времени, когда одновременное лечение является целесообразным [4].
Характер возникновения симптомов ОРВИ был изучен как при экспериментально индуцированных, так и естественно протекающих инфекциях. После заражения добровольцев одним из респираторных вирусов (риновирусом, коронавирусом или респираторно-синцитиальным вирусом) и развития заболевания в течение последующих 5 дней более 50% добровольцев, у которых развилась клиническая картина ОРВИ, испытывали появление катаральных и общих симптомов одновременно, независимо от инфекционного агента [5]. Маркетинговые исследования с участием более чем 1000 пациентов также показали, что 45% пациентов сообщали о возникновении общих и катаральных симптомов одновременно после заражения естественным образом. Из тех пациентов, которые самостоятельно применяли комплексное симптоматическое лечение, 59% получали его в течение двух дней подряд и 35% – в течение трех дней подряд. Этого было достаточно для значительного улучшения состояния [6].
Симптоматическое лечение ОРВИ неоднократно оценивалось в Кокрейновских метаанализах. Первый включил 32 исследования с участием в общей сложности 8930 пациентов и был посвящен применению антигистаминных средств при простудных заболеваниях. Согласно его результатам, монотерапия не улучшала симптомы ни у детей, ни у взрослых [7, 8]. Комбинированное применение антигистаминных препаратов и противоотечных средств продемонстрировало способность облегчать симптомы у взрослых, но соответствующие результаты были неоднородны [9].
Другой недавний метаанализ [10] показал, что тройная комбинация антигистаминных, противоотечных и анальгетических средств обеспечивала улучшение состояния как у взрослых, так и детей старшего возраста.
Таким образом, не вызывает сомнений обоснованность и логичность применения комбинированных препаратов для лечения симптомов ОРВИ. Эти препараты должны быть первой линией терапии, по крайней мере при наличии нескольких симптомов, отсутствии бактериальной инфекции и неэффективности превентивных мер, таких как физические методы, вакцинация или пассивная иммунизация. Не было обнаружено никаких доказательств того, что комбинированные препараты для лечения симптомов ОРВИ несут какие-либо дополнительные риски по сравнению с соответствующими монопрепаратами. Помимо этого, применение комбинированных препаратов характеризуется меньшими затратами, чем «раздельная» симптоматическая терапия, и более удобно для пациентов [2].
Фармацевтической компанией АО «ВЕРТЕКС» (Россия) был разработан препарат Дуоколд® в виде набора порошков для приготовления раствора для приема внутрь. Дуоколд® представляет собой комбинацию хорошо известных и широко назначаемых (в том числе при ОРВИ) лекарственных веществ: парацетамол + рутозид + фенилэфрин + фенирамин + аскорбиновая кислота + кальция глюконат. Лекарственная форма препарата отличается тем, что включает два состава, предназначенных для приема в дневные и вечерние часы: порошок для приема в дневные часы содержит парацетамол, фенилэфрина гидрохлорид, аскорбиновую кислоту, кальция глюконат и рутин, для приема в вечерние (предпочтительно перед сном) часы – парацетомол, фенилэфрина гидрохлорид, фенирамина малеат, аскорбиновую кислоту, кальция глюконат и рутин. В процессе разработки было установлено, что максимальный терапевтический эффект от приема препарата Дуоколд® наблюдается в случае, когда доза парацетамола в составе для приема в вечерние часы в 1,5 раза выше дозировки этого анальгетика-антипиретика в составе для приема в дневные часы.
Целью настоящего исследования стала оценка безопасности и эффективности препарата Дуоколд® в сравнении с комплексным применением препаратов ТераФлю® от гриппа и простуды (порошок для приготовления раствора для приема внутрь) / Терафлю® Экстра (порошок для приготовления раствора для приема внутрь) в комбинации с препаратами Аскорутин и Кальция глюконат у пациентов с ОРВИ.
МАТЕРИАЛ И МЕТОДЫ
Клиническое исследование «Открытое, сравнительное, рандомизированное, активно контролируемое с параллельными группами многоцентровое исследование эффективности и безопасности препарата Дуоколд® порошок для приготовления раствора для приема внутрь производства АО «ВЕРТЕКС», Россия в качестве симптоматического средства у пациентов с острой респираторной вирусной инфекцией» проводилось в 6 клинических центрах в соответствии с утвержденным протоколом № DuoCL-200317-001, этическими принципами Хельсинкской декларации, трехсторонним соглашением по надлежащей клинической практике (ICH GCP) и регламентировалось действующим законодательством России. Оно было одобрено советом по этике и локальными этическими комитетами. Разработка протокола, организация, клинический мониторинг, оценка безопасности и анализ результатов исследования выполнялись контрактно-исследовательской организацией «Медицинский центр Пробиотек».
Шесть клинических центров, одобренных Минздравом России, в которых было выполнено исследование:
1. ООО «Уромед» (адрес: 214031, г. Смоленск, ул. Маршала Соколовского, д. 18/1. Тел.: 8 (4812) 33-98-57. Главный исследователь: И.А. Гринев. Тел.: 8 (4812) 33-98-57. E-mail: igrinyov@smolensktrials.ru).
2. ГБУЗ Самарской области «Самарская городская больница № 4» (адрес: 443056, г. Самара, ул. Мичурина, д. 125. Тел.: 8 (846) 312-55-17. Главный исследователь: И.Л. Фридман. E-mail: fridman_irina@mail.ru).
3. ГБУЗ Ярославской области «Клиническая больница № 3» (адрес: 150007, г. Ярославль, ул. Маяковского, д. 61. Тел.: 8 (4852) 59-11-53. Главный исследователь: С.М. Носков. E-mail: Noskov-SM@mail.ru).
4. ОБУЗ «Городская клиническая больница № 4» (адрес: 153005, г. Иваново, ул. Шошина, д. 8. Тел.: 8 (4932) 37-59-41. Главный исследователь: Т.А. Побединская. E-mail: Tpobedinskaya@mail.ru).
5. ОБУЗ «Ивановская клиническая больница имени Куваевых» (адрес: 153025, г. Иваново, ул. Ермака, д. 52/2. Тел.: 8 (4932) 37-15-51. Главный исследователь: С.Е. Ушакова. E-mail: svetland1962@mail.ru).
6. ФГБОУ ВО «Кировская государственная медицинская академия» Минздрава России (адрес: 610027, г. Киров, ул. Карла Маркса, д. 112. Тел.: 8 (8332) 37-48-55. Главный исследователь: Е.В. Бакулина. E-mail: reqinamed@mail.ru).
В исследование были включены 170 амбулаторных пациентов (мужчин и женщин) в возрасте от 18 до 65 лет.
Критерии включения: установленный диагноз ОРВИ при условии наличия как минимум двух симптомов (чихание, ринорея, заложенность носа, головная боль, боль в мышцах, дискомфорт в горле, боли в горле, дисфония, кашель и лихорадка) и длительности симптомов основного заболевания не менее 6 и не более 48 ч; добровольное согласие на участие в исследовании в письменном виде; готовность к заполнению необходимых шкал, а также соблюдению графика посещений; согласие отказаться от употребления алкоголя на всем протяжении исследования; для женщин с сохраненным потенциалом деторождения – отрицательный тест на беременность и согласие придерживаться надлежащих методов контрацепции.
Критерии невключения: беременность или период лактации; известная гиперчувствительность к любому компоненту исследуемых препаратов; тяжелая аллергическая реакция в анамнезе; выявленная или подозреваемая на момент включения бактериальная инфекция; пациенты, получившие вакцину для профилактики гриппа менее чем за 7 дней до включения в исследование; пациенты с ОРВИ, нуждающиеся, по мнению исследователя, в назначении противовирусных или антибактериальных препаратов; тяжелое течение ОРВИ, показания к госпитализации; пациенты, получившие до момента включения более 2 доз НПВП, антигистаминных средств, топических или системных деконгестантов, глюкокортикостероидов; прием ингибиторов МАО, барбитуратов, сердечных гликозидов, трициклических антидепрессантов, бета-адреноблокаторов; наличие в анамнезе таких заболеваний, как сахарный диабет, закрытоугольная глаукома, коагулопатии; феохромоцитома, гипертиреоз, муковисцидоз, фенилкетонурия, язвенная болезнь, сезонный или круглогодичный аллергический ринит, бронхиальная астма, ХОБЛ, дефицит глюкозо-6-фосфатдегидрогеназы, гиперплазия предстательной железы, алкоголизм, наркотическая или лекарственная зависимость, эпилепсия; гепатит любой этиологии, печеночная или почечная недостаточность; или следующие аномальные значения лабораторных показателей на скрининге: уровень АЛТ и/или АСТ сыворотки, превышающий верхнюю границу нормы в 2 раза, клиренс креатинина ≤30 мл/мин; неконтролируемая артериальная гипертензия; сердечная недостаточность (ІІ–ІV класс по NYHA); ВИЧ-инфекция, иммуносупрессивная терапия, другие иммунодефицитные состояния.
Дизайн исследования
Исследование было открытым, рандомизированным, активно контролируемым в параллельных группах, с вводным периодом, периодом активной терапии и последующего наблюдения. Общая длительность исследования для каждого пациента составила около 10 дней.
Исследование предполагало 5 визитов, включая визит скрининга.
На исходном визите (визит 1) пациенты получали следующий нераспределенный рандомизационный номер и соответствующие исследуемые препараты. Оценки эффективности и безопасности терапии проводились на визитах 1–4, визит 5 посвящался дополнительной оценке безопасности.
Рандомизация проводилась с использованием валидированной программы. Каждому пациенту, соответствующему критериям включения/невключения, был присвоен трехзначный рандомизационнный порядковый номер.
Лечение
В соответствии со схемой рандомизации пациенты были разделены на 2 равные группы: 85 пациентов группы 1 получали исследуемый препарат Дуоколд®, 85 пациентов группы 2 – активную терапию сравнения (препараты ТераФлю® от гриппа и простуды/Терафлю® Экстра + таблетки Аскорутин и Кальция глюконат). Длительность терапии в обеих группах составляла не менее 48 и не более 72 ч в зависимости от состояния пациента при оценке исследователем на визите 2. Если полное или почти полное клиническое выздоровление наступало через 48 ч от начала терапии, лечение прекращалось.
Параметры эффективности и безопасности
Первичная конечная точка исследования включала изменение общей оценки шкалы Ликерта для 10 симптомов ОРВИ на 3-й день исследования (визит 2) по сравнению с исходным уровнем.
Вторичные конечные точки включали долю пациентов с полным или почти полным отсутствием симптомов ОРВИ на 3-й день исследования; длительность заболевания (количество дней с момента начала терапии до полного или почти полного отсутствия симптомов); изменение общего счета шкалы Ликерта для 10 симптомов ОРВИ на 7-й день исследования (визит 3); оценку по шкалам IMOS и IMPSS ; оценку Лидского опросника качества сна на протяжении исследования; среднее изменение аксиллярной температуры тела через 1 и через 3 ч от момента приема первой дозы исследуемых препаратов.
Анализ безопасности осуществлялся на протяжении всего исследования и включал оценку нежелательных явлений, лабораторных данных (общего и биохимического анализа крови, общего анализа мочи), показателей жизненно важных функций (артериального давления, частоты сердечных сокращений), данные электрокардиографии (ЭКГ).
Расчет объема выборки проводился на основе первичной переменной и для проверки гипотезы не меньшей эффективности (non-inferiority). Граница не меньшей эффективности была установлена на уровне 2 баллов. Предполагая стандартное отклонение изменений порядка 5 баллов, минимальное число пациентов было оценено как 77 в каждой группе для поддержания 80% мощности сравнения при одностороннем 5% уровне значимости. С учетом возможного 10% выбывания было рекомендовано увеличить объем выборки до 85 пациентов в каждой группе (всего 170 рандомизированных пациентов).
Статистический анализ проводился при помощи программы R 3.4.
Распределение пациентов
По результатам скрининга в исследование были включены 170 пациентов (рис. 1), соответствующих критериям включения/невключения. Все они получили хотя бы одну дозу исследуемого препарата и предоставили хотя бы одну оценку эффективности, войдя в популяции безопасности и ITT. 168 пациентов завершили все процедуры исследования в соответствии с протоколом, войдя в популяцию РР. 2 пациента (по одному из каждой группы терапии) были исключены из популяции РР в связи с применением в ходе исследования запрещенной сопутствующей терапии.
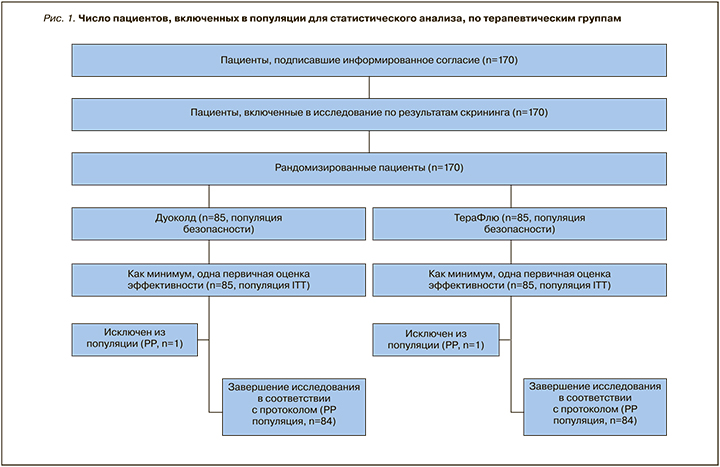
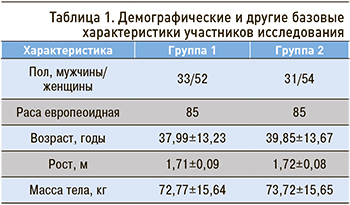 Группы лечения не различались по демографическим и другим базовым характеристикам (пол, возраст, раса, рост, масса тела): дисперсионный анализ ANOVA с терапией в качестве фактора не выявил статистически значимых различий ни в одном из показателей (табл. 1).
Группы лечения не различались по демографическим и другим базовым характеристикам (пол, возраст, раса, рост, масса тела): дисперсионный анализ ANOVA с терапией в качестве фактора не выявил статистически значимых различий ни в одном из показателей (табл. 1).
РЕЗУЛЬТАТЫ
Первичной переменной эффективности в исследовании служило изменение общей оценки шкалы Ликерта для 10 симптомов ОРВИ на визите 2 по сравнению с исходным уровнем. Тестирование гипотезы проводилось с помощью построения одно- и двустороннего 95% доверительного интервала (ДИ) для разности средних значений первичной переменной и дисперсионного анализа ANOVA с терапией в качестве фактора.
Анализировались значения в группе исследуемого препарата относительно препарата сравнения, проверялась гипотеза о равенстве средних в двух группах.
В популяции ITT разница средних значений между группами на визите 2 (3-й день терапии) по сравнению с исходным уровнем (исследуемый препарат – препарат сравнения) составила 0,659 балла со стандартной ошибкой среднего SE=0,445. Правая граница одностороннего 95% ДИ составила 1,395 балла, а граница двустороннего 95% ДИ – 1,537 балла. В обоих случаях результаты находятся левее установленной границы не меньшей эффективности, составляющей 2 балла по шкале симптомов (р=0,141).
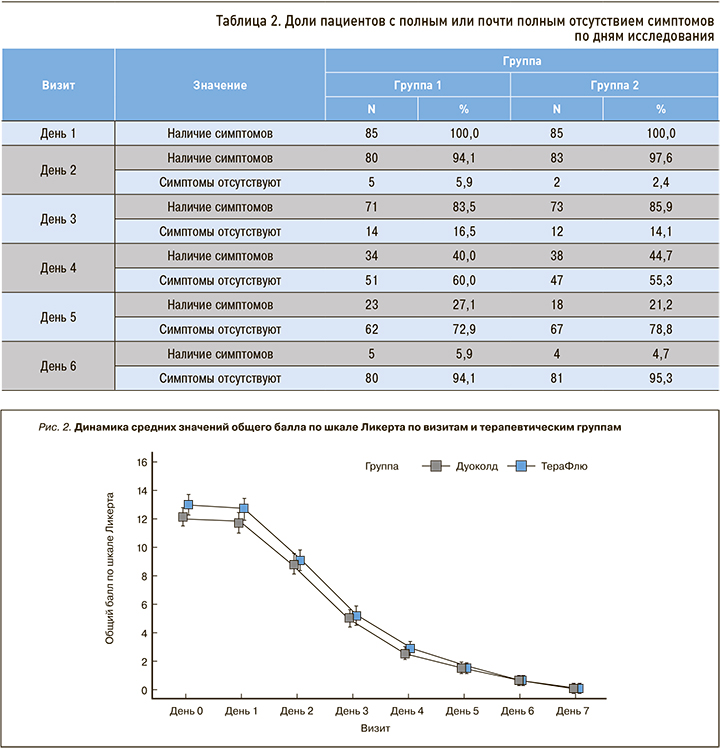
Результаты анализа первичной конечной точки исследования представлены на рисунке 2.
Вторичные параметры эффективности
Доля пациентов с полным или почти полным отсутствием симптомов ОРВИ на визите 2
Отсутствие или полное отсутствие симптомов ОРВИ определялось как отсутствие лихорадки (температура в подмышечной впадине ≤37,1 °C) и общий счет шкалы симптомов ≥2 баллов при условии оценки по интегральной шкале оценки результатов лечения (IMOS) «Полное выздоровление» или «Значительное улучшение». Точный критерий Фишера не выявил статистически значимых различий между группами по долям пациентов с полным или почти полным отсутствием симптомов ОРВИ ни на одном из дней терапии (p >0,05). Распределение долей пациентов с полным или почти полным отсутствием симптомов по дням исследования представлено в таблице 2.
Изменение на визите 3 по сравнению с исходным уровнем общего счета шкалы Ликерта для 10 симптомов ОРВИ
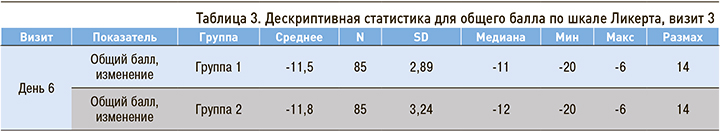
По результатам дисперсионного анализа (ANOVA), для такого параметра, как изменение оценки симптомов ОРВИ на визите 3 (на 6-й день исследования) относительно исходного уровня, статистически значимых различий средних показателей между терапевтическими группами выявлено не было (p >0,05) (табл. 3).
Лидский опросник для оценки сна
Однофакторный дисперсионный анализ полученным данных (ANOVA) с терапией в качестве фактора не выявил статистически значимых различий между группами по средним изменениям различных секций Лидского опросника (засыпание, качество сна, пробуждение, состояние после пробуждения; p >0,05).
Интегральная шкала оценки результатов лечения (IMOS) и Интегральная шкала оценки удовлетворенности пациента лечением (IMPSS)
Точный критерий Фишера не выявил статистически значимых различий между группами в отношении оценок интегральных шкал IMOS и IMPSS ни на одном из визитов исследования (p >0,05).
Изменение аксиллярной температуры тела после приема первой дозы исследуемых препаратов
Однофакторный дисперсионный анализ (ANOVA) с терапией в качестве фактора не выявил статистически значимых различий между группами по средним изменениям аксиллярной температуры тела через 1 и 3 ч после приема первой дозы исследуемых препаратов (p >0,05).
Длительность заболевания
Длительность заболевания (количество дней с момента начала терапии до полного или почти полного отсутствия симптомов) для группы исследуемого препарата составила 4,3±1,1 дней, для группы сравнения – 4,4±1,0. Критерий Уилкоксона–Манна–Уитни не выявил статистически значимых различий между сравниваемыми группами по длительности заболевания в днях (p=0,643).
Безопасность
Всего в исследовании было отмечено 3 нежелательных явления у 3 (3,5%) пациентов группы исследуемого препарата и 4 у 4 (4,7%) пациентов группы контроля. Статистически значимой разницы между группами не выявлено (p=1,000, точный критерий Фишера).
Ни одно из нежелательных явлений не было серьезным и не повлекло исключение пациентов из исследования. Не было обнаружено отрицательной динамики лабораторных и жизненных показателей, клинически значимых изменений на ЭКГ.
ОБСУЖДЕНИЕ
Ежегодно в России регистрируется более 30 млн случаев ОРВИ. Поскольку за возникновение ОРВИ ответственно значительное число различных вирусов, а в основе заболевания лежат многообразные патогенетические механизмы, это делает невозможным создание какого-либо универсального лекарственного средства, эффективного в отношении данной патологии. Среди безрецептурных препаратов широко используются комбинированные лекарственные средства, содержащие компоненты разных фармакологических групп: нестероидные противовоспалительные препараты, деконгестанты, антигистаминные, противокашлевые компоненты, витамины, адаптогенты и т.д. [11, 12].
Комбинированные препараты для облегчения симптомов, содержащие несколько активных ингредиентов, обеспечивают безопасный, эффективный, экономичный и удобный способ лечения множественных симптомов простуды. Учитывая, что эти препараты регистрируются за пределами России в основном по пути хорошо изученного медицинского применения, данные клинических исследований для таких комбинаций весьма ограничены. Поскольку же «противопростудные» комбинации – одни из наиболее часто назначаемых врачами и рекомендуемых фармацевтами препаратов, необходимы качественные клинические испытания, подтверждающие их эффективность и безопасность при облегчении широкого спектра симптомов.
Новый комбинированный препарат Дуоколд® оказывает жаропонижающее, противовоспалительное, обезболивающее, противоаллергическое, ангиопротекторное и сосудосуживающее действие, устраняя симптомы ОРВИ. Представленное клиническое исследование было проведено для подтверждения эффективности и безопасности препарата Дуоколд® и стало «опорной точкой» для его государственной регистрации.
ЗАКЛЮЧЕНИЕ
По результатам проведенного исследования и сравнительного анализа первичной и вторичных конечных точек эффективности можно сделать вывод, что исследуемый препарат Дуоколд® в форме порошка для приготовления раствора для приема внутрь (АО «ВЕРТЕКС», Россия) не уступает по параметрам эффективности комплексному применению препаратов ТераФлю® от гриппа и простуды (порошок для приготовления раствора для приема внутрь) / ТераФлю® Экстра (порошок для приготовления раствора для приема внутрь) в комбинации с препаратами Аскорутин и Кальция глюконат в качестве симптоматического средства у пациентов с ОРВИ. При этом анализ данных безопасности, включавший оценку нежелательных явлений, основных жизненных показателей, лабораторных исследований и ЭКГ, не выявил статистически достоверных и клинически значимых различий между препаратами.
Можно констатировать, что Дуоколд® позволяет контролировать симптомы ОРВИ 24 ч и благодаря отсутствию фенирамина в пакетиках «День» не вызывает дневной сонливости.
В свою очередь, наличие этого антигистаминного компонента в пакетиках «Ночь» обеспечивает контроль респираторных симптомов во время сна: снижает чувство заложенности носа, уменьшает чихание, слезотечение, зуд и покраснение глаз. Кроме того, фенирамин в пакетике «Ночь» может оказывать седативное действие. Таким образом, Дуоколд® способствует нормализации ночного сна, снижая респираторные симптомы ОРВИ.
Антигистаминное действие фенирамина усиливает кальция глюконат. Дополнительно это лекарственное вещество оказывает ионную поддержку организму, способствуя нормализации свертываемости крови, клеточного обмена, защите миокарда и сосудов.
Сосудосуживающий компонент фенилэфрин в составе препарата Дуоколд® помогает снизить риск осложнений ОРВИ (синуситов и отитов), обеспечивает уменьшение отека, гиперемии слизистой оболочки носа, восстанавливает нарушенное носовое дыхание и понижает давление в параназальных полостях и среднем ухе. Фенилэфрин может положительно влиять на общее самочувствие пациента, уменьшая проявления астении, усталости, слабости.
В свете данных о поражении сосудов при коронавирусе нового типа в лечении ОРВИ возрастает значение ангиопротекторов. В связи с этим включение в компонентную формулу препарата Дуоколд® ангиопротекторного средства рутозида (рутина) представляется весьма актуальным.
Состав Дуоколда® дополнен также витамином С в дозе 200 мг в 1 пакетике, что в пересчете на суточную дозу составляет 800 мг. Это так называемая ударная доза аскорбиновой кислоты, способствующая повышению сопротивляемости организма инфекционным заболеваниям. Дополнительного приема витамина С при использовании препарата Дуоколд® не потребуется, что может быть удобным для пациентов в период гиповитаминоза C при эпидемиях.
В целом состав препарата сбалансирован и соответствует современным представлениям о лечении симптомов ОРВИ. Дуоколд® – это оригинальный противопростудный препарат с запатентованной формулой действующих веществ «День» и «Ночь», контролирующий симптомы ОРВИ 24 ч в сутки без развития дневной сонливости.



