В настоящее время все более актуальным становится применение телемедицины (ТМ) для повышения эффективности и качества здравоохранения путем использования информационно-коммуникационных технологий и удаленного доступа [1, 2].
Пандемия COVID-19 привела к ускорению внедрения ТМ-технологий [3], которые в настоящее время активно используются при ведении пациентов с имплантированными кардиовертер-дефибрилляторами, устройствами сердечной ресинхронизирующей терапии [4, 5], артериальной гипертензией (АГ) [6], хронической сердечной недостаточностью (ХСН) [7], пожилых больных с сердечно-сосудистыми заболеваниями [8] и пациентов всех возрастов с высоким кардиоваскулярным риском [9], а также пациентов с ишемической болезнью сердца (ИБС), в том числе с острым коронарным синдромом (ОКС). При этом ТМ-технологии зачастую включают не только расшифровку электрокардиограммы (ЭКГ), отбор пациентов для чрескожного коронарного вмешательства (ЧКВ), но и вторичную профилактику после ОКС [10, 11].
Вместе с тем в доступной литературе нам не удалось найти отечественные работы, посвященные созданию, внедрению, оценке эффективности и безопасности использования ТМ-технологий при ведении пациентов после инфаркта миокарда (ИМ) в условиях пандемии.
Цель предлагаемого исследования – создание, оценка возможности использования, эффективности и безопасности системы удаленного контроля состояния пациентов, перенесших ИМ.
МАТЕРИАЛ И МЕТОДЫ
В проспективное одноцентровое исследование вошли пациенты, госпитализированные в стационар по поводу ИМ с 01.09.2018 по 01.05.2019. Больные включались в исследование при условии подписания информированного согласия и наличия у них высокого уровня потенциальной приверженности к лекарственной терапии, которая определялась по количественному опроснику приверженности КОП-25 [12], заполнявшемуся пациентом на момент включения.
Критериями невключения являлись:
- абсолютные противопоказания к назначению ингибиторов АПФ, бета-адреноблокаторов, статинов, антиагрегантов;
- психические заболевания;
- злоупотребление алкоголем и наркотическими средствами;
- низкая и средняя потенциальная приверженность к лекарственной терапии по данным КОП-25.
Все пациенты, выжившие в срок 12 мес после ИМ (n=221, в том числе 155 мужчин (70,1%); медиана возраста 61,4 {54,3; 68,6} лет), были разделены на две группы – опытную (n=109) и контрольную (n=112).
Опытную группу составили все пациенты, давшие устное согласие на использование системы удаленного контроля (добровольное информированное согласие пациентов было подписано всеми участниками исследования ранее и содержало данные о возможности удаленного наблюдения в момент включения). Им была предоставлена ссылка на Google-опросник, содержащий вопросы о характере и длительности болевого синдрома, которым они должны были пользоваться при появлении у них эпизодов загрудинных болей и/ или одышки. Результаты опросника поступали врачу-исследователю на электронную почту; при ухудшении состояния исследуемого врач, в зависимости от полученных данных в течение нескольких ближайших минут/часов/дней, связывался с пациентом, рекомендовал ему вызов скорой медицинской помощи (в случае длительности болевого синдрома ≥20 мин данную рекомендацию пациент получал удаленно, ответив на вопрос о длительности болевого синдрома в опроснике), обращение за медицинской помощью в поликлинику или кардиологический стационар по месту жительства и/или проводил коррекцию терапии.
Контрольная группа пациентов велась согласно принятой клинической практике по месту их проживания. При этом из 109 пациентов, давших свое предварительное согласие на использование системы удаленного контроля, ею пользовались 87 (79,8%) пациентов. Из 112 отказавшихся пациентов ни один не пользовался этой системой.
Всем участникам исследования была назначена оптимальная медикаментозная терапия в соответствии с клиническими рекомендациями Минздрава России 2020 г., включавшая ингибитор АПФ, бета-блокатор, статин, антиагрегант или антикоагулянт при наличии у пациента фибрилляции предсердий.
По истечении 12 мес наблюдения выполнялся сбор сведений о пациентах, использовавших и не использовавших систему удаленного мониторинга, частоте смертельных исходов, ИМ, мозговых инсультах, ЧКВ, причинах и сроках их проведения.
Для статистической обработки материала использовались программы Microsoft Excel 2010 и StatsoftStatistica10.0, SPSS 23.0. Данные представлены в виде частот (%). Распределение всех признаков отличалось от нормального. Количественные признаки описывались медианой и нижним и верхним квартилями. Сравнение двух независимых групп по количественным признакам проводилось с помощью U-критерия Манна–Уитни, по качественным – с помощью критериев хи-квадрат по Пирсону, хи-квадрат с поправкой Йетса, критерия Фишера. Силу выявленных ассоциаций оценивали отношением шансов (ОШ) и его 95% доверительным интервалом (95% ДИ).
Для исключения влияния на результат исследования различий исходных клинических параметров в группах была проведена «псевдорандомизация» (propensity score matching анализ, PSM) с использованием метода поиска «ближайшего соседа» в отношении подбора пар 1:1. После «псевдорандомизации» в исследование было включено 122 пациента – по 61 пациенту в обе группы. За статистически значимые принимались различия при p <0,05. Исследование было одобрено локальным этическим комитетом Рязанского государственного медицинского университета им. академика И.П. Павлова.
РЕЗУЛЬТАТЫ
При сравнении обеих групп пациентов по клинико-демографическим показателям было отмечено, что среди пациентов, использовавших систему удаленного контроля, значимо чаще встречались АГ, сахарный диабет (СД) и нарушенная толерантность к глюкозе (НТГ). Также среди них было больше пациентов, перенесших ОКС с подъемом сегмента ST ЭКГ (ОКСпST) и Q-ИМ (табл. 1, 2).
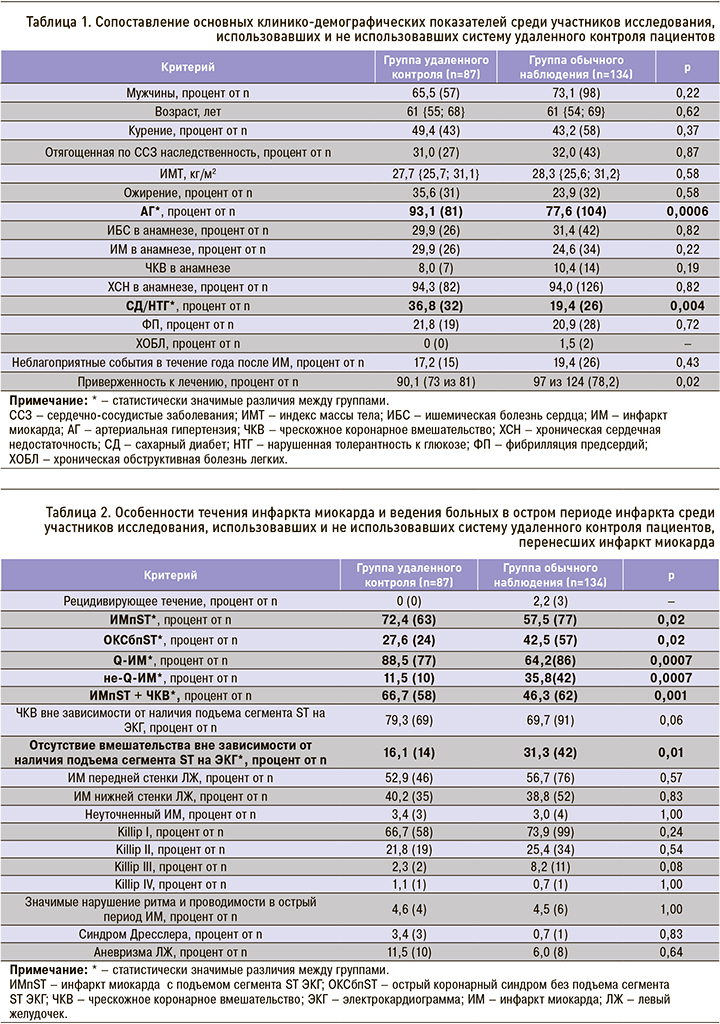
Таким образом, более склонными к использованию системы удаленного контроля были лица с АГ (ОШ 3,9; 95% ДИ: 1,5–9,8; p=0,0006), СД/ НТГ (ОШ 2,3; 95% ДИ:1,3–4,4; p=0,004), а также лица, перенесшие ИМпST (ОШ 1,9; 95% ДИ: 1,1–3,5; p=0,02), и в особенности пациенты с ИМпST, подвергнутые ЧКВ (ОШ 2,3; 95% ДИ: 1,3–4,1; p=0,001), и Q-ИМ (ОШ 3,5; 95% ДИ: 1,7–7,5; p=0,0007).
Менее склонными к использованию системы удаленного контроля были пациенты с ОКС без подъема сегмента ST (ОШ 0,5; 95% ДИ: 0,3–0,9; p=0,02) и не-Q-ИМ (ОШ 0,2; 95% ДИ: 0,1–0,6; p=0,0007), а также те, кому не проводилось никаких вмешательств вне зависимости от наличия подъема сегмента ST на ЭКГ (ОШ 0,4; 95% ДИ: 0,2–0,8; p=0,01).
В связи с этим для исключения влияния на результат исследования различий исходных клинических параметров была применена «псевдорандомизация», и сформированы две группы пациентов, сопоставимые по основным клинико-демографических показателям (табл. 3), особенностям течения ИМ и ведению больных в остром периоде ИМ (табл. 4).
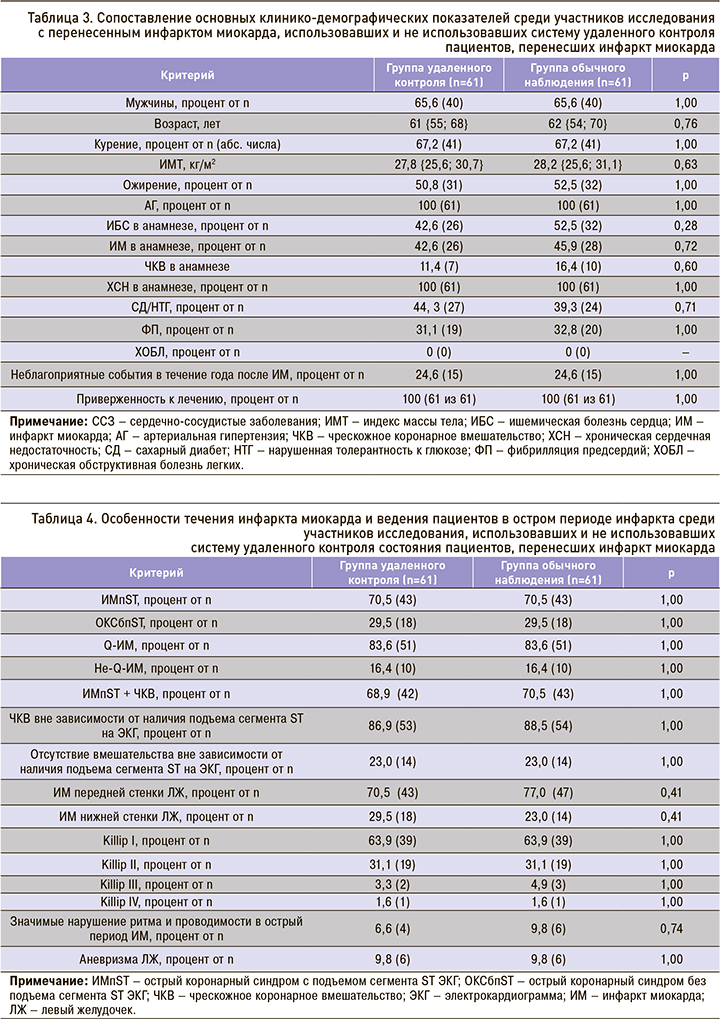
За 12-месячный период наблюдения с июня 2020 г. по июнь 2021 г. умерло 16 (7,2%) пациентов, из них от сердечно-сосудистых причин – 13 (81,2%). Четверо больных (1,8%) перенесли ИМ и реваскуляризацию по поводу него, у двоих (0,9%) случился мозговой инсульт, 21 (9,5%) подверглись реваскуляризации коронарных артерий по поводу прогрессирования ИБС. Таким образом неблагоприятные события произошли у 18,6% (41) пациентов (табл. 5).
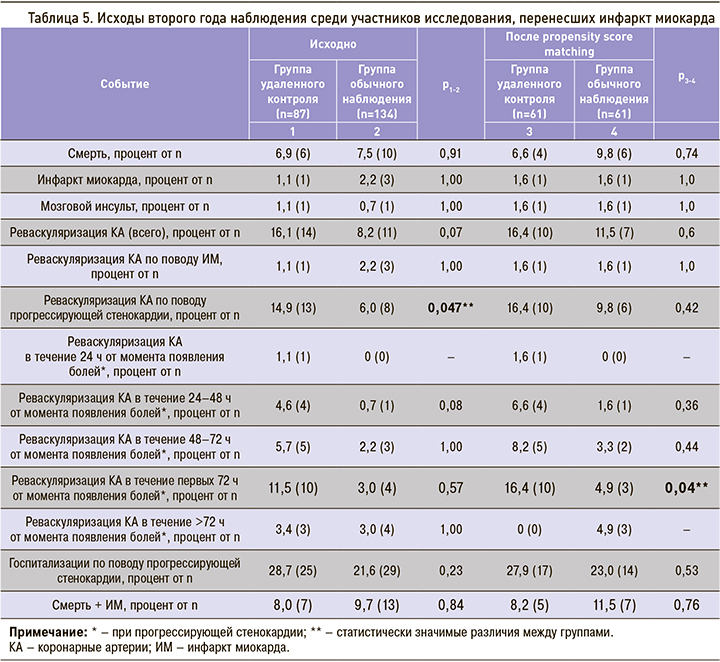
Как видно из представленных результатов, анализируемые группы (до применения propensity score matching) статистически значимо и более чем в 2 раза отличались только частотой реваскуляризация коронарных артерий по поводу прогрессирующей стенокардии, которая проводилась в 14,9% (13) случаях среди пациентов, вошедших в группу удаленного контроля, и в 6,0% (8) случаев среди пациентов из группы рутинного наблюдения (p=0,047). При этом статистически значимой разницы в частоте госпитализаций по поводу прогрессирующей стенокардии между этими группами пациентов не было.
После «псевдорандомизации» группы пациентов, использующих и не использующих систему удаленного контроля, статистически значимые отличия наблюдались только по частоте ранней реваскуляризации коронарных артерий, т.е. по частоте реваскуляризации коронарных артерий, проведенной в течение первых 72 ч от момента появления болей. Она проводилась в 3 раза чаще в группе пациентов, использующих систему удаленного контроля, по сравнению с группой пациентов, не использующих ее:16,4% (10) против 4,9% (3) случаев соответственно (p=0,04).
Примечательно, что пациенты, использующие систему удаленного контроля и не использующие ее, через 12 мес наблюдения статистически значимо отличались по уровню приверженности к лекарственной терапии. Из 81 выжившего пациента, пользовавшегося системой удаленного наблюдения, приверженными к лечению были 90,1% (73) человек, тогда как из 124 выживших больных, не использующих эту систему, только 78,2% (97) (p=0,02).
Применение системы удаленного мониторинга по всем сравниваемым показателям, в том числе по частоте смертельных исходов, нефатальных ИМ, как по отдельности, так и суммарно, оказалось не хуже рутинного наблюдения пациентов на протяжении второго года после ИМ.
ОБСУЖДЕНИЕ
Важность сокращения общего времени ишемии миокарда хорошо известна и доказана на основании улучшения клинических исходов у пациентов с ОКСбпST, в ранние сроки подвергнутых ЧКВ, особенно при высоких рисках смерти [13, 14]. В частности, при раннем вмешательстве отмечается сокращение частоты рецидивирующей и рефрактерной ишемии, продолжительности пребывания в стационаре, снижение смертности [14, 15].
В данной работе до применения «псевдорандомизации» анализируемые группы статистически значимо отличались частотой реваскуляризация коронарных артерий по поводу прогрессирующей стенокардии, которая проводилась в 14,9% случаях среди пациентов, относящихся в группу удаленного контроля, и в 6,0% случаев среди пациентов, относящихся к группе рутинного наблюдения (p=0,047). Других различий между этими группами пациентов не было. Можно предположить, что большая частота реваскуляризаций коронарных артерий среди пациентов в группе удаленного мониторинга связана как с исходными характеристиками больных, так и с использованием данной системы мониторинга, обеспечившей своевременные и правильные врачебные рекомендации по госпитализации с последующим выполнением ЧКВ и высокую приверженность к лечению (90,1 против 78,2%; p=0,02).
После «псевдорандомизации» на сопоставимых группах пациентов было показано, что использование системы удаленного контроля состояния пациентов, перенесших ИМ, способствует более раннему применению инвазивной тактики ведения больных с ОКСбпST. Так, доля пациентов, использующих систему удаленного контроля, которые были подвергнуты ранней реваскуляризации коронарных артерий, была большей по сравнению с аналогичной долей больных, не использовавших систему удаленного контроля: 16,4 (10) против 4,9% (3) соответственно (p=0,04). При этом не наблюдалось отличий по частоте развития летальных исходов, числу нефатальных ИМ и мозговых инсультов, реваскуляризаций в целом и по поводу ИМ, госпитализаций по поводу прогрессирующей стенокардии.
Похожий результат получен и в исследовании, проведенном в Китае, где использование ТМ-технологий оказалось эффективным в плане сокращения времени задержки оказания медицинской помощи пациентам с ОКС как до, так и во время пандемии. Однако существенной разницы в клинических исходах между пациентами, использующими ТМ-технологии и поступающими в лечебные учреждения в рутинном порядке, отмечено не было [3].
ЗАКЛЮЧЕНИЕ
Результаты проведенной работы свидетельствуют о том, что использование разработанной и апробированной нами системы удаленного контроля состояния пациентов, перенесших ИМ, по сравнению с рутинным наблюдением за такими пациентами в амбулаторных условиях, обеспечивает сходные показатели летальности, частоты нефатальных ИМ и мозговых инсультов, госпитализаций по поводу прогрессирующей стенокардии, реваскуляризаций коронарных артерий и способствует более раннему применению инвазивной тактики ведения пациентов с ОКСбпST.



