АКТУАЛЬНОСТЬ
К настоящему времени на основании анализа фундаментальных и клинических проспективных исследований достигнуты определенные успехи в понимании механизмов боли и факторов риска ее хронизации, в том числе при дорсопатиях. Установлено, что основным патогенетическим механизмом инициации ноцицептивной импульсации выступает формирование триггеров боли, обусловленных спондилоартрозом, грыжеобразованием, спондилезом и другими проявлениями дегенеративно-дистрофических изменений позвоночника, а также связанных с системным воспалением, например, при коронавирусной инфекции [1]. В случае рациональной терапии пациентов с обострением дорсопатии активность триггеров боли может значительно уменьшаться, что соответствует клиническому выздоровлению. Однако чаще их инактивация бывает недостаточной, поэтому формируется стойкий ноцицептивный трафик; это приводит к хронизации болевого синдрома за счет развития ноцицептивного коннектома, проявляющегося возникновением таких патофизиологических механизмов, как периферическая и центральная сенситизация, которые поддерживаются хроническим нейровоспалением (персистирующее низкоградуальное воспаление). В основе нейровоспаления лежит ноцицептивная активация глиальных клеток, которые, в свою очередь, начинают продуцировать провоспалительные цитокины, такие как фактор некроза опухоли альфа (ФНО-α), интерлейкин 1 бета (ИЛ-1β) и др. Эти цитокины, в свою очередь, способны модулировать синаптическую передачу в спинном и головном мозге, благодаря чему формируются центральная сенситизация, мультиплицирующая боль (нейропатический компонент болевого синдрома) [2]. Трудность идентификации нейровоспаления обусловлена тем, что оно не сопровождается характерными изменениями в периферической крови (повышением скорости оседания эритроцитов, увеличением уровня С-реактивного белка и пр.), гипертермией и субъективно может не ощущаться индивидуумом.
Проблема роли воспалительных механизмов в хронизации болевых синдромов приобрела особую актуальность в условиях пандемии COVID- 19, когда стало очевидным, что «цитокиновый шторм» вызывает не только поражение различных органов и систем организма в остром периоде заболевания, но и длительное время после него (постковидный синдром, ПКС). Согласно результатам исследований, проведенных в США, странах Европы и Азии, клинические проявления ПКС имеют широкий диапазон. Самыми распространенными жалобами пациентов были ощущение общей слабости (53,1% случаев), одышка (43,4%), артралгии (27,3%), а также боль в нижней части спины, грудной клетке (21,7%), нарушение памяти и внимания, аносмия/агевзия, тревога/дистимия, расстройства сна, симптомы, связанные с дисфункцией желудочно-кишечного тракта (ЖКТ) и выпадение волос [3].
К настоящему времени патогенетические механизмы поражения различных органов и систем после перенесенного COVID-19 остаются неизвестными, что значительно затрудняет поиск эффективных медицинских стратегий лечения дорсопатий. Исследователи полагают, что в основе симптомокомплекса ПКС лежат генетические факторы (например, женский пол), аутоиммунные процессы, усиление дегенеративно-дистрофических процессов суставно-связочного аппарата, нарушение микроциркуляции и гипоксия, а также возможная декомпенсация аффективных расстройств, наблюдавшихся у пациентов до развития инфекционного заболевания [4].
Целью настоящего открытого наблюдательного исследования стал анализ эффективности и переносимости препарата Алфлутоп в терапии дорсопатий пояснично-крестцовой локализации (ДПКЛ) у больных с ПКС.
Первичной конечной точкой исследования была оценка влияния препарата Алфлутоп на выраженность болевого синдрома у пациентов с ДПКЛ (баллы по визуальной аналоговой шкале, ВАШ).
Вторичные конечные точки: баллы по шкале оценки невропатической боли LANSS, показатели цифровой прессорной альгометрии, баллы по опроснику Post-COVID-19 Functional Status (PCFS) до и в динамике проводимой терапии и наблюдения.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 75 пациентов (26 мужчин и 49 женщин, средний возраст 55,5±7,2 лет), соответствующих всем критериям включения и не имеющих каких‑либо критериев невключения.
Критерии включения:
1) пациенты мужского или женского пола в возрасте от 30 до 70 лет;
2) вертеброгенный болевой синдром в области нижней части спины (код M54.5 по МКБ-10), верифицированный в том числе по результатам нейровизуализационного обследования (МРТ или КТ).
Критерии невключения:
1) повышенная чувствительность к компонентам препарата Алфлутоп;
2) применение препаратов из группы симптоматических медленных действующих препаратов (SYSADOA) в течение последних 3 мес;
3) неконтролируемая артериальная гипертензия и/или хроническая сердечная недостаточность IIa, IIb, III стадии (II–IV функциональные классы по NYHA), кардиоваскулярные «катастрофы» (острые нарушения мозгового кровообращения, инфаркт миокарда), декомпенсированный сахарный диабет, ишемическая болезнь сердца;
4) тяжелые, декомпенсированные или нестабильные соматические и неврологические заболевания (любые заболевания или состояния, которые угрожают жизни больного или ухудшают прогноз основного заболевания, а также делают невозможным проведение клинического исследования у больного);
5) язва желудка или двенадцатиперстной кишки, обострения в течение последних 3 мес;
6) острые заболевания печени (например, гепатит) или тяжелый цирроз печени (класс C по Чайлд–Пью);
7) психические заболевания, сведения о злоупотреблении наркотическими/лекарственными препаратами и/или алкоголизме;
8) наличие в анамнезе злокачественных образований, за исключением пациентов, у которых рецидив заболевания не наблюдался в течение последних 5 лет;
9) ВИЧ/СПИД, туберкулез.
По поводу ДПКЛ проводилась монотерапия препаратом Алфлутоп в количестве 10 внутримышечных инъекций по 2 мл через день в соответствии с инструкцией по медицинскому применению. В качестве средства неотложной помощи для купирования болевого синдрома пациентам предлагалось использовать ибупрофен в дозе 400 мг по требованию.
Все больные наблюдались в течение 3 мес, а контрольные исследования и диагностические процедуры проводились в рамках 4 визитов:
- визит 1 – скрининг и начало терапии с оценкой критериев включения/невключения в исследование;
- визит 2 – промежуточный визит, сразу после завершения курса лечения препаратом Алфлутоп;
- визит 3 – промежуточный визит, через 1 мес (±3 дня) после завершения курса лечения препаратом Алфлутоп;
- визит 4 – заключительный визит, через 3 мес (±7 дней) после завершения курса лечения препаратом Алфлутоп.
Контроль эффективности лечения осуществлялся на основании анализа следующих показателей:
1) самооценки уровня боли в спине по шкале ВАШ (100 мм) [5];
2) Лидской шкалы оценки невропатической боли (LANSS) [6];
3) необходимости приема препарата неотложной помощи (ибупрофен) для купирования болевого синдрома в течение каждого месяца наблюдения (количество дней приема, n);
4) опросника Post-COVID-19 Functional Status (PCFS, баллы) – опросника для оценки выраженности функциональных ограничений у пациентов с ПКС [7];
5) результатов цифровой прессорной альгометрии при помощи аппарата FPX 50 (Wagner instruments, США) с оценкой следующих параметров:
- локального болевого порога (БПл, кг/см2) – силы давления резиновой рабочей поверхностью альгометра, которую необходимо приложить для появления ощущения боли в области нижней части спины;
- супрасегментарного болевого порога (БПс, кг/ см2) – измерения болевого порога в центральной области тенара правой руки.
В качестве группы контроля в исследование было включено 15 человек от 30 до 70 лет (46,4±8,2 года) без жалоб на боль любой локализации, которым выполнялась цифровая прессорная альгометрия по описанной выше методике.
Для статистического анализа полученные в ходе исследования данные вносились в базу, сформированную на основе программного обеспечения Excel из пакета MS Office 2016. Для статистического анализа результатов исследования использовалась программа STATISTICА 7.0 (StatSoft, Inc., США) в соответствии с рекомендациями по обработке результатов медико-биологических исследований [8]. Демографические данные, данные исходного состояния представлены в виде частот, процентного отношения или среднего значения и стандартного отклонения. Статистические сравнения связанных выборок (до – после терапии) проводились с помощью методов непараметрического теста знаковых рангов Уилкоксона. Пороговый уровень статистической значимости был принят равным 0,05.
РЕЗУЛЬТАТЫ
Анализ частоты встречаемости жалоб в остром периоде COVID-19 и в постковидном периоде у обследованной категории больных позволил установить, что наиболее распространенными симптомами в период дебюта заболевания были астения, потеря аппетита, кашель и головная боль, в то время как в рамках ПКС доминирующими жалобами (помимо боли в области нижней части спины) оказались астения, боль в суставах и диарея (рис. 1).
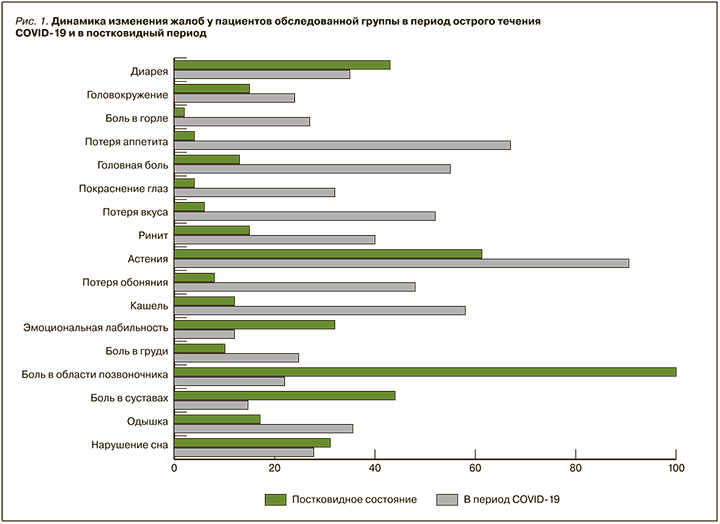
Среди пациентов с ПКС и ДПКЛ преобладали женщины (49/65,3%), перенесшие среднетяжелую форму SARS-CoV-2 (44/58,7%), у которых болевой синдром носил постоянный характер (48/64%), беспокоил в покое (58/77,3%) и уменьшался после физической нагрузки (38/50,7%) (табл. 1). Помимо дорсалгии, у пациентов наблюдались мышечно-скелетные боли другой локализации, наиболее часто в шейном и грудном отделах позвоночного столба (27/36%). Любопытно, что часть пациентов мужского пола (8/30,8%) предъявляла жалобы на боль в области тестикул. Следует отметить, что подавляющее большинство пациентов (65/86,7%) имели анамнестические сведения о наличии боли в области нижней части спины, которая стала причиной приема лекарственных препаратов хотя бы 1 раз в жизни. Около половины пациентов (см. табл. 1) имели коморбидную патологию, в основном заболевания ЖКТ (36/48%), метаболический синдром (35/46,7%), сердечно-сосудистые заболевания (25/33,3%) и др. В связи с этим данная категория больных принимала предписанные терапевтом или эндокринологом препараты (антигипертензивные, кардиопротекторные, сахаропонижающие, ноотропные средства).
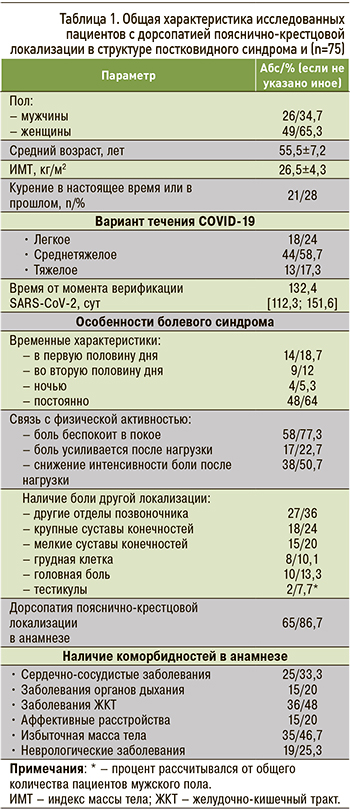
На момент начала исследования у большинства пациентов интенсивность болевого синдрома по ВАШ классифицировалась как «умеренная» (42,3±8,4 мм), а сами болевые ощущения, согласно анализу результатов тестирования по шкале LANSS, формировались в том числе за счет нейропатического механизма (14,6±2,3 баллов). После цифровой альгометрии на визите 1 было установлено, что и в зоне максимальной болезненности, расположенной в области нижней части спины (БПл – 3,85±1,1 кг/см2) и супрасегментарно, в проекции тенара правой руки (БПс – 4,78±1,4 кг/см2), отмечалось существенное снижение значений болевого порога по сравнению с параметрами, полученными в контрольной группе (табл. 2). При этом в целом пациенты отмечали умеренные функциональные ограничения в повседневной активности в связи с ПКС (3,0±0,4 баллов по PCFS).
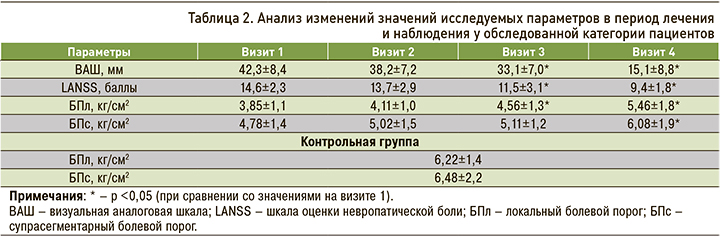
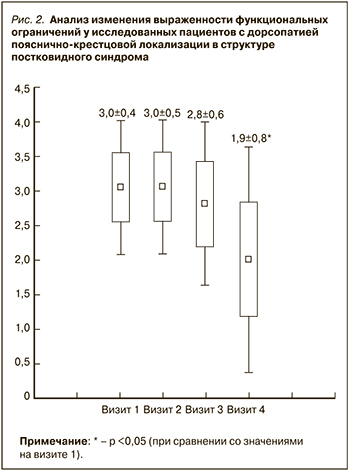
После начала терапии препаратом Алфлутоп выраженность болевого синдрома значимо изменилась к визиту 3 (42,3±8,4 против 33,1±7,0 мм; р <0,05), а после окончания наблюдения снизилась до уровня «незначительная» (15,1±8,8 мм, р <0,05). Сходная динамика наблюдалась и при анализе результатов тестирования по опроснику LANSS: к визиту 3 было выявлено значимое снижение среднего результата опросника до 11,5±3,1 баллов, а через 3 мес – до 9,4±1,8 баллов. Значимое повышение локального болевого порога (БПл) было зарегистрировано нами у обследованной категории больных на визите 3 (4,56±1,3 кг/ см2), максимальное – по завершении исследования (визит 4 – 5,46±1,8 кг/ см2). А вот супрасегментарный болевой порог (БПс) значимо изменился относительно изначального уровня только на финальном визите – 6,08±1,9 кг/см2. Также только на визите 4 было отмечено значимое улучшение функционального статуса обследованной категории больных согласно анализу результатов опросника PCFS (1,9±0,8 баллов, р <0,05; рис. 2). Дополнительный прием ибупрофена как средства неотложной помощи при болевом синдроме был необходим в течение первого (6,2±3,8 дней приема) и второго месяцев терапии (3,2±1,9 дней приема).
Примечательно, что применение препарата Алфлутоп ни в одном из рассматриваемых клинических случаев не вызывало нежелательных явлений.
ОБСУЖДЕНИЕ
Появление новых нозологий и принятие этого факта практикующим врачебным сообществом – настоящее событие в современной медицине. Вероятно, поэтому научные работы, посвященные исследованию особенностей ПКС, занимают особую роль на публикационном горизонте в отечественных и зарубежных журналах. В открытом наблюдательном исследовании мы анализировали течение ПКС у особой категории больных – пациентов, предъявляющих жалобы на боль в области нижней части спины. В целом необходимо отметить, что пациенты с мышечно-скелетной болью, согласно недавним статистическим данным, составляют от 4,6 до 23,6% всех больных с ПКС [9]. Любопытно, что как в нашей работе, так и по данным зарубежных коллег можно отметить 2 важных факта, применительно к особенностям развития болевого синдрома у пациентов с ПКС. Во-первых, на практике мы можем обнаружить несколько типов алгического синдрома у одного пациента. Так, в нашей работе наиболее частым сочетанием оказалась боль в области нижней части спины, артралгии и головная боль (для сравнения – в 75% случаев по данным Bileviciute-Ljungar I. et al. [10]). Во-вторых, у части пациентов болевые ощущение возникли de novo (в нашей работе у 13,3% обследованных); это свидетельствует о том, что мы вправе рассматривать инфицирование SARS-CoV-2 как отдельный независимый фактор хронизации болевого синдрома.
В большинстве случаев ДПКЛ при ПКС развивалась у женщин среднего возраста, перенесших среднетяжелое вариант коронавирусной инфекции. Эти данные согласуются с результатами других исследований, где среди факторов риска возникновения болевого синдрома в структуре ПКС выделяют возраст (средний и пожилой) и пол (женский) [11]. В настоящее время предполагается, что в основе развития боли у пациентов с ПКС лежат иммуноопосредованные механизмы [12], что находит косвенное подтверждение в нашем исследовании. Важной особенностью боли у обследованных пациентов был ее преимущественно воспалительный характер: боль в покое у 77,3% респондентов и снижение ее интенсивности после физической нагрузки в 50,7% случаев. В то же самое время в патогенезе развития алгического синдрома принимали участие и нейропатические механизмы (LANSS >14 баллов на визите 1). Кроме того, анализ результатов цифровой альгометрии свидетельствует о наличии феномена центральной и периферической сенситизации у пациентов с ДПКЛ в рамках ПКС, что предполагается и другими авторами, изучающими особенности болевых ощущение у пациентов, перенесших новую коронавирусную инфекцию [13]. Редким вариантом алгического синдрома, встречающегося в нашей выборке пациентов, оказалась тестикулярная боль (7,7% мужчин). Наличие боли в этой области у пациентов с ПКС объясняется высоким содержанием рецепторов к ангиотензинпревращающему ферменту типа 2 в тканях тестикул, к которым тропен SARS-CoV-2 [14].
К настоящему времени отсутствует фармакологическое или какое-либо другое лечение, достоверно позволяющее предотвратить или незамедлительно купировать симптоматику при ПКС. На наш взгляд, наиболее оптимальным подходом к ведению пациентов с ДПКЛ при ПКС является применение препаратов, позволяющих, с одной стороны, купировать иммуноопосредованное воспаление, а с другой – ускорить регенерацию хрящевой ткани. К таким лекарственным средствам можно отнести Алфлутоп – препарат, который обладает прямым хондропротективным эффектом и в то же время позволяет снизить продукцию ключевых белков, отвечающих за инициацию и персистирование процесса воспаления, – ФНО- α, ИЛ-6 и ИЛ-8 [15, 16]. Ранее исследования по эффективности применения препарата Алфлутоп в терапии боли в области нижней части спины в структуре ПКС не проводились.
В настоящей работе приняли участие 75 пациентов с ДПКЛ и ПКС. На фоне лечения Алфлутопом было достигнуто значимое снижение выраженности болевого синдрома, а также его нейропатического компонента и феномена периферической сенситизации через 1 мес после завершения курса терапии препаратом с достижением максимального эффекта от проводимого лечения через 3 мес от начала парентерального введения Алфлутопа, когда было отмечено значимое улучшение функционального статуса пациентов и минимальная интенсивность алгического синдрома.
Добавим, что эффективность применения препарата Алфлутоп в терапии дорсопатий была неоднократно продемонстрирована в исследованиях предыдущих лет [15, 17, 18], однако все они проводились до пандемии SARS-CoV-2 и не анализировали эффективность препарата в рамках ПКС. На наш взгляд, главной особенностью Алфлутопа, позволяющей добиться эффективного контроля над болью у пациентов с ДПКЛ и ПКС, является его способность результативно подавлять экспрессию специфических провоспалительных агентов (ФНО-α, ИЛ-6 и ИЛ-8), результатом чего становится бикомпонентное влияние препарата на процессы возникновения боли: периферическую и центральную сенситизацию.
ЗАКЛЮЧЕНИЕ
Широкий спектр клинических проявлений ПКС включает, помимо прочего, развитие хронического болевого синдрома, имеющего различную локализацию и характеристики. Для лечения ДПКЛ в структуре ПКС возможно применение препарата Алфлутоп, позволяющее достичь значимого снижения выраженности боли и улучшения функционального статуса пациентов в короткие сроки от момента начала терапии. Препарат хорошо переносился больными, включенными в исследование, что предполагает целесообразность его использования у коморбидных пациентов, поскольку Алфлутоп не вызывал нежелательных взаимодействий с лекарственными средствами, которые применяли для лечения сопутствующих патологий. Конечные механизмы реализации терапевтического эффекта препарата еще предстоит уточнить, однако, основываясь на анализе результатов предыдущих исследований, возможно предположить, что в реализации противоболевого действия Алфлутопа при ПКС лежит способность препарата подавлять нейровоспаление – базовый патогенетический механизм, ответственный за развитие хронической боли.



