ВВЕДЕНИЕ
Цереброваскулярные заболевания относятся к наиболее часто встречающимся в клинической практике неврологическим патологическим состояниям [1–3]. Особое место среди них занимает так называемая хроническая ишемия головного (ХИМ). По некоторым данным, в нашей стране она встречается с частотой 5,6 тыс. случаев на 100 000 человек и диагностируется примерно у 5% населения. ХИМ ассоциирована с широким спектром неврологических нарушений, включая двигательные, психоэмоциональные, когнитивные расстройства, что оказывает крайне негативное влияние на качество жизни пациентов [4]. Следует отметить, что среди них исключительную значимость имеют когнитивные нарушения (КН), которые также широко распространены в практике, характеризуются прогредиентным течением и в конечных своих стадиях приводят к деменции с возникновением зависимости пациента от посторонней помощи во всех аспектах повседневной жизни [4].
ХИМ характеризуются мультифакторной этиологией, в которой важнейшее значение имеют изменения со стороны церебрального сосудистого русла [5]. При этом одним из наиболее сильных факторов риска сосудистых КН служит артериальная гипертония (АГ) [6], поскольку головной мозг входит в число органов-мишеней этого заболевания. Повышенное артериальное давление (АД) становится причиной формирования болезни мелких сосудов, вызывающей появление в веществе головного мозга широкого спектра изменений, таких как лейкоареоз, лакунарные инфаркты, микрокровоизлияния. Указанные сосудистые поражения непосредственно ведут к развитию и прогрессированию КН [6, 7]. В действующих клинических рекомендациях по АГ как Минздрава России 2020 г. [6], так и Европейского общества по артериальной гипертензии (ESH) [8] эксперты обращают внимание на необходимость тестирования когнитивных функций у пациента с этим заболеванием, поскольку их снижение относится к самым ранним признакам поражения головного мозга как органа-мишени АГ.
Соответственно не вызывает сомнений актуальность поиска эффективных стратегий защиты головного мозга у пациентов с АГ как от осложнений, ассоциированных с поражением сосудистого русла, в целом, так и от развития и прогрессирования КН в частности. В связи с этим представляют интерес возможности применения этиметилгидроксипиридина сукцината (Мексидол®), который реализует на уровне организма мультимодальный спектр протективных эффектов (антигипоксантный, антиоксидантный, мембраностабилизирующий, защита от глутаматной эксайтотоксичности, стимуляция ангиогенеза), воздействуя в первую очередь на нейрональные и сосудистые нарушения и тем самым улучшая мозговое кровообращение, микроциркуляцию и оказывая нейропротекцию [9, 10].
Мексидол® имеет обширную доказательную базу клинической эффективности и безопасности у различных категорий пациентов [1, 9–14]. В частности, в 2021 г. были опубликованы результаты международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования МЕМО (МЕксидол – хроническая ишемия МОзга) по оценке эффективности и безопасности последовательной терапии препаратами Мексидол® и Мексидол® ФОРТЕ 250 у пациентов с ХИМ, общие результаты и выводы которого приведены в опорной публикации [1].
В настоящей статье представлены данные исследования МЕМО как субанализа сравнительной эффективности и безопасности Мексидола в группах пациентов с АГ и без нее в аспекте влияния препарата на когнитивное функции, а также на выраженность астенических, тревожных, вегетативных, двигательных нарушений и качество жизни в условиях хронической ишемии головного мозга.
МАТЕРИАЛ И МЕТОДЫ
Подробное описание дизайна исследования МЕМО, критериев включения, невключения, первичных и вторичных критериев эффективности, изучаемых показателей безопасности дано в опорной публикации [1].
РЕЗУЛЬТАТЫ
Для выполнения субанализа исследования МЕМО, посвященного сравнительной оценке эффектов препарата Мексидол® у пациентов с АГ, все участники были разделены на четыре подгруппы: 1-я (n=144) – пациенты с АГ, получавшие длительную последовательную терапию Мексидол® + Мексидол® ФОРТЕ 250; 2-я (n=146) – пациенты с АГ, получавшие плацебо; 3-я (n=15) – пациенты без АГ, получавшие длительную последовательную терапию Мексидол® + Мексидол® ФОРТЕ 250; 4-я (n=12) – пациенты без АГ, получавшие плацебо.
Исходная характеристика пациентов представлена в таблицах 1 и 2. Группы были сопоставимы между собой по всем исходным характеристикам и изучаемым параметрам, за исключением уровней систолического и диастолического АД, которые были выше в популяции пациентов с АГ (см. табл. 1). Статистически значимые различия (р=0,007) также имелись в исходном уровне баллов по шкале МоСА между группами пациентов, получавших Мексидол®, у которых АГ либо отсутствовала, либо имелась (см. табл. 2).
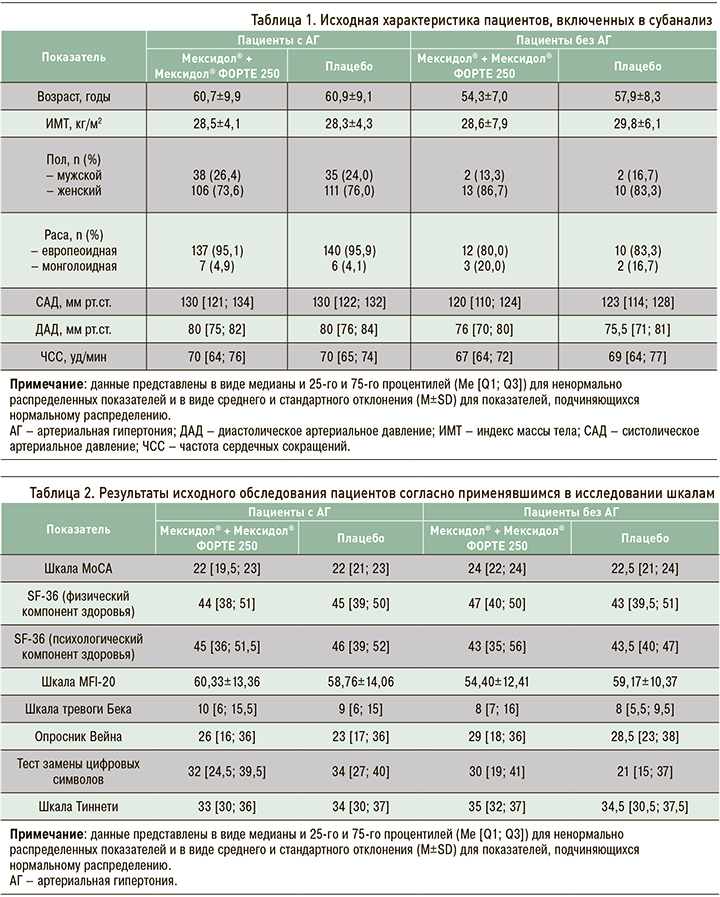
В соответствии с протоколом исследования основным критерием эффективности являлось среднее значение изменения балла по шкале MоCA на этапе завершения исследования пациентом (визит 5) по сравнению с исходным уровнем (визит 0; табл. 3). По результатам исследования, статистически значимые изменения баллов по шкале MoCA на этапе завершения исследования пациентом (визит 5) были выявлены при сравнении динамики между группами Мексидол® + Мексидол® ФОРТЕ 250 в подгруппе пациентов с АГ и Плацебо в подгруппе пациентов с АГ (p=0,000). Нижняя граница 95% доверительного интервала (ДИ) для разности средних основного показателя эффективности в группах Мексидол® + Мексидол® ФОРТЕ 250 в подгруппе пациентов с АГ и Плацебо в подгруппе пациентов с АГ составила 1,51. Данная граница является положительной величиной, что позволяет констатировать превосходство в эффективности последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250 над Плацебо в подгруппе пациентов с АГ.
Для других сравнений подтвержденных статистически значимых различий выявлено не было. Кроме того, именно в группах длительной последовательной терапии препаратами линейки Мексидол® медианное значение балла по шкале МоСА в конце периода наблюдения (визит 5) достигло уровня нормы (26 баллов) как у пациентов с АГ, так и без таковой. В группе плацебо медиана суммарного балла по шкале МоСА на визите 5 составила 24 балла для пациентов с АГ и 25,5 – для лиц без этого заболевания (см. табл. 3).
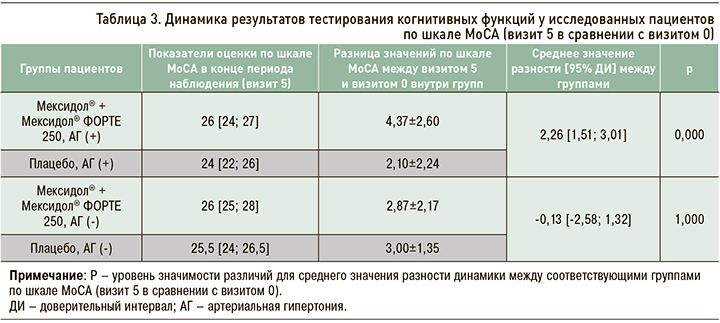
При сравнении медианы изменения баллов по шкале MoCA на разных визитах относительно исходного уровня уже начиная со 2-го визита были отмечены статистически значимые различия динамики баллов между группами Мексидол® + Мексидол® ФОРТЕ 250 в подгруппе пациентов с АГ и Плацебо в подгруппе пациентов с АГ (p=0,000 во всех случаях при сравнении динамики между группами на визитах 2, 4, 5). Далее на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250 была отмечена нарастающая положительная динамика в подгруппе пациентов с АГ (рис. 1).
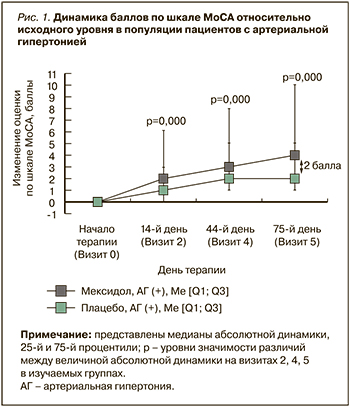
Динамика состояния пациентов, согласно тесту замены цифровых символов, оценивалась по результатам, полученным на визитах 2, 4 и 5 в сравнении с данными, зафиксированными на визите рандомизации (визит 1). В популяции пациентов с АГ были выявлены статистически значимые (p=0,000) различия между группами Мексидол® + Мексидол® ФОРТЕ 250 и Плацебо в величине медиан абсолютной динамики (8,00 [4,00; 16,00] и 4,00 [0,00; 10,00] баллов соответственно) в тесте замены цифровых символов на визите 5 относительно исходного уровня (табл. 4, рис. 2). Других статистически значимых различий в абсолютной динамике результатов между группами в этом тесте обнаружено не было. Таким образом, в группе пациентов с АГ, получавших Мексидол®, по сравнению с группой пациентов с АГ, получавших плацебо, в тесте замены цифровых символов была выявлена статистически значимо большая величина положительной динамики показателей: различия в медианах абсолютной динамики между группами составили 4 балла в пользу группы пациентов с АГ, применявших Мексидол®.
При оценке результатов по шкале астении MFI- 20 на визите 5 в сравнении с их исходным уровнем на визите 1 были выявлены статистически значимые различия в абсолютной динамике баллов между подгруппами Мексидол® + Мексидол® ФОРТЕ 250 (АГ+) и Плацебо (АГ+), причем статистической значимости они достигли уже на визите 4 (p=0,000 табл. 5). Такие результаты свидетельствуют о нарастающей положительной динамике при оценке по шкале MFI-20 на фоне длительной последовательной терапии препаратами линейки Мексидол® у пациентов с АГ. Других статистических значимых различий при попарных сравнениях динамики на визитах 2, 4, 5 по сравнению с исходным уровнем по шкале MFI-20 в изучаемых подгруппах обнаружено не было.
Изменения показателей по шкале Бека оценивались по результатам, полученным на визитах 2, 4 и 5, относительно результатов на визите рандомизации (визит 1). В популяции пациентов с АГ, начиная с визита 4, были установлены статистически значимые различия между группами Мексидол® + Мексидол® ФОРТЕ 250 и Плацебо в величине медиан абсолютной динамики по шкале Бека в сравнении с исходными значениями (табл. 6): к визиту 5 эти показатели составили -4,00 [-8,00; -1,00] и -1,00 [-4,00; 1,00] баллов соответственно (p=0,000). Других статистически значимых различий в абсолютной динамике результатов между группами по рассматриваемой шкале зафиксировано не было. Подобные результаты свидетельствуют о нарастающей положительной динамике в виде уменьшения уровня тревоги на фоне длительной последовательной терапии препаратами Мексидол® + Мексидол® ФОРТЕ 250 у пациентов с АГ.
При анализе результатов тестирования по опроснику Вейна в динамике статистически значимых различий выявлено не было. Вместе с тем наблюдалась тенденция к прогрессивному снижению количества баллов по данному опроснику среди пациентов с АГ, получавших последовательную терапию препаратами Мексидол® + Мексидол® ФОРТЕ 250, начиная с визита 4 (по сравнению с визитом 1), что, в свою очередь, указывает на некоторое уменьшение выраженности вегетативных нарушений на фоне изучаемой терапии.
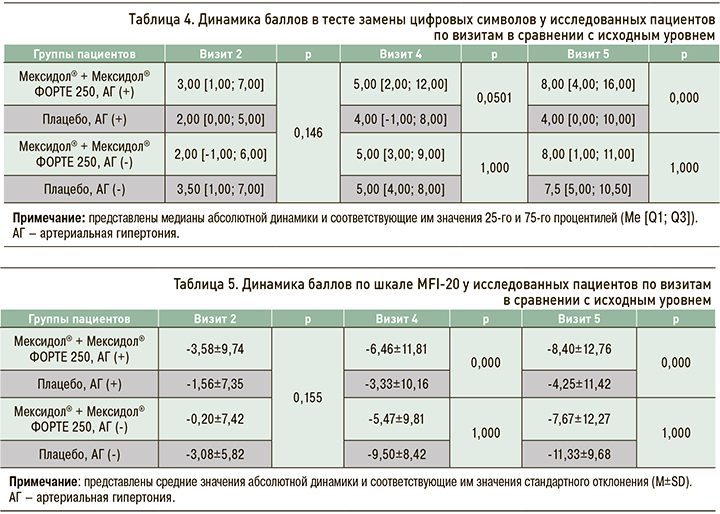
Изменения баллов по шкале Тинетти оценивались по результатам, полученным на визитах 2, 4 и 5, в сопоставлении с результатами на визите рандомизации (визит 1). При анализе этих изменений в популяции пациентов с АГ были обнаружены статистически значимые различия между группами Мексидол® + Мексидол® ФОРТЕ 250 и Плацебо в величине медиан абсолютной динамики по сравнению с исходным уровнем уже на визитах 2 и 4, а к визиту 5 они составили соответственно,3,00 [1,00; 6,00] и 1,00 [0,00; 4,00] баллов (р=0,000; табл. 7 и рис. 3). Других статически значимых различий между группами в динамике результатов по шкале Тинетти установлено не было. Таким образом, при длительной последовательной терапии препаратами Мексидол® + Мексидол® ФОРТЕ 250 у пациентов с АГ отмечалась нарастающая в своей выраженности положительная динамика показателей по шкале равновесия и ходьбы Тиннети.
В динамике баллов по опроснику SF-36 (физический компонент здоровья) ни на одном из визитов статистически значимых различий выявлено не было. Вместе с тем наблюдалась тенденция к нарастанию количества баллов по данному опроснику среди пациентов с АГ, получавших последовательную терапию препаратами Мексидол® + Мексидол® ФОРТЕ 250, начиная с Визита 4 (по сравнению с Визитом 1), что указывает на тенденцию к улучшению физического компонента здоровья.
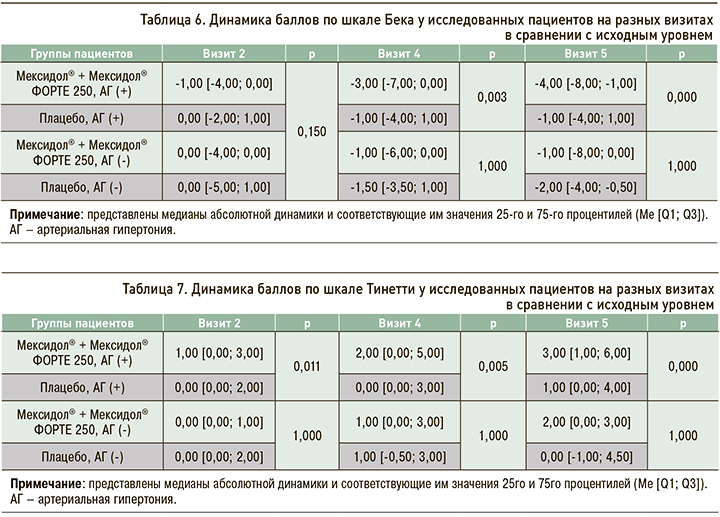
При анализе изменений в психологическом компоненте здоровья согласно опроснику SF-36 среди пациентов с АГ были обнаружены статистически значимые (p=0,000) различия между группами Мексидол® + Мексидол® ФОРТЕ 250 и Плацебо в величине медиан абсолютной динамики на визите 5 относительно исходного уровня: 5,50 [1,00; 11,00] и 1,00 [-2,00; 8,00] баллов соответственно, т.е. +4,5 балла в пользу группы активной терапии (табл. 8, рис. 4). Других статистически значимых различий между группами в абсолютной динамике результатов этого теста обнаружено не было. Полученные результаты демонстрируют статистически значимое улучшение в психологическом аспекте качества жизни в группе пациентов с АГ, применявших Мексидол® + Мексидол® ФОРТЕ 250, по сравнению с группой больных с АГ, получавших плацебо.
Динамика показателей Шкалы общего клинического впечатления (CGI) оценивалась по значениям, зафиксированным на визитах 2 и 5 (табл. 9 и 10), в сравнении с данными, полученными на визите рандомизации (визит 1).
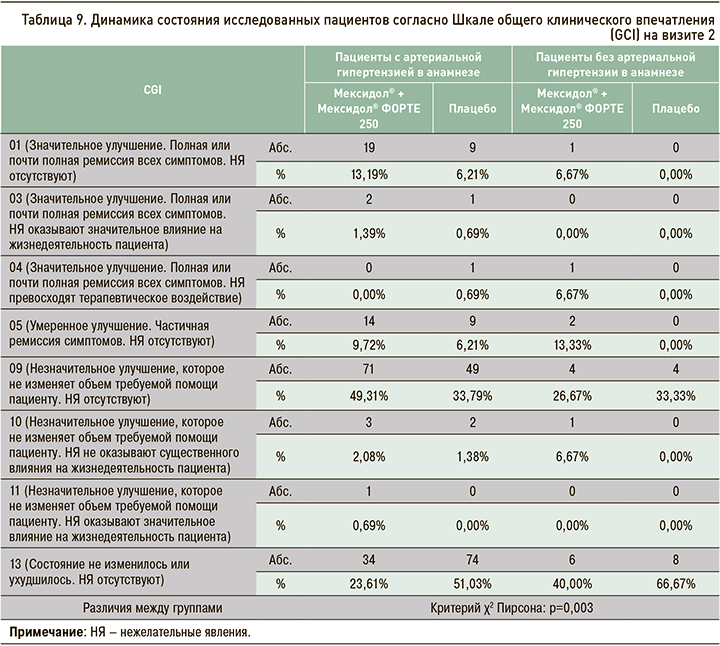
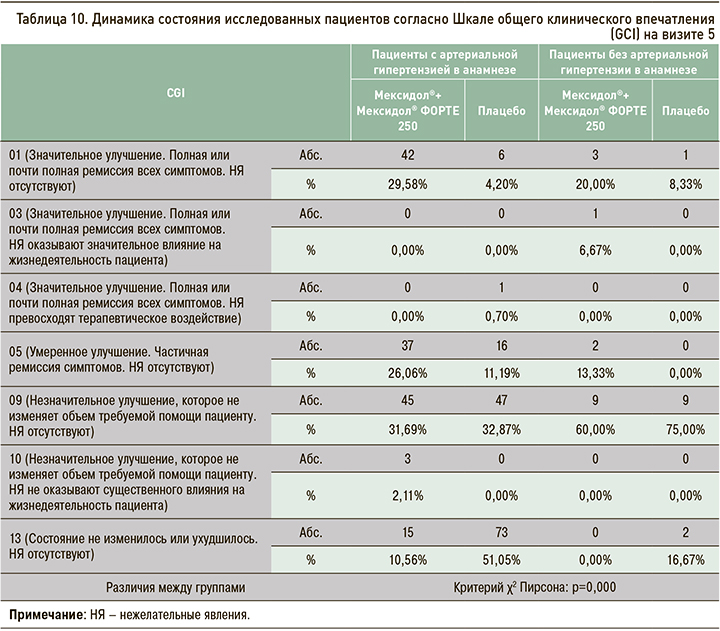
Обращает на себя внимание, что, согласно шкале CGI, именно среди пациентов, получавших последовательную терапию препаратами Мексидол® + Мексидол®, и преимущественно в группе участников с АГ наблюдалась более частая встречаемость положительного терапевтического эффекта, описываемого как улучшение разной степени выраженности и сочетавшегося в большинстве случаев с полным отсутствием нежелательных явлений. Подобная статистически значимая структура результатов отмечалась, начиная уже с визита 2, и становилась более отчетливой и значимой на визите 5.
Безопасность терапии. Среди участников исследования с АГ было зарегистрировано 50 нежелательных явлений (НЯ), ни одно из которых не было серьезным. НЯ были выявлены у 15 (10,42%) пациентов в группе Мексидол® + Мексидол® ФОРТЕ 250 (всего 19 НЯ) и у 19 (12,93%) – в группе Плацебо (всего 31 НЯ). Различия между группами по частоте обнаружения НЯ оказались статистически незначимы (p=0,505). Все зарегистрированные в настоящем исследовании НЯ имели легкую и умеренную степени тяжести, причем в обеих группах подавляющее большинство НЯ (45) соответствовало легкой степени: 19 (100,00%) в группе Мексидол® + Мексидол® ФОРТЕ 250 и 26 (83,87%) в группе Плацебо. Различия между группами по степени тяжести побочных эффектов также были статистически незначимы (p=0,142). В большинстве случаев (36) НЯ в обеих группах разрешались самостоятельно (13 (68,42%) в группе Мексидол® + Мексидол® ФОРТЕ 250 и 23 (74,19%) в группе Плацебо), и никакие дополнительные действия для их купирования не требовались.
ОБСУЖДЕНИЕ
В исследовании МЕМО первичным критерием эффективности служила динамика среднего балла по шкале МоСА. MoCA-тест представляет собой инструмент диагностики КН, в том числе сосудистого генеза, который оценивает различные когнитивные функции: внимание, планирование и контроль, память, зрительно-пространственные способности, абстрагирование, способность к счету и ориентацию [15–17]. Максимально возможное количество баллов по данному тесту составляет 30, нормальным считается показатель ≥26 баллов. В представленном субанализе исследования МЕМО длительная последовательная терапия препаратами Мексидол® + Мексидол® ФОРТЕ 250 у пациентов с АГ продемонстрировала более высокую эффективность по сравнению с плацебо в отношении когнитивного функционирования при его оценке по шкале МоСА. Эффективность указанной терапии подтверждалась нарастающей положительной динамикой результатов MoCA-теста, уже начиная с визита 2, и ее статистически значимо большей выраженностью по сравнению с группой плацебо. Показателен факт достижения уровня нормы по этому тесту (согласно медиане общего балла) среди больных, получавших Мексидол® + Мексидол® ФОРТЕ 250, как в подгруппе пациентов с АГ, так и без таковой.
В дополнение к этому в популяции исследованных пациентов с АГ, получавших длительную последовательную терапию препаратами Мексидол® + Мексидол® ФОРТЕ 250, наблюдалось статистически значимо (p=0,000) более выраженное увеличение баллов по тесту замены цифровых символов на визите 5 относительно исходного уровня в сравнении с больными АГ, рандомизированными в группу плацебо; это также доказывает улучшение когнитивного функционирования на фоне изучаемой терапии. Тест замены цифровых символов [18–20] оценивает в целом состояние психомоторных процессов: скорость обработки зрительно-пространственной информации, оперативную память, концентрацию и поддержание внимания. Считается [21], что преимущество этого теста заключается в его способности выявлять лиц с самыми начальными признаками КН.
Результаты настоящего субанализа в аспекте регресса когнитивных расстройств на фоне активной терапии соотносятся, в частности, с данными исследования Е.В. Болотовой с соавт. [10], в котором изучались эффективность и переносимость препарата Мексидол® как корректора КН у пациентов с АГ и клиническими проявлениями хронической недостаточности мозгового кровообращения. Было сформировано две группы пациентов с АГ: в первой пациенты получали только антигипертензивную терапию, во второй в дополнение к ней назначался Мексидол®. На фоне последовательной терапии препаратом Мексидол® (внутривенно струйно в суточной дозировке 200 мг в течение 10 дней, далее перорально 500 мг/сут в продолжение еще 6,5 нед, улучшение памяти отметили 50%, концентрацию внимания – 55%, исчезновение тревожности – 67% пациентов. В группе активной терапии этилметилгидроксипирина сукцинатом наблюдалась статистически значимо (p <0,02) более выраженная положительная динамика в тесте рисования часов, достигшая уровня +0,95 балла; в группе рутинной антигипертензивной терапии аналогичный показатель составил +0,54. Только в группе Мексидола имело место статистически значимое увеличение количество баллов по шкале МоСА (с 24,4±0,7 исходно до 26,5±0,9 баллов в конце периода наблюдения) и краткой шкале оценки психического статуса (с 26,85±1,1 исходно до 28,71±0,8 в конце периода набдения; p<0,001 в обоих случаях). Полученные результаты свидетельствуют об эффективности Мексидола в плане регресса КН сосудистого и нейродегенеративного генеза.
В исследовании МЕМО способность к двигательной активности оценивалась с помощью шкалы Тинетти [22, 23]. В подгруппе пациентов с АГ в настоящем субанализе была выявлена нарастающая по своей выраженности положительная динамика показателей шкалы Тинетти на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250, что говорит об улучшении двигательной активности, включая улучшение показателей равновесия и ходьбы.
Такие результаты соотносятся с выводами исследования Е.И. Чукановой и А.С. Чукановой [14], в котором выполнялся анализ эффективности и безопасности применения этиметилгидроксипиридина сукцината в форме внутривенных капельных инфузий (500 мг 1 раз/сут) на протяжении 14 дней с дальнейшим переходом на пероральный прием препарата (Мексидол® ФОРТЕ 250 в дозе 250 мг 3 раза/сут) в течение последующих 60 дней у пациентов с хронической ишемией головного мозга на фоне АГ и атеросклеротического поражения сосудов. В это исследование вошли 60 пациентов, составивших две группы по 30 человек: первая группа получала Мексидол® по описанной выше схеме, вторая представляла собой группу контроля, сопоставимую с основной по возрасту, факторам риска и степени выраженности неврологических нарушений. Пациенты обеих групп получали базисную терапию, направленную на коррекцию имеющихся факторов риска и сопутствующих состояний (антигипертензивные, кардиотропные, антитромботические средства по показаниям). Двигательные нарушения анализировались посредством шкалы Тинетти. При исходной оценке параметров двигательной активности по этой шкале у пациентов основной группы, получавших Мексидол®, средний балл составлял 25,9±1,9. В последующем на втором визите (на 14-е сутки терапии) этот показатель возрос на 7,3 балла и составил 33,2±2,4 (р <0,05 по сравнению с исходным уровнем), а в конце периода наблюдения (третий визит на 74-е сутки) статистически значимо увеличился до 38,7±2,1 баллов (р <0,01 относительно исходного уровня). В группе контроля динамика балльной оценки по шкале Тинетти статистически значимо не изменялась и равнялась 25,5±1,8 баллов исходно, 26,2±1,9 баллов на визите 2 и 25,2±2,3 баллов на визите 3.
В ходе исследования МЕМО и настоящего субанализа анализировалось влияние терапии препаратом Мексидол® на выраженность симптомов астении по шкале MFI-20 [24]. В настоящем субанализе также была установлена нарастающая положительная динамика при оценке по шкале MFI-20 на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250 у пациентов с АГ, что доказывает регресс выраженности астении.
Сходные результаты были получены в работе Е.И. Чукановой с соавт. [12], где изучались эффективность и безопасность включения Мексидол® ФОРТЕ 250 в комплексную терапию хронической церебральной венозной недостаточности. Было сформировано 3 группы участников: в первой (n=40) пациентам назначались перорально Мексидол® ФОРТЕ 250 и диосмин + гесперидин в течение 74 дней в сочетании с двумя курсами L-лизина эсцината внутривенно на 1-е и 30-е сутки от начала лечения; во второй (n=40) применялись перорально Мексидол® ФОРТЕ 250 и диосмин + гесперидин в течение 74 дней; в третьей (n=40) использовался только пероральный препарат, содержащий диосмин + гесперидин, на протяжении тех же 74 дней. Среди прочих результатов в первой и второй группах (где в комплексную терапию добавлялся этилметилгидроксипиридина сукцинат) отмечалась статистически значимая положительная динамика показателей по шкале MFI-20, иллюстрирующая уменьшение симптоматики астении: уже на 37-е сутки от начала наблюдения произошло снижение среднего балла по указанной шкале с 23,5±5,0 до 12,2±4,5 и с 22,0±4,6 до 11,9±3,0 в первой и второй группах соответственно (p <0,05 в обоих случаях). В дальнейшем положительная динамика сохранялась, и к 74-м суткам наблюдения общий балл по MFI-20 снизился до 10,0±4,2 балла в первой группе и до 10,1±4,1 во второй (p <0,001 в обоих случаях). При этом статистически значимых изменений результатов по шкале MFI-20 у пациентов третьей группы, не получавших этилметилгидроксипиридина сукцинат, выявлено не было.
В субанализе исследования МЕМО в популяции пациентов с АГ была обнаружена нарастающая положительная динамика в виде уменьшения уровня тревоги по шкале Бека на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250, причем абсолютная величина динамики этого показателя была статистически значимо более выражена на визитах 4 и 5 (р=0,003 и р=0,000) по сравнению с группой плацебо.
Выраженность вегетативных нарушений оценивалась согласно опроснику Вейна [25]. В настоящем субанализе наблюдалась тенденция к прогрессивному снижению количества баллов по опроснику Вейна среди пациентов с АГ, получавших Мексидол® + Мексидол® ФОРТЕ 250, начиная с визита 4 (по сравнению с визитом 1), что демонстрирует уменьшение выраженности вегетативных нарушений на фоне изучаемой терапии.
В упомянутой выше работе Е.И. Чукановой с соавт. [12] были получены схожие результаты. В ней уровень тревоги оценивали с помощью шкалы тревоги Гамильтона. У пациентов первой группы, где в комплексной терапии применялся Мексидол®, отмечалась положительная статистически значимая динамика по данной шкале: исходно больные имели 15,9±6,8 баллов, к 37-м суткам показатель снизился до 6,9±1,1 баллов (p <0,05), а на 74-е сутки достиг 3,1±0,7 (p <0,001), что говорит об отсутствии тревожных нарушений. Аналогичные результаты были получены и у пациентов второй группы, где в комплексное лечение также включался Мексидол®: при исходном показателе по шкале тревоги Гамильтона в 15,5±7,7 баллов к 37-м суткам терапии наблюдалась тенденция к нормализации эмоционального состояния в виде снижения суммарного балла до 8,1±2,4 баллов, а в конце периода наблюдения (на 74 сутки) результат составлял 3,7±1,1 баллов (p <0,05 по сравнению с исходным уровнем). В третьей группе пациентов, не получавших этилметилгидроксипиридина сукцинат в составе комплексной терапии, статистически значимых изменений по рассматриваемой шкале обнаружено не было. У пациентов, применявших Мексидол®, также снизилась тяжесть вегетативных нарушений по модифицированному опроснику Вейна с исходных 28,0±6,0 баллов в группе 1 и 26,1±6,5 баллов в группе 2 до 6,7±3,1 баллов (p <0,001) и 7,6±3,9 баллов (p <0,05) соответственно. В третьей группе статистически значимых изменений показателей по опроснику Вейна не отмечалось.
Показатели качества жизни в исследовании МЕМО оценивались посредством опросника SF-36 [26, 27]. В описываемом субанализе на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250 наблюдалась тенденция к нарастанию количества баллов в физическом компоненте здоровья по опроснику SF-36 среди пациентов с АГ. Также на визите 5 медиана абсолютной динамики психологического компонента здоровья по данным SF-36 была статистически значимо (р=0,000) выше у пациентов с АГ, получавших Мексидол® + Мексидол® ФОРТЕ 250, по сравнению с больными АГ, принимавшими плацебо.
Это соотносится с результатами исследования препарата Мексидол® у пациентов с хронической ишемией головного мозга [11], в котором на фоне проводимой терапии показатель оценки с пересчетом полезности по шкале качества жизни SF-36 при исходном значении в 0,6±0,07 баллов к 14-м суткам достиг 0,8±0,03 (p <0,05), а к концу периода наблюдения (74-е сутки) увеличился до 0,9±0,02 баллов (p <0,01). В то же время в группе сравнения в этой работе статистически значимых изменений по шкале SF-36 обнаружено не было.
Наконец, в настоящем субанализе преимущественно у пациентов с АГ на фоне длительной последовательной терапии Мексидол® + Мексидол® ФОРТЕ 250 в соответствии с данными Шкалы общего клинического впечатления (GCI) отмечалась более частая встречаемость положительного терапевтического эффекта, описываемого как улучшение разной степени выраженности и сочетающегося в большинстве случаев с полным отсутствием НЯ.
В целом подобные преимущества Мексидола у пациентов с АГ с ХИМ, и прежде всего его высокая эффективность в аспекте торможения прогрессирования и регресса сосудистых КН, можно объяснить мультимодальным спектром терапевтических влияний препарата, включающих выраженные антиоксидантные, мебмраностабилизирующие и антигипоксантные свойства [13]. Препарат обеспечивает также непосредственную нейрональную защиту посредством прямого действия на дыхательную цепь митохондрий, способствуя ее восстановлению при ишемии и гипоксии и активируя энергообмен в нейроне [13]. Мексидол® угнетает глутамат-индуцируемую эксайтотоксичность, аскорбат-зависимое и НАДФН2-зависимое перекисное окисление липидов, протекающее при участии ионов железа, связывает супероксидный анион-радикал, повышает активность селен-зависимой глутатионпероксидазы, обеспечивая подавление оксидативного стресса [28]. В дополнение к этому доказана способность Мексидола тормозить АДФ-индуцированную агрегацию тромбоцитов, улучшать функцию эндотелия и реологию крови за счет повышения соотношения простациклин/тромбоксан А2 [14]. В условиях применения этилметигидроксипиридина сукцината улучшается антиагрегационный профиль сосудистой стенки и показатели эндотелий-зависимой вазодилатации [13]. Такой спектр мультимодальных плейотропных эффектов Мексидола может лежать в основе всех тех положительных эффектов на уровне центральной нервной системы, которые были продемонстрированы в приведенном субанализе исследования МЕМО у пациентов с АГ.
ЗАКЛЮЧЕНИЕ
Таким образом, принимая во внимание высокую клиническую эффективность препарата Мексидол®, сочетающуюся с благоприятным профилем безопасности, возможно рекомендовать использование этого препарата в клинической практике в комплексной терапии пациентов с АГ и ХИМ. В данном случае Мексидол® выступает в качестве фармакологического «инструмента» защиты головного мозга как органа-мишени при АГ и средства патогенетически обоснованной терапии когнитивных, эмоциональных, вегетативных и двигательных нарушений. Рекомендованная схема терапии, подтвердившая свою эффективность и высокий профиль безопасности у пациентов с ХИМ на фоне АГ: инъекции по 500 мг/ сут в течение 14 дней с последующим применением таблеток Мексидол® ФОРТЕ 250 по 250 мг 3 раза/ сут в течение 2 мес.



