Эпидемиологическая ситуация в мире по заболеваемости острыми кишечными инфекциями (ОКИ) остается на стабильно неблагоприятном уровне. С января по июнь 2015 г. в Российской Федерации был зарегистрирован 16 491 случай сальмонеллезной инфекции, более половины приходилось на детей в возрасте до 14 лет (8161 пациент). Показатель заболеваемости на 100 тыс. населения другими ОКИ, вызванными установленными бактериальными, вирусными возбудителями, а также пищевые токсикоинфекции установленной этиологии, составил в указанный период 98,3, а для детского населения – 511,8. Для ОКИ неустановленной этиологии этот показатель за первые 6 месяцев 2015 г. равнялся 170,0, а для детей – 556,6 на 100 тыс. населения. Высокие показатели заболеваемости (от 13,06 до 44,98 на 100 тыс. населения) зарегистрированы в Ненецком, Ханты-Мансийском, Ямало-Ненецком автономных округах, в Томской, Тамбовской, Липецкой, Иркутской, Новосибирской, Амурской, Оренбургской, Кемеровской, Калининградской областях, республиках Коми, Мордовия, Саха [1].
Этиологическая структура ОКИ в настоящее время характеризуется преобладанием вирусных агентов над бактериальными. При этом доминирующими возбудителями являются рота- и норовирусные инфекции. Следует отметить, что норовирусная инфекция играет большую роль во вспышках ОКИ, а также в случае развития инфекций, связанных с оказанием медицинской помощи. Среди бактериальных инфекций лидирующие позиции в этиологической структуре занимают сальмонеллез и кампилобактериоз [2].
К сожалению, в рутинной клинической практике этиология ОКИ в большинстве случаев остается неустановленной. В таких случаях диагноз выставляется посиндромно: гастрит, гастроэнтерит, энтерит, энтероколит, колит, гемоколит или тотальное поражение всего желудочно-кишечного тракта (ЖКТ) – гастроэнтероколит (табл. 1) [3].

Установление этиопатогенетической группы диареи является важным компонентом тактики терапии: водянистая диарея в большинстве случаев вызвана вирусами и требует назначения в качестве этиотропной терапии противовирусных препаратов, инвазивная – относится к бактериальным ОКИ, что диктует необходимость рассмотрения антибактериальной терапии.
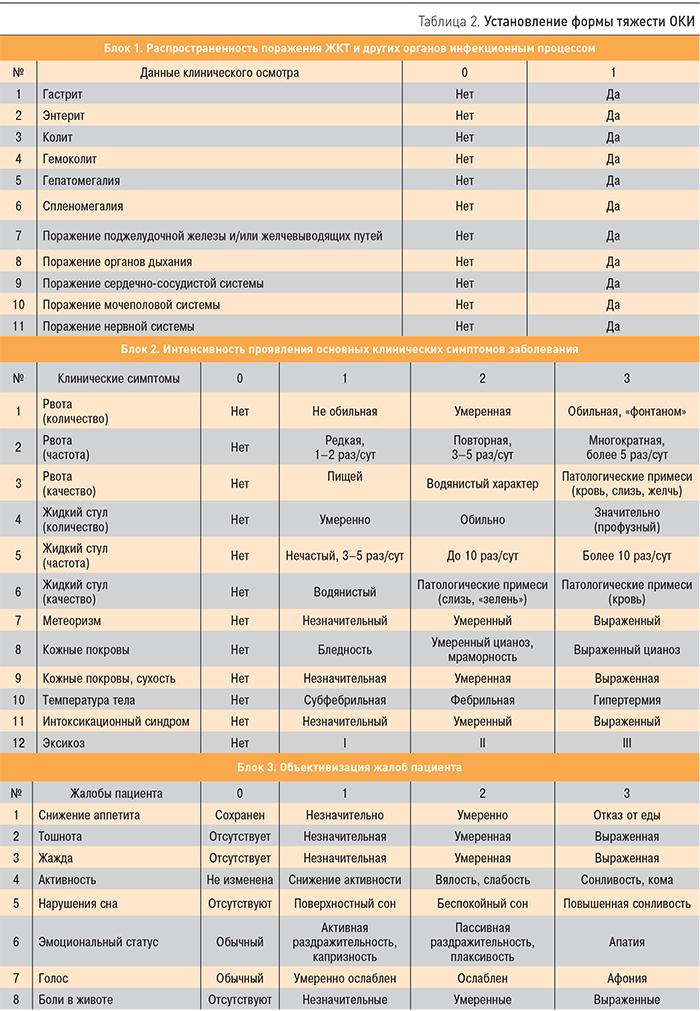
По форме тяжести ОКИ подразделяются на легкую, среднюю и тяжелую. Установление формы тяжести заболевания осуществляется путем интегрального анализа клинических данных по трем блокам:
- распространенность поражения ЖКТ и других органов инфекционным процессом;
- интенсивность проявления основных клинических симптомов заболевания;
- объективизация жалоб пациента [4].
Симптомы из представленного в блоках перечня (табл. 2) оцениваются по их наличию (есть или нет – блок 1), а также по интенсивности проявлений в соответствии с предлагаемой шкалой (блоки 2 и 3). У пациента могут отмечаться не все клинические проявления данного заболевания, представленные в блоках. В таком случае оценка проводится по имеющимся симптомам, отсутствующие проявления заболевания не учитываются. Данный метод интегральной оценки клинических данных применим как в терапевтической, так и в педиатрической практике.
Установление формы тяжести можно проводить визуально: чем больше пунктов отмечено в блоке 1 и чем больше суммарное количество баллов в блоках 2 и 3, тем более тяжелая форма заболевания отмечается у больного. Однако более предпочтительным является расчет интегрального индекса клинических симптомов, который осуществляется по формуле:
ИИКС = ((А×100/11) + (В×100/36) + (С×100/24))/3,
где показатель А – сумма положительных значений для каждого пункта блока 1, В и С– сумма положительных значений для каждого пункта блоков 2 и 3 соответственно.
Значения данного показателя в пределах от 1 до 35% относятся к легкой форме, от 36 до 70% – к среднетяжелой, а 71% и более – к тяжелой форме заболевания.
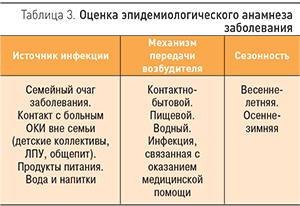
Одним из важных компонентов ведения больных ОКИ является оценка эпидемиологического анамнеза заболевания, которую наиболее удобно проводить по следующей схеме (табл. 3).
Эпидемиологический анамнез необходим врачу, чтобы сориентироваться в этиологии заболевания. Так, пищевой и водный пути передачи более характерны для бактериальных ОКИ, контактно-бытовой – для вирусных агентов. В осенне-зимний период отмечается подъем заболеваемости вирусными ОКИ, в летний – бактериальными.
 На каждый случай инфекционного заболевания (подозрения) заполняют экстренное извещение по форме № 58, которое должно быть передано в течение 12 ч в территориальный центр Роспотребнадзора по месту регистрации заболевания (независимо от места жительства больного). ЛПУ, уточнившее или изменившее диагноз, обязано составить новое экстренное извещение и в течение 24 ч отослать его в центр Роспотребнадзора по месту обнаружения заболевания, указав измененный диагноз, дату его установления, первоначальный диагноз и результаты лабораторного обследования [3].
На каждый случай инфекционного заболевания (подозрения) заполняют экстренное извещение по форме № 58, которое должно быть передано в течение 12 ч в территориальный центр Роспотребнадзора по месту регистрации заболевания (независимо от места жительства больного). ЛПУ, уточнившее или изменившее диагноз, обязано составить новое экстренное извещение и в течение 24 ч отослать его в центр Роспотребнадзора по месту обнаружения заболевания, указав измененный диагноз, дату его установления, первоначальный диагноз и результаты лабораторного обследования [3].
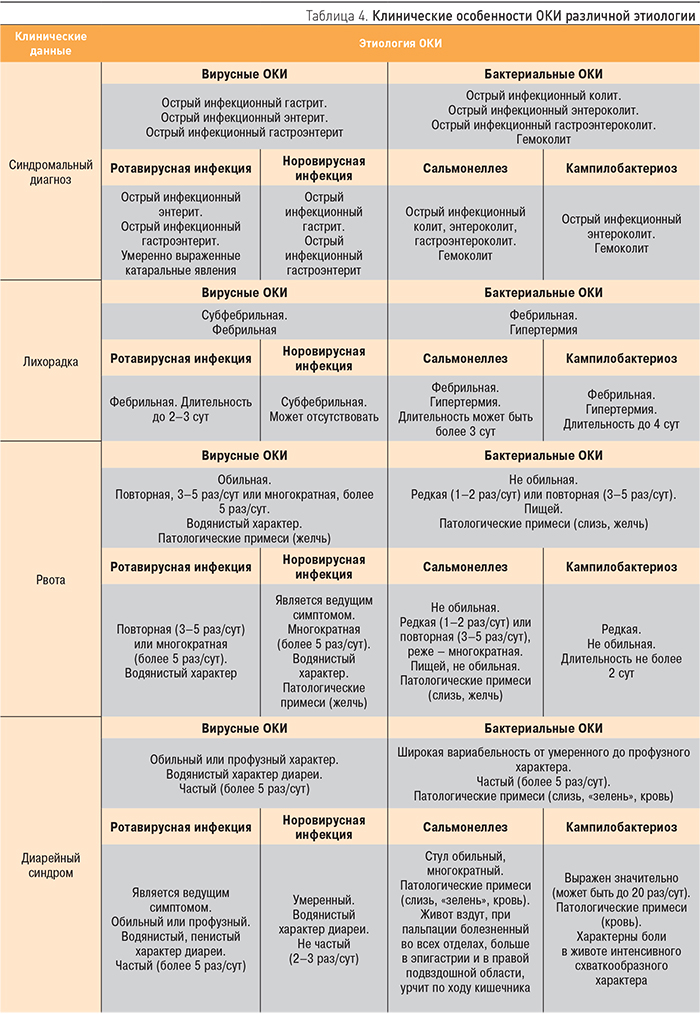
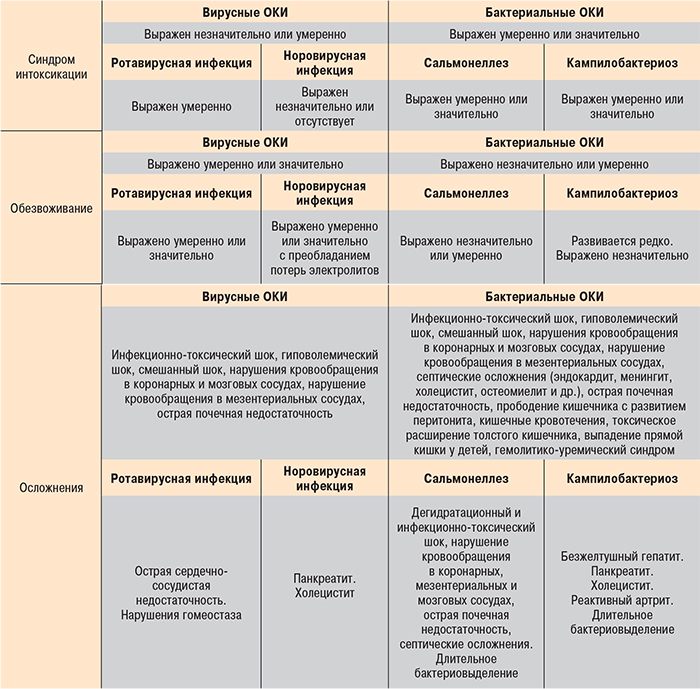
Дифференциальная диагностика ОКИ основывается на клинических особенностях ведущих синдромов – поражении ЖКТ, синдроме интоксикации и развитии дегидратации (табл. 4) и клинико-лабораторном подтверждении этиологии заболевания (табл. 5). Клинико-лабораторное обследование пациентов с ОКИ должно осуществляться поэтапно:
- 1-й этап – предварительная клиническая диагностика;
- 2-й этап – окончательная диагностика, основанная на результатах данных лабораторных и инструментальных методов диагностики, оценке дальнейшей динамики клинических проявлений болезни;
- 3-й этап – диагностика в периоде реконвалесценции (оценка санации от возбудителя, состояния органов гепатобилиарной системы, микрофлоры ЖКТ и т.п.).
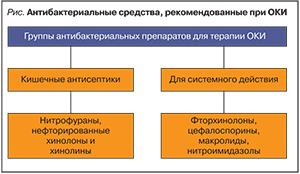
Дифференциальная диагностика ОКИ с другими заболеваниями зависит от возраста пациента (табл. 6).
Терапевтическая тактика при ОКИ у конкретного пациента базируется на знании или предположении (на основании клинических особенностей, данных эпидемиологического анамнеза) об этиологии заболевания: бактериальная или вирусная инфекция. Кроме того, необходимо учитывать возраст пациента, особенности его преморбидного фона и период заболевания. Схема терапевтической тактики при ОКИ в зависимости от типа диареи и периода заболевания приведена в табл. 7.
Этиотропная терапия является ключевым звеном и имеет три основных направления:
- устранение возбудителя инфекции (антибактериальные, противовирусные, противопаразитарные препараты, бактериофаги);
- связывание возбудителя (специфические антитела и сыворотки, сорбенты);
- выведение (сорбенты) [3, 5].
Противовирусные препараты рекомендованы при вирусных ОКИ. Показаниями к их назначению являются:
- установленная вирусная этиология ОКИ; в связи с этим представляется целесообразным более широкое использование в рутинной клинической практике экспресс-тестов для быстрой диагностики вирусной этиологии ОКИ;
- предполагаемая вирусная этиология ОКИ (заболевание в форме острого инфекционного гастрита, энтерита, гастроэнтерита; зимний период; «вспышечная» заболеваемость);
- раннее обращение за медицинской помощью;
- профилактика инфекций, связанных с оказанием медицинской помощи, вирусной этиологии (ротавирусная, норовирусная инфекции).
Среди противовирусных препаратов эффективность в клинических исследованиях показали препараты, содержащие аффинно очищенные антитела к гамма-интерферону человека, интерферон альфа-2b в сочетании с таурином, метилфенилтиометил-диметиламинометил-гидроксиброминдол карбоновой кислоты этиловый эфир (умифеновир) [6–9].
Вопросы антибактериальной терапии ОКИ для практикующего врача остаются одними из самых насущных. К сожалению, большая часть докторов подходит к вопросу назначения антибиотиков шаблонно, без учета этиологии заболевания, рекомендуют их даже при вирусных ОКИ и без знания данных о чувствительности и резистентности основных бактериальных возбудителей. Абсолютными показаниями к назначению антибактериальных лекарственных средств (ЛС), на основании рекомендаций Всемирной организации здравоохранения, считаются установленные диагнозы дизентерии, брюшного тифа, амебиаза, холеры [2, 3]. В нашей стране предусмотрены более детальные показания для назначения антибиотиков: наличие клинических признаков инвазивной диареи, гемоколита (исключение составляет ОКИ, вызванные энтерогеморрагическими E. Coli, при которых назначение антибактериальной терапии может повысить риск развития геолитико-уремического синдрома), возраст больше 65 лет, наличие в анамнезе поражения ЖКТ воспалительного характера, иммуносупрессивные состояния (ВИЧ-инфекция, онкологические заболевания, сахарный диабет), хронические заболевания/пациенты из группы риска (гемоглобинопатии, потребность в гемодиализе и т.п.) [2].
В настоящее время существует достаточно большой выбор антибактериальных средств. При их назначении необходимо учитывать следующие факторы:
- антимикробный спектр действия ЛС;
- механизм антимикробного действия (бактерицидное, бактериостатическое);
- наличие лекарственной устойчивости возбудителей ОКИ, циркулирующих в данное время в данной местности, на данной территории или в данном стационаре – в связи с этим необходимо подчеркнуть важность регулярных бактериологических исследований с определением чувствительности в каждом регионе, лечебно-профилактическом учреждении;
- фармакодинамика и фармакокинетика препарата (всасывание, распределение, выведение, способность к внутриклеточному проникновению и накоплению в тканях организма, пути его выведения из организма) и их соответствие патогенезу данной инфекции;
- возможные побочные реакции и доказанная в клинических исследованиях безопасность при использования;
- применительно к педиатрической практике – наличие лекарственных форм, предназначенных для детей (сироп и т.п.) [10].
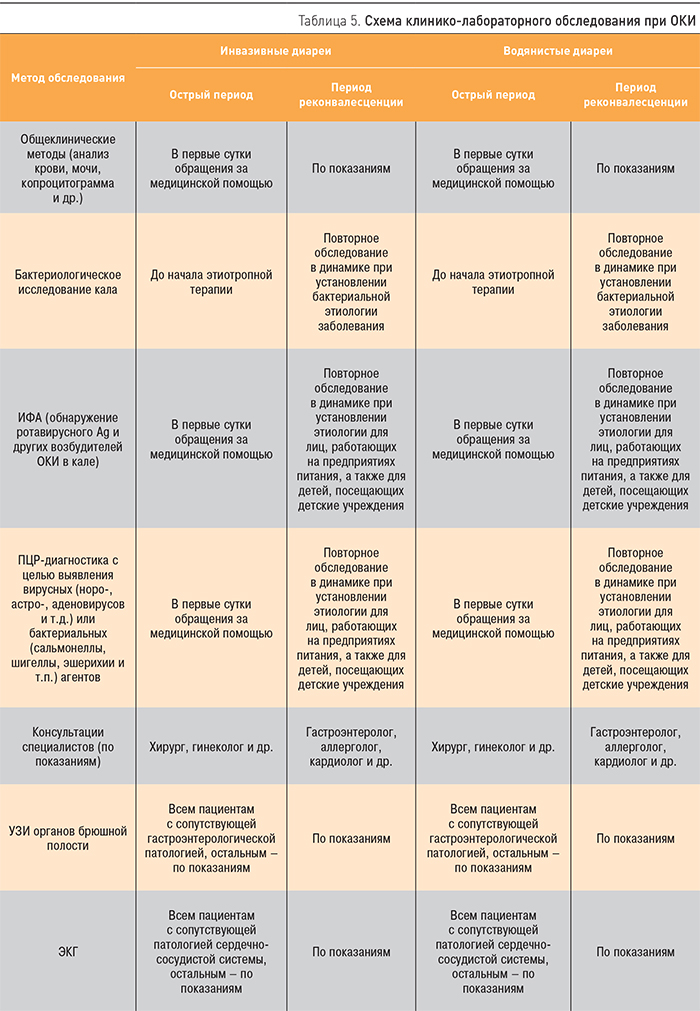
Антибактериальные средства, рекомендованные при ОКИ, подразделяются на два типа: кишечные антисептики и препараты, предназначенные для системного действия (рисунок). Первая группа может быть рекомендована для назначения в амбулаторно-поликлинической практике, где наиболее оправданной тактикой стартовой терапии ОКИ является использование нитрофуранов (нифуроксазид, нифурантел). Хинолоны (налидиксовая кислота, ципрофлоксацин) хорошо себя зарекомендовали в терапии сальмонеллезов. Цефалоспорины рекомендованы для системной антибактериальной терапии при среднетяжелых и тяжелых ОКИ в условиях стационара. Возможно назначение тетрациклинов, метронидазола, аминогликозидов, хлорамфеникола. Препаратами выбора для стартовой этиотропной терапии кампилобактериоза являются макролиды (эритромицин, макропен, азитромицин, кларитромицин).
Курс антибактериальной терапии в острой фазе локализованных ОКИ должен составлять не менее 5–7 сут. Показания к смене препарата общепринятые – клиническая неэффективность ЛС в течение 3 сут [3, 10].
Следует отметить, что в последние годы большинство возбудителей резистентны к фуразолидону. Сальмонеллы сохраняют высокую чувствительность к фторхинолонам (например, ципрофлоксацин – 96,7% штаммов чувствительны, однако к пефлоксацину 23,3% умеренно устойчивы и 17,2% устойчивы), налидиксовой кислоте (53,1%), к амикацину (61,1%), к нетилмицину (63,9%), к некоторым цефалоспоринам II (цефокситин, цефуроксим – 86,7–57,9%), III (цефтриаксон, цефотаксим, цефтазидим – 84,4, 85,0 и 81,7 соответственно) и IV поколения (цефепим – 91,3% чувствительных штаммов).
Всем пациентам вне зависимости от этиологии и формы тяжести заболевания в качестве одного из важных аспектов этиотропной терапии должны быть назначены сорбенты (угольные, синтетические, минеральные, волокнистые). В настоящее время на российском фармацевтическом рынке присутствует достаточно большое количество препаратов, обладающих сорбционными свойствами в различной степени [11]. Назначение энтеросорбентов показано в как можно более ранние сроки болезни – до идентификации возбудителя, позволяет добиваться «обрывающего» действия на течение ОКИ. Применение энтеросорбентов в поздние сроки заболевания (после 5–7-го дня), особенно при инвазивных ОКИ, меньше влияет на диарейный синдром, но оказывает выраженное дезинтоксикационное и энтеропротективное действие. К важным положительным моментам использования энтеросорбентов следует относить и отсутствие влияния этих препаратов на состав облигатной микрофлоры кишечника. Курс лечения энтеросорбентами обычно составляет 5–7 сут. Критерий ранней отмены препаратов – стойкая нормализация стула или его задержка в течение 2 сут [3].
Среди патогенетических методов терапии наиболее важными остаются средства регидратации (оральной, парентеральной), препараты, влияющие на процессы дегидратации (желатина танат), и пробиотики.
Для диагностики обезвоживания «золотым стандартом» является оценка динамики массы тела пациента. Так, эксикозу I степени соответствует потеря до 5% массы тела, что составляет до 50 мл/ кг жидкости, эксикозу II степени – потеря 6–10% массы тела (60–100 мл/кг), эксикозу III степени – потеря более 10% массы тела (110–150 мл/кг). Обезвоживание, характеризующееся потерей более 20% массы тела, несовместимо с жизнью [3].
Оральная регидратация показана всем пациентам с ОКИ. Для этих целей используют специальные, сбалансированные по электролитному составу и осмолярности растворы для оральной регидратации, содержащие 75 мэкв/л натрия и 75 мэкв/л глюкозы, с осмолярностью 245 мосм/л. Оральная регидратация проводится в два этапа:
- 1-й этап – первичная регидратация (первые 6 ч от момента обращения к врачу) – назначается суммарное количество жидкости 50–80 мл/кг за 6 ч.
- 2-й этап – поддерживающая регидратация (восполнение текущих потерь жидкости при ОКИ) – количество жидкости 80–100 мл/кг/сут.
Следует подчеркнуть, что в регидратационную терапию должны быть включены и бессолевые растворы, среди которых предпочтение следует отдать питьевой воде (не минеральной!), возможно использование пектинсодержащих отваров (яблочный компот без сахара, морковно-рисовый отвар). При этом соотношение глюкозо-солевых растворов и кипяченой воды должно быть 1:1 при водянистой диарее, 2:1 – при выраженной рвоте, 1:2 – при инвазивных диареях [2, 3].
 При тяжелых формах ОКИ, отсутствии эффекта от оральной регидратации, наличии обильной рвоты, отеков, развитии функциональной (острой) почечной недостаточности необходимо обеспечивать пациенту проведение парентеральной регидратации. Одним из новых препаратов для парентеральной дегидратации при ОКИ является 1,5% раствор меглюмина натрия сукцинат (реамберин) [12].
При тяжелых формах ОКИ, отсутствии эффекта от оральной регидратации, наличии обильной рвоты, отеков, развитии функциональной (острой) почечной недостаточности необходимо обеспечивать пациенту проведение парентеральной регидратации. Одним из новых препаратов для парентеральной дегидратации при ОКИ является 1,5% раствор меглюмина натрия сукцинат (реамберин) [12].
Использование противодиарейных средств (лоперамид) при ОКИ патогенетически не оправдано, т.к. механизм действия данных препаратов подразумевает снижение моторики ЖКТ (усиление моторики является защитной реакцией организма при остром инфекционном поражении кишечника) и может способствовать усугублению интоксикационного синдрома при ОКИ.
ОКИ любых форм тяжести являются причиной значительных измененией микробиоценоза ЖКТ. Назначение пробиотиков в качестве препаратов «стартовой» терапии, особенно при вирусных диареях, позволяет сокращать сроки купирования основных симптомов заболевания, способствует восстановлению параметров микрофлоры ЖКТ. Данные препараты показаны также всем пациентам в периоде реконвалесценции с целью улучшения параметров микробиоценоза.
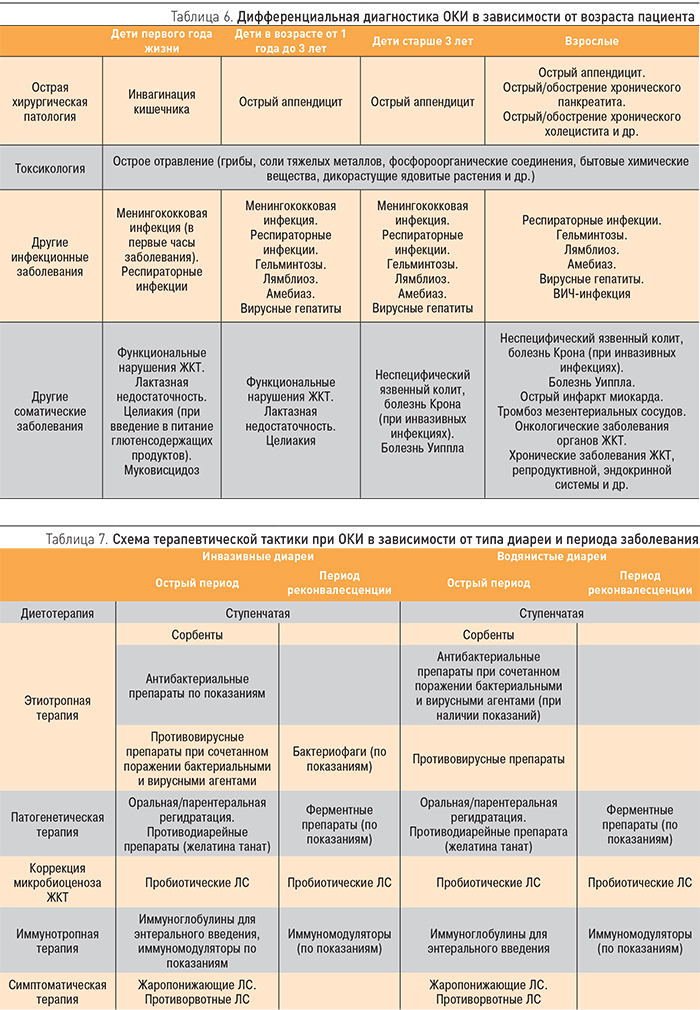
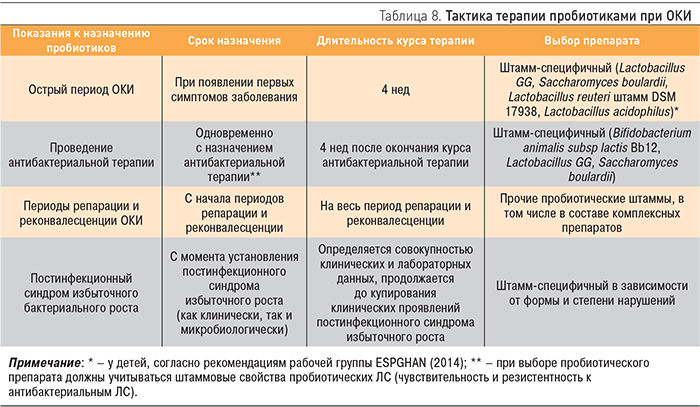
Современный подход к терапии пробиотиками подразумевает назначение препарата с учетом свойств штаммов, входящих в его состав. Генетическое разнообразие пробиотических штаммов определяет и их фенотипические различия, в первую очередь по клиническим эффектам, при этом не все пробиотические штаммы убедительно показали свою эффективность в клинической практике при определенных заболеваниях, что диктует необходимость анализа данных о штамм-специфичных свойствах пробиотиков в различных клинических ситуациях [13]. Тактика терапии пробиотиками при ОКИ представлена в табл. 8.
Среди штаммовых свойств пробиотиков, используемых в терапии ОКИ, наиболее существенным является способность к адгезии, играющей ключевую роль в обеспечении колонизационной резистентности и иммуннотропного влияния, что важно не только в остром периоде заболевания, но и в периоде репарации, реконвалесценции, а также в случае развития синдрома избыточного бактериального роста.
Среди пробиотических штаммов, характеризующихся высоким уровнем адгезии, можно выделить Bifidobacterium lactis Bb12. В исследованиях для данного микроорганизма in vitro была показана способность к высокоуровневой адгезии к поверхностям с муцином (использовались поликарбонатные луночные планшеты), без муцина и пленкам клеточных культур (Caco-2, HT29-MTX) [14], в том числе на фоне ротавирусной инфекции и после нее [15].
К числу важных для клинического применения свойств данного штамма следует отнести его устойчивость к действию агрессивных сред организма человека – соляной кислоты и желчи. Для Bifidobacterium lactis Bb12 было показано, что данный микроорганизм при низких рН синтезирует рН-зависимую АТФазу, регулирующую кислотно-основной баланс внутри бактерии. Данный фермент позволяет сохранить жизнедеятельность микроорганизму в условиях кислой среды желудка [16]. А наличие у Bifidobacterium lactis Bb12 гидролазы солей желчных кислот позволяет бактерии сохранять активность в присутствии желчи [17].
Штамм Bifidobacterium lactis Bb12 характеризуется выраженной антагонистической активностью в отношении целого ряда кишечных патогенов (Bacillus cereus, Clostridium difficile, Clostridium perfringens тип A, Escherichia coli, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp enterica serovar Typhimurium, S. enterica subsp. enterica serovar Typhi, Shigella flexneri, Shigella sonnei, Campylobacter jejuni и Candida albicans [18, 19]), что делает использование его предпочтительным при ОКИ бактериальной этиологии.
Особого внимания заслуживают пациенты, которые нуждаются в терапии антибактериальными ЛС. Вызванные течением инфекционного процесса изменения микрофлоры ЖКТ могут усугубляться действием антибиотиков. Поэтому данная категория пациентов нуждается во включении в состав комплексной терапии ОКИ пробиотических ЛС, направленных на поддержание микробиоценоза. В этом случае штамм-специфичные свойства устойчивости к антибактериальными средствам делает некоторые пробиотические штаммы препаратами выбора. Так, проведенное исследование показало, что Bifidobacterium lactis Bb12 обладает резистентностью к таким антибиотикам, как гентамицин, стрептомицин, полимиксин В, налидиксовая кислота, канамицин, неомицин, циклосерин, тетрациклин, спектиномицин. Это исследование делает препараты, в состав которых входит Bifidobacterium lactis Bb12, препаратами выбора при назначении пациентам данных антибактериальных средств, например, при ОКИ (сальмонеллез, шигеллез) [20].
Проведенные плацебо-контролируемые исследования показали, что, помимо терапевтических, штамму Bifidobacterium lactis Bb12 присущи и профилактические свойства. В частности, его применение снижает риск развития инфекций ЖКТ, в том числе ротавирусной, связанных с оказанием медицинской помощи [21, 22].
Следует отметить, что высокий профиль безопасности данного штамм был утвержден регуляторными органами в Европе (в 2008 г. European Food Safety Authority (EFSA) присвоил ему статус Qualified Presumption of Safety (безусловной безопасности)) и в США (Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) он признан безопасным (Generally Regarded As Safe (GRAS)).
Еще одним штаммом, заслуживающим внимания, является Lactobacillus acidophilus (LA-5). Он относится к молочнокислым бактериям, основной отличительной особенностью которых является выраженная антибактериальная активность. Это реализуется путем снижения pH в кишечнике за счет синтеза молочной кислоты, выработки метаболитов, которые обладают токсическим действием в отношении патогенных бактерий, образования Н2О2, бактериоцинов, конкуренции с патогенными бактериями за питательные вещества, взаимодействия с рецепторами адгезии, предотвращая таким образом колонизацию патогенными и условно-патогенными микроорганизмами. Важным свойством Lactobacillus acidophilus, показанным в клинических исследования, является профилактика антибиотик-ассоциированной диареи (ААД) у взрослых [23].
Среди пробиотических средств терапии, содержащих Bifidobacterium lactis Bb12, можно рекомендовать препарат Линекс® Форте, содержащий молочнокислые бактерии (Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (Bb12)). Каждая капсула препарата содержит 2×109 колониеобразующих единиц живых лиофилизированных молочнокислых бактерий. Данный препарат может быть назначен в остром периоде ОКИ, в периоде репарации и реконвалесценции, а также в случае развития синдрома избыточного бактериального роста после перенесенной ОКИ и в качестве профилактики развития ААД при приеме антибиотиков. Схема лечения в остром периоде ОКИ: для детей с рождения и до 2 лет – по 1 капсуле 1 раз/сут, для детей в возрасте 2–12 лет – по 1 капсуле 1–2 раза/сут, дети старше 12 лет и взрослые – по 1 капсуле 3 раза/ сут. Далее возможно снижение дозы до 1–2 капсул/сут в зависимости от клинической ситуации. В период реконвалесценции или для профилактики ААД рекомендуется назначать по 1 капсуле 1 раз/сут пациентам всех возрастных групп. Для обеспечения максимальной эффективности препарат рекомендуется принимать после еды, а для профилактики ААД – через 3 ч после приема антибиотиков.
Симптоматическая терапия включает терапию лихорадочных состояний. Жаропонижающие средства показаны не всем пациентам, т.к. повышение температуры является адаптационной реакцией организма на инфекцию, создающей оптимальные условия для иммунной перестройки организма. Назначение данной категории ЛС показано всем больным при гипертермии, а при наличии тяжелой сопутствующей патологии – при лихорадке более 38,50С.
Развитие вторичной панкреатической недостаточности, обострения хронической патологии поджелудочной железы нередко наблюдаются в периоде репарации и реконвалесценции ОКИ. Следует обратить внимание, что при норовирусной инфекции поражение поджелудочной железы отмечается чаще, чем при ОКИ другой этиологии. В таких случаях показано назначение ферментных препаратов, предпочтительно в минимикросферической форме. Следует учесть, что в остром периоде ОКИ ферментные препараты не показаны. Наиболее оптимальным сроком их назначения при наличии показаний являются 5–6-е сутки, критерий назначения – появление у пациента аппетита.
Для купирования упорной рвоты можно использовать прокинетики и противорвотные препараты: метоклопрамид, домперидон, прометазин, 0,25% новокаин – 1 ложку (чайную, десертную, столовую по возрасту) [3].
Критерии оценки эффективности лечения:
- клинические (купирование интоксикационного синдрома, нормализация температуры, купирование рвоты, диареи и других симптомов);
- клинико-лабораторные (стойкая нормализация гемограммы, копроцитограммы, отрицательные результаты при бактериологическом и ПЦР-обследовании).
В связи с тем, что санация от возбудителя, полная репарация кишечника и восстановление его нарушенных функций наступают значительно позже, чем исчезают клинические проявления болезни, целесообразно проводить динамическое наблюдение за пациентами, перенесшими ОКИ.
Таким образом, ОКИ требуют от врача особых подходов к диагностике, тактике ведения и терапии.



