Заболевания желудочно-кишечного тракта (ЖКТ) – функциональная диспепсия (ФД) и синдром раздраженного кишечника (СРК) – являются одной из значимых и не до конца решенных проблем современной медицины [3], в том числе с точки зрения обеспеченности эффективными безопасными лекарственными препаратами (ЛП). В этой связи особую значимость приобретает комплексный фитопрепарат Иберогаст (Байер, Германия). Сегодня Иберогаст является одним из немногих лекарственных фитопрепаратов с клинически доказанной эффективностью применения для лечения ФД и СРК [18, 22, 26]. Мировой опыт его успешного применения составляет уже более 50 лет.
Распространенность заболеваний ЖКТ в настоящее время широка. К основным причинам относят неправильный образ жизни, нарушения режима питания, стрессы и др. Среди заболеваний ЖКТ СРК оценивается в 5,7–22,1% от общей численности населения, общая распространенность симптомов диспепсии колеблется от 7 до 41% и составляет 25% и более [24]. При этом следует учитывать, что лишь каждый 2–4 пациент, например, с синдромом ФД обращается за медицинской помощью [20]. СРК относится к наиболее часто встречающимся заболеваниям ЖКТ. В России отсутствуют официальные эпидемиологические данные по частоте встречаемости СКР. Косвенно, по некоторым региональным данным, она достигает 15% [8]. Заболевание значительно ухудшает качество жизни, снижает социальную активность, требует значительных материальных затрат на обследование и лечение. Однако эффективность большинства применяемых ЛП и схем лечения таких многофакторных заболеваний, как ФД и СРК, не превышает 40% [5].
СОВРЕМЕННЫЕ ПЕРСПЕКТИВЫ ФИТОТЕРАПИИ
Во все периоды развития медицины как в Европе, так и на Востоке фитотерапия традиционно применялась для профилактики и лечения различных недугов ЖКТ. В настоящее время на мировом рынке фармацевтики доля средств растительного происхождения составляет более 40% с неуклонной тенденцией к увеличению. По прогнозам Всемирной организации здравоохранения (ВОЗ) в течение ближайших лет доля фитопрепаратов в общем объеме лекарственных средств составит более 60% [1].
В эпоху инновационных технологий преимущества натуральных ЛП, в частности отсутствие или незначительное количество побочных эффектов, мягкое действие, совместимость в многокомпонентных растительных препаратах, экономичность, становятся все более привлекательными. Современные производства, реализующие правила надлежащей производственной практики (Good manufacturing practice, GMP), позволяют грамотно реализовать традиционно ценимые природные свойства растительных ЛП. Это, несомненно, обусловливает одну из причин роста интереса к ним. Так, в Государственный реестр лекарственных средств, разрешенных для медицинского применения, уже включены около 260 видов сырья для производства фитопрепаратов.
ЛП, используемые для лечения заболеваний ЖКТ, выпускают в виде таблеток, жевательных кубиков, экстрактов, бальзамов, настоек, капель. Большинство таблетированных ЛП изготовлены из одного вида лекарственного растительного сырья, что в сочетании с особенностями используемой лекарственной формы ограничивает возрастной контингент пациентов и нозологическую область применения. Возможны также ограничения в группе гериатрических пациентов, что связано с физиологическими особенностями (снижение функции секреции слюнных желез, сложность проглатывания и др.) и специфическими возрастными характеристиками всасывания ЛП в ЖКТ из твердых лекарственных форм. Важным фактором выбора ЛП является биодоступность его активного ингредиента. В первую очередь она зависит от вида лекарственной формы. Так, уже много десятилетий клиницистам хорошо известно, что по скорости наступления фармакологического эффекта жидкие лекарственные формы значительно опережают таблетки для приема внутрь. При возможности выбора жидкой лекарственной форме отдается безусловное предпочтение. К их числу относятся капли для приема внутрь (после растворения в небольшом количестве воды); удобство и простота применения, точность дозирования и, что немаловажно, быстрота действия, сравнимая с инъекцией, характеризуют основные преимущества этой лекарственной формы. К таким препаратам относится фитопрепарат Иберогаст (рисунок) [2].
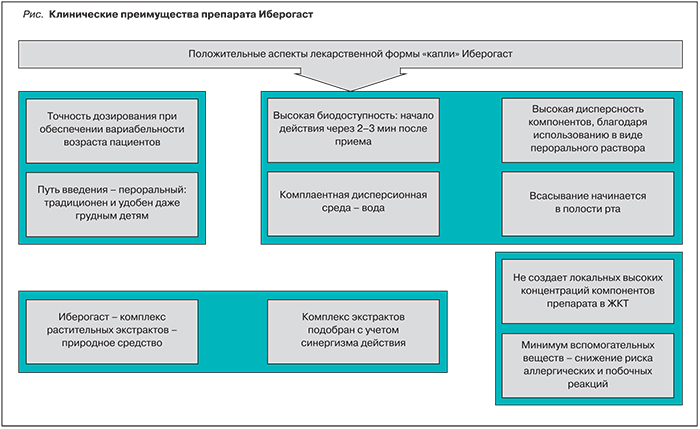
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ НАСТУПЛЕНИЯ КЛИНИЧЕСКОГО ЭФФЕКТА
Немаловажное значение для быстроты начала действия ЛП в ЖКТ и времени поступления активного вещества в системный кровоток имеет лекарственная форма и способ применения [6, 7, 9]. Известно, что поступление активного вещества в системный кровоток происходит только после высвобождения его из лекарственной формы и последующего всасывания через биологические мембраны клеток. Одним из определяющих факторов при применении, например, таблеток и капсул является скорость дезинтеграции лекарственной формы и время растворения активного вещества в биологических жидкостях. При этом следует иметь в виду, что между растворением ЛП в биологических жидкостях и его действием на слизистую ЖКТ с последующим попаданием в системный кровоток проходит некоторое время, иногда значительное [6]. В то же время после попадания в организм в форме раствора всасывание препарата может начинаться уже непосредственно в момент приема, при проникновении через слизистую оболочку полости рта.
Однако, рассматривая время начала терапевтического эффекта, следует учитывать не только вид лекарственной формы, но и носитель активных компонентов. В растительном препарате Иберогаст носителем действующих веществ является вода (капли препарата в небольшом количестве воды). Вода, как известно, в подавляющем большинстве случаев представляет наиболее предпочтительную среду для обеспечения высокой биодоступности активных компонентов. Большим числом исследований и клинической практикой установлено, что начало всасывания пероральных препаратов, тонко диспергированных, а особенно растворенных в водной среде, начинается уже в полости рта и пищеводе [4, 7, 9]. Начало фармакологического действия подобных ЛП наступает в течение первых 2–3 мин при приеме в виде перорального раствора. Быстрота фармакологического действия ЛП при приеме в виде капель per os обеспечивается богатой васкуляризацией слизистой оболочки полости рта. Значительный вклад вносит и то, что активные вещества поступают непосредственно в системный кровоток, минуя печень. Содержание этанола в крайне небольшой концентрации (после разведения препарата в воде она снижается на порядок) активизирует всасывание растительных компонентов. Таким образом, пероральный прием комплекса жидких высокоактивных экстрактов обеспечивает высокую биодоступность и быстроту наступления терапевтического эффекта (табл. 1).
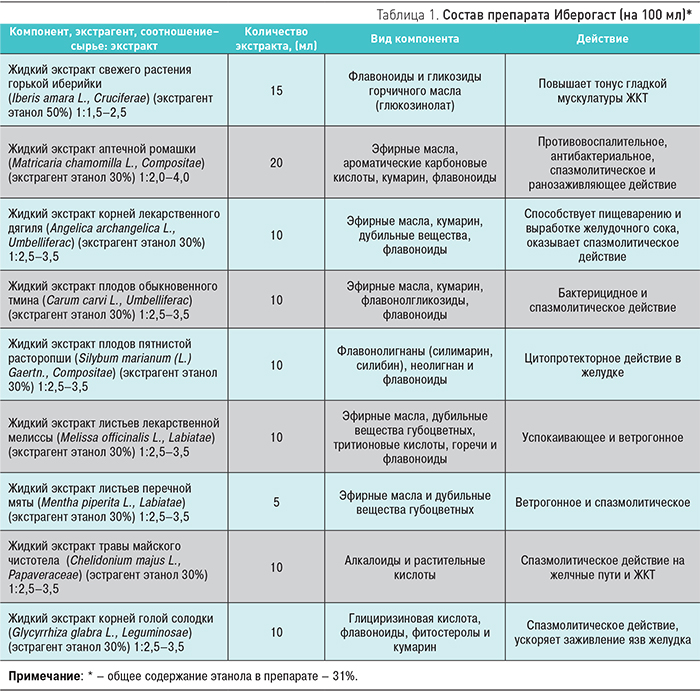
Отличительной особенностью Иберогаста является тщательная подобранность состава и наличие внушительного «доказательного досье» – научных данных в отношении эффективности и безопасности, полученных в ходе исследований, проведенных в соответствии с современными требованиями доказательной медицины и принципами надлежащей клинической практики (Good clinical practice, GCP) [10]. Это и определяет значительный вклад препарата в арсенал средств, предназначенных для терапии функциональных заболеваний ЖКТ, и в полной мере соответствует современной концепции многоцелевой терапии [15, 27]. Согласно международной анатомо-терапевтическо-химической классификации лекарств (АТХ) Иберогаст относится к группе А03 «Средства, применяемые при функциональных желудочно-кишечных расстройствах». Препарат выпускается в форме капель для перорального применения во флаконах по 20, 50 и 100 мл в условиях стандарта GMP. Компоненты – растительное сырье – выращивают с соблюдением норм надлежащей сельскохозяйственной практики (Good agricultural practice, GAP).
Иберогаст обладает выраженным противовоспалительным действием, гастропротективным действием на слизистую желудка, снижает секрецию соляной кислоты, нормализует тонус гладкой мускулатуры ЖКТ, ингибирует рост Helicobacter pylori. Начало фармакологического действия наступает в течение 2–3 мин. В клинической практике препарат применяется для лечения ФД, нарушений перистальтики ЖКТ, в том числе СРК; в качестве вспомогательного средства для симптоматического лечения гастрита, пептической язвы желудка и 12-перстной кишки. Продолжительность курса лечения определяется индивидуально. Лекарственные растения, экстракты которых входят в состав ЛП, применяются в традиционной медицине разных народов с незапамятных времен. Для 6 из 9 растительных составляющих Иберогаста (цветки ромашки, корень солодки, листья мелиссы, листья мяты перечной, плоды расторопши, корень дягиля) существуют монографии ВОЗ. Клинические, обсервационные и другие исследования эффективности и безопасности препарата проводились с 1970 г. по 2007 г. Авторы отмечают статистически значимую высокую терапевтическую эффективность Иберогаста по сравнению с плацебо в случаях с ФД и СРК [8]. Большое количество исследований свидетельствует о действии препарата, отвечающем концепции эффективной многоцелевой лекарственной терапии [27].
В терапии многофакторных заболеваний (вызываемых множественными причинами), такими как ФД и СРК, с успехом применяются комбинированные фитопрепараты, содержащие комплексы активных ингредиентов с различными точками приложения эффектов, т.е. обладающих множественным действием [27]. На протяжении многих лет подтверждением терапевтического превосходства растительных комбинированных препаратов над моноэкстрактами служил только практический опыт. Впервые синергизм терапевтического действия компонентов фитопрепаратов описал M. Berenbaum (1989) [11]. Врачи, практикующие фитотерапию, давно признали, что применение комбинации растительных лекарственных препаратов характеризуется большей эффективностью по сравнению с монотерапией. Кроме того, отмечено, что при многоцелевой терапии количество побочных эффектов либо значительно снижается, либо наблюдается их полное отсутствие, что происходит за счет более низких доз отдельных компонентов растительного происхождения [14, 29]. Именно по этой причине в практической фитотерапии Запада, напоминающей традиционную терапию Китая, Индии, Африки и Южной Америки, используют комбинированные фитопрепараты. Идея, лежащая в основе данной концепции лекарственной терапии, берет свои истоки из опыта многовековой фитотерапии при сложной многофакторной патофизиологии (многопричинности), такой как ФД и СРК. Эта концепция подтверждается результатами современной доказательной медицины и молекулярно-биологическими исследованиями [29].
ИССЛЕДОВАНИЯ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
Эффективность Иберогаста подтверждена множеством клинических исследований и наиболее хорошо изучена при ФД и СРК (табл. 2). При ФД эффективность препарата оценивалась в 4 плацебо-контролируемых клинических исследованиях. Von Arnim и соавт. [27] описали результаты рандомизированного двойного слепого плацебо-контролируемого исследования, в которое были включены 315 пациентов. Авторами было отмечено клинически достоверное улучшение симптомов ФД в группе Иберогаста в сравнении с больными контрольной группы. Остальные 3 плацебо-контролируемые исследования у пациентов с ФД показали схожие результаты [13, 18, 23]. При этом было выявлено практически одинаковое с группой плацебо минимальное количество больных с нежелательными явлениями. Результаты проведенных плацебо-контролируемых исследований эффективности Иберогаста позволили обобщить их в нескольких мета-анализах. В последний мета-анализ были включены данные по 637 пациентам, позволившие подтвердить клинически значимый эффект проведенной терапии (р=0,0005) [16].
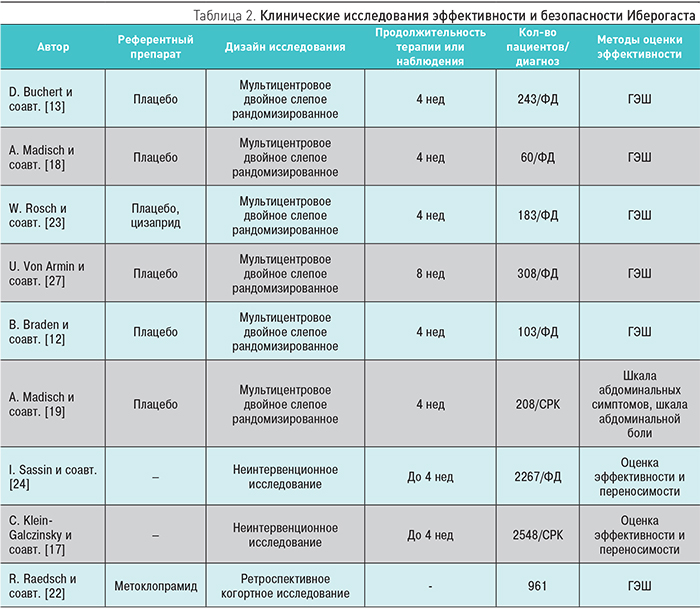
В наиболее крупное неинтервенционное исследование эффективности Иберогаста при ФД вошли 2267 пациентов [24]. Продолжительность терапии Иберогастом достигала 4 нед. Около 80% лечащих врачей и пациентов, включенных в исследование, охарактеризовали эффективность препарата как «хорошую» или «очень хорошую». В ретроспективном когортном исследовании были проанализированы результаты лечения 961 пациента, которые получали либо метоклопрамид, либо Иберогаст в рекомендованных дозировках [23]. В качестве параметра, оценивающего эффективность в этом исследовании, использовалась ГЭШ, с помощью которой проводили оценку динамики редукции жалоб. В группе больных, получавших Иберогаст, наблюдалось большее количество пациентов с наиболее высокой клинической эффективностью по сравнению с группой метоклопрамида (72 против 63%, р<0,05). Кроме того, у больных в группе Иберогаста отмечался более короткий период нетрудоспособности в сравнении с пациентами, получавшими терапию метоклопрамидом (р<0,001). В свете описанных результатов 90% лечащих врачей, назначавших терапию Иберогастом в этом исследовании, охарактеризовали переносимость препарата как «очень хорошую», и только 71% специалистов так же оценили метоклопрамид.
К настоящему времени описано 1 рандомизированное двойное слепое плацебо-контролируемое клиническое исследование эффективности и безопасности Иберогаста у пациентов с СРК [19]. В качестве ключевого параметра оценки эффективности была использована шкала из 8 СРК-специфичных симптомов, выраженность которых оценивалась по 4-балльной шкале Лайкерта. В исследование были включены 208 пациентов, которые были рандомизированы в основную группу, получавшую Иберогаст, и контрольную, получавшую плацебо. Результаты исследования показали значительное статистически значимое клиническое превосходство в группе Иберогаста (р<0,0004).
Профиль безопасности препарата оценивали в доклинических, а также в клинических контролируемых и неинтервенционных наблюдательных исследованиях. Доклиническая оценка включала в себя проведение исследований острой, субхронической и хронической токсичности. Полученные результаты не выявили гепатотоксичности, репродуктивной токсичности, эмбрио-, фетотоксичности, мутагенного или цитотоксического действия препарата [26]. В проведенных клинических исследованиях не было зарегистрировано серьезных нежелательных явлений. Во всех случаях была отмечена хорошая переносимость препарата, отсутствие влияния на сопутствующие заболевания у пациентов, а также отсутствие лекарственных взаимодействий. В дополнение к вышеперечисленному необходимо заметить, что по результатам мониторинга фармакобезопасности Иберогаста было выявлено очень небольшое количество сообщений о нежелательных явлениях, связанных с его применением (n=111), что составляет крайне незначительное количество от более чем 25 млн пациентов, получивших препарат за более чем 50-летний период его обращения на рынке лекарственных средств [20].
ЗАКЛЮЧЕНИЕ
Комплексный фитосостав, созданный в рамках современной концепции многоцелевой терапии, показывает прекрасный пример будущего фитотерапии: позволяет получить ей большую легитимность и перспективу в разработке новых комбинаций растительных ЛП для лечения заболеваний, при которых ранее единственным вариантом была химиотерапия. Многоцелевое потенцированное действие высококачественного экологически чистого препарата растительного происхождения Иберогаст открыло новую страницу в эффективной и безопасной терапии функциональных заболеваний ЖКТ.



