К проблеме дисплазии соединительной ткани (ДСТ) внимание клиницистов привлекают значительная популяционная частота (35–65%), высокая распространенность среди лиц молодого возраста, вероятность развития осложнений (преимущественно кардиоваскулярных) [1]. ДСТ определяют как структурно-функциональные нарушения соединительнотканного каркаса полигенно-мультифакториальной природы, объединенные на основе общности внешних и/или висцеральных признаков, которые не классифицируются в конкретные наследственные синдромы [2]. Фенотип пациентов с ДСТ формируют астенический тип конституции, долихостеномелия, воронкообразная деформация грудной клетки, сколиоз, плоскостопие, пролапс митрального клапана (ПМК), аномально расположенные хорды и другие внешние и висцеральные диспластические признаки [2, 3]. В клинической картине при этом доминируют симптомы вегетативной дисфункции, нарушения сердечного ритма и проводимости, дисрегуляция артериального давления, хронические часто рецидивирующие инфекционно-воспалительные заболевания [4].
Пациенты с ДСТ прогностически неоднородны: от лиц, не отличающихся по продолжительности жизни от среднепопуляционных показателей, до вариантов патологии, сопряженных с серьезными осложнениями (аритмиями, тромбоэмболиями, сердечной недостаточностью и др.) [1, 3]. В связи с этим чрезвычайно важно рационально планировать медицинское сопровождение больных, ориентированное на предупреждение диспластикозависимых осложнений. Это диктует необходимость внесения дополнений в стандарты обследования пациентов с ДСТ, а также решения вопросов стратификации индивидуального риска осложнений и сопутствующих заболеваний.
Современные представления о формировании диспластического фенотипа базируются на новейших знаниях о морфогенезе и метаболизме соединительной ткани [1]. Недостаточно изученными при ДСТ остаются такие клеточные регуляторы соединительнотканного гомеостаза, как молекулы адгезии. В то же время известна их способность контролировать морфогенез, эмбриональное развитие, формирование и деградацию внеклеточного матрикса, эндотелиальную функцию, иммунный ответ и др. [5, 6]. Доказано существование тесной взаимосвязи адгезивных молекул с сердечно-сосудистой патологией. Так, гиперэкспрессия молекулы сосудистой адгезии 1 типа (VCAM-1) является предиктором постоперационной фибрилляции предсердий, высокие уровни молекулы межклеточной адгезии 1 типа (ICAM-1), VCAM-1 и Р-селектина предшествуют ретромбозу после стентирования у больных ишемической болезнью сердца, а гиперпродукция Е-селектина лежит в основе ремоделирования миокарда [7, 8].
 Вполне очевидно, что выявление ассоциации плазменных уровней молекул адгезии с клиническими проявлениями ДСТ откроет общие закономерности их формирования и может быть использовано в оценке риска прогностически неблагоприятных событий у данной категории пациентов.
Вполне очевидно, что выявление ассоциации плазменных уровней молекул адгезии с клиническими проявлениями ДСТ откроет общие закономерности их формирования и может быть использовано в оценке риска прогностически неблагоприятных событий у данной категории пациентов.
Цель исследования: сформировать прогностически ориентированный подход к оценке клинического статуса пациентов с ДСТ на основе изучения плазменных уровней молекул адгезии – E-, L-, Р-селектинов, ICAM-1, VCAM-1 и тромбоцитарно-эндотелиальной адгезивной молекулы 1 типа (РЕСАМ-1).
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 102 пациента с ДСТ (79 мужчин, 23 женщины; средний возраст 21,9±4,4 года). Критериями включения в исследование являлись: наличие внешних и/или висцеральных признаков ДСТ, возраст пациентов 18–35 лет, подписание информированного добровольного согласия на участие в исследовании. Критерии исключения: моногенные наследственные синдромы (Марфана, Элерса–Данло и др.), артериальная гипертензия (АГ), ишемическая болезнь сердца, некоронарогенные заболевания миокарда, пороки сердца, инфекционный эндокардит, травмы грудной клетки, диффузные болезни соединительной ткани, хроническая почечная недостаточность, ожирение, острые и хронические в периоде обострения заболевания внутренних органов, эндокринная патология, злокачественные заболевания, беременность. Выбор данных критериев обусловлен необходимостью исключения заболеваний и состояний, которые могут быть причиной гиперсекреции адгезивных молекул. Пациенты отрицали злоупотребление алкоголем, прием наркотических веществ. Курение (1–2 сигареты в день в течение 3–4 лет) отметили 8 (7,8%) пациентов.
Бóльшая часть обследованных предъявляла многочисленные и разнообразные жалобы, преимущественно астено-вегетативного характера: боль в области сердца (n=52; 50,9%), головокружение при переходе из горизонтального в вертикальное положение тела (n=35; 34,3%) или в душном помещении (n=5; 4,9%), чувство нехватки воздуха в душном помещении (n=23; 22,5%), учащенное сердцебиение (n=23; 22,5%), общая слабость, быстрая утомляемость (n=14; 13,7%), обмороки при взятии крови из вены (n=5; 4,9%).
Системное вовлечение соединительной ткани определялось у 99 (97,1%) пациентов и в среднем составило 2 (1,0–3,0) балла. Среди внешних диспластических признаков преобладали сколиотическая деформация грудного отдела позвоночника I–II степени (n=43; 42,2%), продольное плоскостопие I–II степени (n=33; 32,4%), нарушения роста и скученность зубов (n=28; 27,5%), арахнодактилия (n=22; 21,6%), долихостеномелия (n=21; 20,6%). Различные варианты сердечных аномалий диагностированы у всех обследуемых. Наиболее частыми были аномально расположенные хорды в полости левого желудочка (n=95; 93,1%) и ПМК (n=91; 89,2%), реже диагностировались аневризма межпредсердной перегородки (n=17; 16,7%), открытое овальное окно (n=15; 14,7%), двустворчатый аортальный клапан (n=4; 3,9%), пролапс трикуспидального клапана (n=1; 0,9%), удлиненный евстахиев клапан (n=1; 0,9%). Кардиальные аномалии встречались как одиночные варианты (n=11; 10,8%), так и в виде сочетаний по 2–4 (n=91; 89,2%). Степень ПМК соответствовала 1-й (от 3 до 6 мм) у 89 (97,8%) пациентов и 2-й (от 6 до 9 мм) – у 2 (2,2%). Митральная регургитация 1-й степени зарегистрирована у 41 (45,1%) и 2-й – у 50 (54,9%) больных ПМК. Эхокардиографические признаки миксоматозной дегенерации клапана выявлены у 2 (1,9%) пациентов.
Фенотипическое обследование позволило верифицировать наибольшую частоту синдрома ПМК (n=88; 86,3%). В единичных наблюдениях диагностированы доброкачественная гипермобильность суставов (n=2; 1,9%), неклассифицируемый фенотип (n=3; 2,9%) и повышенная диспластическая стигматизация (n=9; 8,8%), в т.ч. висцеральная (n=4; 3,9%). Последняя, как известно, не классифицируется в конкретный синдром или фенотип [2].
 В 8 (7,8%) наблюдениях ДСТ верифицирована «гипертония белого халата», в 16 (15,7%) – артериальная гипотензия. Нарушения сердечного ритма и проводимости зарегистрированы у 65 (63,7%) пациентов, характеризовались значительным разнообразием (синусовая аритмия, миграция водителя ритма по предсердиям, наджелудочковая и желудочковая экстрасистолия, пароксизмальная наджелудочковая и желудочковая тахикардия, пароксизмальная фибрилляция предсердий, синоатриальная и атриовентрикулярная блокады, блокада правой ножки пучка Гиса, феномены и синдромы предвозбуждения желудочков). У 14 (13,7%) пациентов с ДСТ был диагностирован хронический тонзиллит в стадии ремиссии.
В 8 (7,8%) наблюдениях ДСТ верифицирована «гипертония белого халата», в 16 (15,7%) – артериальная гипотензия. Нарушения сердечного ритма и проводимости зарегистрированы у 65 (63,7%) пациентов, характеризовались значительным разнообразием (синусовая аритмия, миграция водителя ритма по предсердиям, наджелудочковая и желудочковая экстрасистолия, пароксизмальная наджелудочковая и желудочковая тахикардия, пароксизмальная фибрилляция предсердий, синоатриальная и атриовентрикулярная блокады, блокада правой ножки пучка Гиса, феномены и синдромы предвозбуждения желудочков). У 14 (13,7%) пациентов с ДСТ был диагностирован хронический тонзиллит в стадии ремиссии.
Контрольную группу сформировали 10 здоровых людей (7 мужчин, 3 женщины; средний возраст 22,5±2,9 года) без признаков ДСТ.
Уровень E-, L- и P-селектинов, ICAM-1, PECAM- 1 и VCAM-1 определяли в плазме крови иммуноферментным методом (Bender MedSystems GmbH, Австрия).
Выборки представлены медианой (Ме) и интерквартильным интервалом (P25–P75). Качественные признаки описаны абсолютными значениями (n) и процентными долями (%). Для статистического анализа данных применяли пакет программы Biostat 4.0. Использовали критерии Манна–Уитни (при сравнении изменений между двумя группами) и Данна (при сравнении изменений между тремя группами). Достоверными считали различия при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Статистический анализ показал, что в общей группе пациентов с ДСТ плазменное содержание Е-селектина, ICAM-1 и VCAM-1 было значительно выше, а PECAM-1, наоборот, ниже, чем у здоровых людей (табл. 1).
Выявленные отклонения в концентрациях циркулирующих молекул адгезии предполагают их участие в патогенезе ДСТ [9]. Кроме того, высокое содержание E-селектина, ICAM-1 и VCAM-1 отражает процесс активации эндотелия, а низкий уровень РЕСАМ-1, по-видимому, обусловлен генетически предопределенными изменениями взаимосвязи «тромбоцит – сосудистая стенка» при доминировании гипоагрегационных сдвигов у значительного числа пациентов [3]. Высокие уровни E-селектина, ICAM-1 и VCAM- 1 также могут свидетельствовать о персистирующей активности провоспалительного потенциала [10].
В зависимости от характера диспластического фенотипа пациенты с ДСТ были разделены на 2 группы: 1-я группа (n=93) – c систематизированными в виде конкретного синдрома или фенотипа признаками (синдром ПМК, доброкачественная гипермобильность суставов, неклассифицируемый фенотип) и 2-я (n=9) – с недиагностическими заключениями о нарушении соединительной ткани (повышенная диспластическая стигматизация). У больных ДСТ с классифицируемыми синдромами и фенотипами выявлено увеличение концентрации Е-селектина (42,7 (33,0–55,5) нг/мл; р<0,05) и VCAM-1 (925,0 (705,0–1204,0) нг/мл; р<0,05) по сравнению со здоровыми. В случаях повышенной диспластической стигматизации плазменное содержание изучаемых молекул не отличалось существенно от нормы.
В связи с преобладанием в нашем исследовании больных ПМК сравнительное изучение уровней молекул адгезии было проведено с учетом выраженности митральной регургитации. Оказалось, что у пациентов с митральной регургитацией 2-й степени (n=50) содержание Е-селектина (43,3 (36,1–54,9) нг/мл), ICAM-1 (695,5 (594,6–916,1) нг/мл) и VCAM-1 (910,0 (705,0–1413,8) нг/мл) было значительно выше, чем у здоровых (р<0,05). В случаях регургитации 1-й степени (n=41) контрольные величины превышал лишь показатель VCAM-1 (985,0 (734,5–1194,5) нг/мл; р<0,05). Ранее уже указывалось на наличие связи гиперсекреции ICAM-1 и VCAM-1 с гемодинамическими изменениями в большей степени, чем с воспалительной активностью, в частности у пациентов с хронической ревматической болезнью сердца [11].
Характерно, что у больных с более выраженной митральной регургитацией снижения РЕСАМ-1 не наблюдалось (52,1 (43,6–62,1) нг/мл; р>0,05), что, возможно, свидетельствует о начальном отклонении соотношения «тромбоцит – сосудистая стенка» в сторону гиперагрегации. РЕСАМ-1, как известно, способна осуществлять трансмембранную передачу сигнала межклеточного взаимодействия, приводящего в конечном счете к тромбозу, а большинство случаев тромбоэмболических осложнений первичного ПМК зарегистрировано именно у больных со значительной митральной регургитацией [12].
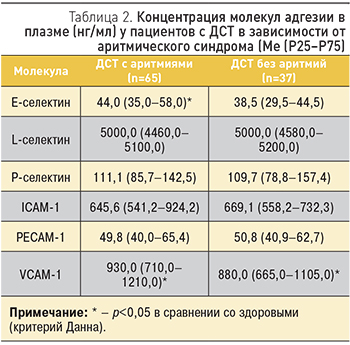
Выявлено, что нарушения сердечного ритма и проводимости у пациентов с ДСТ ассоциированы с повышением уровней Е-селектина и VCAM-1 (табл. 2).
В этой связи заслуживают внимания данные об определяющем значении молекул адгезии в аритмогенезе, полученные преимущественно в эксперименте [13], и сведения о растворимых Е-селектине и VCAM- 1 как маркерах эндотелиоза [7], при том что роль эндотелиального повреждения в патогенезе некоторых видов аритмий считается доказанной [8].
Представляло интерес рассмотрение случаев «гипертонии белого халата» через призму врожденной дисплазии соединительной ткани, которая выступает одним из значимых звеньев эндотелиальной дисфункции [14]. У пациентов с ДСТ и «гипертонией белого халата» были обнаружены высокие уровни ICAM-1 (885,8 (702,4–1095,0) нг/мл; р<0,05) и VCAM- 1 (1082,3 (923,8–1866,3) нг/мл; р<0,05). Ранее сообщалось о высокой концентрации эндотелина-1 и сниженной – 6-кето-простагландина F1α у пациентов с ПМК при наличии «гипертонии белого халата» [15]. Представленные данные являются патогенетическим обоснованием выделения случаев ДСТ с «гипертонией белого халата» в группу риска по развитию стабильной АГ в связи с ролью эндотелиальной дисфункции в ее формировании и прогрессировании, тем более что у пациентов с сочетанием АГ и ДСТ отмечается более выраженная дисфункция эндотелия по сравнению с больными АГ без ДСТ [16].
Вместе с тем известно, что ДСТ нередко ассоциируется с наличием артериальной гипотензии [2]. Однако проспективное наблюдение больных ДСТ продемонстрировало следующие закономерности: тенденция к гипотонии на фоне проявлений вегето-сосудистой дистонии в подростковом возрасте сменяется к 18–20 годам периодами гипотонии с эпизодами нестойкого повышения артериального давления, вегетативными реакциями и развитием у этих лиц в последующем стабильной АГ [4]. В этой связи мы предпочли рассматривать повышенную сывороточную концентрацию ICAM-1 (866,7 (628,2–977,7) нг/мл; р<0,05) в случаях ДСТ и артериальной гипотензии как патогенетическую предпосылку к формированию АГ. Данные о нарушении адгезивной функции эндотелия у больных ДСТ с «гипертонией белого халата» и артериальной гипотензией являются основой для активного систематического контроля уровня артериального давления (офисного, внеофисного, суточного).
Получены данные об увеличенной секреции Е-селектина (52,8 (44,6–60,6) нг/мл; р<0,05) у больных ДСТ в период ремиссии хронической инфекции. Имеются сообщения о влиянии хронических очагов инфекции на развитие дисфункции эндотелия сосудистой стенки у молодых пациентов с нейроциркуляторной астенией [17]. В этом контексте следует рассматривать необходимость ранней санации очагов хронической инфекции у пациентов с ДСТ и высоким уровнем Е-селектина как маркера дисфункции эндотелия.
ЗАКЛЮЧЕНИЕ
Анализ содержания циркулирующих молекул адгезии позволил не только выявить нарушения регуляции соединительнотканного гомеостаза, но и определить наличие закономерностей в уровнях изучаемых молекул с учетом клинических проявлений ДСТ. Предлагаемый подход позволит, с одной стороны, на основе данных клинического обследования (характер диспластического фенотипа, степень митральной регургитации, наличие нарушений сердечного ритма, «гипертонии белого халата» и др.) стратифицировать пациентов по уровню секреции таких молекул адгезии, как Е-селектин, ICAM-1 и VCAM-1, а с другой, патогенетически обосновывать формирование групп, подлежащих диспансерному наблюдению.



