Анемия – это клинико-лабораторный синдром, при котором уровень гемоглобина (Hb) <130 г/л у взрослых мужчин, <115 г/л у взрослых небеременных женщин и <110 г/л у беременных. Количество эритроцитов (red blood cells – RBC) при анемии снижено или может быть в норме. Основными причинами анемий являются: дефицит железа – 29%, хронические заболевания – 27%, острая кровопотеря – 17,5%, гемолиз – 17,5%. Другими причинами обусловлены 9% анемий.
Клинические проявления анемий вариабельны и зависят от их степени, скорости развития, возраста, кардиоваскулярного резерва.
Общие симптомы анемического синдрома неспецифичны – это слабость, утомляемость, головокружение, одышка при нагрузке, сердцебиение, боли в сердце, в т.ч. ишемического характера, особенно у пожилых. При ряде анемий возникают некоторые специфические синдромы: на фоне железодефицитной анемии (ЖДА) – сидеропенический, при дефиците витамина В12 – неврологические симптомы, при гемолитических анемиях – признаки внутриклеточного или внутрисосудистого гемолиза, при апластической анемии – осложнения цитопений (геморрагии, инфекции).
При дифференциальной диагностике анемий большое значение имеют проявления, связанные с их этиологией: анамнестические или актуальные признаки острой или хронической кровопотери, поражения желудочно-кишечного тракта (ЖКТ; атрофический гастрит, инвазия широким лентецом), хронические заболевания (воспалительные, эндокринные, заболевания печени, почек, злокачественные опухоли, инфекции), алкоголизм и др. Анамнез жизни также играет значительную роль в установлении вида или причины анемии, включая национальность, наследственность, место жительства, контакт с вредными веществами. Т.к. нередко, особенно на фоне полиморбидности, установить вид анемии при первом контакте с больным затруднительно, алгоритм дифференциальной диагностики начинается с характеризации анемии по объему эритроцитов. Необходимо помнить, что в литературе и в инструкциях к гематологическим анализаторам приводятся вариабельные «нормативы» показателей крови. В зарубежных источниках указаны «референтные интервалы», охватывающие 95% показателей условно здоровых лиц, в отечественных рекомендациях приводятся референтные значения для 86% популяции, т.е. более узкие интервалы, позволяющие диагностировать патологию раньше. Поэтому для трактовки результатов лабораторных исследований логично пользоваться отечественными нормативами, в том числе приведенными в Руководстве по гематологии под редакцией А.И. Воробьева (2002).
Помимо лабораторной оценки показателей крови, в т.ч. морфологических особенностей, весьма актуален клинический подход, особенно при диагностике анемий у пациентов отделений неотложной терапии (анемии критических состояний – АКС) или пожилых пациентов.
КЛАССИФИКАЦИЯ АНЕМИЙ
Классификация анемий основана на среднем объеме эритроцитов – MCV (mean corpuscular volum), нормальный показатель составляет 76–96 фл. В соответствии с этим показателем анемии подразделяются на микроцитарные, макроцитарные и нормоцитарные (табл. 1). Важным дополнительным методом диагностики при макроцитарных анемиях является исследование миелограммы.
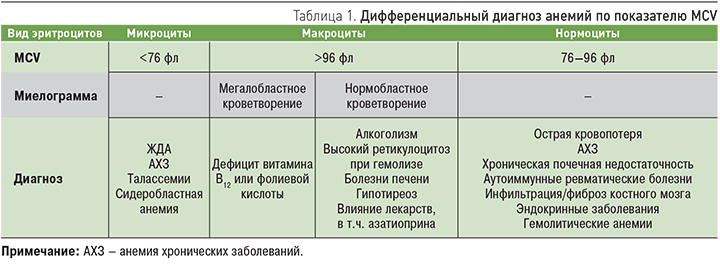
МИКРОЦИТАРНЫЕ АНЕМИИ
Железодефицитная анемия
К причинам дефицита железа (ДЖ), приводящего к анемии, относятся:
- Повышенные потери железа: меноррагии, роды (наиболее частая причина у молодых женщин); желудочно-кишечные кровотечения при язвенной болезни, раке желудка, толстой или прямой кишки, анальной трещине и пр.; воспалительные заболевания кишечника; аномальные кровеносные сосуды в кишечнике (ангиодисплазия); инвазия анкилостомой.
- Снижение потребления железа: мальабсорбция (при целиакии, резекции желудка или тонкого кишечника, инфекции Нelicobacter pylori, аутоиммунном атрофическом гастрите); вегетарианская диета; недоедание; пожилой возраст.
- Повышенная потребность в железе: беременность, лактация; быстрый рост в пубертатном периоде; терапия эритропоэтином.
На фоне ДЖ нарушается гемоглобинизация эритрокариоцитов и созревание эритроцитов. Клинически развивается сидеропенический синдром: повышенная ломкость ногтей, койлонихии, хейлит, глоссит, гнездная аллопеция, пристрастие к необычным запахам и вкусам. Для исключения ДЖ как причины анемии необходимо исследование лабораторных показателей метаболизма железа. При ЖДА в сыворотке крови снижены концентрация железа и уровень ферритина (не всегда отражает истинные запасы железа в организме, т.к. является белком острой фазы и повышается при воспалении, инфекциях, онкозаболеваниях, патологии печени и др.), увеличено содержание трансферрина и числа растворимых рецепторов к трансферрину (наиболее чувствительный тест при ДЖ), увеличена общая железосвязывающая способность сыворотки (ОЖСС).
Разная степень ДЖ характеризуется различными изменениями лабораторных тестов:
- Латентный дефицит железа – снижение уровней ферритина, сывороточного железа, увеличение содержания трансферрина и числа растворимых рецепторов к трансферрину, ОЖСС; в костном мозге снижено количество сидеробластов; эритроцитарные показатели (Hb, RBC, MCV, MCH – среднее содержание Hb в эритроците, MCHC – средняя концентрация Hb в эритроците) обычно в норме или слегка снижены, показатель анизоцитоза – ширина распределения эритроцитов (RDW) немного повышен.
- Регенераторная стадия ЖДА – RBC в норме, снижены показатели Hb, MCV (<80 фл), MCH (<27 пг), MCHC (<300 г/л), RDW в норме или повышен, эритроцитарная гистограмма смещена влево, СОЭ обычно в норме; в мазке – микроанизоцитоз, гипохромия, могут встречаться мишеневидные эритроциты, овалоциты, число ретикулоцитов в норме или немного повышено, возможен тромбоцитоз, реже тромбоцитопения; в костном мозге гиперплазия эритроидного ростка до 40–60%, торможение гемоглобинизации (индекс эритрокариоцитов <0,5), снижено количество сидеробластов.
- Гипорегенераторная стадия ЖДА – снижение RBC, эритроцитарные индексы снижены, возможна нейтропения; в мазке – смешанный анизоцитоз (появление макроцитов), пойкилоцитоз, ретикулоциты в норме или снижены; в костном мозге возможно снижение клеточности, задержка созревания эритрокариоцитов, гранулоцитов, отсутствуют сидеробласты.
Дифференциальный диагноз ЖДА проводят с другими гипохромными анемиями: АХЗ, талассемией, сидеробластными анемиями.
При назначении препаратов железа ретикулоцитарный криз наступает через 10–12 дней, что можно использовать в качестве теста диагностики ЖДА ex juvantibus, восстановление Hb происходит медленнее – через 1–2 мес.
Анемии хронических заболеваний
АХЗ занимают второе место по частоте встречаемости. Развиваются на фоне инфекций, ревматических болезней, опухолей, сахарного диабета, хронической болезни почек. Патогенез АХЗ многофакторный, зависит от конкретного заболевания, в основном связан с влиянием провоспалительных цитокинов, недостаточностью эритропоэтина и ряда других факторов, в результате чего нарушается мобилизация железа из депо (функциональный перераспределительный ДЖ), развивается торможение эритропоэза, происходит укорочение продолжительности жизни эритроцитов.
 Картина периферической крови может быть вариабельна. АХЗ чаще имеет нормоцитарный нормохромный характер, хотя могут развиваться нормоцитарные и гипохромные формы из-за перераспределительного ДЖ, поэтому приходится проводить дифференциальную диагностику с ЖДА (табл. 2), число ретикулоцитов в норме или снижено. В костном мозге: эритроидный росток сохранен или сужен, нормальное или повышенное количество сидеробластов. Показатели обмена железа при АХЗ характеризуются снижением уровня сывороточного железа, насыщения трансферрина железом, ОЖСС, повышением содержания ферритина; уровень трансферрина в норме или снижен, количество растворимых рецепторов к трансферрину в норме. Другие биохимические тесты при АХЗ выявляют повышение белков острой фазы (С-реактивный белок [СРБ], гаптоглобин) (табл. 2). Снижение уровня Нb при АХЗ выражено нерезко, в случае ошибочного назначения препаратов железа при сниженной концентрации его в сыворотке (псевдодефицит железа) эффекта от лечения нет.
Картина периферической крови может быть вариабельна. АХЗ чаще имеет нормоцитарный нормохромный характер, хотя могут развиваться нормоцитарные и гипохромные формы из-за перераспределительного ДЖ, поэтому приходится проводить дифференциальную диагностику с ЖДА (табл. 2), число ретикулоцитов в норме или снижено. В костном мозге: эритроидный росток сохранен или сужен, нормальное или повышенное количество сидеробластов. Показатели обмена железа при АХЗ характеризуются снижением уровня сывороточного железа, насыщения трансферрина железом, ОЖСС, повышением содержания ферритина; уровень трансферрина в норме или снижен, количество растворимых рецепторов к трансферрину в норме. Другие биохимические тесты при АХЗ выявляют повышение белков острой фазы (С-реактивный белок [СРБ], гаптоглобин) (табл. 2). Снижение уровня Нb при АХЗ выражено нерезко, в случае ошибочного назначения препаратов железа при сниженной концентрации его в сыворотке (псевдодефицит железа) эффекта от лечения нет.
В патогенезе АХЗ при хронической почечной недостаточности – снижение продукции эритропоэтина, повышенный гемолиз, постоянные кровопотери, ДЖ, действие уремических токсинов на костный мозг. В периферической крови: нормохромная анемия, но при лечении эритропоэтином может развиться гипохромная микроцитарная анемия, пойкилоцитоз с преобладанием эхиноцитов. В костном мозге эритроидный росток в норме или сужен.
Патогенез АХЗ в условиях ВИЧ-инфекции многофакторный и обусловлен не только влиянием вируса иммунодефицита, но и оппортунистическими инфекциями, развитием злокачественных новообразований, дефицитом питания, действием лекарств; реализуется он путем воздействия на кинетику дифференцировки гемопоэтических клеток с развитием миелодисплазии, созревание эритрокариоцитов, выработку эритропоэтина. Нередко развивается ДЖ, у части пациентов анемия носит сочетанный характер – АХЗ+ЖДА. Со стороны других лабораторных тестов выявляются лейкопения, нейтропения, возможны лимфопения, тромбоцитопения, при этом может быть нарушена морфология всех ростков системы крови.
Сидеробластная анемия
При сидеробластной анемии из-за нарушения синтеза порфиринов снижается утилизация железа для синтеза гема. Сидеробластная анемия может быть наследственной и приобретенной (миелодиспластический синдром – МДС, токсическое действие свинца, этанола, хронические вирусные инфекции – вирусный гепатит С, ВИЧ, лекарственное воздействие – цитостатики, изониазид и др). В тканях за счет повышенного отложения железа развивается сидероз, в костном мозге – неэффективный эритропоэз с кольцевидными сидеробластами (нормобласты с множественными гранулами железа вокруг ядра), гиперплазия эритроидного ростка, торможение гемоглобинизации эритрокариоцитов. В периферической крови – микроцитоз (снижение MCV), пойкилоцитоз, стоматоциты, овалоциты, шизоциты, могут обнаруживаться мишеневидные эритроциты, выраженная гипохромия (снижение MCH, MCHC), повышение RDW. В сыворотке крови – повышено содержание железа, трансферрина и ферритина.
При первичном МДС, связанном с мутациями на уровне стволовой кроветворной клетки, характерны цитопении в периферической крови (лейкопения, тромбоцитопения) и нарушения морфологии в нескольких ростках кроветворения (многоядерность и уродливые ядра эритрокариоцитов, мегалобласты, изменения ядер и гипогранулярность в нейтрофилах и др.). Микроцитарная гипохромная анемия чаще развивается при одном из вариантов МДС – рефрактерной сидеробластной анемии, при других вариантах более характерна картина макроцитарной гиперхромной или нормохромной анемии.
При свинцовой интоксикации в мазке крови много эритроцитов с базофильной пунктацией, наблюдается ретикулоцитоз. В цельной крови и моче повышены концентрации свинца, протопорфирина, в сыворотке крови и моче повышены уровни δ-аминолевулиновой кислоты и копропорфирин. В клинической картине обращают на себя внимание неврологические симптомы, боли в животе, темная кайма на деснах, землистая окраска кожи, признаки гемолиза.
Талассемии
Талассемия относится к числу гемолитических анемий, которые возникают в результате преждевременного разрушения эритроцитов за счет дефектов клеток или под действием ряда внешних факторов. Если срок жизни эритроцитов укорачивается и составляет менее 30 дней, костный мозг не способен компенсировать гемолиз, и развивается анемия. Гемолиз по течению может быть хронический, с периодическими кризами и острый. Признаки гемолиза включают:
- показатели повышенного разрушения эритроцитов (зависят от вида гемолиза);
- признаки увеличения продукции эритроцитов (ретикулоцитоз, полихроматофилы, нормобласты в крови, гиперплазия эритроидного ростка в костном мозге до 70%, при тяжелом гемолитическом кризе может быть мегалобластоз костного мозга за счет относительного дефицита витамина В12 при очень активной регенерации эритрокариоцитов);
- морфологические изменения эритроцитов (сфероциты, овалоциты, мишеневидные эритроциты и пр.);
- на фоне криза – высокий нормобластоз, лейкоцитоз со сдвигом влево, возможен тромбоцитоз, повышение активности лактатдегидрогеназы.
Гемолиз может быть внутриклеточным и внутрисосудистым.
Причинами внутриклеточного гемолиза, когда происходит разрушение эритроцитов в макрофагах селезенки, печени и костного мозга, являются:
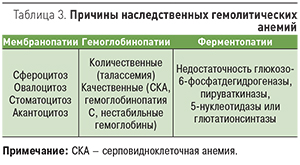
- наследственные гемолитические анемии – эритроцитопатии, гемоглобинопатии, энзимопатии (ферментопатии; табл. 3);
- аутоиммунная гемолитическая анемия с тепловыми агглютининами.
Признаками внутриклеточного гемолиза являются:
- показатели повышенного разрушения эритроцитов – гипербилирубинемия, уробилинурия, увеличение содержания стеркобилина в кале;
- морфологические изменения эритроцитов – сфероциты, овалоциты, мишеневидные эритроциты и пр.;
- клинические проявления – спленомегалия.
 Талассемии – это группа заболеваний, возникающих в результате ослабления или отсутствия синтеза одной или нескольких цепей Нb, при этом увеличена продукция других цепей. Из-за осаждения нестабильных избыточных цепей в эритроцитах возникает гемолиз. Характерен семейный анамнез анемии. Высокая частота талассемий наблюдается в эндемичных для малярии зонах: Средиземноморье, Ближний Восток, Индия. Это обусловлено накоплением мутаций в популяции, т.к. нестабильный Нb препятствует развитию плазмодия в пораженных эритроцитах, и выживают дети, устойчивые к инфекции.
Талассемии – это группа заболеваний, возникающих в результате ослабления или отсутствия синтеза одной или нескольких цепей Нb, при этом увеличена продукция других цепей. Из-за осаждения нестабильных избыточных цепей в эритроцитах возникает гемолиз. Характерен семейный анамнез анемии. Высокая частота талассемий наблюдается в эндемичных для малярии зонах: Средиземноморье, Ближний Восток, Индия. Это обусловлено накоплением мутаций в популяции, т.к. нестабильный Нb препятствует развитию плазмодия в пораженных эритроцитах, и выживают дети, устойчивые к инфекции.
Альфа-талассемия связана с ослаблением или отсутствия синтеза α-цепи Нb. В норме имеется 4 α-глобиновых гена – αα/αα. Больные могут иметь мягкую α-талассемию – α-/αα или α-/α-, если отсутствуют 1 или 2 гена. Тяжелая анемия развивается, если отсутствуют 3 или 4 гена: α-/-- или --/-- (сопровождается водянкой плода, внутриутробной гибелью). При легкой форме α-талассемии клинических симптомов обычно нет. Количество эритроцитов в крови может быть в норме и даже увеличенным до 6 × 1012/л, уровень Нb может быть слегка снижен, при этом возможны гипохромия, микроцитоз.
Бета-талассемия. В норме имеется 2 гена β-глобина. Если в результате мутации синтез β-глобина снижен за счет патологии 1 гена, то симптоматика может отсутствовать или развивается легкая анемия с редкими кризами (малая талассемия). Если мутации имеют место в 2 генах, синтез цепей β-глобина нарушен вплоть до полного их исчезновения, повышается содержание фетального Нb (большая талассемия). После снижения уровня фетального Нb у детей через несколько месяцев развивается тяжелая анемия, что приводит к необходимости переливания крови каждые 4–6 нед. Характерно отставание детей в развитии, постепенно развиваются гепато- и спленомегалия, гемосидероз, сердечная недостаточность. Талассемия может сочетаться с СКА.
При β-талассемии MCV снижен, число эрироцитов нередко повышено, в мазке определяются гипохромные микроциты, резкий анизоцитоз, полихромазия, умеренный ретикулоцитоз, нормобласты, пойкилоцитоз, шизоциты, мишеневидные эритроциты, базофильная пунктация. Характерна лейкопения, при кризе – много нормобластов, нейтрофильный лейкоцитоз со сдвигом влево, тромбоцитоз. При специальной окраске на нестабильный Нb выявляются тельца Гейнца. При электрофорезе Нb фетальный вариант достигает 70%.
Гемолитические анемии, связанные с аномальными гемоглобинами C, D, E
Данные анемии связаны с точечными мутациями в генах Нb. Гетерозиготные формы бессимптомны. У гомозигот развивается легкая анемия, желтуха, спленомегалия. При этом в мазке крови выявляется большое количество (30–100%) мишеневидных эритроцитов. При окраске на ретикулоциты выявляются тельца Гейнца. Такие анемии могут сочетаться с талассемией, что дает тяжелую клиническую картину.
МАКРОЦИТАРНЫЕ АНЕМИИ
Макроцитарные мегалобластные анемии
Причинами макроцитарных мегалобрастных анемий являются:
- Дефицит витамина В12 – нарушение всасывания при атрофическом аутоиммунном гастрите, резекции желудка или кишечника, мальабсорбция при заболеваниях тонкого кишечника (болезнь Крона, целиакия), инвазия широким лентецом, конкурентное потребление при полигельминтозах, дисбактериозе, недостаточное поступление с пищей, наследственный дефицит транскобаламина-2.
- Дефицит фолиевой кислоты – нарушения питания (отсутствие в рационе свежих овощей), повышение потребности (беременность), снижение запасов при заболеваниях печени, особенно на фоне алкоголизма, прием антагонистов фолиевой кислоты, злокачественные опухоли, хронический гемолиз.
- Комбинированный дефицит витамина В12 и фолиевой кислоты – спру, глютеновая энтеропатия.
- Токсические нарушения синтеза ДНК – обусловлены алкилирующими препаратами, в т.ч. цитостатиками, антиконвульсантами, оральными контрацептивами, барбитуратами и др.
При В12-дефицитной анемии нарушается синтез ДНК, что в первую очередь отражается на гемопоэзе и ведет к задержке созревания клеток. Нарушение синтеза жирных кислот способствует демиелинизации нервных стволов. Клиническая картина В12-дефицитной анемии включает:
- неврологические расстройства (парестезии, слабость в ногах, вплоть до параличей, судороги, дезориентация, галлюцинации) – фуникулярный миелоз;
- поражение ЖКТ (снижение аппетита, диспепсия, глоссит);
- небольшая спленомегалия (связана с повышенным разрушением перегруженных Hb эритроцитов);
- желтушность (из-за разрушения перегруженных Hb эритроцитов).
В костном мозге: гиперклеточность, гиперплазия эритроидного ростка, соотношение лейко/эритро снижено (менее 2,1), мегалобластный характер кроветворения, торможение гемоглобинизации («синий» костный мозг), дизэритропоэз (многоядерные эритрокариоциты, межъядерные мостики, тельца Жолли, кариорексис); гигантские гранулоциты, гиперсегментация нейтрофилов, возможно уменьшение количества мегакариоцитов и снижение отшнуровки тромбоцитов.
В общем анализе крови: панцитопения со снижением числа эритроцитов <1 млн/ мкл, макроцитоз (MCV >100 фл), гиперхромия (MCH >32 пг), МСНС в норме. Эритроцитарная гистограмма смещена вправо, уплощена, растянута за счет анизоцитоза. В мазке макро- и мегалоциты на фоне резкого анизоцитоза, овалоциты, шизоциты, пойкилоцитоз, в эритроцитах остатки ядерной субстанции – тельца Жолли, кольца Кебота, встречается базофильная пунктация, число ретикулоцитов снижено.
При назначении витамина В12 – ретикулоцитарный криз на 5–7-й день, восстановление уровня Hb в течение 1 мес. При дефиците фолата клинические и лабораторные признаки аналогичны наблюдаемым при В12-дефицитной анемии.
Макроцитарные нормобластные анемии
Причинами макроцитарных нормобластных анемий являются:
- повышенный эритропоэз при гемолитических анемиях (за счет увеличения MCV на фоне высокого ретикулоцитоза);
- увеличение площади мембраны эритроцитов – заболевания печени, обструктивная желтуха, состояние после спленэктомии;
- рефрактерные анемии – МДС, апластическая анемия, парциальная красноклеточная аплазия;
- алкоголизм, гипотиреоз, хроническая обструктивная болезнь легких, применения цитостатиков.
В костном мозге выявляется расширение красного ростка, эритропоэз нормобластический.
НОРМОЦИТАРНЫЕ АНЕМИИ
Анемия при острой кровопотере
При массивной кровопотере в первые несколько часов показатели красной крови сохраняются в норме за счет одновременной потери эритроцитов и плазы, выброса крови из селезеночного депо. Степень кровопотери оценивают косвенно по выраженности тахикардии и гипотонии. При восстановлении объема крови за счет внесосудистой жидкости возникает острая постгеморрагическая анемия – нормохромная и нормоцитарная. К концу недели развивается ретикулоцитарный криз за счет стимуляции регенерации эритроидного ростка на фоне гипоксии, связанной с кровопотерей, в это время может быть макроцитоз.
Апластическая анемия
Апластическая анемия характеризуется резким угнетением костномозгового кроветворения за счет нарушения пролиферации стволовых клеток и регуляции гемопоэза иммунокомпетентными клетками, дефекта стромы костного мозга. Развивается резко выраженная панцитопения в периферической крови. Врожденная форма – анемия Фанкони, которая сочетается с другими наследственными заболеваниями. Приобретенные вторичные формы связаны с ионизирующей радиацией, лекарственными препаратами, химическими соединениями, вирусными инфекциями (вирус гепатита С, ВИЧ), патологией тимуса (парциальная красноклеточная аплазия аутоиммунного генеза). Клиническая картина характеризуется анемическим, геморрагическим синдромами, инфекционными осложнениями.
В периферической крови: нормохромная анемия, умеренный анизоцитоз с тенденцией к макроцитозу, пойкилоцитозу, снижение ретикулоцитов до 0, лейкопения с абсолютной нейтропенией, относительным лимфоцитозом, тромбоцитопения, СОЭ нередко ускорена. В костном мозге: клеточность резко снижена, число мегакариоцитов уменьшено, иногда они отсутствуют, задержка созревания всех ростков, относительный лимфоцитоз (до 30%), плазмоцитоз (до 10–12%), гранулоцитаный и эритроидный ростки сужены, встречаются макрофаги, фибробласты, увеличено количество сидеробластов.
Дифференциальный диагноз апластической анемии проводят с другими заболеваниями, сопровождающимися панцитопенией, такими как острый лейкоз, МДС, метастазы опухолей в костный мозг, пароксизмальная ночная гемоглобинурия, болезнь Гоше, вирусные гепатиты, ревматические болезни (системная красная волчанка и др.), ВИЧ-инфекция. Основное значение имеет исследование миелограммы (или трепанобиопсия).
Гемолитические анемии
Иммунные гемолитические анемии. При этих анемиях антитела (чаще IgG) вырабатываются к измененным и неизмененным антигенам эритроцитов. Изоиммунные анемии могут возникать при инфекциях, воздействии лекарств, переохлаждении, вакцинации и т.д. Аутоиммунные анемии могут быть идиопатическими, но чаще возникают на фоне лимфопролиферативных и других злокачественных заболеваний, болезней соединительной ткани, аутоиммунных заболеваний, при хронических инфекциях.
Аутоиммунные гемолитические анемии. Чаще протекают с внутриклеточным гемолизом, возможен и внутрисосудистый гемолиз. В мазке на фоне макроанизоцитоза характерны микросфероциты (за счет неполного фагоцитоза мембран эритроцитов, покрытых антителами), ретикулоцитоз, полихроматофилия. Анемия носит нормо- или гиперхромный характер (повышен МСН). В диагностике имеет значение прямая проба Кумбса (или прямой антиглобулиновый тест), хотя и отрицательная проба не исключает аутоиммунный гемолиз. Нередко сочетаются с лимфопролиферативными заболеваниями.
Гемолитическая анемия, обусловленная соматической мутацией клеток-предшественников миелопоэза (пароксизмальная ночная гемоглобинурия). Редкий дефект эритроцитов, проявляющийся повышенной чувствительностью к активированному комплементу при ацидозе, развивающемуся ночью. Гемолиз внутрисосудистый. Утром у больных появляется темная моча (гемоглобинурия). Развивается панцитопения, т.к. дефект мембран присущ всем клеткам. Кризы повторяются с разной частотой. Характерна склонность к тромбозам, из-за тромбоза селезеночных вен возможна спленомегалия. На фоне переливаний крови развивается гемосидероз. Возможно присоединение ЖДА на фоне потери железа с мочой. В костном мозге гиперплазия эритроидного ростка может смениться гипоплазией. В крови на фоне панцитопении развивается ретикулоцитоз, отмечаются нормобласты.
Дополнительные тесты: пробы на повышенную чувствительность к комплементу (сахарозный тест, проба Хема), выявление мутации PIG-А-гена, иммунофенотипирование (проточная цитометрия с антителами к СD55 и СD59).
Мембранопатии
Наследственный сфероцитоз. Связан с мутациями спектрина. Мутация α-спектрина характеризуется рецессивным типом наследования, мутация β-спектрина – аутосомно-доминантным типом. Клинические проявления: помимо гемолитической анемии с гемолитическими и апластическими кризами выявляются деформации клеточного скелета, задержка развития, спленомегалия, гепатомегалия, холелитиаз. При гетерозиготной форме клинические признаки выражены слабо. Гемолитический криз развивается под влиянием инфекции, переохлаждения, переутомления, беременности и других провоцирующих факторов. Показатели крови: нормоцитарная анемия, при кризе нередко макроцитарная – увеличение МСV за счет большого числа ретикулоцитов, вероятна гиперхромия (сферические эритроциты могу вмещать больше Нb, чем двояковогнутые). В мазке крови – микросфероциты (до 30% при кризе), полихромазия, ретикулоцитоз, нормобластоз. При гетерозиготной форме – небольшой ретикулоцитоз, микросфероциты в незначительном количестве.
Дополнительные тесты: снижение осмотической резистентности эритроцитов в гипотоническом растворе NaCl. Можно исследовать продолжительность жизни эритроцитов, меченых радиоактивным хромом, радиоактивность в контрольных точках в динамике снижается быстрее, чем в норме.
Овалоцитоз. Наследование данной анемии аутосомно-доминантное. В крови – нормоцитарная, нормохромная анемия, в мазке у гетерозигот 10–50% овалоцитов, у гомозигот – до 96%. Менее 10% овалоцитов наблюдается при других гемолитических, мегалобластных анемиях, МДС, ЖДА. Клинические проявления сходны со сфероцитозом, снижена осмотическая резистентность эритроцитов.
Стоматоцитоз. Наследование анемии аутосомно-доминантное. Клиника сходна со сфероцитозом. В мазке крови выявляются стоматоциты (в центре эритроцита неокрашенный вытянутый участок), возможно снижение осмотической резистентности эритроцитов.
Акантоцитоз. Для этой анемии характерен аутосомно-рецессивный тип наследования, заболевание связано с нарушением липидного обмена – снижением содержания лецитина и повышением уровня фосфатидилхолина, что изменяет форму мембран эритроцитов. Сочетается с пигментным ретинитом, неврологическими нарушениями. В мазке крови выявляется до 40–80% акантоцитов (эритроциты с выступами контура), имеются признаки гемолиза. Приобретенный акантоцитоз может обнаруживаться при циррозе печени, применении аппарата искусственного кровообращения.
Ферментопатии
При дефиците глюкозо-6-фосфатдегидрогеназы нарушается защита эритроцитов от окислительного повреждения. Ферментопатия передается через Х-хромосому рецессивно, мужчины болеют чаще, хотя у женщин-гетерозигот также могут быть умеренные проявления болезни. Распространена в основном в тропиках. Описаны несколько сотен мутаций с разной выраженностью проявлений заболевания. Причины, провоцирующие гемолиз: бактериемия при сепсисе, лекарства (анальгетики, антибиотики, противомалярийные препараты, наркотики). В мазке крови при суправитальной окраске можно выявить тельца Гейнца, что демонстрирует нестабильность Нb при воздействии окислителя, могут определяться анизо- и пойкилоцитоз, мишеневидные эритроциты, полихроматофилы, ретикулоцитоз при кризе до 70%.
При недостаточности пируваткиназы и других ферментопатиях наблюдаются проявления, сходные с дефицитом глюкозо-6-фосфатдегидрогеназы.
Гемоглобинопатии
Серповидноклеточная анемия (СКА) развивается в результате точечной мутации с заменой в положении 6 β-цепи глобина глутамина на валин, что приводит к синтезу нового гемоглобина – НbS, у которого нарушена функция переноса кислорода, он менее растворим, чем НbА, что приводит к изменению формы эритроцитов. При гомозиготном состоянии концентрация НbS в эритроцитах составляет 90–100%, эритроциты принимают форму серпа при нормальной оксигенации крови; при гетерозиготном состоянии концентрация НbS составляет 20–40%, и серповидные эритроциты появляются в условиях гипоксии. Они плохо деформируются, что приводит к стазу крови в мелких сосудах, развитию инфарктов в различных органах, снижению продолжительности жизни эритроцитов.
Типы СКА:
- СКА с HbSS;
- СКА с HbС (HbSC);
- серповидноклеточная β-талассемия – HbS/β;
- редкая сложная гетерозигота – HbSD.
СКА распространена в малярийных регионах, в эритроцитах при СКА не может развиваться плазмодий. Дети при рождении здоровы, т.к. имеют высокий уровень фетального Нb (не содержит β-цепи), по мере его снижения при гомозиготной форме начинают проявляться признаки болезни: поражения суставов (кистей, стоп, голеней) за счет тромбозов, асептические некрозы головок бедренной и плечевой костей, инфаркт легких, инсульт, сплено- и гепатомегалия. Имеют место аномалии развития скелета: башенный череп, искривление позвоночника, изменения зубов. При гетерозиготной форме – доброкачественное течение либо «носительство», возможна спонтанная гематурия за счет мелких инфарктов почек, в условиях гипоксии развиваются тромбозы. Причины кризов при СКА: инфекция, обезвоживание, холод, гипоксия, ацидоз. В крови нерезкая нормохромная анемия, при кризе – резкое падение уровня Нb, ретикулоцитоз, в мазке крови – полихроматофилия, нормобластоз, серповидные эритроциты в разных количествах, тельца Жолли, мишеневидные эритроциты (за счет восстановленного НbS – меньше объем эритроцитов), пойкилоцитоз, базофильная пунктация, лейкоцитоз со сдвигом влево, тромбоцитоз. В биохимическом анализе крови – признаки гемолиза (повышены уровни неконъюгированного билирубина и свободного Hb, снижен гаптоглобин). При вариантах HbSC или HbS/β концентрация Hb, ретикулоциты и билирубин могут быть в норме.
Специальные тесты: тест на S-гемоглобин с дигидрофосфатом калия (раствор мутнеет при наличии НbS в количестве более 10%), электрофорез Нb (у гомозигот 80–95% НbS, фетальный Нb 5–15%, НbА отсутствует). Более точное исследование – высокоэффективная жидкостная хроматография.
Другие нормоцитарные анемии
Причинами нормоцитарных анемий могут быть:
- инфильтрация костного мозга при злокачественных заболеваниях (острые, хронические лейкозы, метастазы других злокачественных опухолей);
- фиброз костного мозга (туберкулез, миелопролиферативные заболевания – идеопатический миелофиброз и др., лимфомы, облучение, отравление бензолом, остеопетроз);
- эндокринные заболевания.
ОСОБЕННОСТИ ДИАГНОСТИКИ АНЕМИЙ В ОТДЕЛЬНЫХ КЛИНИЧЕСКИХ ГРУППАХ
Помимо традиционного подхода к дифференциальной диагностике анемий, основанного на показателях общего анализа крови, возможно использование алгоритма, связанного с учетом клинических ситуаций. В зависимости от тяжести состояния, возраста, темпов развития анемии вероятность развития разных видов анемии варьирует. В зарубежной клинической практике в настоящее время в качестве отдельных клинических форм анемии выделяют АКС и анемию пожилого возраста.
Анемия критических состояний
АКС является частой проблемой у тяжелых контингентов больных. Более 60% всех пациентов отделений интенсивной терапии (ОИТ) страдает анемией при поступлении, а у большинства поступающих с нормальным уровнем Hb также развивается анемия. У 29% из них уровень Hb <100 г/л. Этиология АКС чаще всего многофакторная: снижение пролиферации и дефекты созревания эритроцитов в костном мозге, а также уменьшение выживаемости эритроцитов из-за вторичных потерь крови или гемолиза, воздействия провоспалительных цитокинов. Наиболее распространенными причинами АКС являются кровопотери, в т.ч. связанные с взятием крови для диагностического лабораторного исследования. Такого рода потеря крови часто не учитывается, но в ОИТ, где пациентам берут кровь в среднем 4,6 раза в день, она достигает 40–60 мл ежедневно. Вторичные кровопотери, связанные с эрозивным гастритом, преимущественно наблюдаются у больных, находящихся на искусственной вентиляции легких, у пациентов с коагулопатиями, черепно-мозговой травмой, на фоне глюкокортикостероидной терапии, а также при операциях. У пациентов ОИТ анемия может быть связана со злокачественными опухолями, особенно на фоне химиотерапии, заболеваниями, протекающими с почечной и/или печеночной недостаточностью, что приводит к угнетению эритропоэза и сокращению продолжительности жизни эритроцитов. Сокращение продукции эритропоэтина является ключевой особенностью АКС, подобно АХЗ, что опосредуется провоспалительными цитокинами. Дополнительные эффекты провоспалительных цитокинов включают: развитие относительного ДЖ, дефицит витаминов и изменение метаболизма железа в костном мозге. АКС характеризуется низкой концентрацией железа в сыворотке крови, снижением ОЖСС, низким насыщением трансферрина, нормальным уровнем трансферрина и растворимых рецепторов к трансферрину и нормальным или повышенным уровнем ферритина. Таким образом, у больных в критическом состоянии может развиться ЖДА, АХЗ или их сочетание, что требует дифференцированных подходов к лечению.
Анемия пожилых
Независимо от степени выраженности, анемия пожилых часто ассоциируется с высокой смертностью и тяжестью общего состояния больных. Частота анемий увеличивается с возрастом, приближаясь к 40% у лиц старше 90 лет, у большинства этих пациентов концентрация Hb <100 г/л. Диагностическая оценка анемии у пожилых людей в целом соответствует алгоритмам ее оценки у молодых взрослых пациентов. Начинается этот алгоритм с определения размера эритроцитов: микроцитарная, нормоцитарная или макроцитарная анемия. Преимущественные причины развития анемий у пожилых больных помогают оптимизировать диагностический процесс в каждом конкретном случае.
Причинами микроцитарной анемии у пожилых могут быть хронические кровопотери, талассемия, отравление свинцом. Вариантами микроцитарной анемии в пожилом возрасте являются ЖДА, сидеробластная анемия (хотя нередко при ней обнаруживается макроцитоз), АХЗ. Нормоцитарные анемии у пожилых развиваются в результате острой потери крови; воспаления, связанного с хронической инфекцией, аутоиммунными или злокачественными заболеваниями; эндогенной интоксикации при хронической патологии печени и почек (АХЗ). Также их причинами могут быть: гемолиз, моноклональные гаммапатии, множественная миелома, острый лейкоз, апластическая анемия, нарушения костномозгового кроветворения при миелофиброзе, инфильтрации костного мозга метастазами злокачественной опухоли, воздействии цитотоксических агентов. Наиболее частая причина макроцитарной анемии – дефицит витамина B12 или дефицит фолатов. Также у пожилых она встречается при гипотиреозе, заболеваниях печени. Макроцитарной у пожилых больных может быть сидеробластная анемия.
По быстроте развития анемии пожилых подразделяются на острые, подострые и хронические.
Острые анемии, требующие срочного вмешательства, могут быть обусловлены кровотечением, гемолизом и апластической анемией. Кровотечение может исходить из любого отдела ЖКТ, в том числе из варикозно расширенных вен пищевода, дивертикулов, злокачественных опухолей. Оно также может быть связано с разрывом аневризмы, травмой селезенки или печени, разрывом гематомы. Следует учитывать, что у пожилых людей тяжелые кровотечения возможны в результате относительно незначительных травм. Антикоагулянтная или антиагрегантная терапия увеличивает риск желудочно-кишечных кровотечений и кровотечений в результате травм (пожилые пациенты значительно чаще принимают эти лекарства, чем более молодые люди). Причинами гемолиза могут быть: применение некоторых лекарств (сульфасалазин, нитрофурантоин и др.), инфекции (в частности малярия), гемолитико-уремический синдром, тромбоцитопеническая пурпура, ДВС-синдром, токсины (змеиный яд и др.), аутоиммунные расстройства, в т.ч. связанные с новообразованиями, особенно лимфопролиферативными. Апластическая анемия у пожилых обычно имеет вторичный характер (облучение, цитостатики и др.).
Подострые анемии у пожилых могут быть связаны с приобретенной аплазией эритроидного ростка (вирусная или микобактериальная инфекция, аутоиммунные заболевания, химические, химиотерапевтические и лучевые воздействия), запустеванием костного мозга (злокачественная инфильтрация при лейкозах или метастазах солидных опухолей, миелофиброз), МДС, приобретенными и наследственными дефектами мембран эритроцитов, механическим разрушением эритроцитов при искусственных клапанах сердца или спленомегалии, наличии аномальных и нестабильных форм Hb.
Примерно треть случаев хронической анемии у пожилых людей связана с дефицитом питательных веществ: железа, фолиевой кислоты или витамина В12. В промышленно развитых странах ЖДА у пожилых людей чаще всего ассоциируется с потерей крови через ЖКТ, особенно на фоне опухолей. Реже ЖДА может быть результатом недостаточного потребления других питательных веществ, синдрома мальабсорбции, в т.ч. при целиакии, геликобактерной инфекции или после операций с наложением желудочно-кишечных анастомозов. Мегалобластная анемия часто возникает у пациентов с дефицитом витамина В12 (на фоне аутоиммунного гастрита), недостаточным питанием или мальабсорбцией, а также при недостаточности фолиевой кислоты, вызванной неадекватным питанием, чрезмерным потребление алкоголя или синдромом мальабсорбции. Также треть случаев хронической анемии приходится на АХЗ. В эту группу входят пациенты с хронической болезнью почек, диабетом, инфекционно-воспалительными и злокачественными заболеваниями. Оставшаяся треть случаев хронической анемии у пожилых людей относится к категории необъяснимых, даже после всестороннего клинического и лабораторного обследования. Необъяснимая анемия обычно проявляется легким снижением уровня Hb с преимущественным снижением пролиферации эритроидного ростка, патогенез ее не изучен, диагноз ставится методом исключения известных видов анемии. У некоторых из этих пациентов отмечается умеренное увеличение уровней маркеров воспаления и снижение уровней эритропоэтина. Возможно, анемия развивается на фоне нарушения нормального возрастного компенсаторного повышения продукции эритропоэтина.
Из-за высокой частоты коморбидности у пожилых людей часто бывает трудно определить, связаны ли имеющиеся симптомы непосредственно с анемией, основной причиной анемии или сопутствующей патологией, поэтому требуется детальное клиническое обследование пациентов. Ниже представлены данные клинического обследования, учет которых необходим при дифференциальной диагностике анемий у пожилых:
- Наличие крови в прямой кишке, мелена или кровь в стуле обнаруживаются у пациентов с желудочно-кишечными кровопотерями.
- Снижение массы тела может свидетельствовать о злокачественном заболевании, пищевом дефиците питательных веществ.
- Острая лихорадка может указывать на гемолиз, связанный с паразитарной инфекцией, например малярией, или микроангиопатическое разрушение эритроцитов, в т.ч. при гемолитико-уремическом синдроме. Периодическое повышение температуры иногда связано со злокачественной опухолью или хронической инфекцией, такой как инфекционный эндокардит.
- Острая вирусная инфекция, например гепатит, может способствовать апластической анемии или вызвать кратковременное подавление костного мозга.
- Пациенты с фибрилляцией предсердий, заменой клапана сердца или тромботическими нарушениями на фоне приема антикоагулянтов имеют повышенный риск кровотечения. Больные с механическими клапанами сердца подвержены риску гемолитической анемии.
- Заболевания мочеполовых органов могу приводить к хронической гематурии или вагинальному кровотечению и ЖДА; хронические заболевания почек приводят к АХЗ в связи с падением синтеза эритропоэтина.
- Жалобы со стороны опорно-двигательного аппарата могут быть связаны с аутоиммунными заболеваниями, такими как ревматоидный артрит, полимиалгия и др.
- Пациент, перенесший инсульт, может принимать антикоагулянты, на фоне которых возникает геморрагический синдром.
- Предыдущий анамнез лейкопении или панцитопении может быть связан с МДС.
- Использование некоторых лекарственных препаратов может приводить к гемолизу, угнетению костного мозга или апластической анемии. Пациенты, принимающие нестероидные противовоспалительные препараты, включая аспирин, и антикоагулянты, подвергаются наиболее высокому риску желудочно-кишечного кровотечения. Химиотерапевтические средства могут вызвать тяжелую анемию, особенно у пожилых.
- Лучевая терапия может вести к подавлению костного мозга.
- Семейный анамнез: анемии или гемолитические нарушения, развившиеся на фоне сфероцитоза, овалоцитоза; СКА или талассемия.
Важное значение при оценке анемии у пожилых имеют данные лабораторного обследования.
Клинический анализ крови. Уровень Hb и гематокрит могут не отражать степень острой анемии. Для характеристики вида анемии используют МСV. Нормальное число ретикулоцитов при значительной анемии указывает на недостаточность костномозгового кроветворения при дефиците питательных веществ, АХЗ, апластической анемии или МДС. С другой стороны, высокий ретикулоцитоз указывает на гиперрегенераторный ответ костного мозга при гемолизе, регенераторной фазе острой гемолитической анемии. Низкий уровень тромбоцитов встречается при В12-дефицитной и апластической анемиях, нередко при МДС. Высокий уровень лейкоцитов может указывать на миелопролиферативные заболевания и определяется у 50% пациентов с острым лейкозом в дебюте болезни. Низкое количество лейкоцитов может указывать на апластическую анемию или МДС. RDW может быть увеличена при ЖДА, особенно в гипорегенераторной стадии, В12-дефицитной и сидеробластной анемиях, выраженных гемолитических или многофакторных анемиях.
Мазок периферической крови. При острой постгеморрагической анемии в мазке крови имеет место нормальная морфология эритроцитов. Базофильная зернистость может присутствовать при ЖДА, отравлении свинцом, талассемии, возможна она и при В12-дефицитной анемии. Острый лейкоз может проявляться наличием бластных клеток. Шизоциты и фрагменты эритроцитов встречаются при микроангиопатической гемолитической анемии, в т.ч. на фоне гемолитико-уремического синдрома. Дефекты мембран эритроцитов связаны с аномальной формой клеток (например овалоциты или сфероциты) в мазке крови. Мишеневидные эритроциты встречаются не только при талассемии, но и при ЖДА, гемоглобинопатии С. Серповидные эритроциты характерны для СКА, но могут иметь место и при талассемии. Гиперсегментированные нейтрофилы можно наблюдать при дефиците фолиевой кислоты или витамина В12. Изменения морфологии эритроцитов, лейкоцитов (пельгеризация, гипогранулярность нейтрофилов и др.) или тромбоцитов (анизоцитоз, гипогранулярность) могут рассматриваться как морфологические доказательства МДС. Нормобласты, особенно на фоне лейкемоидной нейтрофильной реакции, могут быть признаком инфильтративных процессов в костном мозге, в т.ч. при миелофиброзе, злокачественных опухолях (метастазах), при гемолитическом кризе.
Показатели обмена железа. Низкий уровень сывороточного железа характерен при ДЖ и АХЗ. ОЖСС повышена при ДЖ и нормальная или низкая при АХЗ. Ферритин в целом отражает запасы железа в организме, его падение <12 мкг/л является наиболее чувствительным маркером снижения запасов железа. Также ферритин функционирует как острофазовый белок, и его уровни могут быть повышены на фоне хронических воспалительных состояний. Определение показателя sTfR может повысить диагностическую точность выявления ЖДА в присутствии анемии воспаления. Как правило, отношение sTfR к ферритину <1,0 мг/л указывает на анемию воспаления, значение больше 5,0 мг/л говорит о ДЖ, а значения между 2,0 и 5,0 мг/л предполагают комбинацию ДЖ и АХЗ. У пожилых пациентов исследование сывороточного железа, ОЖСС и насыщения трансферрина способствует диагностике ЖДА только в 16% случаев, а определение sTfR позволяет установить ДЖ с точностью 88%, приближаясь по чувствительности к исследованию костного мозга на сидеробласты.
Электрофорез белков. Должен быть включен в план обследования у любого взрослого с пациента анемией, при необходимости показан иммуноэлектрофорез с антисыворотками к различным классам иммуноглобулинов. Моноклональный парапротеин определяется при парапротеинемических гемобластозах, в т.ч. при миеломной болезни.
Воспалительные маркеры. В план обследования больных анемией следует включать определение неспецифических маркеров воспаления, таких как СОЭ, высокочувствительный СРБ, и специфических маркеров аутоиммунных заболеваний (ревматоидный фактор, антинуклеарные антитела). СОЭ и СРБ могут быть повышены при аутоиммунных заболеваниях, инфекциях, злокачественных опухолях и других причинах развития АХЗ.



