Боль в спине (БВС) знакома практически каждому: хотя бы раз в жизни ее испытывали 84% взрослого населения [11]. БВС (дорсалгия) является актуальной проблемой неврологии, т.к. наиболее часто влечет за собой развитие временной нетрудоспособности и ограничение активности в популяции людей трудоспособного возраста [12]. В России боли в нижней части спины составляют от 20 до 80% причин случаев временной нетрудоспособности в активной социальной группе и 20,4% – в общей структуре инвалидности при дегенеративных заболеваниях костно-суставной системы [1]. БВС может быть обусловлена рядом причин: сдавлением спиномозгового корешка грыжей межпозвонкового диска, специфическими причинами (болезни суставов, травмы, воспалительные и онкологические заболевания позвоночника). БВС может быть отраженной и возникать при заболеваниях органов малого таза, брюшной полости. Симптомами «опасного» заболевания являются: возраст пациента старше 50 лет, сохранение боли в покое, беспричинное снижение веса, лихорадка, боль в спине в покое, болезненность при пальпации остистых отростков, травма, остеопороз в анамнезе, наличие изменений в соматическом или неврологическом статусе.
Но наиболее частой причиной дорсалгий является боль скелетно-мышечного происхождения (неспецифическая боль), источником которой служат болезненные мышечные уплотнения (триггеры), фасции, связки, фасеточные суставы, межпозвонковый диск.
Критериями миофасциального болевого синдрома являются [20]:
- наличие пальпируемого тяжа в мышце;
- наличие участка локальной болезненности в пределах тяжа;
- при давлении на участок локальной болезненности воспроизводится типичный для пациента паттерн боли;
- болезненность при пассивном движении, сопровождающемся растяжением пораженной мышцы, и возможное ограничение объема пассивных движений.
Миофасциальные боли развиваются при длительном пребывании в нефизиологичной позе (например, работа за компьютером, посадка растений на грядках и т.д.), после неподготовленной физической нагрузки (например, первый визит в спортивный зал), переохлаждения. С одной стороны, неспецифическая БВС – доброкачественное состояние, с другой, основная и непростая задача терапии – как можно скорее уменьшить боль и восстановить функциональную активность.
В одном из эпидемиологических исследований изучались траектории развития БВС. Было показано, что основной предиктор благоприятного прогноза дорсалгии – купирование или значимый регресс боли в течение 14 дней и отсутствие повреждения нервного корешка [4]. В исследовании было проанализировано течение и исход острой БВС у 1585 пациентов. Подгруппа с быстрым восстановлением (567 человек) характеризовалась полным регрессом боли в течение первых 2-х нед. Исходно у пациентов этой группы была высокая или умеренная интенсивность боли (в среднем 5,9 балла по визуальной аналоговой шкале [ВАШ]), меньше продолжительность обострения (7,06 сут), меньшее количество обострений в анамнезе (5,5), реже отмечалась иррадиация боли ниже колена (13% больных). Пациенты с более длительным восстановлением (543 человека) к 12-й нед характеризовались большей интенсивностью боли (6,26 балла по ВАШ), большей продолжительностью обострения (9,55 сут), большим количеством предыдущих эпизодов (6,17), у них чаще отмечалась иррадиация боли ниже колена (19,2%). У пациентов с неполным восстановлением (222 человека) к 12-й нед отмечалась высокая интенсивность боли (7,11 балла по ВАШ), большая продолжительность обострений (12,87 сут), иррадиация боли ниже колена у трети пациентов (31,1%). Для пациентов с флюктуирующей болью (167 человек) была характерна меньшая интенсивность боли (5,72 балла по ВАШ), но большая продолжительность болевого эпизода (13,5 сут) и большее количество предыдущих эпизодов обострения (10,07). Интенсивность боли среди пациентов с персистирующей болью составила 6,9 балла по ВАШ, количество дней обострения – 15,73, количество предыдущих обострений – 11,86, иррадиация боли ниже колена отмечалась у 30,2% пациентов [4].
Несмотря на то, что раннее начало адекватной терапии имеет ключевое значение в прогнозе дорсалгии, многие пациенты занимаются самолечением и лишь при неэффективности или развитии побочных эффектов обращаются к врачу. Самодиагностика и самолечение заключаются в т.ч. в проведении магнитно-резонансной томографии (МРТ) с неправильной трактовкой результатов, бесконтрольным приемом анальгетиков, самостоятельным назначении себе массажа и других манипуляций. Так, МРТ без назначения врача проводят себе 66,8% пациентов [19]. С учетом того, что при неспецифической БВС изменения на МРТ не коррелируют с клинической картиной [5], пациенты зачастую делают ложные умозаключения о происхождении боли. При этом 25% пациентов назначают себе постельный режим, 40% – массаж, 70% – бесконтрольно принимают анальгетики [19]. В исследовании P. Carrasco-Garrido и соавт. [3] было показано, что среди всех препаратов, приобретаемых для самолечения, 15,1% используется для купирования БВС.
Какой же препарат является наиболее предпочтительным для пациентов? Опрос 1324 пациентов в Германии позволил выявить семь важных основных свойств препарата для лечения боли: отсутствие психотропного действия, отсутствие побочных явлений со стороны желудочно-кишечного тракта (ЖКТ), полный регресс боли, скорость наступления эффекта, низкий риск развития зависимости, возможность приема при сопутствующих заболеваниях, улучшение сна [10].
 Согласно международным стандартам терапии, нестероидные противовоспалительные средства (НПВС) являются средствами выбора для купирования острой БВС (уровень доказательности А) [18]. Тем не менее существуют ограничения приема НПВС, в частности у пациентов с высоким риском патологии ЖКТ, кардиоваскулярной патологии. При назначении НПВС для оценки рисков, связанных с патологий ЖКТ, необходимо выяснить, имеются ли в анамнезе у пациента язвенная болезнь желудка или двенадцатиперстной кишки, колит, инфекция H. pylori, жалобы на диспепсию, принимает ли пациент НПВС с другой целью (например, аспирин для профилактики тромбозов), курит ли. Так, мета-анализ 52 рандомизированных контролируемых исследований, включивший более 50 000 пациентов, показал, что относительный риск кровотечения из ЖКТ и перфорации при применении неселективных НПВС (блокаторы циклооксигеназы-1 и циклооксегиназы-2 [ЦОГ-1, ЦОГ-2]) в 2,3 раза выше, чем при приеме плацебо [9]. В недавно проведенном мета-анализе 35 рандомизированных контролируемых исследований было показано, что вся группа НПВС увеличивает относительный риск гастроэнтерологических реакций в 2,5 раза [7]. Высокий риск осложнений со стороны ЖКТ отмечается у пациентов с язвенной болезнью и кровотечениями в анамнезе, а также у принимающих ацетилсалициловую кислоту для снижения свертываемости крови. В зоне умеренного риска – пациенты пожилого возраста, курильщики, больные с жалобами на диспепсию и имеющие инфицирование H. pylori, лица, длительно принимающие глюкокортикостероиды.
Согласно международным стандартам терапии, нестероидные противовоспалительные средства (НПВС) являются средствами выбора для купирования острой БВС (уровень доказательности А) [18]. Тем не менее существуют ограничения приема НПВС, в частности у пациентов с высоким риском патологии ЖКТ, кардиоваскулярной патологии. При назначении НПВС для оценки рисков, связанных с патологий ЖКТ, необходимо выяснить, имеются ли в анамнезе у пациента язвенная болезнь желудка или двенадцатиперстной кишки, колит, инфекция H. pylori, жалобы на диспепсию, принимает ли пациент НПВС с другой целью (например, аспирин для профилактики тромбозов), курит ли. Так, мета-анализ 52 рандомизированных контролируемых исследований, включивший более 50 000 пациентов, показал, что относительный риск кровотечения из ЖКТ и перфорации при применении неселективных НПВС (блокаторы циклооксигеназы-1 и циклооксегиназы-2 [ЦОГ-1, ЦОГ-2]) в 2,3 раза выше, чем при приеме плацебо [9]. В недавно проведенном мета-анализе 35 рандомизированных контролируемых исследований было показано, что вся группа НПВС увеличивает относительный риск гастроэнтерологических реакций в 2,5 раза [7]. Высокий риск осложнений со стороны ЖКТ отмечается у пациентов с язвенной болезнью и кровотечениями в анамнезе, а также у принимающих ацетилсалициловую кислоту для снижения свертываемости крови. В зоне умеренного риска – пациенты пожилого возраста, курильщики, больные с жалобами на диспепсию и имеющие инфицирование H. pylori, лица, длительно принимающие глюкокортикостероиды.
Для оценки рисков, связанных с кардиоваскулярной патологией, у пациента выясняют, имеются ли ранее диагностированные болезни сердца и сосудов, были ли инфаркты, инсульты, транзиторные ишемические атаки (ТИА), имеется ли артериальная гипертензия, какие-либо дополнительные жалобы (боли в сердце, одышка, отеки, перебои в сердце). К группе риска кардиоваскулярных осложнений при приеме НПВС относятся пациенты, страдающие ишемической болезнью сердца (ИБС), в особенности перенесшие инфаркт миокарда, сахарным диабетом, набравшие по шкале SCORE (Systematic COronary Risk valuation – системная оценка коронарных рисков) более 5%. В мета-анализе 31 рандомизированного контролируемого исследования было показано, что прием ибупрофена увеличивает риск инсульта или инфаркта в 2,26 раза, диклофенака – в 1,6 раза, эторикоксиба – в 1,53 раза [14]. Вместе с тем эти препараты широко и бесконтрольно используются пациентами для самолечения БВС.
Таким образом, НПВС противопоказаны пациентам с открытой язвой или эрозиями, кровотечением из ЖКТ, воспалительными заболеваниями кишечника, пациентам, перенесшим инфаркт, инсульт или ТИА, страдающим ИБС или стенокардией, хронической сердечной недостаточностью (>2 по Классификации сердечной недостаточности Нью-Йоркской ассоциации кардиологов), сахарным диабетом 2 типа с поражением органов-мишеней, хронической почечной недостаточностью (уровень почечной фильтрации <30 p="">
Стратегия снижения основных рисков, сопряженных с приемом НПВС, включает:
- использование селективных НПВС (ингибиторов ЦОГ-2, коксибов) у пациентов с умеренным и высоким риском осложнений со стороны ЖКТ;
- назначение неселективных НПВС в сочетании с противоязвенной терапией (ингибиторы протонной помпы) пациентам с высоким кардиоваскулярным риском;
- применение коксибов в сочетании с противоязвенной терапией (ингибиторы протонной помпы) у пациентов с высоким кардиоваскулярным и ЖКТ риском;
- замену НПВС на препараты с анальгетической активностью других фармакологических групп.
Альтернативой назначению НПВС является использование препаратов группы селективных активаторов нейрональных K-каналов (Selective Neuronal Potassium Channel Opener – SNEPCO), представитель которой флупиртин обладает обезболивающим и миорелаксирующим действием. Механизм действия флупиртина связан непрямым антагонизмом NMDA-рецепторов, чем обусловлено ингибирование активности центральной болевой системы (подавление центральной сенситизации). Вместе с тем, в отличие от опиоидных анальгетиков, флупиртин не взаимодействует с опиоидной системой, чем обусловлено отсутствие у него психотропного эффекта.
Действие флупиртина начинается быстро и сохраняется длительное время. Так, при приеме терапевтической дозы 100–200 мг препарат появляется в крови через 15–30 мин, а пик концентрации отмечается через 1,6–2 ч, период полувыведения составляет 9,6 ч [13]. Показано, что препарат эффективен и безопасен для купирования как острой боли (например, постоперативной) [2], так и хронической невропатической [8].
Объединенный анализ 8 рандомизированных контролируемых исследований, включивший более 1046 пациентов с острой и подострой БВС, показал, что по силе анальгетической активности флупиртин сопоставим с другими средствами (НПВC/трамадол), а по скорости регресса боли несколько превосходит их (боль купируется на 4-й день при приеме флупиртина, на 5-й день при приеме НПВС/трамадола) [17]. Переносимость флупиртина лучше, чем у НПВС: нежелательные явления в группе флупиртина возникают у 28,6% пациентов, а в группе НПВС – у 39,1% (р<0,001). Число пациентов, прервавших терапию в связи с побочными эффектами, было ниже в группе флупиртина (7,1%), чем в группе НПВС (11,7%) [17].
В 2-недельном сравнительном исследовании флупиртина и диклофенака была показана более высокая эффективность флупиртина как в отношении купирования боли, так и восстановления повседневной активности [15]. В исследовании C. Li и соавт. [6] анальгетическая эффективность флупиртина (100 мг 3 раза/сут) при острой боли в спине была сопоставима с анальгетической эффективностью трамадола (50 мг 3 раза/сут). Так, интенсивность боли в группе флупиртина снизилась с 6,8 до 2,8 балла по ВАШ через 5–7 дней терапии, а в группе трамадола – с 6,9 до 3,0 балла по ВАШ за тот же временной промежуток. Уровень регресса боли составил 57% в группе флупиртина и 56% в группе трамадола (р=0,8) [6].
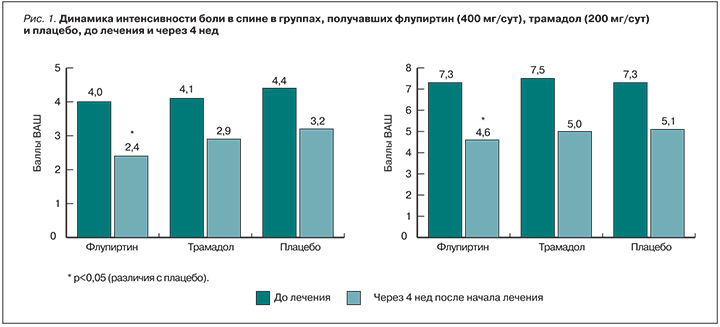
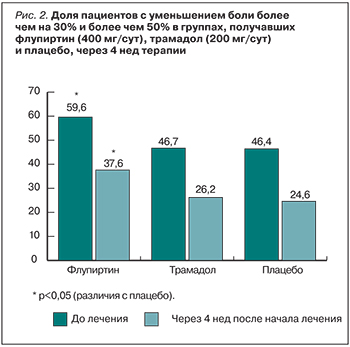
В другом исследовании [16] также сравнивалась анальгетическая эффективность флупиртина, трамадола и плацебо. Флупиртин был статистически значимо эффективнее плацебо и сопоставим по эффективности с трамадолом (рис. 1). Доли пациентов с уменьшением боли более чем на 30% и более чем на 50% в группе флупиртина были сопоставимы с теми же показателями в группе трамадола и статистически значимо превосходили эти показатели в группе плацебо (рис. 2). При этом по степени безопасности флупиртин превосходил трамадол [16].
Для пациентов с болевыми синдромами в настоящее время доступен флупиртин в форме препарата Нолодатак, который позволяет сделать терапию существенно экономичнее, но при этом не менее эффективной. Препарат выпускается в капсулах по 100 мг. Рекомендуемая доза – 1 капсула 3–4 раза/ сут, при выраженной боли – по 2 капсулы 3 раза/сут. Максимальная суточная доза – 600 мг (6 капсул). Необходимо отметить, что Нолодатак полностью отвечает потребностям пациентов с БВС: у препарата отсутствует психотропное действие, побочные явления со стороны ЖКТ. Препарат позволяет добиться полного регресса боли, характеризуется высокой скоростью наступления эффекта. Низкий риск развития зависимости, возможность приема при сопутствующих заболеваниях позволяют широко назначать Нолодатак пациентам с дорсалгией.



