СПИСОК СОКРАЩЕНИЙ
- АГ – артериальная гипертензия
- АД – артериальное давление
- ВАШ – визуальная аналоговая шкала
- ГАГ – гликозаминогликаны
- ЖКК – желудочно-кишечные кровотечения
- ЖКТ – желудочно-кишечный тракт
- ИБС – ишемическая болезнь сердца
- ИЛ-6 – интерлейкин-6
- ИЛ-8 – интерлейкин-8
- ИМ – инфаркт миокарда
- ИМТ – индекс массы тела
- ИПП – ингибиторы протонной помпы
- КМЗ – костно-мышечные заболевания
- МПК – минеральная плотность кости
- НПВП – нестероидные противовоспалительные препараты
- ОА – остеоартрит
- Омега-3 ПНЖК – омега-3 полиненасыщенные жирные кислоты
- РКИ – рандомизированное клиническое исследование
- СД – сахарный диабет
- СОЭ – скорость оседания эритроцитов
- ССЗ – сердечно-сосудистые заболевания
- ССС – сердечно-сосудистая система
- ХОБЛ – хроническая обструктивная болезнь легких
- ХС – хондроитина сульфат
- ЦОГ-2 – циклооксигеназа-2
ПРЕДИСЛОВИЕ
В 2016 г. вышли клинические рекомендации «Ведение больных с остеоартритом и коморбидностью в общей врачебной практике», разработанные при участии Российского научного медицинского общества терапевтов (РНМОТ) и Ассоциации ревматологов России (АРР). Этому предшествовала колоссальная работа по каждому модулю и каждой интервенции. Результирующие данные были обобщены, проанализированы, предварительно представлены в виде отчета и проекта консенсуса, обсуждены на заседании Экспертного совета под председательством президента РНМОТ акад. РАН проф. А.И. Мартынова. На заседании присутствовали 25 членов совета, в том числе профессора по специальностям «внутренние болезни», «кардиология», «неврология», «ревматология», «травматология», «клиническая фармакология», «восстановительная медицина, спортивная медицина, лечебная физкультура, курортология и физиотерапия». В состав Экспертного совета вошли специалисты ведущих учреждений, занимающихся проблемой ОА: ФГБНУ «НИИР им. В.А. Насоновой», ФГБОУ ВО «МГМСУ им. А.И. Евдокимова», ФГБОУ ВО «Первый МГМУ им. И.М. Сеченова», ФГБОУ ВО «РНИМУ им. Н.И. Пирогова». Каждый член совета высказал свое мнение, внес комментарии или замечания по консенсусу, которые нашли отражение в итоговом документе клинических рекомендаций.
В 2018 г. в помощь практикующим врачам вышел сокращенный карманный вариант рекомендаций, который мы и представляем вашему вниманию.
ПРОБЛЕМА ОСТЕОАРТРИТА
Основным заболеванием, определяющим стремительный рост распространенности костно-мышечной патологии, является ОА с его негативным влиянием на пациентов:
- хроническая боль в суставах посредством симпатоадреналовых реакций усугубляет тяжесть коморбидных заболеваний (ССЗ, СД, ХОБЛ, старческая астения);
- уменьшение функциональных возможностей сустава со временем приводит к иммобилизации больных, что требует ежедневной помощи в выполнении рутинных задач (от родственников, работников социальных служб и амбулаторного звена);
- снижение ежедневной физической активности (из-за боли и нарушений функций) увеличивает декомпенсацию ССЗ, поскольку не позволяет проводить реабилитационные мероприятия в полном объеме и усугубляет застойные явления;
- в популяции ОА является главной и самой частой причиной низкого качества жизни в пожилом и старческом возрасте.
 ОПРЕДЕЛЕНИЕ, КЛИНИЧЕСКИЕ ФОРМЫ И ФЕНОТИПЫ ОСТЕОАРТРИТА
ОПРЕДЕЛЕНИЕ, КЛИНИЧЕСКИЕ ФОРМЫ И ФЕНОТИПЫ ОСТЕОАРТРИТА
ОА – заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- и микроповреждениях, с последующими анатомическими и физиологическими нарушениями (деградацией хряща, ремоделированием кости, образованием остеофитов, воспалением, потерей нормальной функции сустава).
В зависимости от распространенности процесса выделяют две формы первичного ОА:
- локальную форму с поражением 1 или 2 суставов (ОА суставов кистей, стоп коленного, тазобедренного суставов, ОА позвоночника);
- генерализованную форму с поражением 3 и более суставов или группы суставов (проксимальные межфаланговые суставы оценивают как одну группу, а дистальные межфаланговые суставы – как другую).
Первичный (идиопатический) ОА развивается в периферических суставах, наиболее часто в дистальных и проксимальных межфаланговых суставах кистей (с образованием узелков Гебердена и Бушара), в 1-м запястно-пястном, 1-м плюснефаланговом, тазобедренном и коленном суставах, в межпозвонковых дисках и суставах позвоночника, особенно шейного и поясничного отделов.
Вторичный ОА возникает в результате травмы, врожденной дисплазии опорно-двигательного аппарата, эндокринных заболеваний (акромегалии, гиперпаратиреоза), метаболических нарушений (охроноза, гемохроматоза, подагры) и других патологий костей и суставов (ревматоидного и инфекционных артритов, асептических некрозов костей).
Патогенетические события, развивающиеся в суставах при ОА, соответствуют воспалению, поэтому врачу необходимо знать наиболее частые причины, инициирующие воспаление в хрящевой и синовиальной ткани.
Медиаторы, запускающие и поддерживающие воспаление в суставе, активно вырабатываются в следующих случаях, требующих обязательной медикаментозной коррекции:
- избыточной массы тела;
- нефизиологической нагрузки на сустав – высокого индекса массы тела (ИМТ), нарушения осей конечностей (деформация ног, галус вальгус и т.п.), подъема тяжестей, падения (все это требует протекции и разгрузки сустава ортезами);
- гиперхолестеринемии, гипергликемии, АГ, гиперурикемии, гипоксии – состояний, включающих синтез всех возможных медиаторов воспаления и приводящих к деструкции хряща и кости. Вследствие этого лечение боли при ОА возможно лишь в случае достижения целевых значений указанных параметров.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА ОСТЕОАРТРИТА
Клинические симптомы ОА:
- боль в суставах и окружающих их мышцах;
- деконфигурация суставов (увеличение в размерах, анатомические деформации);
- снижение функциональных возможностей суставов (невозможность выполнять физиологический объем движений в суставе);
- стартовые боли (кратковременный эпизод интенсивной боли в суставах после периода покоя);
- снижение активности больного, вплоть до иммобилизации;
- атрофия мышц.
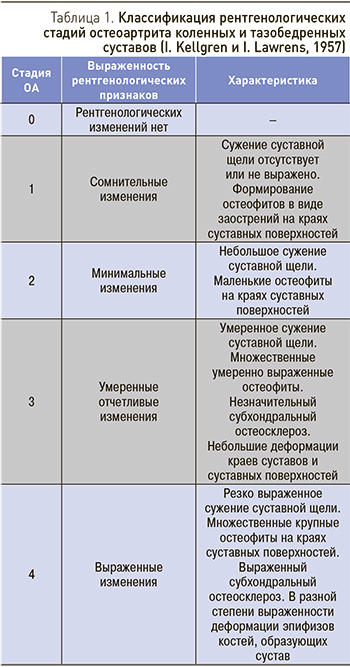
Для определения рентгенологической стадии ОА коленных и тазобедренных суставов используют классификацию I. Kellgren и I. Lawrens (1957), которая в модифицированном виде приведена в табл. 1.
Боли в суставах, требующие проведения дифференциального диагноза:
- симметричный полиартрит (возможен коллагеноз);
- моноартрит (возможна травма сустава в анамнезе, что требует консультации ортопеда);
- продолжительная утренняя скованность (более 30 мин);
- невозможность совершить движения в суставах, особенно в суставах кисти и стоп (коллагеноз);
- боли в суставах, возникшие после значимого стресса – травм, переохлаждения, операции и т.п. (возможен коллагеноз);
- боли в суставах, возникшие после перенесенного инфекционного заболевания (возможен инфекционный артрит);
- боли в суставах у молодых мужчин, злоупотребляющих белковыми коктейлями в фитнесс-центрах (возможна подагра);
- боли в суставах у пациентов с дисплазией соединительной ткани (необходима консультация ортопеда для подбора ортопедических приспособлений, снижающих нагрузку на сустав);
- боли в суставах у больных с патологией щитовидной железы или у больных СД (необходима консультация эндокринолога и акцент внимания на нейропатический компонент боли);
- безрезультатность множества обследований, болезненность мышц, острофазовые белки в анализах (возможна ревматическая полимиалгия);
- боли в суставах у астеничных женщин с анамнезом частых заболеваний в детском возрасте (возможны инфекционные артриты: Эпштейна–Барра, болезнь Рейтера и т.п.).
Ассоциированные клинические синдромы:
- депрессия;
- нарушение сна;
- снижение когнитивных функций;
- гиперурикемия.
Исходы ОА:
- длительные безболевые периоды с оптимальным уровнем активности больного (целевой исход);
- асептический некроз;
- эндопротезирование.
Наиболее частые коморбидные состояния, встречающиеся при ОА и способствующие его прогрессированию (в порядке ранжирования):
- ожирение;
- АГ;
- атеросклероз и ассоциированные с ним состояния (ИБС, периферический атеросклероз, дисциркуляторная энцефалопатия);
- СД;
- патология щитовидной железы;
- ХОБЛ;
- токсические висцеропатии;
- патология ЖКТ.
ПОРЯДОК ОСМОТРА И ОФОРМЛЕНИЯ МЕДИЦИНСКОЙ ДОКУМЕНТАЦИИ
Рекомендации для врачей амбулаторного звена
При первичном осмотре пациента с ОА необходимо оценить и отразить в клинической документации следующие факты:
- болезненные суставы;
- интенсивность боли (используя ВАШ), продолжительность, наличие стартовой боли (утром, после периода покоя);
- сведения о купировании предыдущих рецидивов боли;
- осмотреть и пальпировать сустав для оценки наличия деформации сустава, выпота в полость сустава, костных разрастаний, включая узелки Гебердена и/или Бушара, болезненности при пальпации, атрофии околосуставных мышц;
- изучить движения в суставе (ограничение подвижности, наличие крепитации при движении) и оценить влияние поражения сустава(ов) на выполнение бытовых функций;
- оценить походку;
- выявить нарушения сна и депрессию, вызванные болью.
Для диагностики ОА лабораторные исследования не нужны. Однако следует проводить обязательное изучение концентрации мочевой кислоты для персонификации стратегии терапии с учетом микрокристаллического стресса. На рентгенограммах выявляют сужение суставных щелей, остеосклероз, краевые остеофиты. Ультразвуковое исследование проводится для выявления синовита. Только рентгенологических изменений для клинического диагноза ОА недостаточно – необходимо наличие клинических симптомов.
С целью дифференциальной диагностики проводятся следующие исследования: общий анализ крови (СОЭ, анемия при коллагенозах, лейкоцитоз при реактивном артрите), мочевая кислота, креатинин, С-реактивный белок, антитела к цитруллиновому пептиду, антитела к двуспиральной ДНК, ревматоидный фактор, общий анализ мочи.
С целью персонификации фармакотерапии следует уточнить коморбидный статус пациента: биохимические показатели липидного и углеводного обмена, аминотрансферазы. К дополнительным методам исследования, проведение которых строго регламентировано специальными строгими показаниями, можно отнести магнитно-резонансную томографию суставов, костную денситометрию. Чаще данные методы используются для дифференциальной диагностики.
При первичном осмотре больного необходимо оценить и отразить в клинической документации:
- наличие болезненных суставов или присоединение новых болезненных суставов (в том числе фасеточных суставов и пояснично-крестцового сочленения);
- отметить динамику интенсивности боли (по ВАШ) и ее продолжительность;
- определить динамику синовита, если он был ранее;
- охарактеризовать оценку терапии пациентом;
- при наличии коморбидности оценить клиническую динамику коморбидного заболевания.
Показания для консультации ревматолога при первичном обращении в поликлинику:
- длительно (более месяца) существующий синовит;
- подозрение на воспалительные заболевания суставов или системные заболевания соединительной ткани (длительное припухание сустава, ускоренная СОЭ, высокий уровень С-реактивного белка).
Действия врача на амбулаторном этапе при суставном синдроме:
- В случае отсутствия опыта лечения артрита следует провести консилиум с опытным врачом.
- Провести общий медицинский осмотр и формирование развернутой диагностической концепции.
- Проверить наличие показаний для антиагрегантов, статинов, метформина, инкретинов.
- Определить нейропатический компонент боли.
- Назначить интервенции, направленные на снижение веса. Артрит при ожирении требует всех возможных методов лечения, включая хирургический, поскольку цитокины адипоцитов поддерживают воспаление в суставе.
- Определить стартовую терапию боли.
- Обсудить со специалистом допустимый уровень интенсивности лечебной физкультуры.
- Мониторировать АД в сроки приема НПВП.
- Определить стратегию лечения осложнений СД.
- Определить наличие относительных и абсолютных противопоказаний для назначения НПВП.
- В случае отсутствия навыка внутрисуставных инъекций следует прибегать к помощи ортопеда, ревматолога или врача общей практики, имеющего опыт и сертификат для выполнения таких процедур.
- Инфекционный артрит лечится специфической антибактериальной терапией.
- Решение о заместительной гормональной терапии применяется на консилиуме специалистов.
- Острый артрит, синовит, а также период дифференциально-диагностического поиска требует стратегии разгрузки сустава (ортезы и специальные повязки).
- При СД стратегия разгрузки сустава с болью является приоритетной задачей.
- Гиперхолестеринемия, гипергликемия и гиперурикемия требуют обязательной медикаментозной коррекции, поскольку являются факторами неэффективности обезболивающей стратегии.
- Лечебная физкультура, содержащая упражнения на растяжение мышц, тренировку баланса и функциональных возможностей суставов, является обязательным компонентом терапии любой обезболивающей стратегии.
- Не рекомендуется длительное назначение НПВП, парацетамола и других анальгетических средств. Обезболивания следует достигать реабилитационными методами.

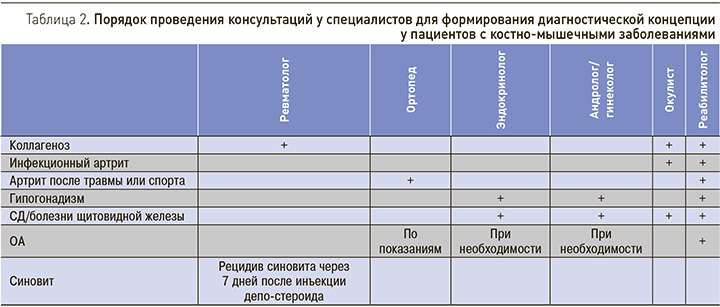
Порядок проведения консультаций у специалистов для формирования диагностической концепции у пациентов с КМЗ представлен в табл. 2.
ЛЕКАРСТВЕННАЯ ТЕРАПИЯ ОСТЕОАРТРИТА
Стартовая фармакотерапия болевого синдрома при ОА
Терапию боли начинают с применения парацетамола в дозе 2–4 г/сут. В то же время в нескольких РКИ была установлена его неэффективность у больных с болью в нижней части спины и у больных ОА коленных суставов в сравнении с диклофенаком натрия в дозе 150 мг/сут. Стоит обратить внимание практикующих врачей на возможность и необходимость мультимодального подхода к обезболиванию. Например, назначение парацетамола может сочетаться с назначением местных форм НПВП, лидокаина и регулярной физической нагрузкой, регламентированной функциональными возможностями.
Большой клинический результат эксперты РФ отмечают и в группе НПВП. Однако при их применении должен учитываться риск нежелательных явлений, особенно у больных с коморбидными состояниями, в основе которых лежат ССЗ. Также подлежит учету спектр коморбидности при выборе и назначении НПВП.
Регламент назначения НПВП в амбулаторной практике НПВП у пациентов с АГ:
- применение всех НПВП практически всегда сопровождается повышением АД, даже при плановой гипотензивной терапии;
- пациенту необходимо рекомендовать строгий самоконтроль АД не менее 3 раз/сут;
- при применении НПВП пациенту всегда должна быть назначена комбинированная гипотензивная терапия;
- при повышении АД следует увеличить дозу препаратов комбинированной гипотензивной терапии;
- в отсутствие эффекта следует добавить еще один гипотензивный препарат из пяти основных классов в соответствии с рекомендованными комбинациями.
НПВП у лиц, перенесших вмешательства на коронарных, сонных и мозговых артериях:
- применение всех НПВП противопоказано больным, недавно перенесшим аортокоронарное шунтирование;
- эта рекомендация может быть распространена и на лиц, которым была проведена ангиопластика или стентирование.
Обезболивание у лиц, применяющих двойную (тройную) антиагрегантную терапию или новые оральные антикоагулянты:
- НПВП таким пациентам не показаны;
- возможен прием парацетамола (2–4 г/сут) в комбинации с симптоматическими медленно действующими препаратами;
- также возможно использование местных форм НПВП и лидокаина.
При хронической болезни почек настороженность должна присутствовать при каждом назначении НПВП, особенно лицам пожилого возраста.
Категории пациентов с абсолютными противопоказаниями к НПВП:
- больные, перенесшие аортокоронарное шунтирование, стентирование или другие чрескожные вмешательства, реконструктивные операции на сонных, мозговых и позвоночных артериях (прием НПВП противопоказан на протяжении всей жизни);
- больные с фибрилляцией предсердий;
- больные с дестабилизированной хронической сердечной недостаточностью;
- больные, применяющие ацетилсалициловую кислоту и клопидогрел в комбинации друг с другом, а также в сочетании с прямыми оральными антикоагулянтами;
- больные, применяющие прямые оральные антикоагулянты.

Риск тромбоэмболических осложнений при приеме НПВП у этих групп больных значимо превышает положительные эффекты.
Решение практической задачи по адекватному обезболиванию пациентов с ОА и сосудистой коморбидностью заключается в назначении им комбинированной стратегии, включающей:
- местные формы НПВП;
- местные формы лидокаина;
- немедикаментозные интервенции;
- коррекцию нейропатического и психогенного компонентов боли на фоне длительного приема базисных противовоспалительных средств;
- при необходимости назначение парацетамола (доза определяется потребностью пациента, в интервале 1–4 г/сут) или иных анальгетиков, традиционно не относящихся к НПВП.
Лечение и профилактика острых гастродуоденальных поражений на фоне приема НПВП
Риск острого эрозивно-язвенного поражения гастродуоденальной слизистой оболочки на фоне приема НПВП резко возрастает у пожилых больных с атеросклерозом аорты и сердечной недостаточностью, приводящих к хронической ишемии гастродуоденальной слизистой оболочки. Обострение ИБС, в частности, при остром ИМ, особенно повторном, приводит к декомпенсации кровообращения в слизистой оболочке желудка и развитию острых язв или эрозий, ведущих к значимому ЖКК.
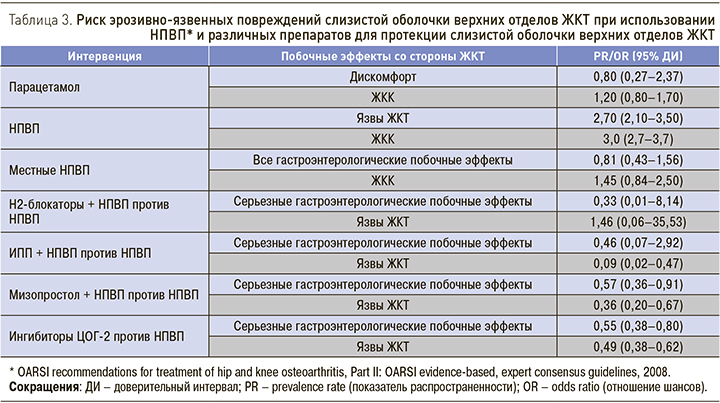
Единственной эффективной стратегией реальной профилактики поражения гастродуоденальной слизистой оболочки служит назначение антисекреторных препаратов тем больным и в тех клинических ситуациях, когда есть высокий риск развития НПВП-гастропатии и ЖКК (табл. 3). Прекращение приема НПВП само по себе не приводит к заживлению НПВП-гастропатии у большинства таких больных.
Ингибиторы протонной помпы
Многолетний вопрос гастротоксичности большинства НПВП сегодня может быть решен обязательным назначением ИПП для профилактики эрозивно-язвенных повреждений слизистой оболочки верхних отделов ЖКТ.
Базисные противовоспалительные препараты в комплексной терапии ОА (симптоматические медленно действующие препараты, хондропротекторы)
Комплексная терапия ОА должна включать средства, влияющие на воспаление и метаболические процессы в хрящевой ткани и хондроцитах. Если суммировать выводы большинства РКИ, то такие препараты с практической точки зрения обладают следующим действием:
- проявляют достоверный обезболивающий эффект;
- проявляют противовоспалительный эффект;
- увеличивают объем функциональной активности;
- нивелируют утреннюю скованность и стартовые боли.
Важным с патогенетической точки зрения является противовоспалительный эффект ХС и глюкозамина сульфата.
Одной из стратегических ошибок в назначении этих препаратов в таблетированных формах является курсовое лечение. Согласно убедительным данным РКИ, представленные выше эффекты симптоматических медленно действующих препаратов достигаются при их приеме сроком от 2 до 4 лет.
Алфлутоп – одобренный для внутримышечного и внутрисуставного введения оригинальный биоактивный концентрат из четырех видов мелкой морской рыбы. Концентрат содержит мукополисахариды, или ГАГ (хондроитина-4-сульфат, хондроитина-6-сульфат, дерматансульфат, кератансульфат), 14 аминокислот, ионы натрия, калия, кальция, магния, железа, меди, марганца, цинка и глюкуроновую кислоту – предшественницу синтеза гиалуроновой кислоты. Эффективность и безопасность препарата подтверждены в ряде клинических исследований. Доказано, что препарат обладает симптоматическим, противовоспалительным и структурно-модифицирующим эффектами. Противовоспалительный эффект и регенерация тканей прежде всего обусловлены угнетением активности гиалуронидазы, нормализацией биосинтеза гиалуроновой кислоты и увеличением пролиферации хондроцитов. Кроме того, препарат уменьшает экспрессию провоспалительных цитокинов, в первую очередь ИЛ-6 и ИЛ-8. Антиоксидантный эффект достигается за счет увеличения активности каталазы, уменьшения внутриклеточного супероксид аниона и пероксида водорода. Структурно-модифицирующее действие обусловлено ингибированием экспрессии протеаз, ответственных за деструкцию аггрекана, усилением клеточного ответа катаболическим процессам через активацию синтеза гиалуронана и аггрекана.
Терапия нейропатического и психогенного компонента хронической боли при ОА и коморбидности
При нейропатической боли главными патогенетическими механизмами являются не процессы активации периферических ноцицепторов, а нейрональные и рецепторные нарушения, периферическая и центральная сенситизация, что требует назначения специальных лекарственных средств.
Эксперты РФ выделяют прегабалин и габапентин как основные средства для лечения нейропатического компонента хронической боли строго по регламентирующим показаниям. Для коррекции психогенного компонента хронической боли целесообразно использовать амитриптилин и дулоксетин.
В настоящее время существует немного активных веществ, оказывающих воздействие на физиологическую регенерацию на уровне периферических нервов. К таким активным компонентам можно отнести эссенциальные составляющие ДНК и РНК – пиримидиновые нуклеотиды (уридин).
Локальная терапия ОА
Этот метод лечения включает внутри- или околосуставное введение препарата Алфлутоп, глюкокортикоидов, внутрисуставное введение препаратов гиалуроновой кислоты, а также местное нанесение на область суставов мазей, кремов, гелей на основе НПВП.
Выпот в суставе составляет основное показание к внутрисуставному введению депо-стероидов. Критерии неэффективности этого метода:
- если через неделю выпот накопился вновь, повторное введение не рекомендовано;
- следует проводить дифференциальную диагностику и консультацию ревматолога.
Показания к внутрисуставному введению препаратов гиалуроновой кислоты:
- главный критерий – отсутствие выпота в сустав (необходимо выполнить ультразвуковое исследование сустава);
- недостаточная эффективность проводимой терапии (прием НПВП 3 мес и более);
- плохой и очень плохой эффект от симптоматических медленно действующих препаратов в течение 3 мес и более.
Внутрисуставное введение протеза синовиальной жидкости – экзогенного гиалуроната натрия – уменьшает болевой синдром, улучшает подвижность суставов, позволяет пациентам сократить применение НПВП, а также отсрочить проведение эндопротезирования сустава.
Сочетание остеоартрита и остеопороза
Большинство российских и международных экспертов предлагают выделять фенотипические варианты ОА в зависимости от качества костной ткани:
- с удовлетворительным качеством костной ткани;
- с неудовлетворительным качеством костной ткани.
Рекомендации по фармакотерапии остеопороза:
- немедикаментозные способы лечения являются обязательной составной частью профилактики и лечения больного с остеопорозом. Они включают образовательные программы, отказ от вредных привычек, физические упражнения (регулярную ходьбу, плавание, упражнения из исходного положения стоя) и другую физическую нагрузку, по показаниям – ношение протекторов бедра;
- при обнаружении переломов тел позвонков больным рекомендуется ношение корсета и ограничение сидения;
- женщинам и мужчинам с низким ИМТ необходимо нормализовать массу тела. Важно предупреждение падений – это в первую очередь фармакологическая коррекция энцефалопатии, стабилизация соматической патологии пациента (нормализация АД, нивелирование одышки, предупреждение ангинозных приступов, коррекция перемежающей хромоты и т.п.).
Физическая активность
Показано, что эффективным способом увеличения МПК в позвоночнике и костях тазобедренного сустава у женщин в постменопаузе является ходьба.
Основой для профилактики и лечения всех форм остеопороза и остеопений является назначение витамина D3 и выполнение рекомендаций по достаточному потреблению кальция.
Отсутствие необходимости выполнения денситометрии у каждого пациента диктует важность обязательного соблюдения ряда тактических приемов, которые приведены в табл. 4.
Препаратами первой линии для лечения остеопороза на сегодняшний день являются бисфосфонаты. Выбор осуществляется между тремя основными средствами этой группы: алендроновой кислотой, ибандроновой кислотой, золедроновой кислотой. Так, алендроновая кислота в дозе 70 мг предназначена для применения 1 раз в неделю, ибандроновая (150 мг) – 1 раз в месяц, золедроновая (5 мг) – 1 раз в год. «Редкий» прием бисфосфонатов, бесспорно, повышает комплаенс пациентов.
При наличии симптомов патологического течения менопаузы (вазомоторные, повышение АД и т.д.) следует обсудить необходимость заместительной гормональной терапии. При этом необходимо помнить, что решение о назначении препаратов заместительной гормональной терапии может принять только гинеколог после соответствующего обследования.
У мужчин с клиническими симптомами андропаузы (в первую очередь эректильная дисфункция и т.д.) наиболее удобным сегодня является тестостерона ундеканоат, инъекции которого осуществляются лишь 1 раз в 3 мес. Для назначения препаратов тестостерона необходима консультация уролога и исследование простатспецифического антигена (ПСА) для исключения пациентов с риском рака простаты.
Мониторинг терапии остеопороза в первую очередь ориентирован на случаи новых и повторных переломов. Однако для предварительных оценок целесообразно использовать показатели денситометрии и маркеров костного ремоделирования. Костная денситометрия проводится 1 раз в год.
Динамика течения остеопороза (имеет значение как для принятия решений о дальнейшей терапии, так и для заключений при направлении на экспертизу нетрудоспособности) может быть следующей:
- положительная динамика устанавливается при повышении МПК более чем на 2–3% за год в отсутствие новых переломов;
- стабильная динамика устанавливается при отсутствии новых переломов костей, но без повышения или снижения МПК;
- прогрессирование болезни определяется при возникновении новых переломов за период лечения и/или при снижении МПК более чем на 3% за год (по процентному значению Т-критерия).
При оценке маркеров костного ремоделирования необходимо снижение значений маркеров резорбции и прирост маркеров новообразования кости (костная фракция щелочной фосфатазы, остеокальцин и т.д.).
Остеоартрит и избыточная масса тела
В диету больных с ОА рекомендуется включать рыбные продукты (как минимум 2 раза/нед), содержащие омега-3 ПНЖК. Омега-3 ПНЖК способны подавлять воспалительные реакции в организме, они нормализуют жировой обмен, положительно влияют на сосудистую стенку и реологические свойства крови. С целью полной компенсации дефицита этих веществ и физиологической коррекции жирового обмена целесообразно назначать лекарственные препараты омега-3 ПНЖК. Медикаментозное лечение рекомендуется пациентам с ИМТ ≥30 кг/м2 или лицам с ИМТ ≥27 кг/м2 и сопутствующими заболеваниями (АГ, СД 2 типа).
Критерии выбора препаратов
В отношении трех препаратов (орлистат, сибутрамин и римонабант), зарегистрированных и рекомендованных для лечения ожирения в Европейском союзе, недостаточно доказательных данных, на основании которых можно было бы рекомендовать конкретный препарат данному пациенту.
Адекватное лечение осложнений ожирения, кроме снижения массы тела, должно включать:
- лечение дислипидемии;
- оптимизацию контроля гликемии у лиц с СД 2 типа;
- лечение респираторных расстройств, таких как синдром апноэ во сне;
- лечение болевого синдрома и двигательных расстройств при ОА;
- коррекцию психосоциальных нарушений, в частности эмоциональных расстройств, нарушений пищевого поведения, низкой самооценки и внешнего вида.
Терапия ожирения (табл. 5) может приводить к уменьшению необходимости в лекарствах, предназначенных для лечения сопутствующей патологии.
Хирургическое лечение ожирения
Хирургическое лечение следует рекомендовать лицам в возрасте 18–60 лет, ИМТ которых превышает 40 кг/м2 или равен 35,0–39,9 кг/м2 при условии наличия сопутствующей патологии, течение которой должно улучшиться после вмешательства (например, СД 2 типа и другие метаболические расстройства, кардиореспираторная патология, тяжелые поражения суставов и связанные с ожирением психологические проблемы) (класс 3, 4).
Ожидаемое среднее снижение массы тела и долгосрочные результаты улучшаются при проведении следующих процедур: бандажирование желудка, рукавная резекция, проксимальное гастрошунтирование, билиопанкреатическое отведение + дуоденальный свитч и билиопанкреатическое отведение. Тем не менее сложность хирургических интервенций и потенциальные хирургические и долгосрочные нутритивные риски этих вмешательств также повышаются при их сочетанном применении.
Терапия сахарного диабета при остеоартрите
Препаратом выбора для лечения СД считается метформин, который не только непосредственно воздействует на инсулинорезистентность, но и обладает рядом благоприятных кардиоваскулярных и метаболических эффектов. Суточная доза метформина не должна быть ниже 1500 мг. Во избежание полипрагмазии может применяться пролонгированная форма этого лекарственного средства.
Метформин противопоказан при нарушении функции почек (снижение клиренса креатинина ниже 45 мл/мин), печеночной недостаточности, гипоксических состояниях любой этиологии, а также при злоупотреблении алкоголем. Следует воздержаться от назначения препарата в период беременности и лактации, необходима его отмена при проведении рентгеноконтрастных исследований в связи с риском развития острой почечной недостаточности и за 5–7 дней до планируемых манипуляций. Метформин следует использовать с осторожностью у пожилых пациентов, со сниженной массой тела.
При недостижении целевых показателей гликемии на монотерапии метформином целесообразна его комбинация с ингибиторами дипептидилпептидазы-4 (иДПП-4). Эта группа препаратов обладает нейтральным эффектом в отношении веса, а в комбинации с метформином приводит к снижению массы тела. Для удобства выпускаются фиксированные комбинации метформина с иДПП-4.
НЕМЕДИКАМЕНТОЗНЫЕ МЕТОДЫ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ОСТЕОАРТРИТА С КОМОРБИДНОСТЬЮ
Регулярная физическая активность и физические упражнения положительно влияют на симптомы, функцию и качество жизни пациентов с ОА и являются решающими компонентами ведения таких больных. Упражнения должны быть направлены на расширение объема движений, увеличение гибкости, пребывания на свежем воздухе и улучшения работы мышц.
Обратите внимание!
Наиболее продуктивной методикой, позволяющей в кратчайшие сроки добиться редукции боли и предотвратить ее рецидивы, является ежедневная непрерывная ходьба на расстояние 3 км в наиболее комфортном для пациента режиме.
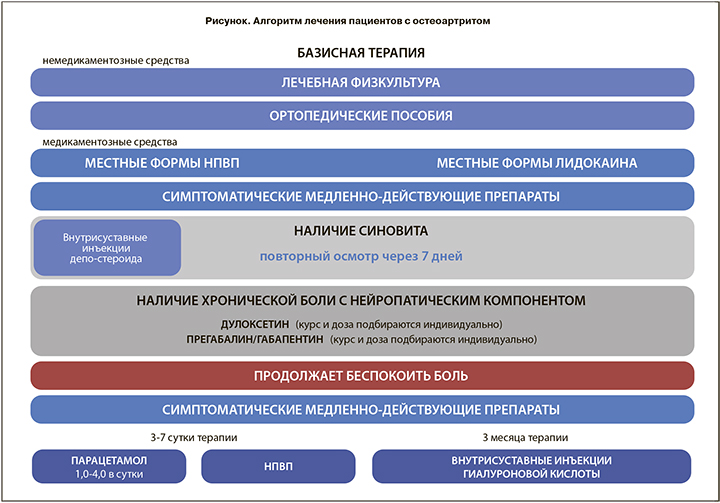
Общий алгоритм лечения ОА отражен на рис.
ВЕДЕНИЕ БОЛЬНОГО ПОСЛЕ ЭНДОПРОТЕЗИРОВАНИЯ НА АМБУЛАТОРНОМ ЭТАПЕ
При лечении хронической боли в неоперированных суставах после эндопротезирования достаточный уровень доказательств симптоматического эффекта имеется в отношении следующих средств:
- ХС;
- глюкозамина сульфат;
- комбинированные препараты ХС и глюкозамина сульфата;
- дополнительные препараты – Алфлутоп;
- диацереин;
В некоторых случаях следует обдумать применение нефиксированных комбинаций.



