Диагностика
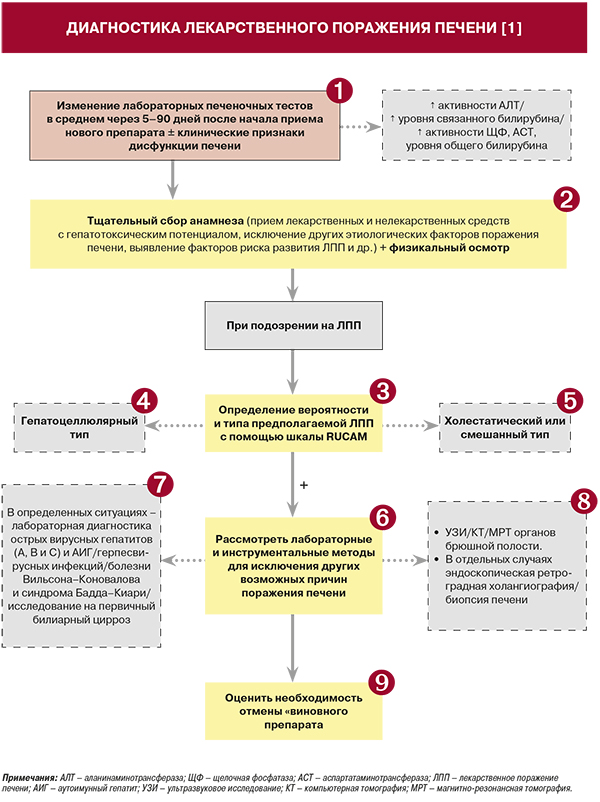
1.
• Согласно рекомендациям Международной рабочей группы экспертов, наличие лекарственного поражения печени (ЛПП) можно обсуждать, если на фоне приема препарата (лекарственное средство, БАД и др.) в период в среднем от 5 до 90 дней от начала его использования наблюдается:
- повышение активности аланинаминтрансферазы (АЛТ) >2 верхних границ нормы (ВГН);
- или повышение уровня связанного билирубина >2 ВГН;
- или сочетание повышения активности аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ) и уровня общего билирубина (один из показателей >2 ВГН).
При этом необходимо учитывать наличие существующих заболеваний печени [1, 2].
• Диапазон клинических проявлений ЛПП может быть разнообразен: от небольшого повышения уровня аминотрансфераз, не сопровождающегося клинической симптоматикой, до молниеносных гепатитов и развития циррозов. Изменения показателей ферментов могут свидетельствовать о гепатоцеллюлярном повреждении печени при повышении уровня аминотрансфераз в качестве преобладающего симптома или о холестатическом повреждении при повышении уровня ЩФ с гипербилирубинемией или без нее [1].
• ЛПП клинически могут напоминать почти все существующие заболевания печени: острый гепатит, стеатогепатит, острую печеночную недостаточность, сосудистые реакции, холестатическое поражение и др. Лекарственные гепатиты, сопровождающиеся желтухой, могут протекать по цитолитическому, холестатическому или смешанному варианту.
В ряде случаев развивается псевдохирургическая симптоматика (боли в животе, лихорадка, желтуха, увеличенный желчный пузырь). К лекарственным средствам, способным вызвать острую псевдохирургическую симптоматику, относятся цитостатики, антидепрессанты, антиаритмические препараты. Фактором, способствующим переходу гепатита в хроническое состояние, является длительный прием лекарственных средств [1].
2.
• Более 60% всех ЛПП приходится на долю антибиотиков и противосудорожных препаратов (табл. 1). Среди анальгетиков, нестероидных противовоспалительных препаратов в этом плане лидируют парацетамол, диклофенак и нимесулид, среди противомикробных средств – амоксициллин + клавулановая кислота [4]. При этом, разумеется, спектр препаратов, способных вызывать ЛПП, ими отнюдь не исчерпывается. Он также включает различные противогрибковые, противовирусные (для лечения ВИЧ-инфекции), противоопухолевые средства, сахароснижающие (глибенкламид, гликлазид), гиполипидемические (статины, фибраты), тиреотропные (тиамазол, пропилтиоурацил) препараты, H2и H1-блокаторы (циметедин, дезлоратадин), иммуномодуляторы (интерфероны альфа, бета, азатиоприн, ингибиторы фактора некроза опухолей-альфа), препараты для заместительной гормональной терапии, анаболические стероиды, антигипертензивные средства, амиодарон, ингибиторы протонной помпы, метотрексат и др. Более того, в этот список входят и некоторые фитопрепараты и диетические (пищевые) добавки, например, содержащие экстракт зеленого чая (катехин), пирролизидиновые алкалоиды [1].
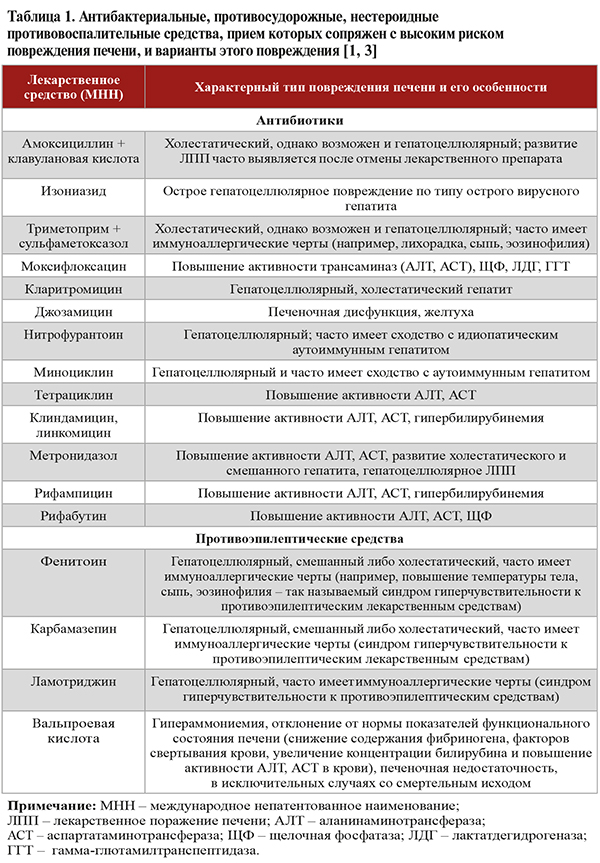
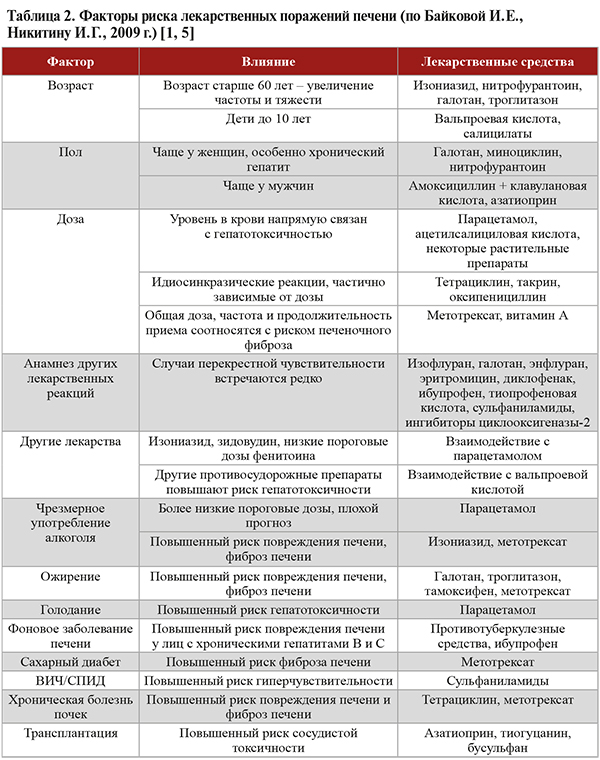
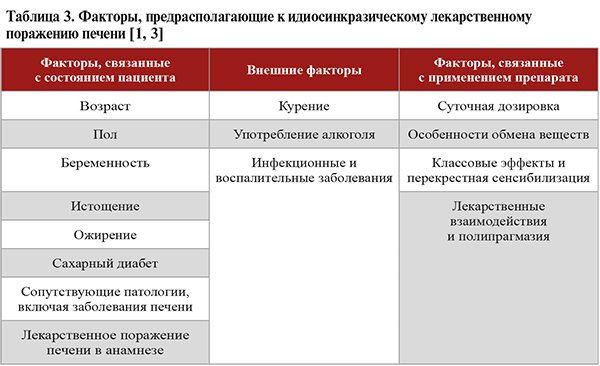
• В отношении некоторых лекарственных препаратов имеются исследования, показавшие наличие факторов риска, которые многократно усиливают риск повреждения печени при их приеме (табл. 2). Отдельно при сборе анамнеза следует учитывать факторы, которые могут вызывать предрасположенность к развитию идиосинкразического ЛПП (табл. 3). Под этим термином понимают такую форму ЛПП, когда гепатотоксичность проявляется лишь у отдельных восприимчивых лиц, реакция имеет менее выраженную зависимость от дозировки и в большей степени различается по длительности латентного периода, манифестации и течению [1].
• Физикальное обследование при подозрении на ЛПП включает осмотр кожных покровов, перкуторное и пальпаторное исследование органов дыхания, пищеварения, сердечно-сосудистой и выделительной систем. Иными словами, проводится полноценный физикальный осмотр больного для констатации патологии печени и выявления или исключения возможной патологии со стороны других органов и систем.
3.
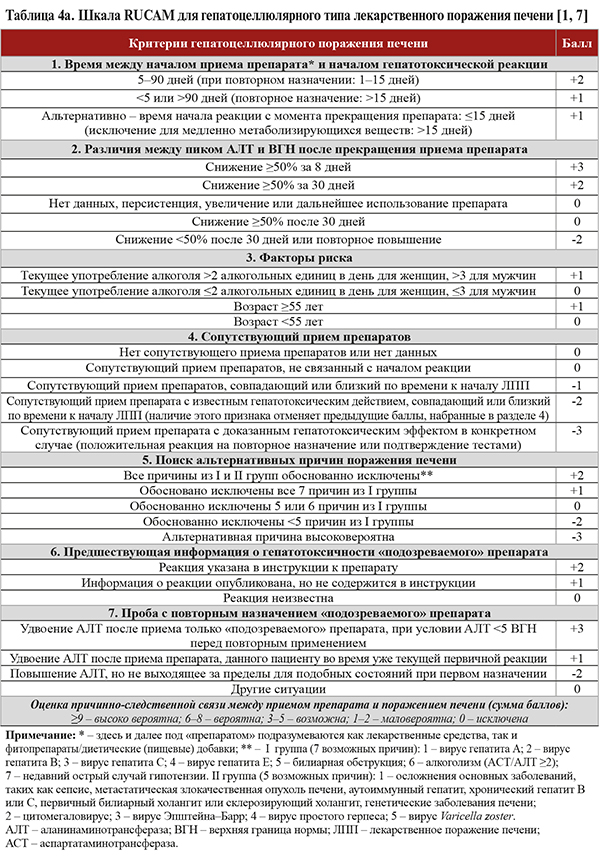
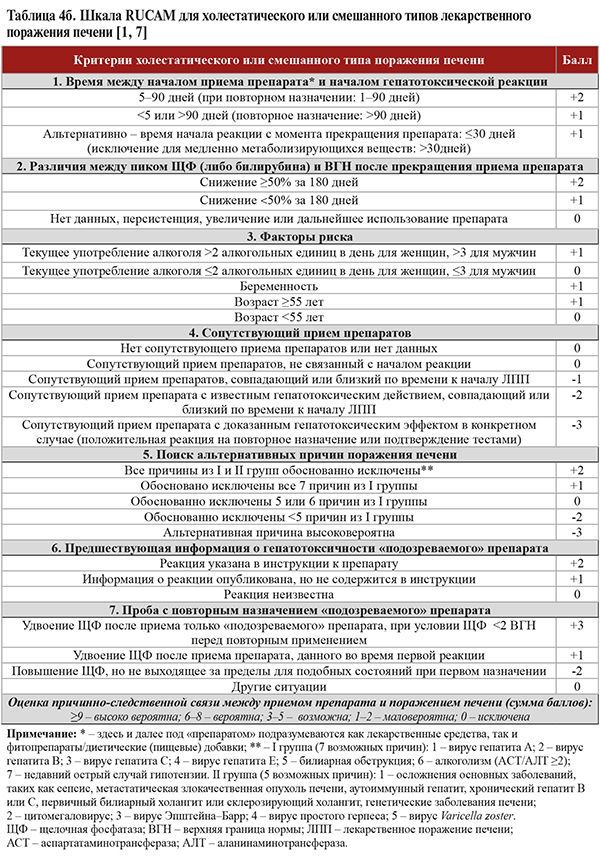
• Шкала RUCAM (табл. 4а, 4б) рекомендуется для использования в качестве полуколичественной системы оценки возможной ЛПП при приеме определенного препарата: уровень убедительности рекомендаций (УУР) B, уровень достоверности доказательств (УДД) 1 [1, 6]. RUCAM учитывает клинико-анамнестические данные, имеющиеся литературные сведения о гепатотоксичности подозреваемого препарата и пробу с повторным назначением препарата.
4.
• Гепатоцеллюлярный тип ЛПП характеризуется повышением активности АЛТ более чем в 2 раза в сравнении с ВГН или соотношением АЛТ/ЩФ ≥5. Эту форму заболевания отличает более тяжелая степень поражения печени по сравнению с холестатической и смешанной формами. Для нее типично острое течение, а сочетание гепатоцеллюлярного типа ЛПП с гипербилирубинемией обусловливает тяжелое повреждение печени и высокую смертность (0,7–1,3 случая на 100 тыс. пациентов) [1].
5.
• Для холестатического типа ЛПП типично повышение активности ЩФ в 2 раза в сравнении с ВГН или соотношение АЛТ/ЩФ ≤2 ВГН при хроническом течении. Для смешанного типа ЛПП свойственно повышение активности АЛТ >2 ВГН и соотношение АЛТ/ЩФ >2, но <5 при хроническом течении [1].
6.
• В настоящее время клинический диагноз ЛПП остается диагнозом исключения и может быть установлен после всестороннего анализа «лекарственного» анамнеза у пациента, клинических признаков поражения печени, динамической оценки изменений в биохимических тестах печеночных синдромов, после оценки истинной или идиосинкразической гепатотоксичности конкретного препарата, если это возможно, а также при исключении других причин поражения печени. При необходимости может быть проведено гистологическое исследование печеночной ткани: УУР B, УДД 1 [1, 2].
• У лиц с подозрением на гепатоцеллюлярное либо смешанное ЛПП рекомендуется исключить острые вирусные гепатиты (A, B и C) и аутоиммунный гепатит (АИГ) при помощи стандартных серологических исследований и исследования на РНК и ДНК вирусных гепатитов: УУР С, УДД 1 [1–3]. Добавим, что с целью дифференциальной диагностики АИГ-подобного ЛПП с АИГ рекомендуется тщательно собирать «лекарственный» анамнез у пациента, анализировать аутоиммунные индексы, наблюдать в динамике клинико-лабораторные сдвиги при отмене препарата и реакции на введение стероидов (если показано) и при необходимости выполнять гистологическое исследование печени для дальнейшей дифференциальной диагностики: УУР С, УДД 1 [1–3, 6].
• Рекомендуется обследование на острую инфекцию, вызванную цитомегаловирусом, вирусом Эпштейна–Барр либо вирусом герпеса простого при исключении распространенных вирусных гепатитов (А, В, С) либо при наличии клинических признаков, характерных для указанных заболеваний, например, атипичного лимфоцитоза, лимфаденопатии: УУР С, УДД 1 [1–3].
7.
• В соответствующих клинических случаях рекомендуется исключить наличие болезни Вильсона–Коновалова и синдрома Бадда–Киари: УУР С, УДД 1 [1–3].
• Выполнение серологических исследований на первичный билиарный цирроз рекомендуется пациентам с отсутствием явных признаков патологии билиарного тракта по результатам визуализирующих исследований органов брюшной полости: УУР С, УДД 1 [1, 3].
8.
• У лиц с подозрением на лекарственный холестаз во всех случаях рекомендуется проводить визуализирующие исследования (ультразвуковое исследование, либо компьютерную томографию, либо магнитно-резонансную томографию) органов брюшной полости с целью исключения патологии билиарного тракта и инфильтративных процессов: УУР С, УДД 1 [1–3].
• Проведение эндоскопической ретроградной холангиографии рекомендуется ограничить случаями, когда рутинные визуализирующие исследования не позволяют исключить наличие конкрементов в общем желчном протоке, первичный склерозирующий холангит либо панкреатобилиарные злокачественные процессы: УУР С, УДД 1 [1–3].
• Выполнение биопсии печени рекомендуется рассмотреть в следующих случаях:
- одной из возможных причин повреждения печени служит АИГ, и предполагается проведение иммуносупрессивной терапии (УУР С, УДД 1) [1–3];
- при продолжающемся повышении уровня ферментов печени либо признаках ухудшения функции печени, несмотря на отмену подозреваемого лекарственного средства (УУР С, УДД 1) [1–3];
- если максимальный уровень АЛТ не снизился на более чем 50% через 30–60 дней после развития патологии при гепатоцеллюлярном ЛПП либо если максимальный уровень ЩФ не уменьшился более чем на 50 % через 180 дней после развития патологии при холестатическом ЛПП, несмотря на отмену подозреваемого лекарственного препарата (УУР С, УДД 2) [1–3];
- когда предполагается продолжение приема препарата, подозреваемого в ЛПП, либо его повторное назначение (УУР С, УДД 1) [1–3];
- при сохранении патологического уровня ферментов печени спустя 180 дней после отмены лекарственных средств для исключения хронического заболевания печени, не связанного с приемом лекарств, и/или диагностики хронического течения ЛПП (УУР С, УДД 2) [1, 3].
• Неинвазивные методы оценки фиброза (лабораторные расчетные методики, эластография) могут быть использованы при хронических ЛПП. Однако их данные следует трактовать как ориентировочные, поскольку эти методы не адаптированы для применения при ЛПП [1, 3, 6].
9.
• В окончательный диагноз ЛПП рекомендуется включать название участвующего препарата, клинический тип ЛПП, острый или хронический вид ЛПП, показатель RUCAM и степень тяжести ЛПП (табл. 5): УУР B, УДД 1 [1–3, 6].
• Диагностический алгоритм при ЛПП рекомендуется использовать и при подозрении на гепатотоксичность, связанную с приемом фитопрепаратов и/или диетических добавок (ФДД). Это означает, что другие причины повреждения печени должны быть исключены посредством тщательного сбора анамнеза, соответствующего лабораторного обследования и визуализирующих исследований гепатобилиарной системы. При исключении других причин на фоне недавнего приема ФДД может быть достоверно установлен диагноз связанной с ФДД гепатотоксичности: УУР С, УДД 1 [1–3, 6].

Лечение
1.
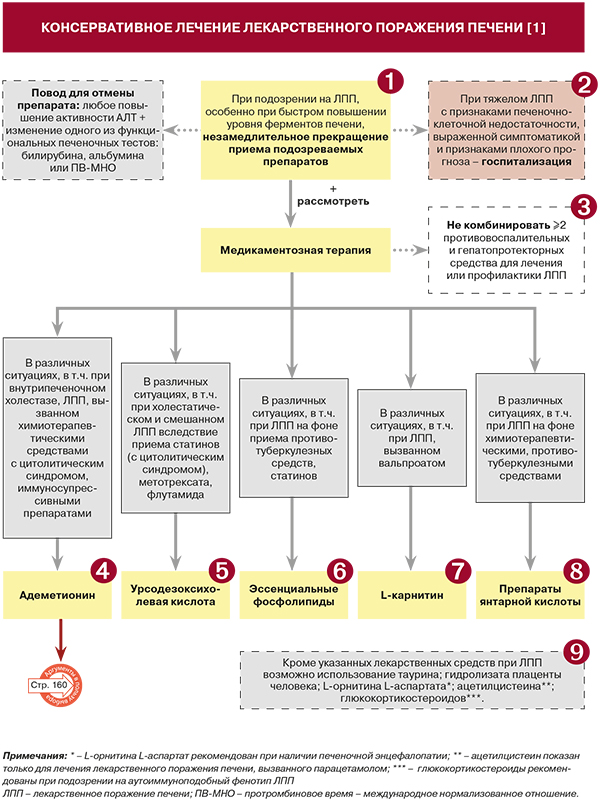
• При подозрении на ЛПП, особенно при быстром повышении уровня ферментов печени либо наличии печеночно-клеточной недостаточности (особенно быстро прогрессирующей), рекомендуется незамедлительно отменить подозреваемое(-ые) лекарственное(-ые) средство(-а) либо ФДД: УУР А, УДД 1 [1, 3]. Если прекращение лечения нежелательно, а ЛПП является легким (см. раздел «Диагностика. Комментарии», табл. 5), возможна либо отмена «виновного» препарата, либо уменьшение его дозировки: УУР B, УДД 1 [1–3].
• Крайне не рекомендуется повторно назначать препарат, вероятно вызвавший гепатотоксическое повреждение, особенно в тех случаях, когда первичное повреждение печени было связано со значительным повышением уровня аминотрансфераз (например, >5 ВГН, развитием желтухи и др.). Исключением могут быть угрожающие жизни состояния при невозможности проведения альтернативного лечения: УУР С, УДД 1 [1–3].
• Если «виновный» препарат жизненно необходим пациенту, он должен быть отменен при развитии следующих признаков:
- АЛТ или АСТ сыворотки >8 ВГН;
- AЛT или AСT >5 ВГН в течение 2 нед и более;
- AЛT или AСT >3 ВГН, билирубин >2 ВГН или международное нормализованное отношение (МНО) >1,5;
- AЛT или AСT >3 ВГН, цитолиз сопровождается постепенно прогрессирующей слабостью, усталостью, симптомами желудочно-кишечной диспепсии и/или эозинофилией (>5%) [1–3].
В отсутствии указанных признаков возможно продолжение приема «виновного» препарата по жизненным показаниям под прикрытием средств с гепатопротективными свойствами, показавших положительные результаты применения при ЛПП (см. ниже) [1].
• Назначение пациентам с хроническими заболеваниями печени лекарственных средств, обладающих гепатотоксическим действием, рекомендуется базировать на оценке риска и пользы рассматриваемого вида лечения в каждом конкретном случае: УУР С, УДД 1 [1–3].
• Согласно алгоритму ведения пациентов с ЛПП Kazuto T. и Yukihiro S. (2008), при гепатоцеллюлярном или смешанном типе ЛПП, выявленном по опроснику RUCAM, «подозреваемый» препарат сразу отменяют и продолжают наблюдение за пациентом. Если же установлен холелитический тип ЛПП, то сначала продолжают наблюдение, а отмену «подозреваемого препарата» производят в случае дальнейшего ухудшения функции печени [1, 2].
2.
• К выраженным симптомам ЛПП, требующим госпитализации, относят рвоту, обезвоживание, кровотечение, проявления печеночной энцефалопатии. Признаки плохого прогноза, также диктующие необходимость стационарного лечения, описываются законом Хая. Суть его состоит в эмпирической закономерности, согласно которой у пациента существует высокий риск летального ЛПП, если препарат вызывает печеночно-клеточную, а не холестатическую желтуху. Закон Хая состоит из трех частей:
a) 3или более кратное превышение ВГН АЛТ или АСТ;
b) более чем в 2 раза превышен верхний предел нормы общего билирубина сыворотки, без застоя желчи (определяется как менее чем 2-кратное превышение ВГН ЩФ);
c) отсутствуют другие причины подобной комбинации повышенных аминотрансфераз и общего билирубина сыворотки: вирусный гепатит, алкоголизм, ишемия, ранее выявленное заболевание печени или иное лекарство, способное вызвать наблюдаемое поражение [1].
• Обо всех случаях тяжелого ЛПП необходимо сообщать в центр трансплантации печени, поскольку своевременное оперативное лечение спасает около 40% пациентов с ЛПП [1, 6].
3.
Не рекомендуется комбинировать два или более типа противовоспалительных и гепатопротекторных средств для лечения или профилактики ЛПП: УУР В, УДД 2 [1–3].
4.
• Рекомендуется рассмотреть применение адеметионина при ЛПП, поскольку в ряде клинических исследований показана его эффективность у этой категории больных: УУР В, УДД 2 [1].
• Препараты адеметионина зарегистрированы с показанием «внутрипеченочный холестаз» на основании нескольких двойных слепых плацебо-контролируемых рандомизированных клинических исследований, а также открытых исследований с референсконтролем и ряда рандомизированных исследований, демонстрирующих эффекты адеметионина и при цитолитическом синдроме [1, 8]. Адеметионин сочетает гепатопротекторное (стабилизация клеточных мембран гепатоцитов), холеретическое, холекинетическое, детоксикационное, антиоксидантное, регенерирующее, антифибротическое и антидепрессивное действие, участвует в регуляции энергообмена (синтез АТФ), способствует нормализации обмена триглицеридов [9, 10]. Холеретический и гепатопротекторный эффект препарата сохраняется до 3 мес после прекращения курса терапии [9].
• Адеметионин может быть использован у пациентов с ЛПП химиотерапевтическими средствами при наличии цитолитического синдрома [1, 8]. Эффективность при таком варианте ЛПП доказана в наблюдательном исследовании, в котором пациенты получали три разных противоопухолевых режима: ралтитрексид + оксалиплатин, FOLFIRI (иринотекан, 5-фторурацил, натрия левофолинат), CMF (циклофосфан, метотрексат, 5-фторурацил). При развитии гепатотоксичности (повышении уровня сывороточных трансаминаз и ЛДГ) назначение адеметионина приводило к снижению этих показателей уже в течение 1-й недели с сохранением положительного эффекта, что давало возможность сохранения запланированного курса полихимиотерапии [6, 8].
• Ретроспективное исследование 105 пациентов с колоректальным раком и режимом химиотерапии FOLFOXIV (оксалиплатин, лейковорин, 5-фторурацил) показало, что адъювантное назначение адеметионина внутрь в дозе 400 мг 2 раза/сут в течение всего курса химиотерапии достоверно снижало такие печеночные тесты, как АЛТ, АСТ, лактатдегидрогеназа (ЛДГ), ЩФ и общий билирубин, в сравнении с теми, кому адеметионин не назначался. Аналогичные результаты были получены в исследовании той же группы авторов: у пациентов с метастатическим колоректальным раком, которые в дополнении к химиотерапии (оксалиплатин, капецитабин + бевацизумаб) получали адеметионин (400 мг 2 раза/сут), при развитии ЛПП отмечалось достоверное снижение сывороточных трансаминаз в сравнении с теми, кто не получал этот гепатопротектор [6, 11].
• В российском многоцентровом проспективном наблюдательном исследовании 105 пациентов с псориазом, получавших иммуносупрессивную терапию (метотрексат, циклоспорин, глюкокортикостероиды), показана эффективность адеметионина при ЛПП с холестазом [1, 12, 13].
• Имеются экспериментальные исследования, свидетельствующие об эффективности адеметионина у лабораторных мышей с гепатотоксическим поражением печени в результате введения парацетамола [1, 14].
• У пациентов с опиоидной наркоманией, сопровождающей поражением печени, адеметионин приводит к улучшению функционального состояния печени и микросомального окисления, а также к регрессии клинических проявлений абстиненции [9].
• Рекомендуемая схема перорального приема адеметионина при ЛПП: 800–1600 мг/сут в 2 этапа в течение 4 нед (если используется доза 400 мг в одной таблетке) или 1000–1500 мг/сут перорально в 2 этапа в течение 4 нед (если используется доза 500 мг в одной таблетке). Возможен и более длительный прием препарата [1, 6].
• Пероральный прием адеметионина способствует быстрому улучшению биохимического профиля крови. Например, в двойном слепом плацебо-контролируемом исследовании (220 пациентов с внутрипеченочным холестазом) препарат через 15–30 дней терапии способствовал улучшению на 50% уровня таких показателей, как общий и прямой билирубин, АЛТ, АСТ, ГГТ, ЩФ [1, 15].
5.
• Рекомендуется рассмотреть применение урсодезоксихолевой кислоты (УДХК) при ЛПП, поскольку в ряде клинических исследований показана ее эффективность у этой категории больных: УУР В, УДД 2 [1].
• Имеются сообщения об эффективности УДХК в лечении холестатического и смешанного вариантов ЛПП, развившихся вследствие приема метотрексата, флутамида (антиандрогенного противоопухолевого средства), флувастатина и других препаратов. В рекомендациях EASL приводятся данные об эффективности УДХК в лечении 2/3 случаев холестатических ЛПП [1, 16, 17].
• При цитолитическом синдроме, развившемся на фоне приема статинов, назначение УДХК приводило к нормализации биохимических проб печени и положительной динамике в структуре печени по данным морфологического исследования [1, 18, 19].
• Рекомендуемый режим применения УДХК при ЛПП: 13–15 мг/кг/сут в 2–3 приема; возможен длительный многомесячный прием препарата до разрешения явлений повреждения печени [1, 6].
6.
• Рекомендуется рассмотреть применение эссенциальных фосфолипидов (ЭФЛ) при ЛПП, поскольку в ряде клинических исследований показана их эффективность у этой категории больных: УУР В, УДД 2 [1].
• Использование ЭФЛ при ЛПП противотуберкулезными средствами упоминается в систематическом обзоре Liu Q. et al. [1, 20]. Также ЭФЛ уменьшали активность АЛТ, повышение которой наблюдается после длительной терапии ловастатином [1, 21, 22].
• Статистически значимые положительные изменения при использовании ЭФЛ у пациентов с ЛПП были отмечены только для показателей холестатического, но не гепатоцеллюлярного типа поражения [1, 19].
• Рекомендуемый режим применения ЭФЛ при ЛПП: внутривенное введение от 500 до 1000 мг в течение 7–10 дней с последующим переходом на прием внутрь в дозе 1800 мг/сут, разделенной на три приема. Длительность лечения определяется выраженностью цитолитического синдрома и составляет от 4 до 12 нед. Возможно назначение препарата внутрь c первого дня лечения, если нет возможности парентерального введения [1, 6].
7.
• L-карнитин рекомендовано рассмотреть при ЛПП в силу описанных в исследованиях положительных эффектов этого средства: УУР С, УДД 3 [1].
• Карнитин синтезируется в организме человека в достаточном объеме и присутствует в тканях поперечнополосатых мышц и печени. В исследовании с участием 92 пациентов с тяжелой формой ЛПП, обусловленного вальпроатом, показано, что почти половина больных, получавших L-карнитин, выжили в сравнении с теми, кто получал исключительно поддерживающую интенсивную терапию (их выживаемость составила 10%). Кроме того, было продемонстрировано преимущество парентерального введения L-карнитина перед пероральным в дозе 0,5 г внутривенно или внутримышечно 1 раз/сут в течение 10–14 дней [1, 6].
8.
• Рекомендуется рассмотреть применение препаратов янтарной кислоты при ЛПП, поскольку в ряде клинических исследований показана их эффективность у этой категории больных: УУР В, УДД 2 [1].
• Имеются исследования применения комплексного препарата янтарной кислоты (инозин + меглюмин + метионин + никотинамид + янтарная кислота) при ЛПП на фоне доцетаксела, эрлотиниба, гемцитабина, иматиниба, иринотекана, паклитаксела, сорафениба, топотекана, винорелбина. Согласно клиническим рекомендациям Общества специалистов поддерживающей терапии в онкологии, эти онкологические средства требуют профилактического применения указанного препарата на основе янтарной кислоты [1, 13].
• Режим введения комплексного препарата янтарной кислоты при полихимиотерапии в онкологии: а) для профилактики ЛПП – по 400 мл внутривенно капельно 1 раз/сут не менее 4 инфузий; b) для лечения ЛПП – по 400 мл внутривенно капельно 2 раза/сут не менее 4 дней после каждого курса полихимиотерапии при различных формах онкопроцесса [1, 13].
• Режим введения препаратов янтарной кислоты для лечения и профилактики ЛПП, индуцированных противотуберкулезными препаратами: по 400 мл внутривенно 1 раз/сут в течение 10 дней [1, 6].
9.
• Рекомендуется рассмотреть применение таурина при ЛПП, поскольку в ряде клинических исследований показана его эффективность у этой категории больных: УУР В, УДД 2 [1]. Мембраностабилизирующие, антиоксидантные и гепатопротекторные свойства позволяют рассматривать таурин в качестве средства для профилактики и лечения CYP2E1-ассоциированных повреждений печени, в том числе при передозировке парацетамола [1, 23]. Показано, что в дозе 1000 мг/сут в течение месяца таурин может быть использован для профилактики и лечения ЛПП у пациентов, получающих противотуберкулезную терапию [1, 24]. В ряде исследований продемонстрирована возможность применения таурина в качестве гепатопротектора у пациентов с онихомикозом, получающих терапию противогрибковыми препаратами [1, 25].
• Рекомендуется рассмотреть применение гидролизата плаценты человека при ЛПП, поскольку в ряде клинических исследований показана его эффективность у этой категории больных: УУР В, УДД 2 [1]. Имеются работы по изучению применения гидролизата плаценты при лекарственных гепатитах, развившихся при лечении вирусных гепатитов В и С [26–28]. В парацетамоловой модели острого отравления применение этого препарата приводило к нормализации уровня креатинина, уменьшению жировой инфильтрации печени и повреждения паренхимы, стимуляции регенерации гепатоцитов [29]. Способ применения гидролизата плаценты человека: a) внутримышечно по 2 мл/сут 2–3 раза/сут b) внутривенно капельно после растворения 4 мл препарата в 500 мл 5% раствора декстрозы через локтевую вену в течение 1,5–2 ч, ежедневно, 2–3 нед. [1].
• Применение ацетилцистеина на сегодняшний день одобрено и рекомендовано FDA только для случаев поражения печени парацетамолом: УУР А, УДД 2 [1–3]. При подозрении такой вид ЛПП лечение ацетилцистеином рекомендуется начать как можно раньше: УУР А, УДД 1. Исходя из степени тяжести ЛПП, это лекарственное средство рекомендуется назначать по 50–150 мг/кг/сут в течение как минимум 3 дней [1–3].
• L-орнитина L-аспартат рекомендован при ЛПП в случае печеночной энцефалопатии: УУР В, УДД 2 [1, 30]. Ряд работ продемонстрировал эффективность этого средства при отравлении психотропными средствами (барбитуратами, бензодиазепинами) [1, 21]. Способ применения L-орнитина L-аспартата: а) внутрь после еды по 1 пакетику гранулята, предварительно растворенного в 200 мл жидкости, 2–3 раза/сут; b) внутривенно – обычно по 20 г (4 ампулы). При печеночной энцефалопатии, в зависимости от степени тяжести состояния, до 40 г (8 ампул) в сут. Максимальная скорость инфузии – 5 г/ч [1].
• Глюкокортикостероиды (ГКС) рекомендуются при подозрениях на аутоиммуноподобный фенотип ЛПП: УУР В, УДД 2 [1, 3]. При подозрении на этот фенотип ЛПП дифференцировать его с истинным лекарственно-индуцированным АИГ можно лишь оценкой ответа на терапию ГКС и динамическое наблюдение [11]. При этом аутоиммуноподобное ЛПП после отмены ГКС не рецидивирует в отличие от истинного АИГ. Из ГКС при ЛПП может назначаться преднизолон в дозе 20–40 мг/сут с последующим постепенным снижением дозы после нормализации биохимических показателей в течение 6 мес [1, 6].



