Пандемия, вызванная коронавирусом SARS-CoV-2, характеризуется экспоненциальным ростом заболеваемости с развитием летального исхода в 2,2–3% случаев [1]. Течение вызываемой SARS-CoV-2 COVID-19 инфекции состоит из двух клинических периодов: первый связан с проникновением и репликацией вируса («период вирусной нагрузки»), сопровождается общими симптомами интоксикации и одышкой, второй обусловлен асинхронной активацией иммунологических механизмов и характеризуется усилением одышки, гипоксемии и развитием осложнений (гипервоспалительный ответ) [2]. Выраженность второго клинического периода обуславливает тяжелое течение болезни у 15–25% пациентов, ассоциированное с развитием «цитокинового шторма» [2, 3].
К основным клиническим проявлениям COVID- 19 относятся лихорадка (в 90% случаев), кашель (80%), одышка (30%), общее недомогание (40%), слабость/усталость (40%), боли в мышцах (11%) [4]. Результаты лабораторных исследований инфицированных пациентов включают лимфопению (в 80% случаев), нейтрофилию, повышенный уровень маркеров воспалительного ответа в крови – С-реактивного белка и скорости оседания эритроцитов (СОЭ) [5]. Выраженность лимфопении и нейтрофилии считается связанной с прогнозом заболевания: доля лимфоцитов в крови обратно пропорциональна тяжести и прогнозу, тогда как доля нейтрофилов прямо пропорциональна тяжести и вероятности развития острого респираторного дистресс-синдрома (ОРДС) [6]. Уровень сатурации также напрямую связан с тяжестью и исходом, в связи с чем одной из целей лечения является улучшение динамики нормализации SpO2 [7].
Основу терапии COVID-19 в соответствии с временными клиническими рекомендациями Минздрава России составляют этиотропное, патогенетическое, симптоматическое лечение и оксигенотерапия, а также искусственная вентиляция легких у пациентов с дыхательной недостаточностью [8]. В терапии пациентов в первом клиническом периоде («периоде вирусной нагрузки») целесообразно использовать противовирусные препараты, способные ограничить репликацию вируса [2]. По мере прогрессирования течения COVID-19 и усугубления тяжести состояния большую важность приобретает применение лекарственных средств с противовоспалительным действием [2, 9]. В настоящее время противовоспалительная терапия рекомендуется преимущественно пациентам с тяжелым течением COVID-19 (глюкокортикостероиды, ингибиторы рецепторов интерлейкина-6 и интерлейкина-1β, ингибиторы янус-киназ), в то время как для лечения пациентов с легкой и умеренной степенью тяжести течения COVID- 19 используются парацетамол и нестероидные противовоспалительные препараты (НПВП) [8]. Несмотря на продолжающиеся клинические исследования (КИ) нескольких противовирусных препаратов c этиотропным действием, имеющиеся данные не позволяют сделать однозначный вывод об их эффективности и безопасности в достижении целей лечения COVID-19 [3, 8]. В связи с этим большое внимание научного сообщества уделяется разработке этиотропной терапии, направленной на подавление функциональной активности вируса и воспалительного ответа. Проблема поиска подходов для раннего начала эффективной и безопасной противовоспалительной терапии у пациентов с COVID-19, способной предупредить развитие гипервоспалительного ответа, отягощающего течение заболевания, также остается актуальной [2].
В доклинических и клинических исследованиях показана эффективность имидазолилэтанамида пентандиовой кислоты (Ингавирин®) в отношении вирусов гриппа типа A и В, аденовируса, вируса парагриппа, риновируса, коронавируса, респираторно-синцитиального вируса, метапневмовируса и энтеровирусов [10]. Механизм действия препарата реализуется на уровне инфицированных клеток за счет активации факторов врожденного иммунитета, подавляемых вирусными белками. Ингавирин® повышает экспрессию рецептора интерферона-α первого типа на поверхности эпителиальных и иммунокомпетентных клеток, активирует синтез антивирусного эффекторного белка МхА (раннего фактора противовирусного ответа, ингибирующего внутриклеточный транспорт рибонуклеопротеиновых комплексов вирусов) и фосфорилированной формы протеинкиназы R, подавляющей трансляцию вирусных белков [11]. Помимо противовирусного действия, Ингавирин® оказывает противовоспалительный эффект, обусловленный подавлением продукции фактора некроза опухоли (ФНО-α), интерлейкинов, снижением активности миелопероксидазы, и проявляет регенеративное действие [11, 12]. Сочетание фармакодинамических эффектов позволяет использовать Ингавирин® при острых респираторных инфекциях различной этиологии, отличающихся разнообразием клинических проявлений [10, 12]. Показано, что совместное использование препарата с антибиотиками повышает эффективность терапии на модели бактериального сепсиса, в том числе вызванного пенициллин-резистентными штаммами стафилококка [13]. В КИ отмечена высокая безопасность препарата Ингавирин® у пациентов разного возраста с сопутствующими заболеваниями [10–15].
Наличие доказанного противовирусного и противовоспалительного эффектов Ингавирина® позволили предположить возможность его использования в лечении пациентов с COVID-19 для замедления репликации вируса и предупреждения развития гипервоспалительного ответа. Целью настоящей наблюдательной программы (НП) была оценка эффективности и безопасности включения препарата Ингавирин® в схему стандартной рекомендованной терапии пациентов с COVID-19 в реальной клинической практике.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования
Проспективное неинтервенционное исследование было одобрено этическим комитетом (№ ИНГ-06-06-2020 от 17.11.2020) и проведено в соответствии с рекомендациями Надлежащей клинической практики, Хельсинской декларацией и положениями, касающимися неинтервенционных исследований, изложенных в Решении Евразийской экономической комиссии от 03.11.2016 № 87 «Об утверждении Правил надлежащей клинической практики фармаконадзора Евразийского экономического союза» в период с 21.01.2021 по 04.03.2021 в ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России.
Участники исследования
В НП включали пациентов стационара обоего пола в возрасте 18–75 лет с лабораторно подтвержденным диагнозом COVID-19 (положительный результат определения SARS-CoV-2 методом полимеразной цепной реакции, <14 дней до госпитализации) среднетяжелого течения (t ≥38,0 °C; частота дыхательных движений >22/мин; SpO2 <95%), сопровождающимся характерными двусторонними изменениями в легких по данным компьютерной томографии (КТ) с необходимостью проведения кислородотерапии (категория 4, шкала ВОЗ). Длительность заболевания с момента появления хотя бы одного симптома (повышение температуры, сухой кашель или кашель с небольшим количеством мокроты, одышка, миалгия, утомляемость, ощущение заложенности в грудной клетке, снижение обоняния и/или вкуса) до приема первой дозы препарата исследования составляла ≤7 сут, период от момента госпитализации до приема первой дозы – ≤48 ч.
В исследование не включались пациенты с непереносимостью компонентов назначаемых препаратов, беременностью, тяжелыми хроническими соматическими и психическими заболеваниями, нейтропенией (<0,5×109 клеток/л), тромбоцитопенией (<50 000 клеток/мм3), пятикратным (и более) увеличением активности аланинаминотрансферазы и аспартатаминотрансферазы, ожидаемым летальным исходом или ожидаемой выпиской в течение 48 ч после начала терапии. Применение любых противовирусных и/или иммуномодулирующих препаратов после манифестации COVID- 19, за исключением указанных в рекомендациях Минздрава России (версия 10), а также вакцин против вирусных инфекций в течение 90 дней до момента начала терапии также являлось критерием невключения.
Оцениваемые параметры и исследуемая терапия
До включения в исследование всем пациентам было назначено лечение COVID-19 – Ингавирин® в капсулах 90 мг и/или рекомендованная Минздравом России стандартная терапия (СТ) этого заболевания. Ингавирин® назначался в соответствии с инструкцией по медицинскому применению: по 2 капсулы (180 мг) препарата в первые 3 дня и по 1 капсуле (90 мг) в последующие 4 дня внутрь 1 раз/сут независимо от приема пищи.
После подписания информированного согласия на участие в НП были сформированы две когорты пациентов: когорта 1 принимала Ингавирин® в дополнение к СТ COVID-19, когорта 2 – только СТ.
Формальный расчет объема выборки не проводился. Для решения исследовательских задач в данной НП предполагалось включение 40 пациентов в каждую когорту.
Оценка состояния пациента выполнялась исходно (день -1/1 исследования), ежедневно в период лечения (2–7 дни), на 8, а также на 14±1 и 21±1 дни исследования очно или с помощью телефонного опроса, если пациент был выписан из стационара. Определялись выраженность симптомов COVID- 19, жизненно важные показатели (артериальное давление, частота сердечных сокращений, частота дыхательных движений, SpO2, t °C), состояние пациента по шкалам дневного и ночного кашля, ВОЗ, NEWS, необходимости перевода в отделение реанимации и интенсивной терапии (ОРИТ), проведения различных методов вентиляции легких или экстракорпоральной мембранной оксигенации (ЭКМО). При необходимости проводилась оценка лабораторно-инструментальных показателей (ПЦР-тест SARS-CoV-2, общий и биохимический анализ крови, общий анализ мочи, электрокардиография, КТ, оценка газообмена).
Критерии эффективности и безопасности
Основным критерием эффективности терапии служила оценка времени до развития клинического улучшения, определяемого по снижению температуры тела (t ≤37,5 °C без приема нестероидных противовоспалительных препаратов и/или парацетамола), частоты дыхательных движений (≤22 мин без кислородотерапии) и увеличению сатурации (SpO2 ≥95% без кислородотерапии). Дополнительно анализировались статус и состояние пациента по шкалам ВОЗ (шкала тяжести состояния), NEWS (протокол оценки тяжести и необходимости в проведении интенсивной терапии), шкале дневного и ночного кашля (шкала оценки частоты кашля и его влияния на дневную активность и ночной сон), необходимость в респираторной поддержке, результаты лабораторно-инструментальных исследований (табл.). Критериями безопасности терапии являлись количество, частота нежелательных явлений (НЯ) и их связь с терапией.

Статистический анализ
Статистический анализ проводился с помощью программы IBM SPSS Statistics v27, Julia 1.6.0+. Уровень значимости был выбран равным 5% (пороговое значение p <0,05). Для всех изучаемых параметров использовались двусторонние статистические критерии. Для оценки нормальности распределения количественных показателей применялся критерий Шапиро–Уилка.
Качественные показатели представлены в виде абсолютных частот, относительных частот и 95% доверительного интервала (ДИ). С целью расчета 95% ДИ для долей использовался биномиальный метод Клоппера–Пирсона, расчета 95% ДИ для разницы долей – метод Ньюкомба–Вилсона. Расчет 95% ДИ для показателей с более чем двумя категориями ответа проводился по методу Гудмана.
Для сравнения качественных показателей применялся точный критерий Фишера, количественных показателей – t-критерий, либо критерий Манна–Уитни (в зависимости от характера распределения значений количественных показателей). Для оценки времени до наступления события использовался множительный метод Каплана–Мейера, сравнение групп по времени до наступления события выполнялось при помощи логрангового критерия, либо критерия Вилкоксона–Гехана.
РЕЗУЛЬТАТЫ
Исходные демографические и клинические данные пациентов
В НП приняли участие 80 пациентов (по 40 человек в каждой из двух когорт). Средний возраст участников исследования составил 58,15±10,5 лет (56,73±10,19 в когорте Ингавирин® + CТ, 59,58±10,75 – в когорте СТ). Для всех пациентов была характерна избыточная масса тела – среднее значение индекса массы тела (ИМТ) было равным 30,24±6,64 кг/м2 (29,68±7,71 кг/м2 в когорте Ингавирин® + CТ; 30,79±5,41 кг/м2 – в когорте СТ).
Наиболее распространенными сопутствующими заболеваниями были гипертоническая болезнь (у 50% пациентов каждой из когорт), ожирение (22,5% в когорте Ингавирин® + CТ, 20% в когорте СТ), сахарный диабет 2-го типа (15% в когорте Ингавирин® + CТ; 25% в когорте СТ). Вся сопутствующая терапия, применяемая в НП, не противоречила требованиям протокола и соответствовала рутинной практике. Значимых различий в исходных демографических и клинических данных между когортами выявлено не было (ANOVA, p <0,05).
Основной критерий эффективности
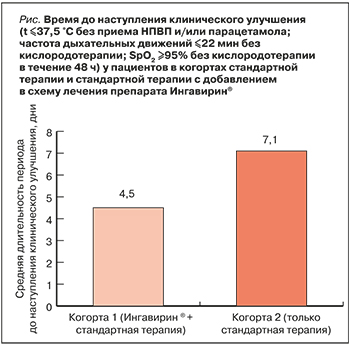 Время до наступления клинического улучшения, оцениваемое по стабильной в течение 48 ч нормализации температуры тела, частоты дыхательных движений и SpO2, значимо сокращалось при добавлении Ингавирина® к СТ (логранговый критерий Мантеля–Кокса: р=0,015; тест Бреслоу: р=0,007; тест Тарона–Уэра: р=0,007). В когорте Ингавирин® + CТ средняя длительность периода до наступления клинического улучшения составила 4,5±0,925 дня; в когорте СТ значение аналогичного показателя оказалось в 1,6 раз больше – 7,1±1,037 дня (рис.).
Время до наступления клинического улучшения, оцениваемое по стабильной в течение 48 ч нормализации температуры тела, частоты дыхательных движений и SpO2, значимо сокращалось при добавлении Ингавирина® к СТ (логранговый критерий Мантеля–Кокса: р=0,015; тест Бреслоу: р=0,007; тест Тарона–Уэра: р=0,007). В когорте Ингавирин® + CТ средняя длительность периода до наступления клинического улучшения составила 4,5±0,925 дня; в когорте СТ значение аналогичного показателя оказалось в 1,6 раз больше – 7,1±1,037 дня (рис.).
Дополнительные критерии эффективности
Доля пациентов с клиническим улучшением в когорте Ингавирин® + СТ была значимо выше, чем в когорте СТ, к 5-му дню терапии: 89,2 против 64,1% соответственно (точный критерий Фишера, р=0,015).
Среднее изменение (динамика) категории тяжести состояния по шкале ВОЗ утром и вечером в когорте Ингавирин® + СТ было значимо более выраженным, чем в когорте СТ (утром р=0,017; вечером р <0,001).
Среднее время до достижения 3 категории и ниже по шкале ВОЗ (госпитальные пациенты без необходимости в оксигенотерапии или амбулаторные пациенты с/без ограничения повседневной активности) составило 10,34±1,025 дня в когорте Ингавирин® + СТ и 14,96±0,974 дней в группе СТ (логранговый тест: р=0,007; тест Бреслоу: р=0,002; тест Тарона–Уэра: р=0,003).
Снижение тяжести состояния по шкале ВОЗ до 3 категории (госпитальные пациенты, не нуждающийся в оксигенотерапии) отмечалось у 44,4% пациентов когорты Ингавирин® + СТ и 10,5% – когорты СТ на 6-й день терапии (точный критерий Фишера, р=0,001). К 7-му дню лечения улучшение статуса пациента по шкале ВОЗ наблюдалось в 50% случаев в когорте Ингавирин® + СТ и в 18,4% – в когорте СТ (точный критерий Фишера, р=0,006).
Среднее время до достижения ≤2 баллов (пациент не требует консультации врача интенсивной терапии и маршрутизации в ОРИТ) по шкале оценки тяжести состояния NEWS в когорте Ингавирин® + СТ составило 5,233±0,847 дней, в когорте СТ – 7,797±1,080 дней (логранговый критерий Мантеля–Кокса: р=0,037; тест Тарона–Уэра: р=0,044).
Доля пациентов с необходимостью кислородной поддержки к 6-му и 7-му дням терапии в когорте Ингавирин® + СТ составила 52,8 и 41,7% соответственно. В когорте СТ аналогичные показатели были значимо выше – 89,5 и 84,2% соответственно (точный критерий Фишера, р=0,001 (6-й день), р <0,001 (7-й день)).
Среднее время до достижения SpO2 ≥95% равнялось 6,401±1,096 дней в группе СТ и 3,625±0,823 в когорте Ингавирин® + СТ. Когорты продемонстрировали значимое статистическое различие (логранговый критерий: p=0,020; тест Бреслоу: р=0,022; тест Тарона–Уэра: р=0,012).
Наибольшая доля пациентов с баллом по шкале дневного и ночного кашля ≤2 (кашель редкий в течение дня и/или приводящий к прерыванию сна не более чем 2 раза за ночь) к 3-му дню лечения была выявлена в когорте Ингавирин® + СТ – 97,5%; в когорте СТ величина данного параметра составила 80,5% (точный критерий Фишера, р=0,029).
Анализ по таким дополнительным критериям эффективности, как «доля пациентов с отрицательным результатом анализа на SARS-CoV-2», «длительность госпитализации», «продолжительность пребывания в ОРИТ», «доля пациентов, нуждающихся в инвазивной вентиляции легких», «доля пациентов, нуждающихся в ЭКМО», «суммарная продолжительность высокопоточной оксигенотерапии к последнему дню госпитализации», «суммарная продолжительность оксигенотерапии к последнему дню госпитализации», «суммарная продолжительность инвазивной вентиляции легких к последнему дню госпитализации», «суммарная продолжительность неинвазивной вентиляции легких к последнему дню госпитализации», «суммарная продолжительность ЭКМО к последнему дню госпитализации», «среднее время до достижения ЧДД ≤22/мин», «среднее время до достижения пациентом температуры ≤37,5 °С», «доля пациентов с КТ-1 по данным КТ», «среднее изменение КТ картины на один пункт по показателю тяжести», «среднее время до достижения КТ-1», «среднее время до достижения ≤2 балла при оценке по шкале дневного и ночного кашля», «доля пациентов с баллом ≤1 по каждому симптому по 4-балльной шкале», «среднее изменение балла по каждому симптому по 4-балльной шкале», «среднее время достижения балла ≤1 по каждому симптому по 4-балльной шкале», не проводился в связи с разреженным характером зарегистрированных данных, малым количеством наблюдений или значительным числом положительных исходов при исходной оценке.
По критериям «доля пациентов, переведенных в ОРИТ за время госпитализации», «доля пациентов с развитием ОРДС за время госпитализации», «доля пациентов, нуждающихся в высокопоточной оксигенотерапии», «доля пациентов, нуждающихся в неинвазивной вентиляции легких», «доля пациентов с SpO2 ≥95%», «среднее изменение SpO2 по сравнению с исходным значением», «доля пациентов с частотой дыхательных движений ≤22/ мин», «среднее изменение частоты дыхательных движений по сравнению с исходным значением», «доля пациентов с температурой ≤37,5 °С», «среднее изменение температуры по сравнению с исходным значением», «среднее изменение балла при оценке по шкале дневного и ночного кашля по сравнению с исходным значением», «доля пациентов с оценкой по шкале NEWS ≤2 баллов», «среднее изменение балла по шкале NEWS по сравнению с исходным значением» различий между группами в статистическом анализе обнаружено не было.
Безопасность
В ходе программы было зарегистрировано 7 НЯ у 7 пациентов: n=4 (8%) – в когорте СТ (десатурация, гипоксия, дыхательная недостаточность); n=3 (6%) – в когорте Ингавирин® + СТ (дыхательная недостаточность, стенокардия, гипоксия). Выявленные НЯ характеризовались средней (n=6) и тяжелой (n=1, дыхательная недостаточность в когорте СТ) степенью тяжести. Зарегистрирован один смертельный исход вследствие дыхательной недостаточности в когорте СТ. Связь с приемом препарата была определена как неклассифицируемая (n=5, из них 4 в когорте СТ и 1 в когорте Ингавирин® + СТ) и сомнительная (n=2 в когорте Ингавирин®+ СТ). При сравнительном анализе частоты НЯ не выявлены статистически значимые различия между когортами пациентов (точный критерий Фишера, р=1,0).
ОБСУЖДЕНИЕ
В НП показано значимое сокращение периода достижения клинического улучшения у пациентов с верифицированным COVID-19 среднетяжелого течения при добавлении препарата Ингавирин® к СТ в реальной клинической практике. Стабильная в течение 48 ч нормализация температуры, частота дыхательных движений и SpО2 у пациентов, принимавших Ингавирин® дополнительно к СТ, наступала в среднем на 2,6 дня (62 ч) быстрее, чем у пациентов, получавших СТ. Статистически и клинически значимый эффект добавления препарата Ингавирин® в схему терапии проявлялся к началу 5-го дня и подтверждался при оценке доли пациентов с клиническим улучшением: нормализация температуры, снижение одышки и повышение сатурации к 5-му дню наблюдались у 89% пациентов.
К концу первой недели терапии с использованием препарата Ингавирин® снижение тяжести состояния до 3 категории по шкале ВОЗ, позволяющей оценить тяжесть пациента с учетом степени ограничения активности и необходимости в оксигенотерапии/вентиляции легких [16], отмечалось у половины участников когорты Ингавирин® + СТ. При этом в когорте Ингавирин® + СТ доля пациентов с адекватной сатурацией, не нуждающихся в кислородной поддержке, была в 2 раза больше по сравнению с группой СТ. Результаты положительной интегральной клинической динамики пациента по шкале ВОЗ полностью согласуются с данными показателя сатурации при изолированной оценке: достижение уровня SpO2 ≥95% в когорте Ингавирин® + СТ происходило к 4-му дню лечения, что было более чем в 1,5 раза быстрее, чем в когорте сравнения. Важно также отметить, что через 3 дня терапии препаратом Ингавирин® частота приступов дневного и ночного кашля снизилась почти у 98% пациентов.
В НП подтверждена высокая безопасность применения Ингавирина® в составе схем терапии пациентов с COVID-19: включение этого препарата в схему лечения не сопровождалось повышением частоты возникновения НЯ. Таким образом, эффективность и безопасность препарата Ингавирин® в отношении COVID-19 в составе комплексной терапии, наблюдаемая в проведенной программе, согласуется с результатами проведенных ранее КИ, в которых участвовали пациенты с другими острыми вирусными инфекциями [10, 14, 17, 18].
Полученные результаты НП позволяют сделать заключение о перспективности применения противовирусного препарата Ингавирин® у пациентов в ранний период COVID-19 («период вирусной нагрузки»), развивающийся в течение первых 7–10 сут заболевания [2]. Назначение Ингавирина® в большинстве наблюдаемых случаев способствовало ускорению достижения адекватного уровня сатурации, снижению необходимости в оксигенотерапии, положительной клинической динамике по общепринятым интегральным шкалам оценки состояния пациента с COVID-19 [16, 19], ускорению регресса респираторных симптомов и интоксикационного синдрома. Результаты мировой практики изучения течения COVID-19 свидетельствуют о наличии связи между выраженностью воспалительного ответа и тяжестью гипоксии [7, 20]. Можно ожидать, что наличие дополнительных противовоспалительных свойств у противовирусного препарата Ингавирин® позволяет ограничить развитие и/или снизить последствия второго клинического периода COVID-19, сопровождающегося гипервоспалительным ответом: это подтверждается улучшением сроков выздоровления пациентов, установленным в проведенной НП. Возможность упреждающего противовоспалительного действия препарата, а также продемонстрированная в реальной клинической практике положительная динамика интегральных показателей улучшения на фоне приема Ингавирина® в сочетании с прогрессивным снижением необходимости пациентов в кислородной поддержке соответствуют основным целям терапии инфекции, вызванной SARS-CoV-2 [8]. Наблюдаемое при использовании препарата Ингавирин® в комплексе с СТ повышение эффективности терапии позволяет рекомендовать его применение в лечении COVID-19.
ЗАКЛЮЧЕНИЕ
Включение препарата Ингавирин® в схему рекомендованной стандартной терапии COVID-19 приводит к более быстрому достижению клинического улучшения, адекватного уровня сатурации и положительной интегральной клинической динамике.



