Диагностика
1
• Факторы риска развития и прогрессирования атеросклероза, при наличии которых показан скрининг на дислипидемию, представлены в таблице 1. Следует обращать особое внимание на наличие сухожильных и кожных ксантом, ксантелазм век или липоидной дуги роговицы у лиц моложе 45 лет. Эти проявления свидетельствуют о выраженном нарушении липидного обмена и вероятной семейной гиперхолестеринемии (СГХС). Детальное обследование для выявления дислипидемии также показано пациентам с заболеваниями периферических артерий [1].
• Выявление факторов риска атеросклероза, включая дислипидемию, нужно проводить у мужчин, достигших 40 лет, и женщин, достигших 50 лет или после наступления менопаузы. Однако при сахарном диабете (СД), отягощенной наследственности скрининг следует проводить у мужчин и женщин с 20 лет [1].

2
• Образцы крови для анализа липидов обычно берутся натощак, однако последние исследования говорят о том, что колебания концентрации липидов плазмы крови, за исключением триглицеридов (ТГ), существенно не зависят от приема пищи. В связи с этим для скрининга забор крови можно проводить не натощак [1].
• Натощак анализ крови нужно брать у лиц с концентрацией ТГ >4,5 ммоль/л, III типом гиперлипидемии (дисбеталипопротеидемией) и СД 2 типа [1].
• Показатели липидного профиля, которые требуется определить для оценки сердечно-сосудистого риска, приведены в таблице 2.
3
• Формула Фридвальда для оценки холестерина липопротеидов низкой плотности (ХС ЛНП) не применяется при значениях ТГ >4,5 ммоль/л (>400 мг/дл). В этом случае используются прямые методы определения ЛНП [1].
4
• Лица с документированным сердечно-сосудистым заболеванием (ССЗ), СД 1 или 2 типа, большим количеством факторов риска (см. табл. 1) или хронической болезнью почек (ХБП), как правило, имеют очень высокий или высокий риск ССЗ. Для них оценка риска по шкале SCORE не требуется [1].
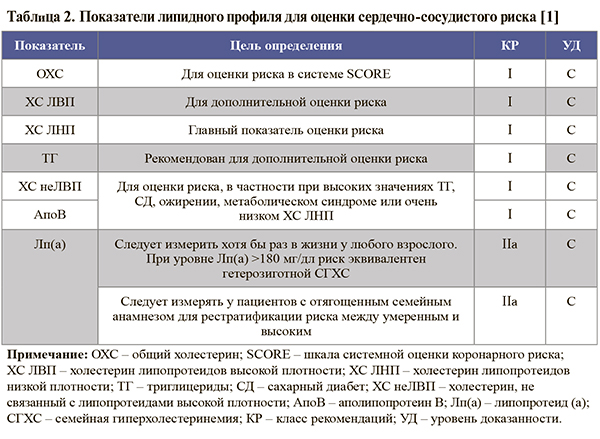
• Шкала SCORE, предназначенная для расчета абсолютного риска смерти от ССЗ (в процентах) в течение ближайших 10 лет, приведена на рисунке. При ее использовании следует выбрать квадрат в зависимости от пола, возраста и статуса курения пациента. В найденном квадрате следует отыскать ячейку, наиболее соответствующую уровню систолического артериального давления (АД) и общего холестерина (ОХС) конкретного пациента [1].
• Чтобы получить значение риска развития ишемической болезни сердца (ИБС) в процентах по шкале SCORE, нужно полученный показатель фатального исхода умножить на 3 у мужчин и на 4 у женщин [1].
5
• Визуализация коронарных артерий с помощью компьютерной томографии (КТ) и сонных артерий методом дуплексного сканирования информативны в плане выявления атеросклеротического поражения артерий [1].
• Обнаружение кальцификации коронарной артерии с помощью неконтрастной КТ дает хорошую оценку атеросклеротической нагрузки и тесно связано с сердечно-сосудистыми осложнениями. КТ-ангиография коронарных артерий имеет чувствительность 95–99% и специфичность 64–83% для диагностики ишемической болезни сердца [1]. Для скрининга атеросклероза коронарных артерий может использоваться кальциевый индекс (КИ) по Agatston, что позволяет обеспечить дополнительную стратификацию риска, имеет меньшую стоимость, не требует внутривенного введения контрастных веществ (табл. 3).
• Использование КИ позволяет в сомнительных случаях провести реклассификацию категории сердечно-сосудистого риска [1]. Выявление атеросклеротической бляшки в сонной или бедренной артерии с помощью ультразвука служит прогностическим фактором сердечно-сосудистых осложнений, сравнимым с КИ [1].
• Измерение толщины комплекса интима-медиа сонной артерии не рекомендуется использовать в качестве маркера сердечно-сосудистого риска [1].

• Дуплексное сканирование сонных артерий позволяет обнаружить локализацию поражения и количественно определить его степень и тяжесть по критериям скорости потока [1].
• У бессимптомных лиц с низким или умеренным риском выявление субклинического атеросклероза может быть основанием для назначения гиполипидемической терапии [1]. У бессимптомных лиц с умеренным риском наличие кальциевого индекса (КИ) >100 по Agatston и наличие атеросклеротической бляшки в сонной или бедренной артерии по данным дуплексного сканирования дает основание перевести их в категорию более высокого риска (см. табл. 4).
• КИ обычно невысок и имеет низкую специфичность у пациентов моложе 45 лет с семейной гиперхолестеринемии [1].

6
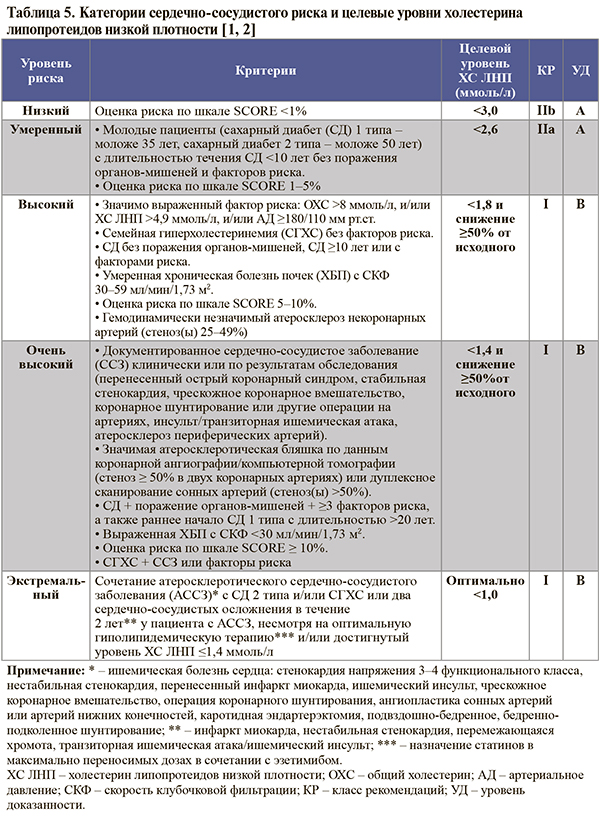
Категории сердечно-сосудистого риска, их критерии (включая риск по шкале SCORE) и соответствующие целевые уровни ХС ЛНП представлены в таблице 5.
• Поскольку прямое измерение ХС ЛНП имеет ограничения, особенно при метаболическом синдроме, СД, гипертриглицеридемии, в этих случаях целесообразно ориентироваться на показатели холестерина, не связанного с липопротеидами высокой плотности (ХС неЛВП), который рассчитывается по формуле: ОХС – холестерин липопротеидов высокой плотности (ХС ЛВП). Желательные целевые уровни этого лабораторного маркера [1, 2]:
- при очень высоком сердечно-сосудистом риске – <2,2 ммоль/л (<85 мг/дл);
- при высоком риске – <2,6 ммоль/л (<100 мг/дл);
- при высоком риске и рецидивирующих ССЗ – <1,8 ммоль/л (<70 мг/дл). Отметим, что у пациентов с метаболическим синдромом, СД, ожирением показатель ХС неЛВП имеет более высокий уровень прогностической значимости по сравнению с ХС ЛНП [1, 3].
• Как альтернативу концентрациям ХС ЛНП для оценки риска ССЗ, особенно у лиц с гипертриглицеридемией, СД, ожирением, также можно использовать (в случае доступности измерения) уровни аполипопротеина В. Целевые значения этого показателя [1, 2]:
- при очень высоком сердечно-сосудистом риске – <65 мг/дл;
- при высоком риске – <80 мг/дл;
- при высоком риске и рецидивирующих ССЗ – <55 мг/дл.
• По данным исследования NCEP-ATP III, нормальный уровень ТГ составляет <1,7 ммоль/л, промежуточно-высокий – 1,7–2,3 ммоль/л. Гипертриглицеридемии соответствуют концентрации ТГ 2,3–5,6 ммоль/л, выраженной гипертриглицеридемии – более 5,6 ммоль/л [1, 4].
Лечение
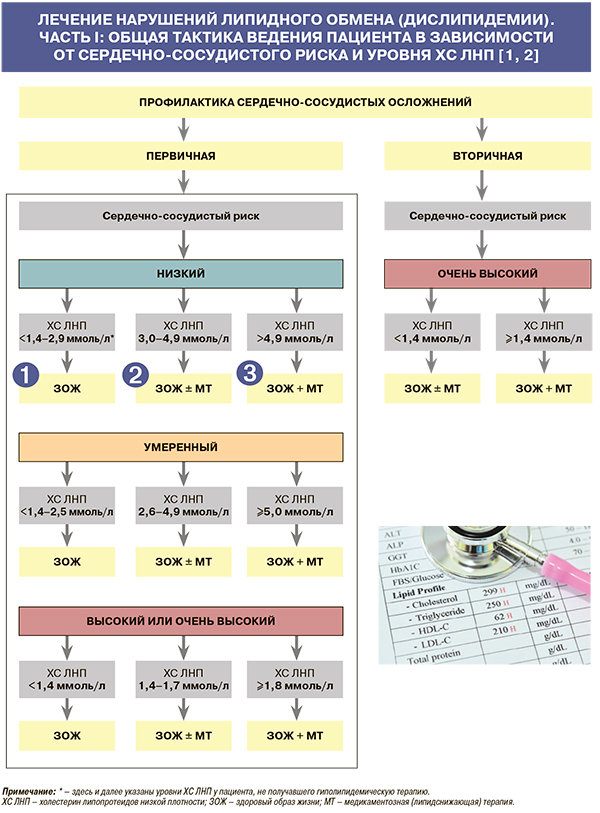
1
• Здоровый образ жизни (ЗОЖ) подразумевает модификацию образа жизни (диета, физическая активность и др.) и контроль факторов риска (нормализация и поддержание артериального давления, коррекция сопутствующих заболеваний и др.) [1, 2]. Влияние различных мер по изменению образа жизни на уровень липидов отражено в таблице 6.

• Классы рекомендаций/уровни доказанности только ЗОЖ при первичной профилактике ССЗ [1, 2]:
- I/C – для пациентов низкого сердечно-сосудистого риска с ХС ЛНП <1,4–2,9 ммоль/л, а также для пациентов умеренного риска с ХС ЛНП <1,4 ммоль/л;
- IIa/A – для пациентов умеренного риска с ХС ЛНП 1,4–2,5 ммоль/л, пациентов высокого риска с ХС ЛНП <1,4 ммоль/л;
- IIa/B – для пациентов очень высокого риска с ХС ЛНП <1,4 ммоль/л.
2
• Формула «ЗОЖ ± медикаментозная терапия (МТ)» означает следующее: рекомендуется поддержание ЗОЖ, также по решению врача возможно назначение липидснижающей МТ, если целевой уровень ХС ЛНП не достигнут [1, 2].
• Классы рекомендаций /уровни доказанности ЗОЖ ± МТ при первичной профилактике ССЗ [1, 2]:
- I/A – для пациентов очень высокого риска с ХС ЛНП 1,4–1,7 ммоль/л;
- IIa/A – для пациентов низкого риска с ХС ЛНП 3,0–4,9 ммоль/л, умеренного риска с ХС ЛНП 2,6–4,9 ммоль/л, высокого риска с ХС ЛНП 1,4–1,7 ммоль/л.
• Классы рекомендаций /уровни доказанности ЗОЖ ± МТ при вторичной профилактике ССЗ: IIa/A для пациентов очень высокого риска с ХС ЛНП <1,4 ммоль/л [1, 2].
3
• Формула «ЗОЖ + МТ» означает следующее: рекомендуется поддержание здорового образа жизни и одновременно рекомендуется назначение липидснижающей МТ [1, 2].
• Классы рекомендаций /уровни доказанности ЗОЖ + МТ при первичной профилактике ССЗ [1, 2]:
- I/A – для пациентов высокого риска с ХС ЛНП ≥2,6 ммоль/л и очень высокого риска с ХС ЛНП ≥1,4 ммоль/л;
- IIa/A – для пациентов низкого и умеренного риска с ХС ЛНП >4,9 ммоль/л.
• Классы рекомендаций /уровни доказанности ЗОЖ + МТ при вторичной профилактике ССЗ: I/A для пациентов очень высокого риска с ХС ЛНП >1,4 ммоль/л [1, 2].
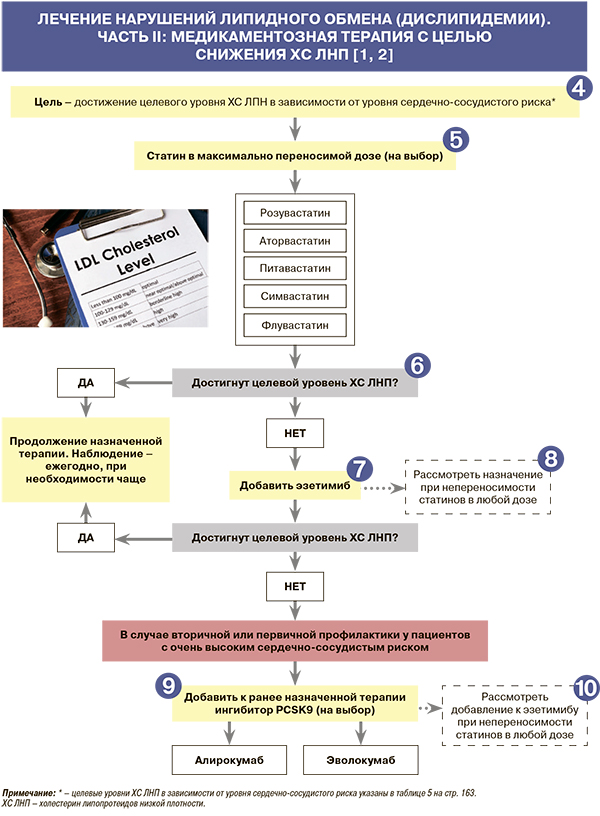
4
• Перед началом гиполипидемической терапии следует провести как минимум два измерения уровня липидов с интервалом в 1–12 нед, за исключением случаев, когда рекомендуется немедленная лекарственная терапия (острый коронарный синдром и пациенты с очень высоким риском). Объем исследований включает определение общего холестерина ОХС, холестерина липопротеидов высокой плотности (ХС ЛВП), ТГ, расчет ХС ЛНП и желательно липопротеида (а) [1].
• После начала лечения уровни липидов следует контролировать каждые 8 (±4) нед, после коррекции терапии – каждые 8 (± 4) нед до достижения целевого уровня [1].
• Наряду с этим перед началом гиполипидемической фармакотерапии рекомендовано измерение уровней аланинаминотрансферазы (АЛТ; мониторинг состояния печени) и креатинфосфокиназы (КФК; мониторинг состояния мышечной ткани). Если исходный уровень КФК >4 верхних границ нормы (ВГН), назначать лекарственную терапию не следует. В этом случае необходимо повторить исследование [1].
• Определение АЛТ также следует выполнять через 8–12 нед после начала МТ или после увеличения дозы препарата. При этом рутинный контроль AЛT вовремя лечения статинами не рекомендуется, за исключением ситуаций, свидетельствующих о патологии печени, а также при лечении фибратами [1].
• Рутинный мониторинг КФК в процессе МТ тоже не требуется; исключение – пациенты с развившейся миалгией (факторы риска – пожилой возраст, полипрагмазия, заболевания печени или почек, профессиональные занятия спортом) [1].
5
• Результаты многочисленных клинических исследований свидетельствуют, что ингибиторы статины (ингибиторы ГМГ-КоА-редуктазы) значительно снижают заболеваемость и смертность от ССЗ при применении с целью первичной и вторичной профилактики во всех возрастных группах, как у мужчин, так и у женщин. В клинических исследованиях статины замедляли прогрессирование и даже вызывали регрессию атеросклеротических бляшек. Крупнейший метаанализ 26 исследований с участием 170 000 пациентов показал снижение случаев инфаркта миокарда, смерти от ИБС, инсульта на 22% при снижении уровня ХС ЛНП на каждый 1,0 ммоль/л [1, 5]. Класс рекомендаций/уровень доказанности терапии статинами в максимально переносимых дозах для пациентов с дислипидемией максимально высокий – I/A [1].
• Имеющиеся данные позволяют предположить, что клинический эффект в значительной степени зависит не от типа статина, а от степени снижения ХС ЛНП [1].
• В порядке убывания величины гиполипидемического эффекта зарегистрированные в России статины [6] располагаются следующим образом: розувастатин, аторвастатин, питавастатин, симвастатин, флувастатин [1].
• Перед назначением статина, помимо определения целевого уровня ХС ЛНП в соответствии с категорией риска, следует подсчитать в процентах степень снижения ХС ЛНП, необходимого для достижения этого уровня, и выбрать препарат, который может обеспечить искомую цель. Процент достигаемого снижения ХС ЛНП при приеме различных статинов в различных суточных дозах отражен в таблице 7. Максимальное снижение ХС ЛНП (на 50–55%) возможно при использовании высоких доз розувастатина и аторвастатина [1].

6
• Ответ пациента на терапию (степень эффективности, переносимость) рекомендуется оценивать через 6–8 нед после начала приема статинов или при изменении дозы препарата. Стандартная практика последующего мониторинга предполагает проведение повторного анализа через 6–12 мес. Целесообразно, наряду с определением липидного профиля, оценивать приверженность пациентов к соблюдению рекомендаций по изменению образа жизни и приему назначенных препаратов [1].
• При лечении статинами в высоких дозах следует регулярно оценивать уровень гликозилированного гемоглобина (HbA1c) глюкозы у пациентов с высоким риском развития СД (пожилые больные, пациенты с метаболическим синдромом, ожирением и др.) [1]. Рекомендации по коррекции терапии статинами при повышении уровней АСТ и КФК представлены в таблице 8.

7
• В клинических исследованиях комбинация ингибитора всасывания холестерина в кишечнике эзетимиба со статинами обеспечивала дополнительное снижение уровня ХС ЛНП на 15–20%. В исследовании SHARP изучалась эффективность эзетимиба в сочетании с симвастатином для лечения пациентов с ХБП. Частота ССЗ снижалась на 17% в основной группе по сравнению с группой, получавшей плацебо [1, 7].
• Наряду с монопрепаратами эзетимиба, в России зарегистрированы его фиксированные комбинации с симвастатином и розувастатином [6].
• Класс рекомендаций/уровень доказанности комбинированной терапии максимальных доз статинов и эзетимиба (при недостижении целевого уровня ХС ЛНП монотерапией статинами) – I/B.
8
Эзетимиб может назначаться как в комбинации со статинами, когда монотерапия статинами не позволяет достичь целевого уровня ХС ЛНП, так и при непереносимости статинов или противопоказаниях к их применению (класс рекомендаций/уровень доказанности IIа/С). Монотерапия эзетимибом в клинических исследованиях сопровождалась снижением уровня ХС ЛНП на 15–22% [1, 8].
9
• Ингибиторы пропротеин-конвертаза субтилизин/кексин типа 9 (PCSK9) в клинических исследованиях существенно снижали уровень ХС ЛНП и соответственно число сердечно-сосудистых осложнений у больных с атеросклеротическими ССЗ. В России из препаратов этой группы одобрены к применению эволокумаб в дозировке 140 мг и алирокумаб в дозировках 75 и 150 мг в одном шприце-ручке. Оба препарата вводят подкожно 2 раза в месяц [1].
• В исследовании FOURIER среди пациентов с очень высоким сердечно-сосудистым риском (n=27 564), получавших адекватную гиполипидемическую терапию (статины в режиме высокой или умеренной интенсивности ± эзетимиб) при медиане длительности наблюдения 2,2 года, применение эволокумаба сопровождалось снижением риска развития первичной конечной точки (сочетание смерти от ССЗ, инфаркта миокарда, инсульта, госпитализации по поводу нестабильной стенокардии или коронарной реваскуляризации) на 15% [9, 10]. В свою очередь, в исследовании ODYSSEY Outcomes через 2,8 года применения алирокумаба у больных той же категории риска (n=18 924) было отмечено снижение относительного риска первичного конечной точки на 15% (сочетание смерти от ИБС, нефатального инфаркта миокарда, ишемического инсульта или нестабильной стенокардии, требующей госпитализации) [11].
• Классы рекомендаций/уровни доказанности добавления ингибиторов PCSK9 к терапии максимальными дозами статинов и эзетимибом при недостижении целевых уровней ХС ЛНП [1]:
- I/A – при вторичной профилактике ССЗ у пациентов очень высокого сердечно-сосудистого риска;
- I/C – при первичной профилактике ССЗ у пациентов очень высокого сердечно-сосудистого риска.
• Хотя ингибиторы PCSK9 являются очень эффективными препаратами, способными дополнительно снизить уровни ХС ЛНП и сердечно-сосудистый риск на фоне лечения статинами и/или эзетимибом, из-за высокой стоимости лечения и ограниченных данных о долгосрочной безопасности они, скорее всего, будут считаться экономически эффективными только у пациентов с очень высоким риском ССЗ [2].
10
• Класс рекомендаций/уровень доказанности добавления ингибиторов PCSK9 к эзетимибу у пациентов с непереносимостью статинов – IIb/С [1].
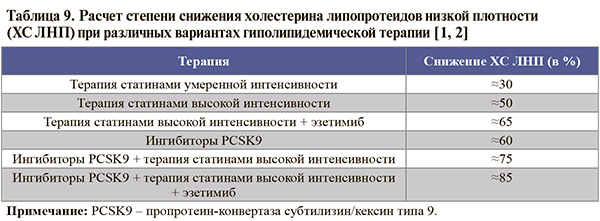
• Степень снижения ХС ЛНП при различных вариантах гиполипидемической терапии суммирована в таблице 9.
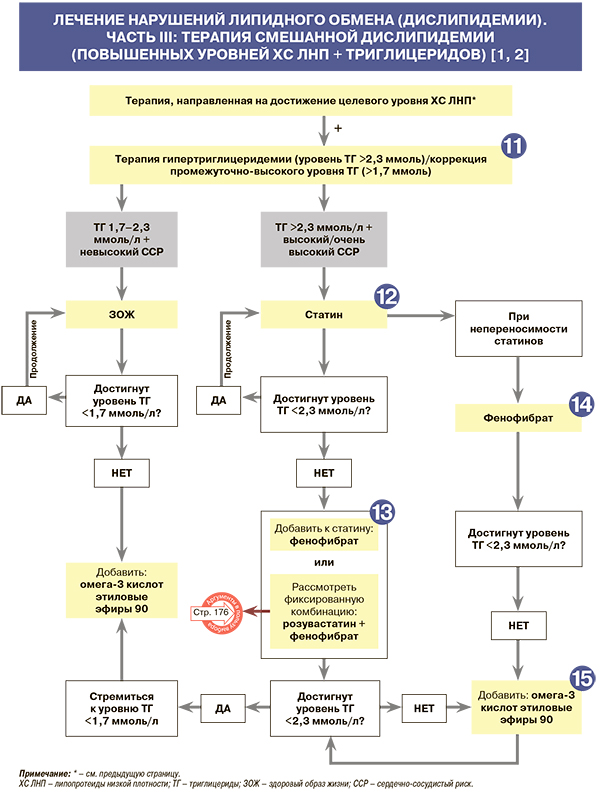
11
Исследователями установлено, что, несмотря на достижение целевого уровня ХС ЛНП, у ряда пациентов сохраняется риск сердечно-сосудистых осложнений. Такое явление определяется как остаточный риск. Наиболее частые причины остаточного риска – высокий уровень ТГ и низкий уровень ХС ЛВП в плазме крови. Показано, что у пациентов с ТГ >2,3 ммоль/л и ХС ЛВП <0,8 ммоль/л риск сердечно-сосудистых осложнений увеличивается в 10 раз по сравнению с пациентами, имеющими оптимальные значения этих показателей [1, 12, 13]. По данным эпидемиологического Фремингемского исследования, уровень ТГ >1,7 ммоль/л также достоверно связан с повышенной вероятностью развития кардиоваскулярных осложнений [1, 14].
12
При гипертриглицеридемии (уровне ТГ >2,3 ммоль/л) пациентам высокого/очень высокого сердечно-сосудистого риска рекомендован прием статинов: класс рекомендаций – I, уровень доказанности – B [1, 2]. При достижении уровня ТГ ниже 2,3 ммоль на фоне статинотерапии прием этой группы лекарств продолжают и далее [1, 15, 16].
13
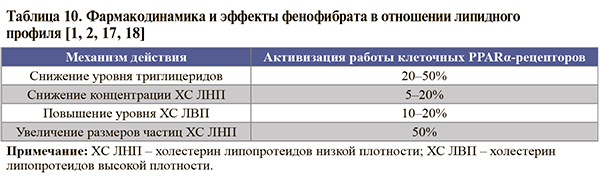
• При сохранении на фоне статинотерапии уровня ТГ >2,3 ммоль/л (даже в случае достижения целевого уровня ХС ЛНП) пациентам высокого/очень высокого сердечно-сосудистого риска рекомендовано добавление к статину фенофибрата: класс рекомендаций – IIa, уровень доказанности – B [1, 2]. Степень снижения ТГ в плазме крови на фоне фенофибрата достигает 50% [1, 2, 17, 18]; при этом он обладает благоприятным действием и на уровни других липидов в плазме крови (табл. 10). Более того, фенофибрат уменьшает концентрацию мочевой кислоты (в среднем на 25%), фибриногена (на 21%) и С-реактивного белка (на 34%) [1, 17, 18].
• Наряду с монопрепаратами фенофибрата, в России также зарегистрирована фиксированная комбинация фенофибрата (145 мг) + розувастатин (5 или 10 мг) [6]. Ее прием возможен при необходимости совместного использования статинов и фибратов с целью повышения приверженности пациента к комбинированной терапии.
14
Прием фенофибрата при гипертриглицеридемии возможен также при наличии у пациента высокого/очень высокого сердечно-сосудистого риска противопоказаний к приему статинов (класс рекомендаций – IIa, уровень доказанности – B) [1, 2]. В исследованиях сердечно-сосудистых исходов при приеме фибратов снижение кардиоваскулярного риска было пропорционально степени снижения ХС неЛВП [2].
15
• Добавление к терапии этиловых эфиров 90 омега-3 кислот (а именно этиловых эфиров эйкозапентаеновой и докозагексаеновой кислот) в дозе 2 г 2 раза/сут рекомендовано пациентам высокого/очень высокого сердечно-сосудистого риска при недостижении уровня ТГ <2,3 ммоль/л на фоне приема статинов и фенофибрата (либо только фенофибрата в случае противопоказаний к статинам): класс рекомендаций – IIa, уровень доказанности – B–С [1, 2]. В исследовании REDUCE-IT (n=8179) продемонстрировано снижение относительного риска развития неблагоприятных сердечно-сосудистых событий на 25% (р <0,001) в группе пациентов, принимавших омега-3-полиненасыщенные жирные кислоты в дозе 4 г/сут в сравнении с плацебо [1, 19].
• В исследовании лекарственного средства, содержащего сумму этиловых эфиров эйкозапентаеновой и докозагексаеновой кислот, по результатам 3,5-летнего наблюдения было показано существенное (на 15%) и достоверное (p <0,005) снижение относительного риска смертности от всех причин, нефатального инфаркта миокарда и нефатального инсульта на фоне приема этого препарата у пациентов с недавним инфарктом в анамнезе [20].



