ВВЕДЕНИЕ
Антикоагулянты обычно используются для снижения риска тромбоэмболических осложнений у пациентов с фибрилляцией предсердий (ФП), механическими клапанами сердца, тромбозом глубоких вен и гиперкоагуляцией. Эти препараты все чаще назначаются во всем мире, в основном из-за роста распространенности и частоты ФП [1]. Согласно исследованию Global Burden of Disease Study, в 2019 г. во всем мире насчитывалось 59,7 млн пациентов с ФП или трепетанием предсердий (для сравнения: с 1990 по 2017 г. наблюдалось увеличение численности таких больных с 19,1 млн до 37,6 млн [1]), 4,72 млн новых случаев заболевания и 0,315 млн смертей [2]. При этом прогнозируется, что в период с 2030 по 2034 г. общая заболеваемость фибрилляцией/трепетанием предсердий и общее число смертей среди мужчин составят 16,08 млн и 1,01 млн соответственно, а среди женщин – 16,85 млн и 1,49 млн [2].
Около 2% населения в развитых странах получают длительную антикоагулянтную терапию, частота применения которой у пациентов пожилого возраста достигает 8–10% [3]. После нескольких десятилетий, когда антагонисты витамина К (АВК) являлись единственными представителями пероральных антикоагулянтов, арсенал этой группы лекарственных средств был расширен за счет появления новых препаратов, называемых прямыми оральными антикоагулянтами (ПОАК). Такое название они получили потому, что непосредственно ингибируют либо тромбин (дабигатрана этексилат), либо активированный фактор свертывания крови X (апиксабан, ривароксабан, эдоксабан).
ПОАК имеют несколько преимуществ относительно АВК. Их назначают в фиксированных дозах, и их антикоагулянтный эффект более предсказуем, чем у варфарина, что устраняет необходимость рутинного мониторинга международного нормализованного отношения (МНО). Более того, быстрое начало действия (в течение 1–4 ч) и короткий период полувыведения (9–17 ч) значительно облегчают начало и прекращение терапии ПОАК по сравнению с АВК. Также, по данным рандомизированных клинических исследований, ПОАК не уступают варфарину (а некоторые даже превосходили его) в эффективности профилактики инсульта, причем их применение было ассоциировано с меньшим риском развития внутричерепных кровоизлияний [4–6].
Вместе с тем прием антикоагулянтов, включая ПОАК, ассоциирован с повышенным риском развития желудочно-кишечных кровотечений (ЖКК) и может вызывать диспепсические явления [6, 7]. Большие ЖКК представляют собой серьезное осложнение антикоагулянтной терапии: частота их возникновения варьирует примерно от 1 до 4% в год, а уровень летальности достигает 10% [8, 9]. До 15 и 32% пациентов с острым кровотечением из верхних и нижних отделов желудочно-кишечного тракта (ЖКТ) соответственно принимают антикоагулянты [10, 11]. Имеются данные, что использование дабигатрана этексилата и ривароксабана может быть ассоциировано с повышением риска кровотечения более чем на 30% по сравнению с варфарином [12–14], при этом 0,4–0,7% пациентов в год переносят ПОАК-опосредованные ЖКК, что предполагает 13 600–23 800 таких кровотечений в год [6].
В связи с этим в настоящее время пациентам, принимающим антикоагулянты, включая ПОАК, эксперты рекомендуют назначать сопутствующую гастропротективную терапию [5, 6, 15]. Особенно важна такая стратегия для пациентов с наличием ЖКК в анамнезе или для тех, у кого имеется язвенное поражение ЖКТ.
Следует отметить, что гастропротекторы – довольно разнородная группа препаратов, которые значимо различаются между собой по механизму действия. Например, одни действуют преимущественно в желудке (в частности, «золотым стандартом» снижения желудочной секреции считаются ингибиторы протонной помпы), другие – на всем протяжении ЖКТ. К последней категории относится ребамипид, который оказывает комплексное протективное действие на ЖКТ, защищая слизистую оболочку на всех ее уровнях (пре-, постэпитеальном и непосредственно эпителиальном), и обеспечивает восстановление плотных контактов в эпителии кишечной трубки на всем ее протяжении [16–18]. Отметим, что на сегодняшний день имеются данные исследований, подтверждающие эффективность ребамипида в защите ЖКТ у пациентов, получающих антитромботическую и в том числе антикоагулянтную терапию [19–22].
Таким образом, для разработки оптимальных стратегий защиты ЖКТ у больных, применяющих антитромботические препараты, и подбора персонализированной гастропротективной терапии необходимо понимать структуру сопутствующих заболеваний пищеварительной системы у этой категории пациентов.
Цель исследования – оценить частоту и структуру сопутствующих заболеваний органов пищеварения у пациентов, получающих ПОАК.
МАТЕРИАЛ И МЕТОДЫ
Дизайн исследования: многоцентровое кросс-секционное (одномоментное) фармакоэпидемиологическое исследование, проводившиеся с июня 2021 г. по март 2022 г. В работе приняли участие 26 научных центров в 15 городах России, из них 13 стационаров и 13 амбулаторных центров (лечебно-профилактические учреждения).
Отбор пациентов в исследование производился ретроспективно в соответствии с анализом медицинской документации и данных электронных карт и предусматривал включение как лиц, обследуемых на амбулаторном этапе, так и госпитализированных в стационар. В первом случае анализировались данные амбулаторной карты больного, а во втором – данные истории болезни.
Условиями отбора амбулаторных больных служили обращение в амбулаторно-поликлиническое учреждение и посещение врача общей практики, врача-терапевта или врача-кардиолога за период в один календарный месяц до момента включения в исследование; прием ПОАК ранее, согласно показаниям в анамнезе, и продолжение их использования по решению врача, а также прием ПОАК, который был назначен впервые непосредственно в течение анализируемого временного периода исследования.
Условиями отбора госпитализированных в стационар больных были госпитализация в стационар в течение одного календарного месяца до момента включения в исследование; прием ПОАК в соответствии с показаниями для его применения на этапе стационарного лечения, а также наличие ранее назначенного приема ПОАК и продолжение его использования в стационаре согласно решению врача.
Критерии включения: пациенты любого пола в возрасте от 18 лет и старше, получающие ПОАК (апиксабан, дабигатрана этексилат, ривароксабан) в соответствии с наличием показаний для их применения.
Критерии невключения: пациенты, не получающих ПОАК или использующие эту группу препаратов не в соответствии с показаниями для их применения.
Период включения пациентов в исследование составил 6 мес, общая длительность исследования тоже 6 мес. Период наблюдения предусмотрен не был.
Исследуемая популяция: согласно проведенному ретроспективному анализу медицинской документации пациентов, была сформирована группа из 662 больных, получающих ПОАК. На основе сведений амбулаторных карт и историй болезни была проанализирована следующая информация: данные анамнеза; данные общеклинического, физикального обследования, включающие индекс массы тела (ИМТ), уровень артериального давления (АД), частоту сердечных сокращений (ЧСС); данные лабораторного и инструментального обследования, включающие результаты клинического и биохимического анализа крови, эзофагогастродуоденоскопии (ЭГДС) при ее наличии; сопутствующие заболевания, в том числе заболевания пищеварительной системы; фармакотерапия.
Характеристика включенных пациентов в исследование приведена в таблице 1. Учитывая, что общая группа обследуемых включала как стационарных больных, так и пациентов амбулаторного звена, в характеристике включенных в исследование участников данные по АД и лабораторным показателям (гемоглобину, креатинину) представлены в виде двух категорий: «при поступлении/на приеме» и «при выписке».
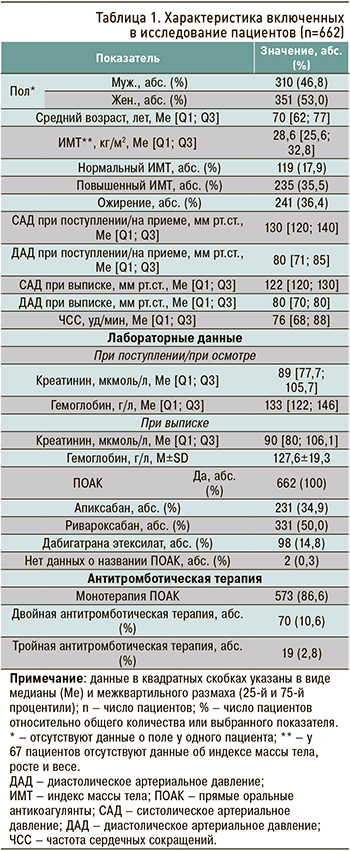
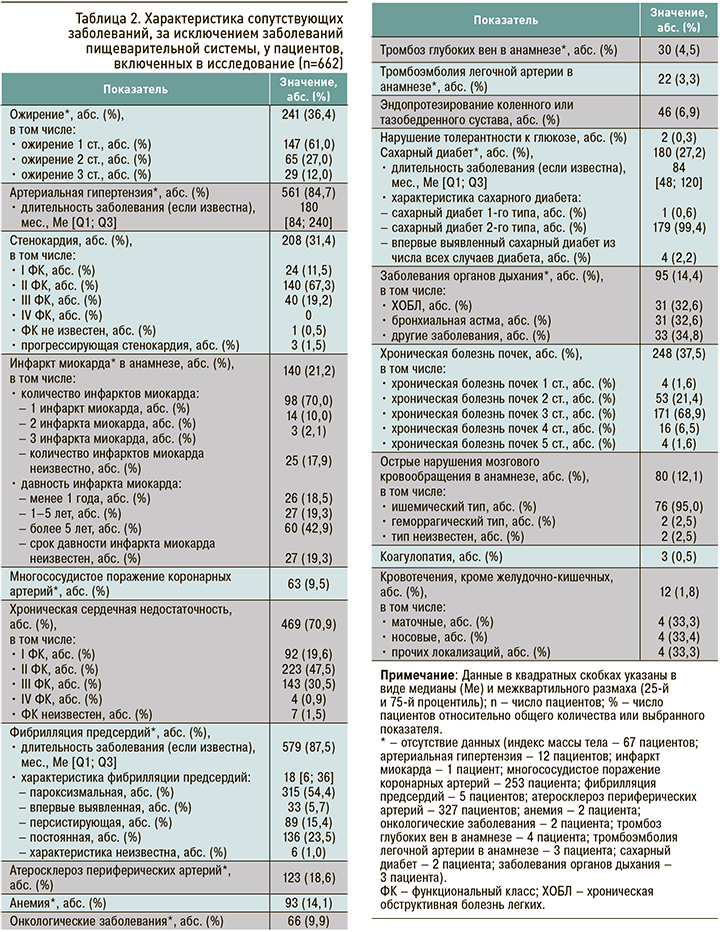
Также были проанализированы сопутствующие заболевания у участников исследования. Наиболее часто пациенты, принимающие ПОАК, имели ФП (87,5%), артериальную гипертензию (84,7%), хроническую сердечную недостаточность (70,9%), хроническую болезнь почек (37,5%), ожирение 1–3 ст. (36,4%), стенокардию напряжения (31,4%), инфаркт миокарда в анамнезе (21,2%) и сахарный диабет (27,2%). Подробная характеристика коморбидных заболеваний, за исключением заболеваний пищеварительной системы, отражена в таблице 2.
Статистическая обработка данных выполнялась с использованием пакетов статистической программы SPSS v.23.0. Нулевая гипотеза о соответствии распределения нормальному закону проверялась с использованием теста Колмогорова–Смирнова. Описание выборки для ненормально распределенных параметров производилось с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25 и 75 процентилей (С25 и С75), для нормально распределенных параметров – путем определения среднего значения (mean) со стандартным отклонением (standard deviation, SD). Качественные данные представлены в виде абсолютных чисел и относительных частот.
РЕЗУЛЬТАТЫ
Характеристика заболеваний пищеварительной системы: в общей сложности у 662 пациентов было описано 1099 заболеваний органов пищеварения, среди всех пациентов было 408 (61,6%) человек с тем или иным заболеванием ЖКТ. Наиболее распространенными среди них были заболевания желудка (54,8%), пищевода (33,8%), кишечника (32,2%), желчного пузыря и желчевыводящих путей (21,6%). Заболевания печени отмечались у 10,7% больных, патология поджелудочной железы – у 8,0%.
Среди заболеваний желудка чаще встречалась патология в виде хронического гастрита неуточненной этиологии (26,7%), атрофического гастрита (16,8%) и язвенной болезни желудка (12,9%). Из заболеваний пищевода наиболее высока была доля гастроэзофагеальной рефлюксной болезни (41,9%) и эзофагита (41,9%). Со стороны кишечника отмечалась довольно высокая встречаемость гипо- и атонического запора (22,1%) и язвенной болезни двенадцатиперстной кишки (21,6%). Подробная характеристика заболеваний пищеварительной системы у исследованных пациентов приведена в таблице 3.
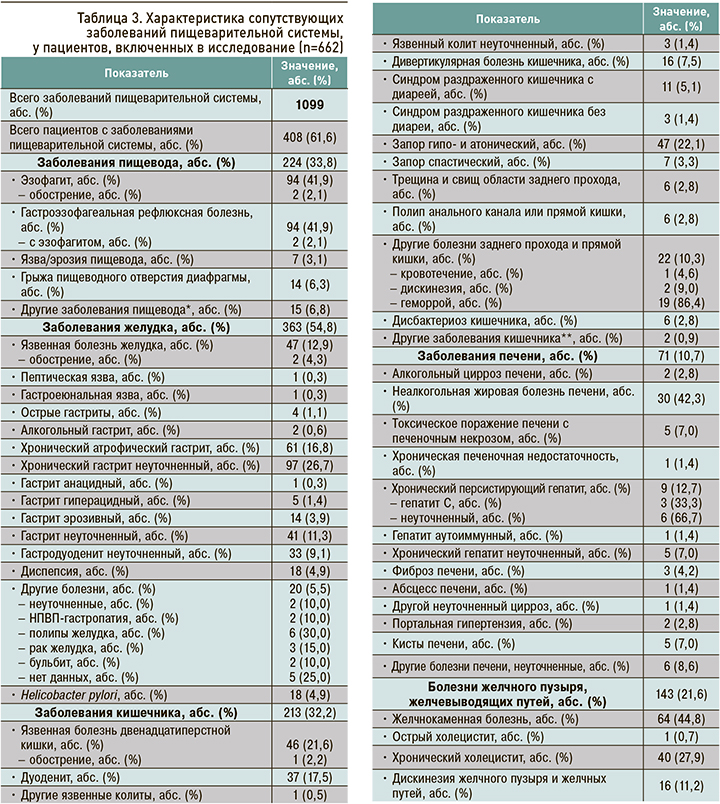
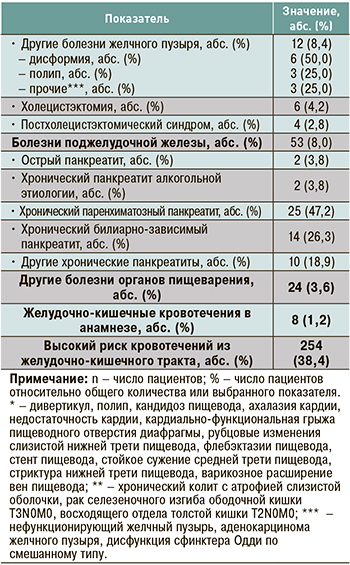
Следует отметить, что из числа всех участников исследования 1,2% имели ЖКК в анамнезе, а 38,4% – высокий риск развития ЖКК.
ОБСУЖДЕНИЕ
Согласно данным отечественного амбулаторно-поликлинического регистра РЕКВАЗА (РЕгистр КардиоВАскулярных ЗАболеваний), включающего в общей сложности данные 3690 пациентов, в том числе 530 пациентов с ФП, заболевания органов пищеварения являются наиболее частой сопутствующей патологией у этой категории больных. Их доля составляет 61,3% [23], что соотносится с полученными нами результатами: в нашем исследовании гастроинтестинальные заболевания имели 61,6% пациентов, принимающих ПОАК, включая и пациентов с ФП. Кроме того, больные ФП из регистра РЕКВАЗА в 9,8% случаев имели диагноз язвенной болезни желудка и двенадцатиперстной кишки, в 3,0% – эрозивный гастрит [23]. Эти данные также схожи с полученными нами результатами, в особенности с частотой встречаемости эрозивного гастрита (3,9%). Данные относительно частоты язвенной болезни желудка и двенадцатиперстной кишки в нашем исследовании были проанализированы по отдельности и составили 12,9 и 21,6% соответственно.
В менее крупном регистре ПРОФИЛЬ, направленном на изучение клинических характеристик больных ФП, язвенная болезнь желудка встречалась у больных ФП в 9,1% случаев (общая группа – 671 пациентов, из них 99 – с ФП) [24]. Исследователи отмечают, что столь большая частота выявления язвы, вероятно, была связана не столько с наличием этой патологии как таковой, сколько с ее обострением, вызванным антикоагулянтами и/или антиагрегантами, которые, как известно, способны провоцировать развитие язвенной болезни желудка [24]. В нашем исследовании общая частота язвенной болезни желудка среди пациентов, принимающих ПОАК и имеющих ФП (в 87,5% случаев), также была высокой и составила 12,9%, однако обострение заболевания наблюдалось только у 2 пациентов (4,3%) из этой группы. Учитывая, что в регистре ПРОФИЛЬ нет указания на частоту применения гастропротективной терапии у пациентов, получающих антитромбоцитарную терапию, выявить особенности взаимосвязи обострений язвенной болезни желудка и приема антикоагулянтов/антиагрегантов не представляется возможным. Вероятно, пациенты из этого исследования не получали гастропротекторы, поэтому частота обострений в нем была выше, чем в нашей работе. Наряду с этим следует подчеркнуть, что результаты регистра ПРОФИЛЬ были опубликованы еще в 2014 г., и это, безусловно, обусловило различия в тактике ведения пациентов по сравнению с настоящим временем, когда действуют обновленные рекомендации по лечению язвенной болезни желудка. В особенности эти различия касаются использования гастропротекторов.
В регистре The Global Registry on Long-Term Oral Antithrombotic Treatment in Patients with Atrial Fibrillation (GLORIA-AF), ориентированном на исследование тех характеристик пациентов, которые влияют на выбор антитромботической терапии при неклапанной ФП, и на получение данных об исходах антитромботической терапии в реальной клинической практике, выявлено следующее: среди всех 3320 включенных в этот регистр пациентов у 1,6% были зарегистрированы заболевания печени (более подробная характеристика не представлена), причем в подгруппе пациентов, принимающих только ПОАК, частота этой патологии составила 1,1% [25]. В нашем исследовании болезни печени встречались у 10,7% пациентов, принимающих ПОАК. Мы предполагаем, что наши результаты обусловлены высокой частотой встречаемости ожирения у исследованных лиц (практически каждый третий из них имел ту или иную степень этого заболевания), и, как следствие, неалкогольной жировой болезни печени, оказавшейся самой распространенной патологией печени в изучавшейся когорте.
В регистре Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF), включающем 10 098 амбулаторных пациентов с ФП, частота ЖКК у 7563 больных, принимающих пероральные антикоагулянты, достигла 8,0% [26]. В нашем же исследовании ЖКК в анамнезе были зарегистрированы только у 1,2% больных. Такие различия, по-видимому, можно объяснить тем, что пациенты, включенные в регистр ORBIT-AF, в 71% случае получали варфарин, а не ПОАК. Учитывая, что терапия варфарином требует постоянного лабораторного мониторинга и контроля целевого уровня МНО, поддерживать данный терапевтический диапазон на практике нередко бывает затруднительно, поэтому несвоевременная коррекция дозы препарата может привести к кровотечению.
ЗАКЛЮЧЕНИЕ
Настоящее исследование выявило, что в реальной клинической практике у 61,6% пациентов, принимающих ПОАК, имеется сопутствующее заболевание ЖКТ, причем 38,4% больных имели высокий риск развития ЖКК. В связи с этим требуется дальнейшая разработка оптимальных стратегий защиты ЖКТ у больных, получающих ПОАК.



