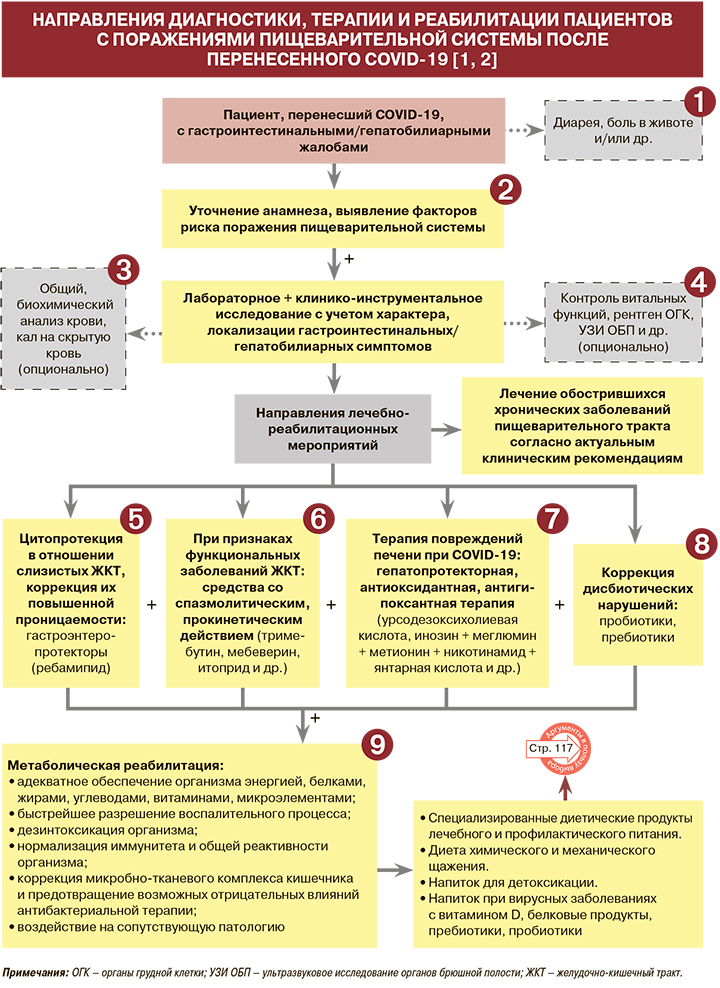
Диагностика
1
• Наиболее распространенные гастроэнтерологические симптомы длительно текущей коронавирусной инфекции (Long-COVID) – диарея и боль в животе [1, 2]. По результатам наблюдения специалистов колумбийского Центра исследований аутоиммунных заболеваний, максимальная распространенность диареи составила 56,1% у больных, перенесших тяжелую форму течения COVID-19 (среднее значение – 40%). Боль в животе у ранее тяжелобольных пациентов с новой коронавирусной инфекцией встречалась в 40% случаев (среднее значение – 24%) [1, 3].
• Другие возможные гастроэнтерологические и гепатобилиарные признаки LongCOVID – запор, рвота, тошнота, изжога, отрыжка, преходящее повышение печеночных трансаминаз (последние обычно носят временный характер и проходят по мере выздоровления) [1, 2]. Одна из наиболее частых форм синдрома Long-COVID со стороны желудочно-кишечного тракта (ЖКТ) − вирусный гастроэнтерит, который, в свою очередь, является самым сильным из известных факторов риска развития синдрома раздраженного кишечника (СРК) и функциональной диспепсии [1]. Частота появления желудочно-кишечных симптомов в течение лонг-ковидного периода зависит от тяжести течения острой инфекции COVID-19 [1, 2].
• Прогрессирующие нарушения метаболизма и недостаточность питания при COVID-19 могут приводить к формированию полиорганной недостаточности, которую следует рассматривать как наиболее тяжелую форму проявления системной воспалительной реакции [1, 2, 4]. Нарушение всасывания питательных веществ сопровождается одновременно и повышением потребностей для развития иммунного ответа, увеличением метаболических потребностей. С другой стороны, нарушение функции органов, отвечающих за метаболизм веществ, приводит к увеличению накопления катаболитов и промежуточных продуктов, что усиливает функциональные нарушения и приводит к системной недостаточности [1, 2].
2
На фоне новой коронавирусной инфекции возможно обострение хронических кислотозависимых заболеваний (гастроэзофагеальная рефлюксная болезнь, хронический гастрит, язвенная болезнь), прогрессирование изменений слизистой оболочки желудка в связи с отложенной эрадикацией H. pylori, обострение хронического панкреатита, хронических диффузных заболеваний печени, воспалительных заболеваний кишечника [2]. То же касается функциональных заболеваний ЖКТ (СРК, функциональная диспепсия), особенно у пациенток женского пола при наличии в анамнезе психологического дистресса и применение антибиотиков во время инфекции [1]. По данным ученых из США, 87,4% пациентов, выздоровевших после COVID-19, сообщали о персистенции по крайней мере одного симптома, включая симптомы со стороны ЖКТ. Ухудшение качества жизни наблюдалось у 44,1% переболевших при оценке состояния спустя 60 дней после начала заболевания [1, 5]. Все это требует как проведения необходимых лечебнодиагностических мероприятий, так и полноценной реабилитации [2].
• При изучении анамнеза пациента с гастроэнтерологическими жалобами после перенесенного COVID-19 следует дифференцировать антибиотико-ассоциированную диарею, обусловленную терапией вторичных бактериальных осложнений вирусной инфекции, и первичную вирусную диарею в связи с различными подходами к их лечению [1].
• Пациенты с вирусными гепатитами в анамнезе более склонны к развитию повреждения печени, что обусловлено усилением репликации вирусов гепатитов В и С во время SARS-CoV-инфекции [1]. Интересно, что пациенты с неалкогольным стеатогепатитом (НАСГ), ассоциированным с сопутствующими заболеваниями (диабетом, артериальной гипертензией, сердечно-сосудистыми нарушениями), подвержены высокому риску заражения SARS-CoV-2 и развитию тяжелой формы COVID-19 [1].
• Еще один возможный фактор развития поражений печени на фоне перенесенного COVID-19 – гепатотоксический эффект высоких доз парацетамола и других обезболивающих, применяемых для купирования лихорадки [1, 2].
3
• Список возможных лабораторных исследований у пациентов с расстройствами пищеварения, необходимых для верификации продленного COVID-19 и постковидных осложнений, с целью определения стратегии маршрутизации и лечения включает определение следующих параметров (опционально) [1]:
– общий анализ крови с лейкоцитарной формулой;
– анализ кала на скрытую кровь;
– биохимический анализ крови на С-реактивный белок (СРБ)/скорость оседания эритроцитов (СОЭ)/ферритин; Д-димер; аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ), билирубин, гамма-глютамилтранспептидазу (ГГТП); мочевину, креатинин; тиреотропный гормон (ТТГ), трийодтиронин (Т3), тироксин (Т4); общий белок, альбумин; амилазу; антитела к трансглутаминазе.
• Частота поражения печени после перенесенного COVID-19 колеблется от 14,8 до 53%, что в основном связано с аномальными уровнями АЛТ/АСТ, сопровождаемыми незначительным повышением уровня билирубина. Альбумин снижается в тяжелых случаях, его уровень составляет около 26,3–30,9 г/л. Гипоальбуминемия считается индикатором длительного COVID-19 [1, 2].
4
Список возможных клинико-инструментальных исследований у пациентов с расстройствами пищеварения, необходимых для верификации продленного COVID-19 и постковидных осложнений, с целью определения стратегии маршрутизации и лечения включает (опционально) [1]:
– контроль витальных функций (частота сердечных сокращений, пульс, частота дыхательных движений, артериальное давление, температура тела);
– пульсоксиметрию (сатурация);
– электрокардиографию;
– рентгенографию органов грудной клетки;
– ультразвуковое исследование органов брюшной полости;
– эндоскопию ЖКТ.
5
С целью цитопротективного действия в отношении слизистой оболочки пищевода, желудка и кишечника, а также коррекции повышенной проницаемости слизистой оболочки ЖКТ для профилактики, при инфицировании COVID-19, а также в период восстановления после инфекции рекомендуется прием ребамипида [1, 2, 6]. Благодаря действию на нескольких структурных уровнях ЖКТ он способствует устранению синдрома повышенной эпителиальной проницаемости, являющийся основной причиной большинства заболеваний ЖКТ [1, 2, 7]. Его рекомендуется применять для защиты и восстановления слизистых оболочек ЖКТ на всех этапах коронавирусной инфекции, включая этап реабилитации [1, 2, 7].
6
В качестве противовоспалительного, спазмолитического средства при функциональных заболеваниях ЖКТ, сопровождающих Long-COVID, рекомендован тримебутин, который оказывает спазмолитическое действие при гиперкинетических состояниях и стимулирующее – при гипокинетических (200 мг 3 раза/сут за 30 мин до еды или 300 мг, не менее 14 дней) [1, 8–10]. Также по показаниям для нормализации нарушенных функций ЖКТ могут применяться другие спазмолитики (мебеверин 200 мг 2 раза/сут, гиосцина бутилбромид 10–20 мг 3–5 раз/сут, пинаверия бромид 50–100 мг 2–3 раза/сут, алверина цитрат + симетикон 1 капс 2–3 раза/сут) и прокинетики (итоприд 150 мг сут), при дисфункции поджелудочной железы (вне фазы обострения) – полиферментные препараты [2].
7
• У коморбидных пациентов с гепатобилиарными нарушениями и сопутствующими заболеваниями/состояниями, которые могут отягощать течение коронавирусной инфекции (атеросклероз, избыточный вес, прием большого количества гепатотоксичных препаратов, сахарный диабет, пожилой возраст и др.), предпочтение в терапии следует отдавать плейотропным молекулам, воздействующим сразу на несколько патологических процессов, а также позволяющим значительно снизить лекарственную нагрузку. К числу таких лекарственных средств относится урсодезоксихолиевая кислота (УДХК), достоверно снижающая как гепатологические, так и сердечно-сосудистые риски у коморбидных пациентов с неалкогольной жировой болезнью печени (НАЖБП) [1, 2, 11]. Рекомендуемый режим применения УДХК: 13–15 мг/кг/сут 2–3 раза/сут. Возможен длительный многомесячный прием до разрешения явлений повреждения печени [1, 2].
• В рамках коррекции повреждений печени, ассоциированных с COVID-19, особенно при длительной персистенции вируса в организме (лонг-ковид), следует рассмотреть использование и других гепатопротекторов, в том числе обладающих антиоксидантными и антигипоксантными свойствами [1]. В связи с этим в качестве препарата инфузионной терапии при элевации уровней печеночных трансамиаз (синдроме цитолиза) возможно назначение полиионного сукцинат-метионинового комплекса инозин + меглюмин + метионин + никотинамид+ янтарная кислота (400–800 мл/сут внутривенно 3–12 дней) [1, 12]. Возникающие на фоне терапии COVID-19 лекарственные поражения печени также могут быть купированы назначением полиионного сукцинат-метионинового комплекса [1, 13].
8
У пациентов с COVID-19 наблюдаются значительные изменения в фекальных микробиомах. Дисбактериоз кишечника сохраняется даже после клиренса SARSCoV-2 (определяемого по мазкам с горла) и разрешения респираторных симптомов. Изменения фекальной микробиоты связаны с тяжестью течения инфекции COVID-19 [1]. C учетом дисбиотических изменений в кишечнике в схемы лечения длительно текущего коронавирусного синдрома необходимо включать пробиотические и пребиотические препараты: Enterococcus faecium ENCfa-68 + B. longum BB-46, B. bifidum + B. longum + B. infantis + L. rhamnosus, L. acidophilus (LA-5) + B. animalis subsp. lactis (BB-12), Saccharomyces cerevisiae (vini) и др. [1, 2].
9
• В рамках метаболической реабилитации при COVID-19 с поражением желудочнокишечного тракта (ЖКТ) и при Long-COVID (постковидном синдроме) необходимо обеспечить энергетическую и пищевую ценность рациона [1, 2]. Энергетические потребности у пациентов с перенесенным COVID-19 могут достигать 30 ккал/кг/сут; они зависят от фактического состояния питания пациентов, возраста, пола и уровня физической активности. В качестве практических стратегий увеличения потребления энергии следует рекомендовать дробное питание и запрещение употребления продуктов с маркировкой «низкокалорийный». Потребность в белке должна достигать 1,3–1,5 г/кг, чтобы избежать дальнейших потерь мышечной массы и профилактировать развитие саркопении [2]. Рекомендуется включать в рацион питания высококачественные белки, как растительного, так и животного происхождения, при каждом приеме пищи и перекусе [2].
• Предпочтительными источниками энергии при Long-COVID служат углеводы и жиры. Вместе с тем установлено, что у пациентов с постковидным синдромом повышается воспалительная активность в организме, поэтому включение в рацион питания пациентов цельнозерновых злаков, фруктов и бобовых культур обладает наименьшей способностью вызывать воспаление. Из рациона питания следует исключить сахар и продукты с высоким гликемическим индексом, пальмовое, подсолнечное, кукурузное, соевое масло, маргарин, красное мясо и изделия из него (сосиски, сардельки и другие продукты глубокой переработки) [2].
• В постковидный период следует снять диетические ограничения, когда это возможно (установлено, что 59% лиц со сниженной массой тела и 75,2% больных с гипоальбуминемией используют диетические ограничения) [1].
• В качестве продуктов питания при COVID-19 с вовлечением ЖКТ и в постковидный период целесообразно использовать лечебное питание, обеспечивающее поступление необходимых нутриентов, соблюдение режимов химического и механического щажения, дробность, умеренность при приеме пищи, низкое содержание поваренной соли. Это достигается включением в рацион специализированных пищевых продуктов диетического лечебного и диетического профилактического питания ЛЕОВИТ GASTRO при болезнях ЖКТ [2]:
– «Суп-пюре овощной с травами и овсянкой», обладающий противовоспалительным действием, снижающий явления диспепсии;
– «Каша овсяная с травами и семенем льна» с обезболивающим, защитным действием, снижающая явления диспепсии;
– «Коктейль белково-облепиховый», способствующий эпителизации слизистой, повышающий уровень белка и альбумина в крови;
– кисель «Желудочный нейтральный», снижающий диспепсические проявления и воспаление, улучшающий состав микробиома.
Эти продукты уменьшают явления диспепсии, обеспечивают значительное улучшение состояния, ослабление болей и дискомфорта, повышение качества жизни, снижают воспаление, концентрацию в плазме крови АСТ, АЛТ и ГГТ, СОЭ, СРБ, способствуют снижению уровня глюкозы и холестерина, а также повышают уровень альбумина в крови. По данным эндоскопического исследования, они уменьшают воспалительные явления, отек складок, улучшают эпителизацию эрозий [1, 2].
• Лечебное питание употребляется как дополнение к диетическому меню в любой прием пищи или самостоятельно [1, 2]:
– на завтрак – «Каша овсяная с травами и семенем льна»;
– на второй завтрак – кисель «Желудочный нейтральный»;
– на обед – «Суп-пюре овощной с травами и овсянкой»;
– между обедом и ужином – «Коктейль белково-облепиховый»;
– на ужин – «Каша овсяная с травами и семенем льна».
– перед сном при желании пациента употребляется на выбор «Коктейль белковооблепиховый» или кисель «Желудочный нейтральный».
• В качестве дополнения допускается использование блюд оптимизированного состава для основных вариантов стандартных диет, применяемых в лечебном питании в медицинских организациях России, включая отварные или запеченные блюда из мяса, птицы, рыбы, творога, яиц, овощей, кисломолочные продукты. Лечебное питание осуществляется в стационаре и в течение не менее 2 нед после выписки [14]. Такая диета с химическим и механическим щажением (ЛЕОВИТ GASTRO) нормализует состояние микробной флоры и устраняет дисбактериоз [1, 2, 15].
• Адекватное потребление витаминов и минеральных веществ с пищей имеет решающее значение для правильного функционирования иммунной системы и поддержания функциональных резервов организма. Показано, что у пациентов с COVID-19 наблюдается комбинированный дефицит витаминов и микроэлементов, особенно витамина D (у 76% пациентов) и селена (у 42%) [2]. Клиническая полезность витамина D в постковидном периоде реализуется через индукцию выработки кателицидинов и дефензинов, снижение репликации вируса и сохранение неповрежденных эпителиальных слоев, а также уменьшение выработки провоспалительных цитокинов [2]. Консенсус экспертов ESPEN рекомендует суточную дозу витамина D всем пациентам с постковидным синдромом [2, 16].
С этой целью рекомендовано использовать специализированные диетические продукты лечебного и профилактического питания при вирусных заболеваниях, например лечебный напиток при вирусных заболеваниях с витамином D (соответствующий готовый продукт представлен в линейке «ЛЕОВИТ») [1, 2]. Применение этого напитка способствует улучшению общего самочувствия, так как он оказывает общеукрепляющее действие, укрепляет стенки сосудов, снижает высокую температуру, устраняет озноб и мышечную боль, подавляет симптомы желудочнокишечного дискомфорта, способствует снижению СРБ и СОЭ [1, 2]. Особенность напитка при вирусных заболеваниях с витамином D – наличие в его составе прополиса, который обладает также выраженной активностью против Helicobacter pylori, что способствует снижению воспаления в ЖКТ [17]. Напиток следует употреблять 1–3 раза/сут в течение 10 дней в составе меню или отдельно, заменяя другие продукты [2].
• В случае недостаточного поступления других витаминов и минеральных веществ с рационом питания можно применять витаминно-минеральные препараты и готовые напитки, например кисель «Витаминный ФОРТЕ» («ЛЕОВИТ»), включающий витамины группы B, РР, Е, С, абрикос, клюкву, яблоко, куркуму, свеклу и пребиотики, или (в том числе при высоком уровне глюкозы в крови) коктейль белковый восстанавливающий («ЛЕОВИТ»), содержащий витамины А, С, Е, или же другие доступные напитки аналогичного действия [1, 2]. Прием указанных лечебных или профилактических витаминосодержащих продуктов рекомендуется проводить 1–2 раза/сут в соответствии с выраженностью имеющегося дефицита [1, 2].
• Для снижения токсического влияния эндои экзотоксинов при легкой и тяжелой стадии интоксикации на фоне COVID-19 и Long-COVID-инфекции, а также для уменьшения побочных эффектов лекарств, в целях антиоксидантной защиты, обеспечения организма витаминами (С, B2, B6, PP), микроэлементами (Zn, Mn, Se), пищевыми волокнами, нормализации функции печени и цикла Кребса рационально употреблять лечебный напиток для детоксикации организма («ЛЕОВИТ»), который способствует выраженной детоксикации организма на клеточном уровне [1, 2]. Этот продукт содержит природные детоксиканты, витамины, микроэлементы, регуляторы цикла Кребса, антиоксиданты, гипоксанты, энерготоники, растворимые пищевые волокна, слизистые вещества, пребиотики. Он обеспечивает детоксикацию организма на клеточном уровне за счет следующих механизмов:
– восстановления работы ферментных систем, I и II фазы детоксикации;
– усиления антитоксической функции печени;
– повышения антиокислительной активности организма;
– восполнения дефицита витаминов и микроэлементов, участвующих в работе ферментных систем детоксикации.
Для снижения уровня эндогенной интоксикации и уменьшения тяжести постковидного синдрома продукт лечебный напиток для детоксикации организма рекомендуется принимать 1–2 раза/сут: утром на завтрак и днем в обед или полдник, курсом от 3 до 6 мес, вплоть до нормализации маркеров интоксикации (АЛТ, АСТ, каталазы, билирубина, ГГТ, ЩФ, СРБ) [1, 2].
• При нарушении состояния кишечного микробиома, происходящего при COVID-19 и Long-COVID-инфекции, целесообразно проводить коррекцию дисбиоза, которая предполагает комплексный подход. Прежде всего это патогенетическое лечение основного заболевания. Необходимое условие – восстановление нарушенных функций кишечника. При купировании моторно-эвакуационных расстройств кишечника нормализуется окислительно-восстановительный потенциал внутриполостной среды и, как следствие, восстанавливается баланс аэробных и анаэробных популяций микроорганизмов. Мероприятия по коррекции дисбиоза толстой кишки предусматривают использование пребиотиков, пробиотиков, синбиотиков и метабиотиков. Пребиотики ферментируются кишечной микробиотой, генерируя различные метаболиты, играющие важную роль в восстановлении и функционировании микрофлоры, улучшают состояние слизистой оболочки, укрепляют защитные функции эпителия, нормализуют иммунный ответ и т.д. [2].
• Нормализация микрофлоры позволяет также снизить риск развития антибиотикоассоциированной диареи, в том числе вызванной Clostridium difficile [1, 2]. В связи с этим в рамках диетотерапии целесообразно использовать специализированные лечебные диетические и профилактические продукты со свойствами пребиотиков, содержащие лактозу, олигополисахариды, пектин, инулин, другие пищевые волокна: кисель «Желудочный нейтральный», лечебный напиток для детоксикации организма и кисель «Общеукрепляющий», лечебный напиток при вирусных заболеваниях с витамином D («ЛЕОВИТ») [1, 2]. Инулины и пектины также входят в состав специализированных продуктов лечебного диетического питания «Каша с травами и семенем льна» и «Суп-пюре овощной с травами и овсянкой» («ЛЕОВИТ») [1, 2].
Эти продукты могут включаться в состав меню для механического и химического щажения или употребляться самостоятельно 1–2 раза в течение дня.
• У пациентов, перенесших COVID-19, оправдано потребление специальных пищевых продуктов, характеризующихся высокой энергетической плотностью, высоким содержанием белка и высокой биодоступностью нутриентов [1, 18], например коктейля белкового восстанавливающего на основе молочных и растительных белков, пищевых волокон, экстрактов родиолы розовой, девясила, бессмертника, облепихи, барбариса, одуванчика, комплекса витаминов («ЛЕОВИТ») [1].
• Лечебное питание употребляется как дополнение к диетическому меню в любой прием пищи или самостоятельно. Эффективность указанных специализированных пищевых продуктов диетического лечебного и диетического профилактического питания при COVID-19 доказана клиническими исследованиями. Они способствуют не только уменьшению явлений диспепсии, болей, дискомфорта, воспаления, но и нормализации концентрации в плазме крови АСТ, АЛТ, ГГТ, СОЭ, СРБ, снижению уровня глюкозы в крови и холестерина, повышению уровня альбумина в крови [19–25].
• Пациенты с риском неблагоприятных исходов и более высокой смертности после заражения SARS-CoV-2 (пожилые и полиморбидные больные) должны обследоваться на предмет мальнутриции с помощью критериев MUST (Malnutrition Universal Screening Tool) или NRS-2002 (Nutrtional Risk Screening) [1, 26]. В соответствии с рекомендациями ESPEN следует потреблять 20–30 ккал/кг/сут в зависимости от тяжести заболевания (27–30 ккал/кг/сут для пациентов в тяжелом состоянии или имеющих сопутствующие заболевания) [1, 26–29]. Если пациент получал парентеральное питание, то он переводится на энтеральное питание, которое проводится через зонд или маленькими глотками 7–8 раз/сут [2]. Энтеральное питание при отсутствии стрессорной гипергликемии следует начинать с углеводного специализированного напитка для лечебного и профилактического питания – напитка для детоксикации («ЛЕОВИТ») – в течение 1–3 дней 6 раз/сут по 50–70 мл для адаптации ЖКТ. Со 2–4-го дня можно постепенно добавлять белковое энтеральное питание – коктейль белковый восстанавливающий («ЛЕОВИТ»), доводя соотношение белкового и углеводного питания до 1:2 [1, 2].



