Диагностика и лечение
1
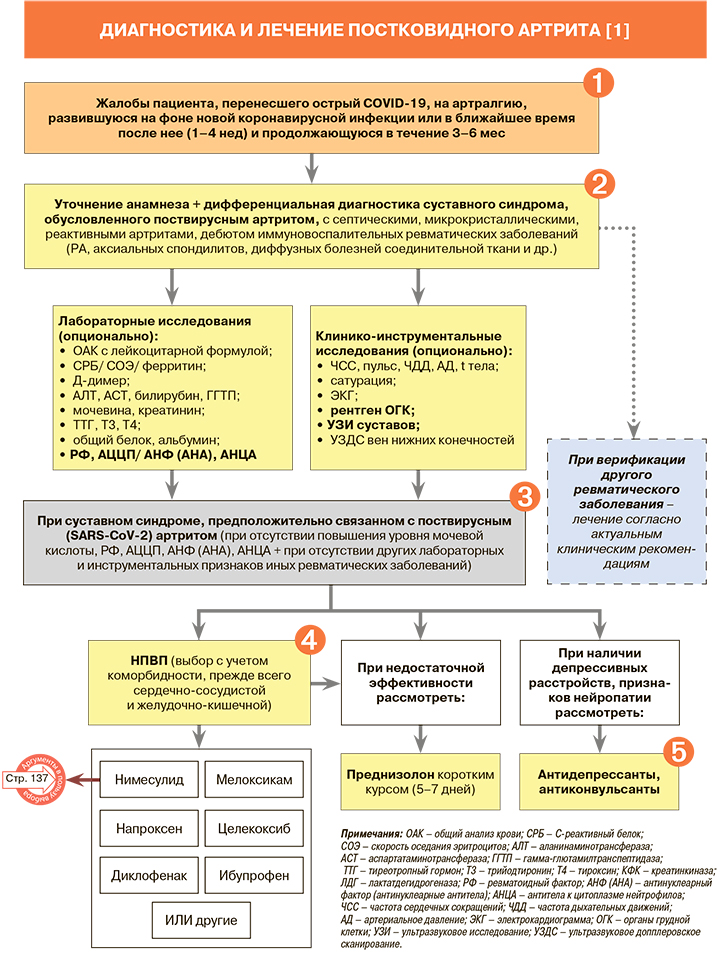
• Артралгии и миалгии относятся к числу характерных проявлений вирусной инфекции.
Эти симптомы возникают у 50–90% больных в остром периоде COVID-19 и имеют прямые взаимосвязи с тяжестью течения заболевания и наличием стойкой фебрильной лихорадки [1–3]. Даже через 6 мес наблюдения боли в суставах в среднем фиксируются у 9%, в мышцах – у 5–43% реконвалесцентов [1]. Интересно, что у пациентов с легким течением COVID-19 в острой фазе отмечается более высокая частота и спектр постковидных симптомов, включая боли в суставах, по сравнению с тяжелым течением инфекции [1].
• Особенности течения скелетно-мышечных проявлений лонг-ковида были представлены в наблюдательном проспективном одноцентровом исследовании акад. В.И. Мазурова с соавт. (2021), включившем 121 пациента с недифференцированным артритом. Продолжительность периода от перенесенного COVID-19 до манифестации суставного синдрома составила от 1 до 6 мес. В ходе исследования были обнаружены следующие клинические проявления суставного синдрома: артралгии, артриты, синовиты, моноартрит и полиартрит. Наиболее часто поражались коленный, голеностопный и лучезапястный суставы. Все случаи полиартрита включали вовлечение в патологический процесс мелких суставов кистей и стоп [1, 4].
2
• Один из частых вариантов клинических проявлений лонг-ковида – формирование суставного синдрома, который может быть связан с развитием поствирусного артрита (ПВА) [5–7]. В указанном выше исследовании [4] ПВА выявлялся у 22,6% пациентов на фоне COVID-19 или в ближайшее время после перенесенной вирусной инфекции (1–4 нед). Этот вариант артрита характеризовался моно-/ олигоартритом коленных, голеностопных, проксимальных и дистальных межфаланговых суставов, а также припухлостью периартикулярных мягких тканей, отсутствием деструктивных изменений в суставах и хорошим клиническим ответом на лечение нестероидными противовоспалительными препаратами (НПВП) или глюкокортикостероидами (ГКС) [1].
• При уточнении анамнеза пациента с постковидной артралгией, наряду с наличием прежде диагностированных ревматических заболеваний, следует учитывать возможность формирования асептического некроза головок крупных суставов (коленных, тазобедренных) на фоне вирусной инфекции и применения ГКС для ее терапии [1]. Формированию хронической боли в рамках постковидного синдрома могут способствовать депрессия, тревожность и психоэмоциональный стресс, связанные с COVID-19 и сопутствующей пандемией [1]. Перенесенный COVID-19 может стать причиной развития или обострения фибромиалгии [1].
• Суставной синдром, разившийся после перенесенного COVID-19, может быть не только проявлением ПВА, но и дебютом системных иммуновоспалительных ревматических заболеваний (ИВРЗ), что требует расширения дифференциально-диагностического поиска и динамического наблюдения за этой группой пациентов [1, 8]. В наблюдательном проспективном одноцентровом исследовании акад. В.И. Мазурова с соавт. (2021) среди пациентов с недифференцированным артритом определенный диагноз ревматического заболевания был верифицирован в 49% случаев в течение 3–6 мес. Наиболее часто выявлялся ранний ревматоидный артрит (РА). Наряду с этим через 3–6 мес после перенесенного COVID-19 у пациентов с недифференцированным артритом были диагностированы аксиальный спондилоартрит, болезнь Шегрена, псориатический артрит, полиостеоартрит, системная красная волчанка (СКВ), лейкоцитокластический васкулит, геморрагический васкулит, очаговая склеродермия и др. [1, 4]. Добавим, что недифференцированный артрит, развившийся на фоне COVID-19, может в дальнейшем трансформироваться в остеоартрит [1].
3
• ПВА в большинстве случаев остается диагнозом исключения после изучения результатов лабораторных и клинико-инструментальных исследований.
В качестве примера можно привести набор признаков, позволяющих исключить ранний РА после перенесенного COVID-19: в этом случае должны отсутствовать симметричный артрит, быстрое увеличение числа болезненных и припухших суставов (преимущественно коленных, а также лучезапястных, проксимальных межфаланговых суставов кистей и плюснефаланговых суставах стоп), серопозитивность по ревматоидному фактору (РФ) и антителам к циклическому цитруллинсодержащему пептиду (АЦЦП), теносиновиты и костно-хрящевые эрозии при ультразвуковом исследовании (УЗИ) суставов [1].
• Определение диагностических значений антинуклеарного фактора (≥1:160 на клеточной линии Hep 2) у пациентов с артралгией, перенесших COVID-19, требует проведения клинико-иммунологического обследования для исключения/ подтверждения диагноза ИВРЗ. Однако следует учитывать, что позитивность по АНФ и антинуклеарным антителам (АНА) может наблюдаться в рамках иммуноопосредованного ответа на вирусную инфекцию у лиц без ИВРЗ и требует наблюдения в динамике [1].
4
• Пациентам с постковидным артритом могут назначаться НПВП, короткие курсы ГКС (преднизолон ≤10 мг/сут в течение 5–7 дней), а при наличии депрессивных расстройств – антидепрессанты и антиконвульсанты [1, 9, 10]. Отметим, что НПВП играют немаловажную роль и в комплексном лечении многих других суставных заболеваний, включая остеоартрит, ревматоидный артрит, аксиальный спондилоартрит, подагру и др.
• Зарегистрированные в России системные НПВП, показанные для купирования скелетно-мышечной боли, представлены в таблице 1. Считается, что все препараты этого класса в средних и максимальных терапевтических дозах при длительном применении обладают равноценным обезболивающим потенциалом [11].
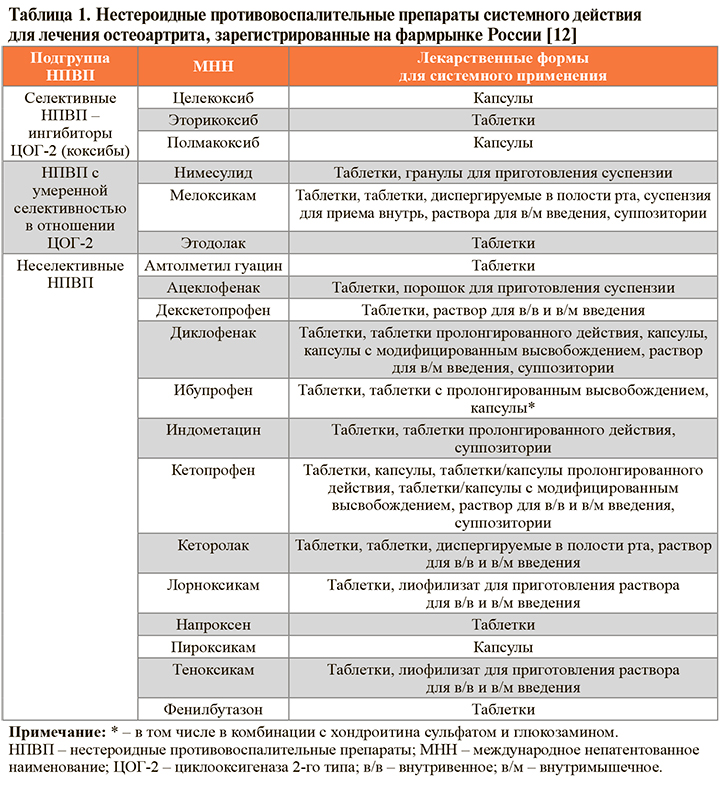
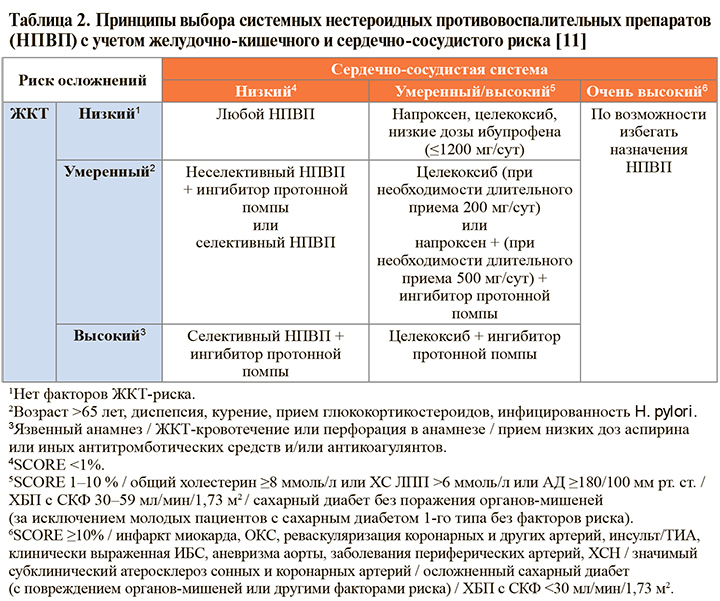
• Обладая сравнимой клинической эффективностью в рекомендуемых дозах, НПВП в то же время могут различаться в плане индивидуальной реакции пациентов на конкретный препарат. Они противопоказаны при эрозивно-язвенных поражениях ЖКТ, особенно в стадии обострения, выраженных нарушениях функции печени и почек, индивидуальной непереносимости, беременности, выраженной сердечной недостаточности [11]. Выбор конкретного НПВП должен осуществляться индивидуально с учетом фармакологических особенностей каждого препарата и коморбидности (сопутствующих заболеваний) конкретного пациента (табл. 2).
• Не рекомендуется одновременное использование двух и более НПВП, так как это увеличивает риск развития нежелательных реакций [11].
• К широко назначаемым НПВП, обладающим выраженным обезболивающим и противовоспалительным эффектом и серьезной доказательной базой эффективности и безопасности при широком спектре ревматических заболеваний, относится умеренно селективный ингибитор ЦОГ-2 нимесулид. Так, выраженное анальгетическое и противовоспалительное действие нимесулида в форме гранул было продемонстрировано в российском 8-недельном контролируемом многоцентровом исследовании у больных РА (n=30). При приеме препарата 200 мг/сут у пациентов наблюдалось снижение выраженности боли по визуальной аналоговой шкале (ВАШ, мм), числа болезненных и воспаленных суставов. В 77% случаев эффект терапии был оценен как хороший. Побочные эффекты наблюдались лишь у 15,3% больных, причем были обратимы и не зависели от дозы препарата [13].
• Нимесулид в разных лекарственных формах, включая гранулированную, продемонстрировал высокую эффективность и при подагрическом артрите. Отдельный интерес представляют результаты рандомизированного исследования 90 больных подагрой, у которых предшествующая терапия НПВП оказалась неэффективной: в нем сравнивалась скорость наступления анальгетического и противовоспалительного эффектов при 7-дневном приеме нимесулида в разных формах и диклофенака. Участники первой группы получали гранулированный нимесулид в саше в дозе 100 мг 2 раза/сут, второй – таблетированный нимесулид по аналогичной схеме, третьей – диклофенак 75 мг 2 раза/сут. Оценка скорости наступления анальгетического эффекта в течение первых 3 ч показала явное преимущество нимесулида в разных формах перед диклофенаком. При этом больные, принимавшие гранулированный нимесулид, отмечали снижение выраженности боли уже на 20-й минуте после приема первой дозы препарата. Через 7 дней приступ подагрического артрита был купирован у 24 (80%) больных, получавших нимесулид в форме гранул, у 11 (36%) – нимесулид в форме таблеток и 4 (13%) – диклофенак [13].
• Изучение частоты ЖКТ-осложнений в реальной клинической практике продемонстрировало, что их суммарная частота при использовании нимесулида существенно меньше, чем при назначении диклофенака (12,1%), и не отличается от таковой у ибупрофена (8,1 и 8,6% соответственно). В свою очередь, риск сердечно-сосудистых катастроф на фоне приема нимесулида не выше, чем при использовании мелоксикама, этодолака, коксибов и неселективных НПВП [13]. Интересно также, что в крупном европейском эпидемиологическом исследовании, включившем около 400 тыс. пациентов, получающих НПВП, нимесулид в плане гепатотоксичности существенно не отличался от других препаратов своего класса, например от диклофенака и ибупрофена [13].
5
Из антидепрессантов при скелетно-мышечных болях может назначаться дулоксетин.
Так, метаанализ, посвященный его использованию при ОА коленного сустава, свидетельствует о значимом уменьшении боли, скованности, функциональной недостаточности и улучшении качества жизни [14]. Назначение дулоксетина наиболее предпочтительно у пациентов с признаками центральной сенситизации, депрессии и распространенной боли [14]. При наличии хронической боли у пациентов с артралгией, особенно выявлении признаков нейропатической боли, также могут назначаться препараты центрального действия из группы антиконвульсантов (габапентин и др.) [15].



