АКТУАЛЬНОСТЬ
Рак желудка (РЖ) занимает пятое место по смертности от онкологических заболеваний в мире [1]. В России бóльшая часть злокачественных новообразований желудка выявляется на поздних стадиях (III, IV), суммарно составляя 61,9% случаев [2]. Частота выявления РЖ на I–II стадиях с 2010 по 2020 увеличилась лишь на 10,4% [2]. В 2020 г. в России удельный вес РЖ, обнаруженного на ранних стадиях, равнялся 36,7%, при этом по уровню летальности заболевание оказалось на шестом месте среди злокачественных новообразований [2]. Несмотря на приведенные показатели, Россия считается страной с промежуточным риском РЖ, поэтому экономическая эффективность рутинного эндоскопического скрининга этого заболевания ставится под сомнение [3]. В настоящее время такой метод используется только в странах с высоким риском РЖ (Япония, Корея и др.) [4].
Проведенные в России эпидемологические исследования на основе 13С-уреазного дыхательного теста (n=19 875) показали, что распространенность инфекции H. pylori в популяции составляет 38,8% [5]. Инфицированность Н. pylori среди врачей в России достигла 59%, при этом у лиц в возрасте до 30 лет показатель инфицированности составил 45,2%, в возрасте 51–60 лет – 65,2% [6]. Среди пациентов гастроэнтерологического профиля в Санкт-Петербурге инфицированность H. pylori равняется 39,5% [7].
Консенсусом Маастрихт VI признано, что H. pylori всегда вызывает хронический гастрит, осложнениями которого могут быть язвенная болезнь, аденокарцинома желудка и MALTлимфома желудка [3]. Метаанализ проспективных исследований продемонстрировал высокую связь между хронического атрофического гастрита (III, IV стадиями по OLGA/OLGIM) и риском РЖ [8]. В консенсусе подчеркивается, что эрадикация H. pylori на более ранних стадиях, до развития тяжелой атрофии, вносит больший вклад в канцеропревенцию [3]. Кроме того, обращается внимание, что после успешной эрадикации H. pylori пациенты с тяжелой атрофией слизистой желудка остаются в группе риска по РЖ и требуют регулярного диспансерного наблюдения [3].
Аутоиммунный гастрит (АИГ) ассоциирован с высоким риском возникновения нейроэндокринных опухолей желудка 1-го типа (отношение шансов (ОШ) 11,43; 95% доверительный интервал (ДИ): 8,90–14,69) и аденокарциномы желудка (ОШ 2,18; 95% ДИ 1,94–2,45) [9–11]. Среди пациентов с АИГ дисплазия или РЖ встречаются с частотой 5,3% с увеличением риска распространенных поражений в старшей возрастной группе. В ретроспективном исследовании среди 150 пациентов с установленным диагнозом АИГ заболеваемость РЖ составила 14,2 на 1000 человеко-лет, что намного превышает аналогичный показатель среди населения в целом (0,073 на 1000 человеколет). Уровни годовой заболеваемости РЖ среди пациентов с АИГ и пернициозной анемией варьируют от 0 до 1,2% [12].
В России существуют лишь единичные исследования по оценке распространенности хронического атрофического гастрита (ХАГ), учитывающие вклад инфекции H. pylori и аутоиммунного воспаления в его развитие. По результатам исследования В.В. Цуканова с соавт., частота атрофии тела желудка у пациентов в возрасте до 55 лет составила 8,3%, в возрасте 55 лет и старше – 13,4% (ОШ 1,7; ДИ: 1,07–2,67; р=0,03) [13]. Встречаемость инфекции H. pylori у пациентов с ХАГ, по некоторым данным, достигает 66,0%, а при выявлении кишечной метаплазии (КМ) и дисплазии слизистой оболочки желудка (СОЖ) – 71,4 и 71,7% соответственно [14]. В Китае в 2014 г. частота положительного теста на H. pylori у пациентов с ХАГ с КМ равнялась 20,26%, что было значительно ниже, чем у пациентов без КМ (25,08%) [15].
В России в 2016 г. распространенность инфекции H. pylori у пациентов с ХАГ составила 76,7% (по данным серологического метода) [16].
В России из актуальных для скрининга РЖ мероприятий в рамках диспансеризации можно выделить выполнение эзофагогастродуоденоскопии (ЭГДС) в возрасте 45 лет и старше, общий анализ крови и исследование кала на скрытую кровь [17]. Учитывая редкое проведение ЭГДС, частое нарушение протокола выполнения биопсии по протоколу OLGA, отсутствие массового тестирования населения на H. pylori, а также высокий уровень выявления РЖ на поздних стадиях представляется актуальным поиск и введение программ по первичной профилактике РЖ в программу диспансеризации взрослого населения.
Цель исследования – оценить эффективность включения скрининга ХАГ и инфекции H. pylori в диспансеризацию взрослого населения для выявления РЖ на ранних стадиях.
Для выполнения поставленной цели нами было запланировано выполнение комплекса задач.
1. Изучить частоту встречаемости отклонений в значениях лабораторных показателей, подтверждающих атрофию и воспаление СОЖ при проведении диспансеризации взрослого населения.
2. Сравнить результаты лабораторных показателей, подтверждающих атрофию, с результатами морфологических исследований.
3. Оценить частоту встречаемости дисплазии и РЖ при выполнении скрининга.
4. Оценить частоту выявления инфекции H. pylori (активной или перенесенной) с помощью серологического метода.
5. Сравнить распространенность инфекции H. pylori в разных возрастных группах по данным серологического метода исследования при проведении диспансеризации, а также оценить распространенность инфицированности H. pylori среди лиц с лабораторными и морфологическими критериями ХАГ.
МАТЕРИАЛ И МЕТОДЫ
В исследовании приняли участие 1705 человек в возрасте от 21 до 81 года, проходивших диспансеризацию в Санкт-Петербурге. Средний возраст исследуемых составил 42 (33–53) года.
Всем участникам исследования выполнялось определение в сыворотке крови пепсиногена-I (П-I), пепсиногена-II (П-II), гастрина-17 (Г-17) и антител к H. pylori класса IgG. Лицам с серологическими признаками ХАГ была выполнена ЭГДС с хромоэндоскопией и биопсия СОЖ по OLGA. Окраска с помощью гематоксилина и эозина и по Романовскому–Гимзе применялась для определения H. pylori.
Статистический анализ полученных данных проводился с использованием программы StatTech v. 3.0.9 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению посредством критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% ДИ. В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные указывались в абсолютных значениях и процентных долях. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение процентных долей при анализе многопольных таблиц сопряженности осуществлялось посредством критерия хи-квадрат Пирсона. Направление и теснота корреляционной связи между двумя количественными показателями определялись с применением коэффициента ранговой корреляции Спирмена (ρ) – при распределении показателей, отличном от нормального. Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с использованием метода линейной регрессии. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
РЕЗУЛЬТАТЫ
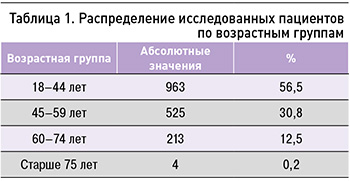
Среди обследуемых лиц преобладали женщины (62,5%) по сравнению с мужчинами (37,5%). Распределение пациентов по возрастным группам представлено в таблице 1. Обращает на себя внимание тот факт, что более половины участников исследования попали в возрастную группу 18–44 года.
Серологические признаки ХАГ были выявлены у 93 человек (5,5%). Из них ЭГДС с биопсией СОЖ по OLGA была выполнена 49 пациентам (2,9%), средний возраст которых составил 57±11 лет (95% ДИ: 54–60). 44 человека от проведения ЭГДС отказались. Среди пациентов с серологическими критериями ХАГ, прошедших ЭГДС и биопсию СОЖ, морфологические признаки ХАГ были выявлены у 48 человек (97,9%).
У 72,9% из 48 человек был обнаружен ХАГ с преимущественным поражением тела желудка, у 20,8% – атрофический пангастрит, у 6,2% – ХАГ антрального отдела желудка. Распределение исследуемых по преимущественному поражению отделов желудка и стадиям атрофии указано в таблице 2.
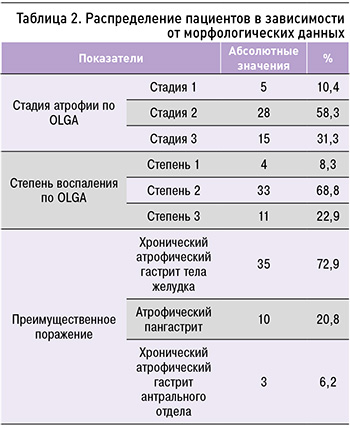
Обращает на себя внимание, что самая большая группа участников исследования была представлена пациентами с ХАГ тела желудка (72,9%), наименьшая – пациентами с ХАГ антрального отдела (6,2%). ХАГ в группе пожилого и старческого возраста (старше 60 лет) отмечался в 35 случаях (16,1%), в возрастной группе 45–59 лет – в 37 случаях (7%). Различия показателей, оцененные с помощью критерия хи-квадрат Пирсона, были статистически значимы (p <0,05; рис. 1). Таким образом, проведенный анализ показал, что шансы развития ХАГ в возрасте старше 60 лет выше в 2,5 раза, чем в 45–59 лет (95% ДИ: 1,5–4,1).

С учетом выполненных методов обследования (серологический метод, морфологический метод оценки СОЖ, расчетный), можно сделать вывод, что распространенность ХАГ среди взрослого населения от 21 до 81 года равна 5,3%.
В результате скрининга были выявлены 1 случай (2,1% среди пациентов с ХАГ) дисплазии высокой степени (high grade), 1 случай (2,1%) дисплазии низкой степени (low grade), 2 случая (4,2%) ХАГ со злокачественными новообразованиями желудка, в том числе 1 случай с нейроэндокринной опухолью 1-го типа (НЭО-1) и 1 случай с аденокарциномой in situ. У всех указанных 4 пациентов были обнаружены серологические и морфологические признаки ХАГ.
В ходе диспансеризации был проведен скрининг инфекции H. pylori с целью установления круга лиц для дообследования валидированными методами и последующей эрадикационной терапией. Антитела IgG к Н. pylori были выявлены в 59,2% случаев (1010 из 1705) среди всех обследованных, в 59,6% (56 из 94) – среди лиц с лабораторными критериями ХАГ, в 47,9% случаев (23 из 48) – среди участников с гистологическими признаками ХАГ.
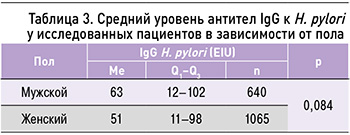
Нами был выполнен анализ зависимости титра антител IgG к Н. pylori от пола; достоверных различий по этому параметру найдено не было (p=0,084, U-критерий Манна–Уитни; табл. 3).
При оценке связи уровня П-II и титра антител IgG к H. pylori была установлена прямая корреляционная связь средней силы (ρ=0,519, p <0,001). Были определены средние уровни П-II у пациентов, инфицированных H. pylori (гистологически), и неинфицированных лиц, но выявленные отличия были недостоверными (табл. 4).

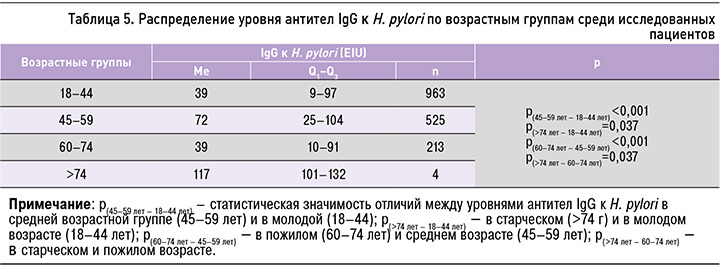
Была обнаружена слабая корреляционная связь между титром антител IgG к H. pylori и возрастом участников (ρ=0,117, p <0,001). При анализе уровня антител IgG к H. pylori в зависимости от возраста отмечался наибольший уровень показателя в среднем (Me=72, 25–104) и старческом возрасте (Me=117, 101–132), что может указывать на важность скрининга H. pylori инфекции в этих возрастных группах (табл. 5).
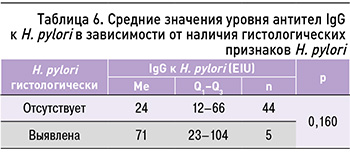
При выполнении анализа сопоставимости серологического метода и гистологического подтверждения инфекции H. pylori, достоверных отличий между группами выявлено не было (U-критерий Манна–Уитни; табл. 6), что еще раз подчеркивает необходимость проведения валидированных тестов для подтверждения инфекции H. pylori.
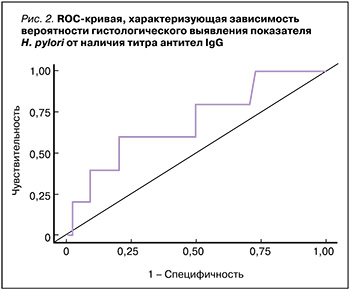
Для оценки диагностической значимости определения титра IgG к H. pylori при скрининге инфицированных H. pylori лиц был выполнен ROCанализ (рис. 2). Площадь под ROC-кривой равнялась 0,693±0,137 (95% ДИ: 0,42–0,96). Пороговое значение уровня антител IgG к H. pylori в точке cut-off, которому соответствовало наивысшее значение индекса Юдена, составило 71,2 EIU. Прогнозировалось, что при титре антител IgG к H. pylori выше данной величины или равном ей гистологическое подтверждение инфекции H. pylori наиболее вероятно, но полученная модель не показала достоверности (p=0,160). Возможно, это требует увеличения выборки.
ОБСУЖДЕНИЕ
Согласно Приказу № 404н, в рамках диспансеризации взрослого населения в перечень исследований, направленных на раннее выявление онкологических заболеваний, входит ЭГДС (однократно) в возрасте 45 лет [17]. Несмотря на проводимые в рамках диспансеризации мероприятия, РЖ в большинстве случаев диагностируется на поздних стадиях заболевания. В нашем исследовании была подтверждена эффективность серологического метода (оценка П-I и П-II, Г-17, антител к H. pylori) для скрининга ХАГ, т.е. для первичной профилактики РЖ. Более того, в результате нашего исследования были выявлены случаи дисплазии высокой и низкой степени, случаи НЭО-1 и аденокарциномы in situ. У всех 4 соответствующих пациентов были обнаружены серологические и морфологические признаки ХАГ. Важно отметить, что в данном исследовании эндоскопическое исследование удалось выполнить только 52,7% пациентам с серологическими признаками ХАГ. Полученные результаты могут стать одним из аргументов для включения «функциональной серологии» в программы диспансеризации взрослого населения в целях скрининга на РЖ в России, учитывая экономическую нецелесообразность рутинного эндоскопического скрининга.
В настоящее время к валидированным и общепризнанным методам диагностики инфекции H. pylori относятся 13С-уреазный дыхательный тест (13С-УДТ) и определение антигена H. pylori в кале [3, 18]. Тем не менее известно, что особую ценность для скрининга хеликобактерной инфекции представляет серологический метод определения антител IgG к Н. pylori [3]. Таким образом, в нашем исследовании показано, что в 59,2% случаев (1010 из 1705) среди всех обследованных и в 59,6% (56 из 94 пациентов) среди пациентов с лабораторными критериями ХАГ имеются серологические маркеры Н. pylori, что требует уточнения хеликобактерного статуса на наличие активной инфекции. Более того, при построении прогностической модели с помощью ROC-анализа в нашем исследовании был получен уровень антител IgG к H. pylori более 71,2 EIU, который является диагностически значимым для дальнейшего подтверждения валидированными методами, однако эта модель не оказалась статистически значимой. Стоит учитывать малую выборку лиц, прошедших гастроскопию и подвергшихся гистологическому исследованию на Н. pylori в нашем исследовании. Кроме того, участникам не выполнялись 13С-УДТ или определение антигена H. pylori в кале, так как это не входило в задачи данного исследования. Возможно, при выполнении описанных условий мы получим возможность построить более точную прогностическую модель, основывающуюся на титре антител IgG к H. pylori.
Представленные ранее данные [19] и результаты нашего исследования демонстрируют сильную корреляционную связь между П-II и титрами антител к H. pylori, что, как правило, объясняется активным воспалением, вызванным воздействием хеликобактерной инфекции. По-видимому, для клинической практики представляет интерес более высокий титр антител в возрасте старше 45 лет, что позволяет выделить данную возрастную категорию в качестве группы риска инфицирования H. pylori. С другой стороны, в литературе все чаще появляются данные о серопозитивности по Н. pylori у пациентов, отрицающих эрадикационную антихеликобактерную терапию и демонстрирующих отсутствие этой бактерии в дополнительных тестах (13С-УДТ, определение антигена H. pylori в кале, гистологический метод) [20]. Причины этого факта являются предметом дискуссии и дальнейшего изучения, но одна из гипотез предполагает молекулярную мимикрию между Н. pylori и H+/K+ АТФазы париетальных клеток [20].
ЗАКЛЮЧЕНИЕ
1. Морфологические признаки ХАГ были обнаружены у 97,9% пациентов с серологическими маркерами атрофии, что говорит о высокой чувствительности определения серологических показателей П-I, П-II и Г-17 для выявления атрофии СОЖ. Среди этих пациентов были зарегистрированы случаи дисплазии высокой, низкой степени, НЭО-1 и аденокарциномы in situ.
2. При сравнении возрастных групп наибольшая распространенность ХАГ отмечена среди лиц пожилого и старческого возраста.
3. Встречаемость ХАГ среди взрослого населения в возрасте от 21 до 81 года составляет 5,3%.
4. Частота выявления инфекции H. pylori (активной или перенесенной), по данным серологического метода (антитела IgG к Н. pylori), равнялась 59,2% среди всех обследованных лиц, среди лиц с лабораторными маркерами ХАГ – 59,6%, при наличии гистологических признаков ХАГ – 47,9%.
5. Между уровнем П-II и титром антител IgG к H. pylori установлена прямая корреляционная связь средней силы (ρ=0,519, p <0,001).
6. Лица старше 45 лет являются группой риска инфицирования Н. pylori, демонстрируя статистически значимые отличия по средним значениям титра антител IgG (EIU) к Н. pylori (Ме18–44=39, Ме45–59=72, Ме60–74=39, Ме>74=117; р <0,05).



