ВВЕДЕНИЕ
Согласно определению Всемирной гастроэнтерологической организации (World Gastroenterology Organisation, WGO), пробиотики – это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью организму-хозяину. Препараты на основе пробиотических штаммов рекомендованы к применению для регулирования состава кишечной микробиоты вследствие их антагонистической активности к патогенным микроорганизмам, а также для нормализации процесса переваривания пищи [1, 2].
Основными пробиотиками являются широко изученные молочнокислые бактерии рода Lactobacillus (L.) и Bifidobacterium (B.), которые входят в состав нормальной микробиоты кишечника человека. Комбинация пробиотических штаммов L. acidophilus LA-5 и B. animalis subsp. lactis ВB-12 широко используется в качестве вспомогательной терапии для улучшения пищеварения, облегчения запоров и нормализации микрофлоры кишечника при диарее различного генеза, в том числе при антибиотик-ассоциированной диарее (ААД) и эрадикационной терапии Helicobacter pylori (H. pylori) [1–3].
В настоящее время изучается возможность применения комбинации штаммов LA-5 и BB-12 для профилактики и лечения иных нозологий: синдрома раздраженного кишечника, инфекционных заболеваний, атопического дерматита, бронхиальной астмы, аллергических реакций и др. [1–3]. Тем не менее эффективность пробиотиков, в том числе включающих штаммы LA-5 и BB-12, при профилактике ААД и эрадикационной терапии остается предметом дискуссии.
Цель настоящей работы – провести метаанализ рандомизированных контролируемых исследований (РКИ), посвященных эффективности применения комбинации LA-5 и ВВ-12, в том числе в составе других пробиотиков, для профилактики ААД, а также в схемах эрадикации H. pylori.
МАТЕРИАЛ И МЕТОДЫ
Поисковая стратегия
В рамках исследования проводился систематический поиск публикаций в базе PubMed (MEDLINE), а также в списках литературы статей по соответствующей тематике. В анализ были включены статьи, опубликованные с 1 января 2000 г. по 31 декабря 2022 г.
Для выявления всех исследований эффективности пробиотиков, включающих штаммы LA-5 и BB-12, при ААД и инфицировании H. pylori первоначальный поиск в базе данных PubMed был выполнен по запросу: probiotics [All Fields] OR probiotic [All Fields] OR probiotic bacteria [All Fields] OR multistrain probiotic [All Fields] OR (Lactobacillus [All Fields] OR La 5 [All Fields]) OR (Bifidobacterium [All Fields] OR Bb 12 [All Fields]) AND (diarrhea [All Fields] OR antibiotic-associated diarrhea [All Fields]) OR (Helicobacter pylori [All Fields] OR H pylori [All Fields] OR eradication [All Fields]).
Отбор публикаций, оценка качества исследований и пригодности для включения в систематический обзор осуществлялись двумя независимыми экспертами.
Критерии включения
Первоначально были идентифицированы публикации, содержавшие информацию о рандомизированных плацебо-контролируемых исследованиях применения комбинации LA-5 и ВВ-12, в том числе в составе других пробиотиков, при диарее, ААД или в схемах эрадикационной терапии независимо от лекарственной формы (носителя), включая исследования с кисломолочными продуктами. Для первичного анализа были отобраны РКИ, где сообщалось об эффективности пробиотиков, включающих LA-5 и BB-12, в том числе в комбинации с другими пробиотическими штаммами, для профилактики ААД и в ходе эрадикационной терапии H. pylori (рис. 1).
При выполнении настоящего метаанализа авторы руководствовались рекомендациями по подготовке публикаций систематических обзоров и метаанализов PRISMA [4].
Статистический анализ
Метаанализ проводился с использованием программного обеспечения RevMan 5.4.1. (Cochrane). Относительные риски (ОР, risk ratio) и отношения шансов (ОШ, odds ratio) для первичных исходов вместе с соответствующими 95% доверительными интервалами (ДИ, confidence interval) были рассчитаны при помощи модели со случайными эффектами. В частности, с целью оценки ОР был применен метод DerSimonian-Laird, подходящий для учета межисследовательской вариабельности, а также было представлено значение тау-квадрат (τ²) как меры гетерогенности между включенными исследованиями.
Выбор меры ассоциации для метаанализа был обоснован характером исходных данных и ожидаемым распределением событий. ОР применялся для оценки риска развития ААД из-за его прямой интерпретируемости в контексте клинической значимости исхода. В то же время ОШ использовалось в метаанализе исходов эрадикации H. pylori, что обусловлено его применимостью в исследованиях, где событие является редким, и ОШ хорошо аппроксимируется к ОР.
РЕЗУЛЬТАТЫ
Эффективность пробиотиков при антибиотик-ассоциированной диарее
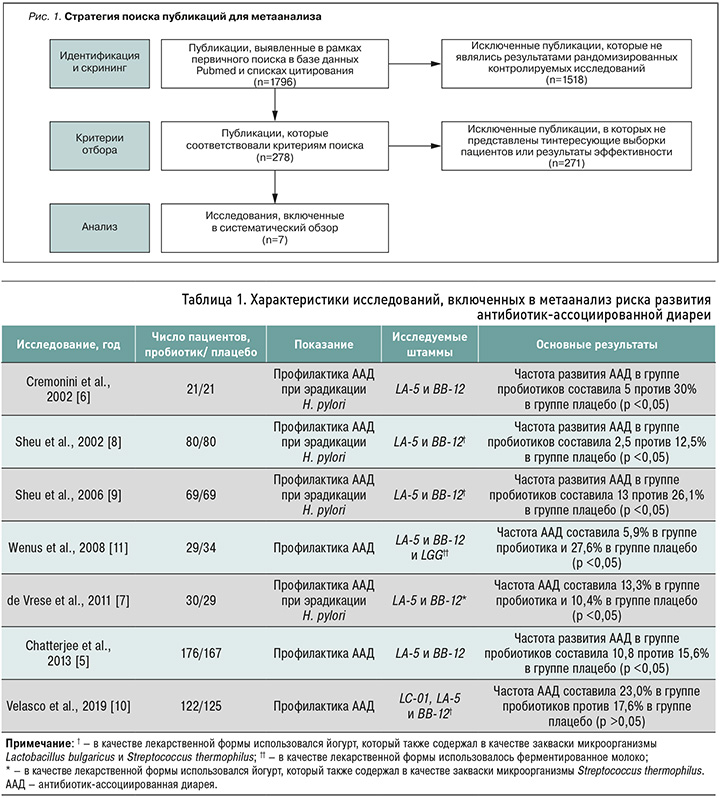
В ходе систематического поиска двумя экспертами независимо друг от друга было выявлено и проанализировано 278 публикаций. В обобщенный анализ вошли данные 7 исследований c участием 1052 пациентов (табл. 1), в которых оценивалась эффективность пробиотиков, содержащих в том числе комбинацию штаммов LA-5 и BB-12, для профилактики ААД и в схемах эрадикации H. pylori [5–11]. В двух исследованиях в состав пробиотика, помимо LA-5 и BB-12, входили штаммы L. rhamnosus LGG [6] и L. casei subsp. casei LC-01 [10].
При первичном анализе всех семи исследований, вошедших в метаанализ, было установлено, что риск ААД на фоне приема пробиотиков, включающих в том числе и комбинацию штаммов LA-5 и BB-12, снижается на 42% по сравнению с контрольными группами (ОР 0,58; 95% ДИ: 0,33–1,02; рис. 2). При этом различия не были статистически значимыми.
Во всех исследованиях у пациентов с ААД наблюдалась хорошая переносимость пробиотических препаратов без возникновения серьезных нежелательных явлений (НЯ), требующих отмены приема препарата. Учитывая высокий уровень гетерогенности (I2=59%) результатов РКИ, а также отсутствие статистически значимых различий (p=0,06), в данном контексте невозможно сделать однозначный вывод о сравнительной эффективности пробиотика и плацебо.
Согласно анализу результатов исследований, где использовались пробиотики, включающие комбинацию LA-5 и BB-12 с другими штаммами [10, 11], в случае их приема различия по сравнению с результатами в группах плацебо не были статистически значимыми (p >0,05) на фоне высокой гетерогенности результатов. Однако при рассмотрении результатов исследований с применением в качестве пробиотиков только комбинации LA-5 и BB-12 было обнаружено снижение риска ААД на 46% (ОР 0,54; 95% ДИ: 0,33–0,91; p=0,002; I2 <50%). Возможные пробиотические эффекты закваски йогуртов нивелировались приемом сопоставимого по составу плацебо.
Эффективность и безопасность комбинации LA-5 и BB-12 при эрадикации H. pylori
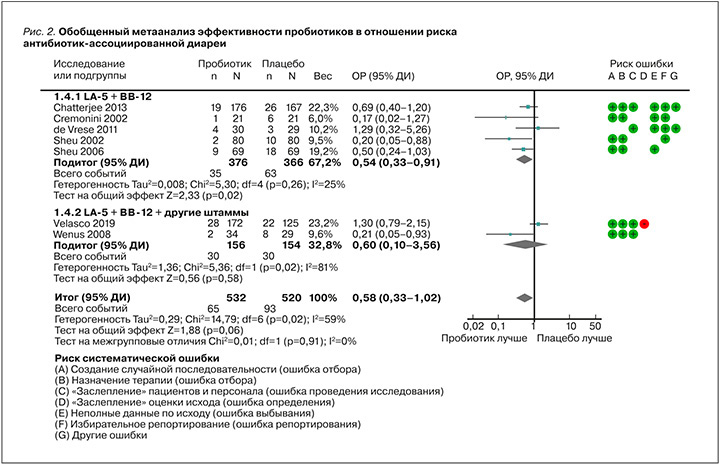
В таблице 2 представлены характеристики и ключевые результаты исследований, включенных в метаанализ эффективности пробиотиков с LA-5 и BB-12 в составе эрадикационной терапии.
В исследовании de Vrese et al. (2011) [7] оценка ОШ не представлялась возможной из-за отсутствия вариабельности эффекта. Согласно рекомендациям Кохрановского сотрудничества, включение подобных исследований в метаанализ не рекомендуется [12]. Пригодными для анализа были результаты трех исследований, в которых изучались эффекты добавления комбинации пробиотических штаммов LA-5 и BB-12 к схемам эрадикационной терапии или до начала эрадикации. В них оценивались как показатели эффективности эрадикации H. pylori, так и НЯ, ассоциированные с эрадикационной терапией, в том числе диарея [6, 8, 9].
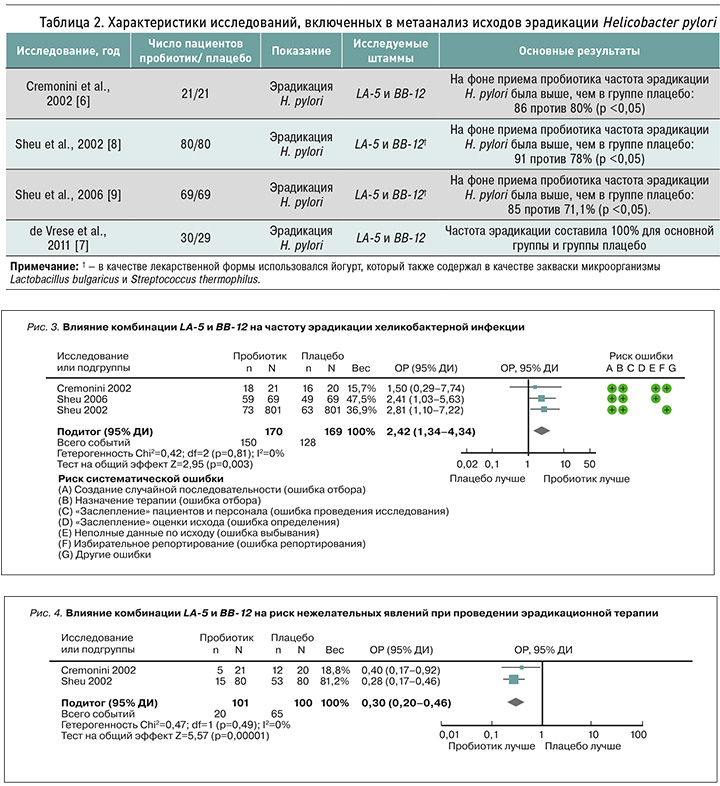
Применение комбинации LA-5 и BB-12 приводило к статистически значимому увеличению шансов на успешную эрадикацию H. pylori: ОШ 2,42; 95% ДИ: 1,34–4,34; p=0,003; I2 <50% (рис. 3). Следует отметить, что при распространенном событии точечная оценка ОШ может неточно отражать изменение вероятности, поэтому для более точного понимания влияния на риск такого события необходимо рассматривать этот параметр в контексте широкого спектра возможных оценок риска, представленных ДИ.
Об общей частоте НЯ на фоне эрадикационной терапии сообщалось в двух исследованиях – Cremonini F. et al. [6] и Sheu B.S. et al. [8]. Согласно результатам анализа (рис. 4), при использовании комбинации штаммов LA-5 и BB-12 риск развития любых НЯ оказался на 70% ниже, чем в контрольных группах (ОР 0,30; 95% ДИ: 0,2–0,46, p <0,00001; I2 <50).
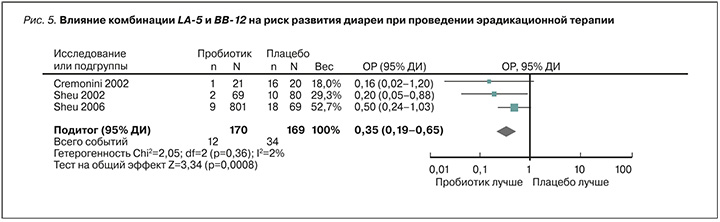
Кроме того, анализ результатов трех РКИ, в которых сообщалось о частоте диареи (рис. 5) [6, 8, 9], позволил установить, что прием пробиотических штаммов LA-5 и BB-12 в дополнение к схемам эрадикационной терапии ассоциировалось со снижением риска диареи на 65% (ОР 0,35; 95% ДИ: 0,19–0,65; p=0,00008) [6, 8, 9].
ОБСУЖДЕНИЕ
Назначение антибиотиков ассоциируется с высокой распространенностью НЯ в желудочно-кишечном тракте, в том числе с ААД, вызываемой нарушениями качественного и количественного состава нормальной кишечной микробиоты [13–15]. По разным оценкам, с желудочно-кишечными симптомами во время антибиотикотерапии сталкивается до 35% пациентов, что, несомненно, снижает приверженность терапии и приводит к отказу от лечения [16–18].
Соблюдение сроков антибиотикотерапии является важнейшим аспектом профилактики формирования и распространения антибиотикорезистентности: нарушение режима и длительности дозирования на фоне НЯ может оказывать негативное влияние на экспозицию патогенных и условно, патогенных микроорганизмов, препятствуя полной элиминации патогена [19]. В связи с вышесказанным особенно остро стоит вопрос о профилактике ААД в целях повышения комплаентности терапии основного заболевания и профилактики распространения антибиотикорезистентности.
Данные последних исследований демонстрируют, что пробиотики, принимаемые одновременно с антибактериальной терапией, приводят к снижению частоты развития ААД, а также уменьшают выраженность и длительность ее симптомов. Кроме того, целесообразность сопутствующего приема ряда пробиотических штаммов в качестве профилактики диареи при антибиотикотерапии на данный момент уже оговорено в нескольких клинических руководствах [1, 2, 20, 21].
Результаты настоящего метаанализа также подтверждают эффективность пробиотиков для профилактики ААД. В большинстве проанализированных исследований наблюдалась высокая эффективность пробиотических штаммов в отношении частоты возникновения, выраженности и длительности диареи по сравнению с плацебо, при этом терапия хорошо переносилась пациентами. Риск развития ААД на фоне приема комбинации пробиотиков LA-5 и BB-12 снижался на 46% по сравнению с плацебо. Эти результаты свидетельствуют о потенциальной пользе назначения комбинации пробиотических штаммов LA-5 и BB-12 в дополнение к антибактериальной терапии. Данные ранее опубликованных исследований показывают, что применение пробиотиков для профилактики ААД достоверно более эффективно, если пробиотики назначают как можно раньше, с момента приема первой дозы антибиотика [22, 23].
Необходимо отметить, что в ряде включенных в метаанализ исследований в качестве лекарственной формы (носителя) использовались кисломолочные продукты, которые исходно содержали микроорганизмы в качестве закваски [7–9, 11]. При этом пациенты из групп плацебо получали такой же кисломолочный продукт, только без добавления изучаемых штаммов, что позволяет исключить возможные пробиотические эффекты заквасочных микроорганизмов в основной группе.
У пациентов с инфекцией H. pylori эффективность пробиотика в отношении диареи была еще более выраженной: риск этого побочного явления при добавлении пробиотиков LA-5 и BB-12 к схемам эрадикационной терапии снижался на 65% по сравнению с плацебо. Вероятность развития НЯ в группе пробиотика была ниже на 70% по сравнению с плацебо. Применение комбинации LA-5 и BB-12 приводило к статистически значимому увеличению шансов на успешную эрадикацию H. pylori. Этот результат оказался сопоставим с данными ранее опубликованных метаанализов, проведенных по схожей методологии, в которые были включены те же группы пробиотических микроорганизмов. Так, в метаанализе Tong J.L. et al. (2007) ОШ эрадикации при терапии пробиотиками составило 1,84 [24], в исследовании Li S. et al. (2014) – 1,96 [25], в анализе Lu M. et al. (2016) – 1,15 [26], Shi X. et al. (2019) – 1,14 [27], Wang Z.H. et al. (2013) – 2,07 [28]. Стоит отметить, что из 10 исследований, использованных в метаанализе Wang Z.H. et al., результаты двух РКИ были включены и в проведенный нами анализ [8, 9]. Рассчитанные значения ОШ эрадикации H. pylori в метаанализе Wang Z.H. et al. соответствуют приведенным нами данным.
ЗАКЛЮЧЕНИЕ
В связи с достаточно высокой эффективностью комбинации пробиотических штаммов LA-5 и BB-12 в отношении ААД и эрадикации H. pylori содержащие их препараты могут быть рассмотрены в качестве дополнения к основной антибактериальной или эрадикационной терапии для профилактики развития ААД, снижения частоты НЯ, повышения эффективности эрадикации. Прием препаратов, содержащих комбинацию пробиотических штаммов LA-5 и BB-12, одновременно с антибиотиками позволит улучшить качество жизни пациентов с желудочно-кишечными и другими инфекционными заболеваниями, а также будет способствовать увеличению комплаентности основной терапии.
Дальнейшие клинические испытания с бо'льшим числом участников необходимы для того, чтобы подтвердить эффективность и безопасность пробиотика, включающего комбинацию LA-5 и BB-12, при диарее, а также расширить список показаний для применения этих пробиотических штаммов.
Номер одобрения: RU2312266493



