ВВЕДЕНИЕ
Холестероз желчного пузыря (ХЖП) относится к гиперпластическим холецистозам и в настоящее время рассматривается в рамках липидассоциированных заболеваний. В основе ХЖП лежит диффузное или очаговое накопление в его стенке липидов, преимущественно в виде свободного и этерефицированного холестерина, приводящее к изменению функции желчного пузыря, но не сопровождающееся воспалительным процессом [1]. С учетом обменного характера заболевания ХЖП чаще изучался у пациентов с избыточной массой тела и ожирением, имевших на момент его диагностики метаболические нарушения. Тем не менее у пациентов с нормальным весом, без значимых изменений в жировом обмене также нередко встречается это заболевание, что диктует необходимость изучения клинико-диагностических особенностей ХЖП в данной когорте и провести сравнительный анализ этих характеристик с группой пациентов, имеющих избыточную массу тела.
Цель исследования – оценить клинико-метаболические особенности больных ХЖП с нормальной и избыточной массой тела.
МАТЕРИАЛ И МЕТОДЫ
Проведено открытое одномоментное сравнительное исследование, в которое были включены 100 пациентов с верифицированным ХЖП, сформировавшие основную (опытную) группу. Все участники основной группы были разделены на две подгруппы по индексу массы тела (ИМТ), рассчитанному согласно формуле Кетле. Подгруппу 1 составили 54 человека с нормальным весом (ИМТ 18–24,9 кг/м²) – 23 мужчины (средний возраст 35,0±8,7 лет) и 31 женщина (44,0±13,9 года). В подгруппу 2 вошли 46 человек с избыточным весом (ИМТ 25–29,9 кг/м²) – 24 мужчины (средний возраст 41,0±10,5 год) и 22 женщины (52,0±12,9 года). Медиана возраста в подгруппах 1 и 2 равнялась 39 и 46 годам соответственно.
Контрольную группу образовали 30 пациентов без патологии желчного пузыря с верифицированным диагнозом «гастроэзофагеальная рефлюксная болезнь (ГЭРБ)». Они были также разделены на 2 подгруппы в зависимости от значений ИМТ: подгруппа 1А – 15 человек с нормальной массой тела, среди которых 4 мужчины (средний возраст 37,2±7,56 лет) и 11 женщин (37,0±10,7 лет); подгруппа 1Б – 15 человек с избыточной массой тела, в том числе 7 мужчин (средний возраст 45,4±11,7 лет) и 8 женщин (56,5±15,3 лет).
Критерии включения в исследование (основная группа):
- пациенты с диагнозом «холестероз желчного пузыря» в возрасте 18 лет и старше;
- наличие информированного добровольного согласия на участие в исследовании.
Критерии невключения в исследование (основная группа):
- беременность, лактация;
- наличие онкологического заболевания в настоящее время;
- доброкачественные опухоли желчного пузыря;
- хронические гепатиты различной этиологии: вирусные, аутоиммунные, лекарственные, гепатиты в рамках болезней накопления и наследственных заболеваний, исключая метаболическую жировую болезнь печени;
- прием лекарственных препаратов из группы статинов и фибратов до включения в исследование;
- острые инфекционные заболевания;
- прием лекарственных препаратов на момент обследования, влияющих на моторную функцию желчного пузыря на момент обследования;
- ожирение;
- наличие аутоиммунного ревматологического заболевания;
- отсутствие информированного добровольного согласия на участие в исследование.
Критерии включения пациентов в контрольную группу:
- возраст от 18 лет и старше;
- отсутствие патологии желчного пузыря;
- наличие ГЭРБ, подтвержденной клинически и эндоскопически.
Критерии невключения пациентов в контрольную группу были такими же, как и у основной группы.
По данным ультразвукового исследования (УЗИ) органов брюшной полости на аппарате SIUI Apogee (Китай) конвексным датчиком с частотой 2–4 MHz в B-режиме с применением функции цветового допплеровского картирования, у пациентов подгруппы 1 (нормальная масса тела) основной группы были выделены следующие формы ХЖП: полипозная (n=47; 87%), сетчато-полипозная (n=4; 7,4%), диффузно-сетчатая (n=3; 5,5%). В подгруппе 2 (избыточная масса тела) основной группы частота встречаемости тех же форм заболевания составила 28 (61%), 14 (30,4%) и 4 (8,6%) случая соответственно.
У всех пациентов был проведен сбор жалоб, анамнеза, выполнены осмотр врачом-гастроэнтерологом и анкетирование. Помимо стандартного общеклинического обследования, которое включало общий и биохимический анализ крови, в рамках исследования оценивались показатели липидного спектра с определением уровней общего холестерина (ОХС), липопротеидов высокой (ЛПВП) и низкой плотности (ЛПНП), триглицеридов (ТГ), липопротеидов очень низкой плотности (ЛПОНП) и индекса атерогенности.
Также всем пациентам проводилось триплексное УЗИ брахиоцефальных сосудов (БЦА) на аппарате SIUI Apogee линейным датчиком с частотой 6,0– 7,5 MHz в B-режиме с применением цветового допплеровского и импульсно-волнового картирования с измерением толщины комплекса интимамедиа (КИМ) в общей сонной артерии полуавтоматическим методом. Для определения уровня субклинического системного воспаления исследовалась сыворотка крови на уровень ультрачувствительного С-реактивного белка (СРБ-уч) методом иммунохемилюминесценции. Осуществлялось скрининговое обследование пациентов на инфекцию H. pylori посредством определения уровня антител IgG к этой бактерии иммуноферментным методом. У лиц без предшествующей терапии ингибиторами протоновой помпы, антибактериальными препаратами и гастропротекторами определялся антиген H. pylori в кале методом полимеразной цепной реакции (ПЦР). Больным с диспепсическими жалобами и болями в верхних отделах живота проводилось фиброгастродуоденоскопическое исследование.
Сократительная функция желчного пузыря оценивалась при помощи УЗИ этого органа с применением 20% раствора сорбита в качестве желчегонного завтрака. Исходный объем желчного пузыря и коэффициент его сокращения определялись через 60 мин после употребления 100 мл 20% сорбита по методике А.А. Ильченко [2].
В контрольной группе обследование выполнялось в том же объеме, что и в основной. Помимо этого, для установления диагноза ГЭРБ всем пациентам было сделано эндоскопическое исследование верхних отделов желудочно-кишечного тракта.
Данные были статистически обработаны и представлены в виде M±σ, где М – среднее арифметическое, а σ – стандартное квадратичное отклонение. Оценка достоверности различий показателей и средних величин осуществлялась с использованием параметрического критерия Стьюдента (t) для нормального распределения данных; различия считались достоверными при p <0,05. В отсутствие нормального распределения признака применялся непараметрический U-критерий Манна–Уитни. Для оценки связи явлений использовался корреляционный анализ с расчетом критерия Пирсона, проводился анализ четырехпольных таблиц сопряженности для независимых выборок.
РЕЗУЛЬТАТЫ
Клиническая картина у большинства пациентов характеризовалась наличием диспепсического и болевого синдромов, которые отражали не только билиарную дисфункцию, но и характер сопутствующей патологии. Наиболее часто пациенты основной группы исследования предъявляли жалобы на болевой синдром в эпигастральной области, связанный с приемом пищи: 37% – в подгруппе 1 (нормальная масса тела) и 43% – в подгруппе 2 (избыточная масса тела). Это можно объяснить сопутствующей патологией желудка и двенадцатиперстной кишки, ассоциированной у части больных с H. pylori и хроническим панкреатитом. На боли в правом подреберье и в точке желчного пузыря через 1–1,5 ч после еды обращала внимание примерно одинаковая доля пациентов в обеих подгруппах основной группы – 33 и 30%. Горечь во рту по утрам и после еды чаще беспокоила пациентов с нормальным весом (33%), чем с избыточным (19,5%). Обращает на себя внимание частое обнаружение синдрома кишечной диспепсии в обеих подгруппах. Так, нарушение стула (запоры, диарея, частый кашицеобразный стул) выявлялось у 33% пациентов в подгруппе 1 и у 47,8% – в подгруппе 2. Кроме того, 65% пациентов с избыточной массой тела и 40% больных с нормальным весом указывали на вздутие живота, метеоризм и выраженную флатуленцию, что, вероятно, обусловлено, синдромом избыточного бактериального роста в кишечнике и признаками билиарной недостаточности. Признаки астеновегетативного синдрома отмечали у себя 22% пациентов подгруппы 1 и только 8,6% пациентов из подгруппы 2.

У всех пациентов учитывались сопутствующие заболевания (табл. 1). Поражение верхних отделов желудочно-кишечного тракта (хронический гастрит, дуоденит, ГЭРБ) чаще обнаруживались у пациентов в подгруппе 2, причем у них преобладали эрозивные изменения гастродуоденальной зоны. Язвенное поражение желудка и двенадцатиперстной кишки носило хронический характер и встречалось только в 9,2% случаев в подгруппе 1 и в 8,6% в подгруппе 2. Хронический вторичный билиарнозависимый панкреатит с преобладанием болевой формы был установлен у 37% пациентов с избыточной массой тела и у 20,3% с нормальным весом, что свидетельствует о значимой роли патологии желчного пузыря, в частности ХЖП, в развитии хронического панкреатита. Отметим также бóльшую долю в подгруппе 2 пациентов с атерогенной дислипидемией, которая представлена так называемой липидной триадой – снижением ЛПВП, гипертриглециридемией и повышением уровня ЛПНП. Данные изменения коррелируют с частой встречаемостью метаболической жировой болезни печени в этой подгруппе больных (34,7%), тогда как в подгруппе 1 таких пациентов выявлено не было. Объем талии как маркер абдоминального ожирения также был достоверно выше в подгруппе 2 – 90,34±6,4 против 73,6±7,52 см в подгруппе 1 (р=0,0). Кроме того, пациенты с избыточной массой тела чаще страдали гипертонической болезнью, что требовало назначения антигипертензивной терапии. Гиперурикемия, которая устанавливалась при превышении сывороточного уровня мочевой кислоты уровня в 360 мкмоль/л, тоже чаще регистрировалась в подгруппе 2 (22%), чем в подгруппе 1 (11%). Средний уровень мочевой кислоты составил 403±13,36 мкмоль/л в подгруппе 2 и 387±10,8 мкмоль/л в подгруппе 1, но эти различия были статистически не значимы (р=0,36).
Результаты общего клинического анализа крови (ОАК) пациентов отражены в таблице 2. В обеих подгруппах основной группы показатели ОАК находились в пределах нормы, однако у больных с избыточным весом были достоверно более высокие показатели уровня лейкоцитов и скорости оседания эритроцитов по сравнению с пациентами, имевшими нормальную массу тела.

Несмотря на то что при исследовании показателей липидного спектра в подгруппе пациентов с избыточной массой тела были выявлены более высокие показатели ОХС и ЛПНП, разница по этим параметрам между подгруппами была статистически не значима, в отличие от уровней ЛПВП, триглицеридов, ЛПОНП и индекса атерогенности (табл. 3).
Средние значения основных показателей биохимического анализа крови не выходили за пределы референсных норм в обеих подгруппах основной группы (табл. 4). В то же время заслуживают внимания достоверно более высокие уровни гамма-глютамилтранспептидазы и аланинаминотрансферазы среди пациентов с избыточным весом, что, вероятно, обусловлено наличием у них сопутствующей метаболической болезни печени. Также в подгруппе 2 отмечались статистически значимо более высокие показатели креатинина по сравнению подгруппой 1 (р=0,03); это, по-видимому, связано с более частой встречаемостью гипертонической болезни, гиперурикемией и развитием хронической болезни почек у больных с избыточной массой тела.
По результатам серологического исследования была выявлена высокая инфицированность инфекцией H. pylori пациентов в обеих подгруппах основной группы (68 и 76%). Средний уровень титра антител IgG в подгруппе 2 оказался достоверно выше, чем в подгруппе 1: 6,94±9,48 против 4,4±6,99 МЕ/л (Uэмп=977, Uкрит=1003; p ≤0,05).
При уточнении анамнеза на факт эрадикационной терапии указывали 42,5% пациентов из подгруппы 1 и 58,7% из подгруппы 2. На наличие антигена H. pylori в кале были обследованы 30 пациентов в подгруппе 1 (55,5%) и 29 – в подгруппе 2 (63%). Положительный результат чаще выявлялся у пациентов с избыточной массой тела (34%), чем у больных с нормальным весом (20%).
В подгруппе пациентов с ХЖП, имевших нормальный вес, при проведении корреляционного анализа была обнаружена статистически значимая связь между значениями индекса атерогенности и уровнем антител IgG к H. pylori (r=0,282, p <0,05), тогда как в подгруппе 2 такая связь установлена не была (r=0,025, p <0,1).
При оценке показателей инфицированности хеликобактериозом в подгруппе 1 больных ХЖП были выявлены достоверно более высокие показатели уровня антител IgG к H. pylori по сравнению с пациентами контрольной группы c нормальным весом (p=0,002 при α=0,05). У пациентов основной группы с избыточным весом аналогичные различия с контролем были недостоверны (p=2,0 при α=0,05). Кроме того, при анализе таблиц сопряженности между подгруппой 1 пациентов с ХЖП и контрольной группой с нормальным весом была обнаружена связь между инфицированием H. pylori и развитием ХЖП (�²=4,436, р=0,036). Для пациентов основной группы с избыточным весом аналогичная связь выявлена не была (�²=1,1 р=0,291). При исследовании БЦА средний показатель толщины КИМ составил 0,67±0,1 мм в подгруппе 1 и 0,79±0,23 мм в подгруппе 2, различия в показателях были статистически достоверны (p=0,00025). Кроме того, у пациентов с ХЖП и избыточным весом чаще выявлялись атеросклеротические бляшки в брахиоцефальных сосудах – 13 (28,3%) случаев против 8 (14,8%) в подгруппе 1. Средние показатели стеноза сосудов в подгруппе 1 были равны 14,8±11,7%, в подгруппе 2 – 19,9±9,8%, но эти различия были статистически не значимы (p=0,27;). При проведении корреляционного анализа была установлена статистически значимая связь между толщиной КИМ и уровнем ЛПНП в подгруппе пациентов с избыточной массой тела (r=0,44, p <0,01), тогда как в подгруппе с нормальным весом такой связи обнаружено не было (r=0,20, p >0,1).
В подгруппе 2 основной группы исследования уровень СРБ-уч (маркера субклинического воспаления) составил 2,31±2,67 мг/л, что оказалось достоверно выше, чем в подгруппе 1 – 0,78±0,93 мг/л (р=0,0003). Напомним, что нормальные показатели СРБ-уч находятся в пределах 0–1 мг/л. При выполнении корреляционного анализа была выявлена значимая прямая связь между толщиной КИМ и уровнем СРБ-уч в подгруппе пациентов с избыточной массой тела (r–0,28, p=0,05).
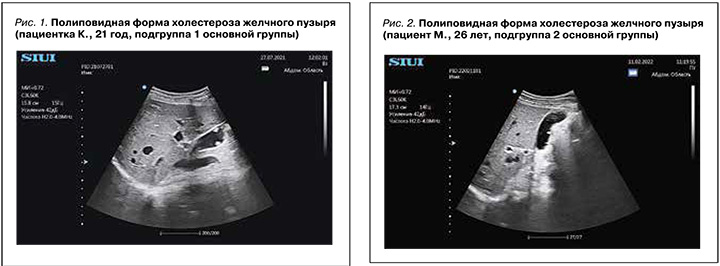
При УЗИ желчного пузыря в обеих подгруппах основной группы холестериновые полипы визуализировались как пристеночные округлые образования, не смещаемые при перемене положения тела пациентов, без локусов кровотока при допплеровском картировании (рис. 1 и 2). Средний диаметр полипов в подгруппе 1 составил 3,5±1,36мм, в подгруппе 2 – 3,41±0,28 мм (р=0,82). Практически все полипы в обеих подгруппах были гиперэхогенными (90,2 и 97,6%). Доля пациентов с одиночными и множественными полипами оказалась примерно одинаковой в обеих подгруппах (47 и 52%). Одиночные полипы чаще локализовались на задней стенке желчного пузыря, множественные визуализировались во всех отделах этого органа. Диффузно-сетчатая форма ХЖП визуализировалась в виде неровного контура стенки желчного пузыря, инфильтрированного множественными гиперэхогенными точечными и линейными включениями. Толщина стенки желчного пузыря при всех формах ХЖП оставалась в пределах нормальных значений, что еще раз подтверждает обменный, а не бактериальный генез этого заболевания. При исследовании сократительной функции желчного пузыря обращали на себя внимание практически одинаковые показатели коэффициента выброса желчи через 60 мин после приема 20% раствора сорбита – 46,6±18,7 и 46,89±18,8% в подгруппах 1 и 2 соответственно (p=0,93), при нормальных значениях этого параметра от 50 до 75%; это указывает на сниженную моторную функцию желчного пузыря в обеих подгруппах основной группы независимо от массы тела. В контрольной группе в подгруппе пациентов с нормальным весом (1А) коэффициент выброса желчи составил 53,36±19,07%, в подгруппе с избыточным весом (1Б) – 54,57±13,35%, при этом статистическая разница с аналогичными подгруппами основной группы исследования была незначимой (p=1,21 и p=1,7 соответственно).
ОБСУЖДЕНИЕ
В клинической картине у пациентов с ХЖП преобладает синдром кишечной диспепсии, который, вероятно, обусловлен билиарной недостаточностью и развитием синдрома избыточного бактериального роста в тонкой и толстой кишке, что связано со сниженной сократительной функцией желчного пузыря как при избыточной, так и нормальной массой тела. Действительно, на снижение фракции выброса желчи при УЗИ указывают многие авторы [3, 4], что является значимым фактором в патогенезе развития любой формы ХЖП и приводит к возникновению болевого синдрома в правом подреберье; в нашем исследовании такую жалобу предъявляла треть пациентов основной группы независимо от массы тела.
Болевой синдром в верхних отделах живота обусловлен чаще всего хроническим гастритом, дуоденитом, хроническим панкреатитом. Он оценивался нами в рамках диагностики и лечения сопутствующей патологии желудочно-кишечного тракта у пациентов с ХЖП. Отдельно стоит выделить такой симптом билиарной дисфункции, как горечь во рту, на который указывал каждый третий пациент с ХЖП в подгруппе с нормальным весом. Напротив, астеновегетативный синдром был не столь характерен для больных ХЖП.
Следует также отметить высокую инфицированность H. pylori в обеих подгруппах исследованных пациентов с ХЖП. Роль этого патогена в развитии различной патологии билиарной системы (желчнокаменной болезни, хронического холецистита, неалкогольной жировой болезни печени) обсуждается учеными уже длительное время, но на сегодняшний день пока нет исследований, которые бы связывали развитие ХЖП с инфицированием H. pylori. В нашем исследовании при анализе показателей инфицированности H. pylori возможная прямая связь этого параметра с развитием ХЖП была установлена только для пациентов с нормальной массой тела. В подгруппе пациентов с избыточной массой тела, несмотря на довольно высокую зараженность H. pylori в настоящее время и в анамнезе, патологический процесс в стенке желчного пузыря, вероятно, реализуется через другие патологические механизмы, а именно через развитие атерогенной дислипидемии. Этот постулат подтверждается выявлением в подгруппе пациентов с ХЖП и избыточным весом повышенного уровня СРБ-уч, который служит суррогатным маркером субклинического воспаления в стенке сосудов, а также статистически значимой связью уровня СРБ-уч с толщиной КИМ в данной подгруппе больных. Кроме того, только в подгруппе пациентов с ХЖП и избыточным весом была выявлена значимая ассоциация между уровнем ЛПНП как наиболее атерогенной группы липидов и толщиной КИМ. На важность изучения уровня СРБ-уч при наличии ХЖП указывает тот факт, что в подгруппе 2 основной группы значительно чаще обнаруживались атеросклеротические бляшки в БЦА. Это еще раз доказывает связь между субклиническим системным воспалением, атерогенной дислипидемией и развитием атеросклеротических изменений в сосудах шеи.
Принимая во внимание, что среди пациентов с ХЖП и нормальным весом, как правило, не выявляются атерогенная дислипидемия и признаки субклинического воспаления, возможен вариант прямого повреждающего действия H. pylori на стенку желчного пузыря через систему провоспалительных цитокинов с развитием патологических изменений (инфильтрация липидами, образование холестериновых полипов). В свою очередь, снижение сократительной функции желчного пузыря поддерживает патологический процесс в этом органе, способствуя формированию билиарного сладжа и повторному отложению липидов в стенку желчного пузыря. Поскольку есть научные работы, подтверждающие наличие ДНК H. pylori в стенке желчного пузыря при желчнокаменной болезни и хроническом холецистите [5, 6], такой механизм образования холестериновых полипов возможен и у пациентов с нормальной массой тела, однако этот вопрос требует дальнейшего изучения.
В настоящее время доказано, что ХЖП – одно из ранних манифестных проявлений липидного дистресс-синдрома, к которым также относятся такие заболевания, как облитерирующий атеросклероз артерий нижних конечностей и органов брюшной полости, липогенный панкреатит и жировой гепатоз [7]. Желчный пузырь, вероятно, является первым органом-мишенью липидного дистресссиндрома у восприимчивых лиц, причем изменения по типу холестериновых полипов развиваются у пациентов с нормальной массой тела без значимых метаболических изменений на ранних стадиях заболевания. Подчеркнем и такой факт, как более частая встречаемость в нашем исследовании сетчато-полипозной формы ХЖП в подгруппе 2 основной группы, который отражает более интенсивное накопление липидов в стенке желчного пузыря и коррелирует с частым развитием атерогенной дислипидемии среди пациентов, имеющих избыточную массу тела, с преобладанием гипертриглицеридемии, повышением ЛПОНП и индекса атерогенности. Для лиц с нормальной массой тела не характерно развитие диффузно-сетчатой формы ХЖП, что отражает точечное накопление липидов в стенке желчного пузыря по типу одиночных или множественных холестериновых полипов.
Значимым отличием больных ХЖП и избыточным весом от пациентов с нормальной массой тела стало обнаружение у них признаков метаболической болезни печени по данным УЗИ и биохимического скрининга в трети случаев. При этом диагностировались как гепатоз, так и хронический стеатогепатит. Немаловажным видится и вклад инфекции H. pylori в развитие стеатогепатоза и стеатогепатита у пациентов с избыточным весом; в связи с этим следует указать на то, что роль хеликобактериоза доказана в развитии балонной дистрофии печени [8]. Наряду с этим не исключается повреждение стенки желчного пузыря посредством биологических эффектов цитокин-ассоциированного гена (Cag A) H. pylori, который не только непосредственно участвует в разрушении целостности эпителиального покрова слизистой оболочки желудка, но и вовлечен в секрецию провоспалительных цитокинов [9]. Отсутствие проявлений метаболической жировой болезни печени у пациентов в подгруппе с нормальной массой тела подтверждает отсутствие у них метаболических изменений и системного воспаления, что, в свою очередь, диктует необходимость разработки медицинских мероприятий для профилактики развития этих изменений в будущем.
ЗАКЛЮЧЕНИЕ
Обследование пациентов с ХЖП, имеющих нормальную и избыточную массу тела, позволило установить различные клинико-метаболические модели в этих подгруппах больных. Изучение особенностей данных моделей позволит в дальнейшем оценить факторы риска развития ХЖП в этих подгруппах и разработать лечебно-профилактические мероприятия по предупреждению развития патологических изменений не только в стенке желчного пузыря, но и на системном уровне.



