ВВЕДЕНИЕ
С внедрением в практику коронароангиографии появились данные об атеротромбозе коронарных артерий как достаточно частой причине инфаркта миокарда (ИМ) 1-го типа в молодом возрасте [1, 2]. В связи с этим представляется важным понимание механизмов столь ранней манифестации атеротромбоза, особенно при отсутствии моногенных форм наследственных гиперлипидемий.
Поскольку, наряду с атеросклерозом, формирование тромба является ключевым событием в развитии ИМ 1-го типа, может иметь значение изучение полиморфизмов генов, ассоциированных с артериальным тромбозом. Роль наследственных тромбофилий в развитии ИМ у молодых пациентов без атеросклеротического поражения сосудов считается доказанной [3, 4]. При этом интересен факт многократного увеличения вероятности ИМ, в частности у молодых женщин с генотипом 1691G/A (Лейденская мутация) гена фактора V свертывания крови (F5) или генотипом 20210G/А гена протромбина (F2) при наличии таких факторов риска развития и прогрессирования атеросклероза, как курение, артериальная гипертензия (АГ), ожирение, сахарный диабет [5–7].
Исследования, посвященные комплексному изучению факторов атеро- и тромбогенеза у молодых больных ИМ единичны. Известны данные о влиянии на развитие ИМ в молодом возрасте курения и гомозиготности по полиморфизму -426C>Т гена F5; наследственности с гомозиготностью по полиморфизму 1691G>A гена F5; сочетания курения с комбинацией полиморфизмов генов тромбоцитарных рецепторов к коллагену (ITGA2: 807C>T) и фибриногену (ITGB3: 1565T>C); наследственности в сочетании с гомозиготностью по полиморфизму гена метилентетрагидрофолатредуктазы (MTHFR); наследственности в комбинации с курением и гомозиготностью по полиморфизму гена MTHFR [8–10]. Другими авторами показан независимый вклад в раннее развитие ИМ только курения и дислипидемии при отсутствии значимости полиморфных маркеров генов фибриногена (FGB; -455G>A), фактора XIII свертывания крови (F13А1; V34L), ITGB3 (HPA1A/b), ингибитора активатора плазминогена типа 1 (PAI-1; -675 4G>5G) [11].
Следует отметить, что в указанных работах отсутствует четкое указание на тип ИМ. Тестовые панели были ограничены 2–5 генами гемостаза, а «молодой» возраст зачастую определялся в более широком диапазоне (18–55 лет), чем в действующей классификации Всемирной организации здравоохранения (25–44 лет).
Таким образом, комплексное изучение факторов риска атеросклероза, липидной компоненты и генетической тромбофилии при ИМ 1-го типа в возрасте 25–44 лет практически отсутствует. Между тем, подобное исследование улучшит понимание патофизиологии ИМ 1-го типа в молодом возрасте и позволит создать научную базу для своевременного выделения группы риска, оптимизации лечебно-профилактических мероприятий.
Цель исследования – изучить факторы риска атеросклероза, липидный профиль и формы генетических тромбофилий у больных ИМ 1-го типа в молодом возрасте.
МАТЕРИАЛ И МЕТОДЫ
Обследовано 102 больных ИМ 1-го типа (100 мужчин, 2 женщины) в возрасте 25–44 лет, находившихся на лечении в региональном сосудистом центре Ставропольской краевой клинической больницы – клинической базы Ставропольского государственного медицинского университета (ГМУ). Протокол исследования одобрен локальным этическим комитетом Ставропольского ГМУ.
Критерии включения: подписание информированного согласия на участие в исследовании; ИМ 1-го типа; мужчины и женщины в возрасте 25–44 лет славянской популяции, проживающие в Ставропольском крае; наличие липидограммы в остром периоде ИМ.
Критерии невключения: отсутствие коронароангиографии; ИМ 2–5-го типов; приобретенные тромбофилии (антифосфолипидный синдром, злокачественные новообразования, нефротический синдром, воспалительные и аутоиммунные заболевания, застойная сердечная недостаточность, дыхательная недостаточность, беременность, длительная иммобилизация, прием глюкокортикостероидов, химиотерапия); гипотиреоз; родство с пациентом, включенным в настоящее исследование.
Критерии исключения: отказ от участия на любом этапе исследования.
В связи с малым количеством женщин (n=2) в дальнейший анализ были включены только мужчины (медиана возраста 41,0 [38,0; 44,0] год).
Контрольную группу сформировали 100 мужчин (славяне) в возрасте 42–44 лет, проживающих в Ставропольском крае и подписавших информированное согласие на участие в исследовании. Критерии невключения: кардиоваскулярная и иная патология, за исключением заболеваний и состояний, являющихся факторами риска атеросклероза; родство с лицом, включенным в настоящее исследование. Критерии исключения: отказ от участия на любом этапе исследования; развитие ИМ после включения в исследование. Период наблюдения за мужчинами контрольной группы составил 1–2 года, тем самым, было соблюдено условие исключения развития ИМ до наступления 44 лет.
У 100% больных острый ИМ был первым проявлением ишемической болезни сердца (ИБС). Q-позитивный ИМ был отмечен в 72% случаев. При коронароангиографии у всех пациентов было верифицировано обструктивное поражение коронарных артерий: однососудистое – в 39% случаев, двухсосудистое – в 23% и многососудистое – в 38%.
Проводился анализ факторов риска атеросклероза: курение (вне зависимости от количества); АГ (артериальное давление ≥140/90 мм рт.ст. или постоянный прием антигипертензивных препаратов); сахарный диабет 2-го типа (глюкоза натощак >6,1 и 7,0 ммоль/л, капиллярная и венозная кровь соответственно); раннее начало ИБС у ближайших родственников (отягощенная наследственность – ИМ или нестабильная стенокардия у мужчин в возрасте <55 лет, у женщин <60 лет); семейная гиперлипидемия по данным анамнеза (IIа, IIb); абдоминальное ожирение (окружность талии ≥94 см); хроническое заболевание почек (снижение скорости клубочковой фильтрации <60 мл/ мин); ожирение (повышение индекса массы тела >25 кг/м2) [12]. Исследовались показатели липидного спектр кровиа: общий холестерин, липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды.
Генотипирование осуществлялось методом полимеразной цепной реакции (ПЦР) в соответствии с инструкцией к тест-системе «КардиоГенетикаТромбофилия» («ДНК-технология», Россия). Тестовая панель для генетического анализа включала 8 генов (по 1 полиморфизму) системы гемостаза: FGB (-455G>A); F2 (20210G>А); F5 (1691G>A); F7 (фактор VII свертывания крови: 10976G>А); F13А1 (103G>Т); PAI-1 (-675 5G>4G); ITGA2 (807С>Т); ITGB3 (1565T>С). Регистрация и учет результатов выполнялись на амплификаторе «ДТ-96» («ДНК-технология», Россия).
Статистический анализ проводился с помощью программы IBM SPSS Statistics 21.0. Качественные показатели описаны в виде абсолютного числа (n) или частоты выявления признака (%). Количественные данные с нормальным распределением представлены в виде среднего значения и стандартного отклонения (М±SD), при распределении, отличном от нормального, в виде медианы и интерквартильных интервалов – Ме (Q25; Q75). Для проверки нормальности распределения количественных признаков использовался критерий Колмогорова–Смирнова. Применялся критерий χ2 с поправкой на непрерывность (для выявления различий в частоте качественных признаков), t-критерий Стьюдента (для сравнения двух независимых выборок с нормальным распределением количественных признаков), критерий Манна–Уитни (для сравнения двух независимых выборок при отсутствии нормального распределения количественных признаков), логистический регрессионный анализ (многофакторный анализ). Различия считались значимыми при величине р <0,05.
РЕЗУЛЬТАТЫ
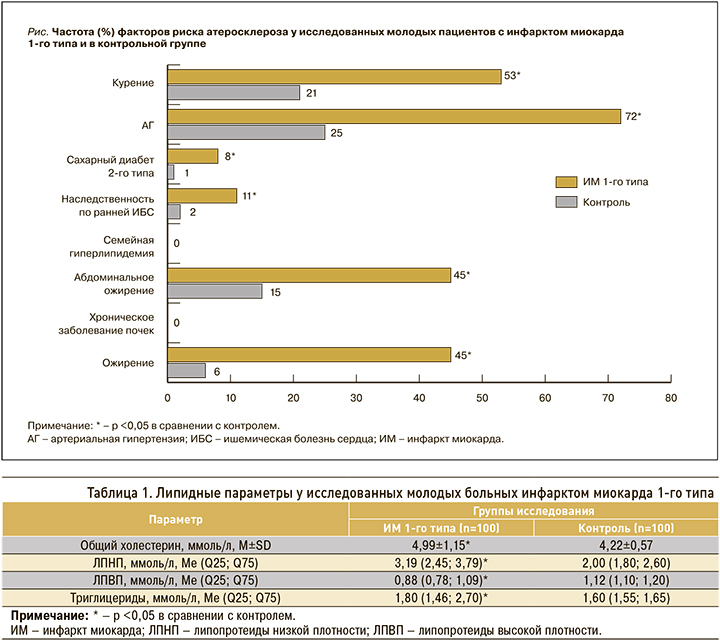
Наличие факторов риска атеросклероза было выявлено у 96% молодых мужчин с ИМ 1-го типа. Характеристика факторов риска атеросклероза и их частота представлены на рисунке.
У молодых больных ИМ 1-го типа по сравнению с контрольной группой частыми оказались курение (χ2=20,61; р <0,0001), АГ (χ2=42,36; р <0,0001), сахарный диабет 2-го типа (χ2=4,19; р=0,041), наследственность по ранней ИБС (χ2=5,27; р=0,022), абдоминальное ожирение (χ2=20,02; р <0,0001) и ожирение (χ2=38,01; р <0,0001).
Проатерогенная направленность липидного спектра в группе ИМ 1-го типа была обусловлена повышением общего холестерина, ЛПНП, триглицеридов и снижением ЛПВП (табл. 1). Гетерозиготная семейная гиперхолестеринемия, согласно Голландским диагностическим критериям [12], была верифицирована у 5% больных.
Особенности распределения генотипов генов системы гемостаза у молодых больных ИМ 1-го типа приведены в таблице 2.
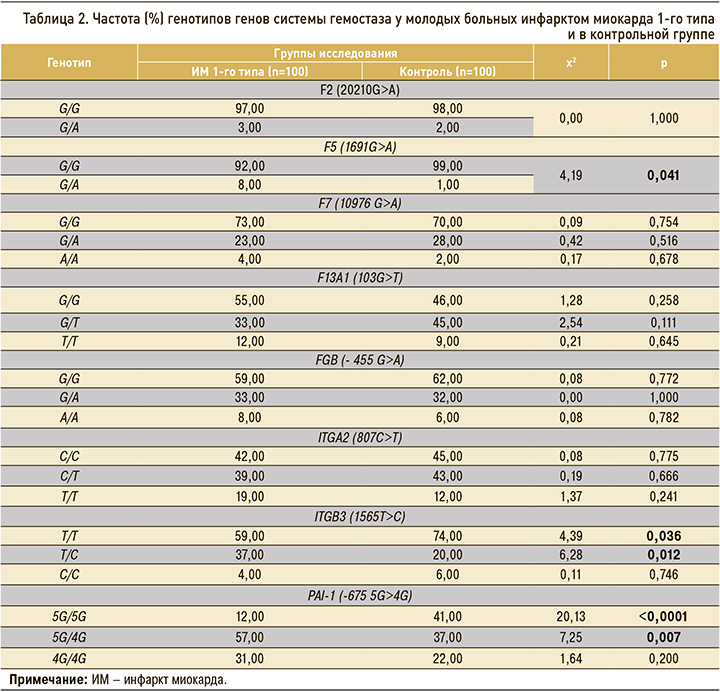
Ассоциированным с развитием ИМ 1-го типа в молодом возрасте оказались генотипы 1691G/A гена F5 (Лейденская мутация), 1565Т/С гена ITGB3 и -675 5G/4G гена PAI-1. Носительство «нормальных» генотипов 1691G/G гена F5, 1565Т/T гена ITGB3 и -675 5G/5G гена PAI-1 в группе ИМ 1-го типа, наоборот, регистрировалось реже, чем в контроле.
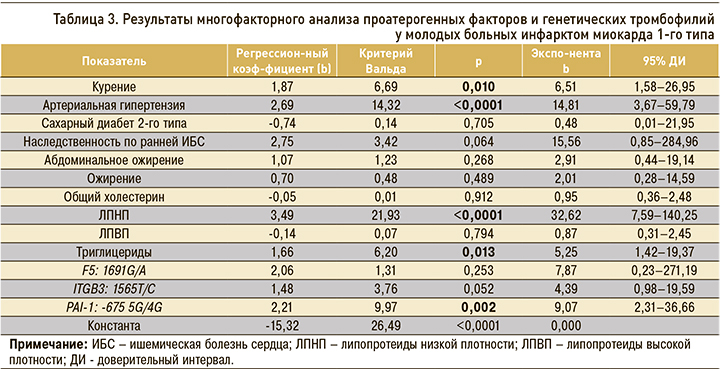
Для определения совокупности наиболее значимых факторов, ассоциированных с ИМ 1-го типа в молодом возрасте, проводился многофакторный регрессионный анализ. В математическую модель были включены 13 факторов (курение, АГ, сахарный диабет 2-го типа, наследственность по ранней ИБС, абдоминальное ожирение, ожирение, общий холестерин, ЛПНП, ЛПВП, триглицериды, гетерозиготные генотипы генов F5 (1691G/A), ITGB3 (1565Т/С), PAI-1 (-675 5G/4G)), показатели которых определяли значимые различия между группой ИМ 1-го типа и контролем.
По данным многофакторного анализа, независимая ассоциация с ИМ 1-го типа у мужчин молодого возраста выявлена для курения, АГ, ЛПНП, триглицеридов и генотипа -675 5G/4G гена PAI-1 (табл. 3).
Получены параметры уравнения: у=-15,32 + 1,87Х1 + 2,69Х2 + 3,49Х3 + 1,66Х4 + 2,21Х5, где у – значение функции логистической регрессии; -15,32 – константа; 1,87, 2,69, 3,49, 1,66, 2,21 – весовые коэффициенты соответствующих показателей; Х1 – курение; Х2 – АГ; Х3 – ЛПНП; Х4 – триглицериды; Х5 – генотип -675 5G/4G гена PAI-1. Переменные Х1, Х2, Х5 принимают значения «1» при наличии признака или «0» – при его отсутствии. Переменные Х3 и Х4 принимают цифровые значения признака в ммоль/л.
Результаты анализа показали, что в совокупности исследуемые факторы оказывают статистически значимое влияние (χ2=194,63; p <0,0001) на итоги классификации.
ОБСУЖДЕНИЕ
Мужской пол определяют как независимый фактор риска развития ИБС, особенно в возрастной группе до 45 лет [9, 13, 14]. В нашем исследовании 98% поступивших пациентов с ИМ 1-го типа в возрастном диапазоне 25–44 лет были мужчинами, что было существенно больше доли женщин (2%). У абсолютного большинства (96%) мужчин с ИМ 1-го типа выявлялись факторы риска атеросклероза, среди которых статистически значимыми оказались АГ, курение, ожирение, абдоминальное ожирение, наследственность по ранней ИБС и сахарный диабет 2-го типа. Распространенность сердечно-сосудистых факторов риска считают одним из главных объяснений возникновения ИМ в молодом возрасте [13, 14]. Представляется логичным, что наличие факторов риска атеросклероза в молодом возрасте способствует раннему атеросклеротическому поражению коронарного русла.
Несмотря на проатерогенную направленность липидного спектра у всех наблюдаемых нами молодых больных ИМ 1-го типа, частота семейной гиперхолестеринемии составила всего лишь 5%, что согласуется с данными других исследователей о 2–7% случаев этого наследственного заболевания среди молодых больных ИМ [15–17].
Помимо проатерогенных факторов, у молодых мужчин с ИМ 1-го типа обнаружены генетически обусловленные формы тромбофилии – гетерозиготные генотипы G1691A гена F5, Т1565С гена ITGB3 и 5G(-675)4G гена PAI-1. Генетические протромботические сдвиги, поддерживая перманентно тромбофилическое состояние, определяют уязвимость к закупорке тромбом в атеросклеротических артериях [18]. Данные о генетических нарушениях в плазменном (F5: 1691G/A), тромбоцитарном (ITGB3: 1565Т/С) звеньях гемостаза и фибринолитической системе (PAI-1: -675 5G/4G) в перспективе могут быть использованы для дифференциального подбора антитромботической терапии. С другой стороны, указанные генетические тромбофилии могут оказывать влияние на собственно атеросклеротический процесс, способствуя его развитию и прогрессированию [4, 5, 19, 20].
По данным многофакторного анализа, выявлено независимое влияние на развитие ИМ 1-го типа у мужчин молодого возраста курения (b=1,87, р=0,010), АГ (b=2,69, р <0,0001), ЛПНП (b=3,49, р <0,0001), триглицеридов (b=1,66, р=0,013) и генотипа -675 5G/4G гена PAI-1 (b=2,21, р=0,002).
PAI-1 – протромбогенный эндотелиальный фактор, ингибирующий фибринолиз и сопряженный с проатерогенным липидным спектром [21]. Вероятно, сочетание этого тромботического генетического варианта с факторами, обусловливающими развитие эндотелиальной дисфункции (курение, АГ, проатерогенные липидные компоненты), имеет решающее значение в формировании тромбофилического статуса. Это особенно важно, если принять во внимание факт дебюта ИБС в виде острого ИМ без предшествующей стенокардии у значительного числа пациентов в молодом возрасте [22]. Поэтому, наряду с оценкой факторов риска атеросклероза и липидного профиля, у мужчин молодого возраста для формирования группы риска ИМ 1-го типа можно рекомендовать исследование полиморфизма в гене PAI-1.
Существует мнение, что генетические варианты оказывают умеренное влияние на риск заболевания, если рассматривать их индивидуально, но усиливают эффективность, когда действуют синергически с традиционными факторами риска [23]. Ранее сообщалось о существенном увеличении вероятности ИМ у носителей Лейденской мутации при наличии курения, АГ, ожирения, сахарного диабета [6, 7]. Полиморфизм -675 5G/4G гена PAI-1 максимально влияет на плазменный уровень PAI-1 у пациентов с АГ, курением, гипертриглицеридемией [4]. Очевидно, что сочетание традиционных факторов риска атеросклероза с тромбофилией усиливает их повреждающее действие на эндотелий – основной субстрат для процессов атеро- и тромбогенеза.
Генетические тромбофилии следует рассматривать в качестве дополнительных факторов риска развития ИМ 1-го типа в молодом возрасте. Выявление протромботических генетических аномалий у мужчин молодого возраста с факторами риска атеросклероза позволит на доклиническом уровне выделить группу риска «атеротромбогенного» ИМ. Тем более, что у значительного числа пациентов в молодом возрасте ИБС дебютирует развитием ИМ без предшествующей стенокардии [22]. Возможность прогнозировать риск ИМ 1-го типа у пациентов молодого возраста на основе традиционных факторов риска атеросклероза, большинство из которых являются модифицируемыми, а также изучение «новых», в частности генетических факторов, открывает новые перспективы в формировании стратегического подхода к ведению молодых пациентов.
ЗАКЛЮЧЕНИЕ
ИМ 1-го типа в возрасте 25–44 лет встречается преимущественно у пациентов мужского пола и манифестирует без предшествующей стенокардии. Вместе с факторами риска атеросклероза (курением, АГ, ожирением, абдоминальным ожирением, сахарным диабетом 2-го типа, наследственностью по ранней ИБС) и проатерогенной направленностью липидного спектра у молодых мужчин с ИМ 1-го типа выявлены генетически обусловленные тромбофилические состояния, затрагивающие плазменное (F5: 1691G/A) и тромбоцитарное (ITGB3: 1565Т/С) звенья гемостаза, а также фибринолитическую систему (PAI-1: -675 5G/4G). Определен независимый вклад в риск развития ИМ 1-го типа в молодом возрасте у мужчин следующих факторов: курения, АГ, ЛПНП, триглицеридов и полиморфизма -675 5G/4G гена PAI-1. Идентификация генетических протромботических аномалий дополняет традиционные факторы риска атеросклероза и позволяет своевременно выделить группу риска ИМ 1-го типа в молодом возрасте.



