ВВЕДЕНИЕ
Гипогонадизм у мужчин – это клинический и биохимический синдром, связанный с низким уровнем тестостерона, а также нечувствительностью рецепторного аппарата к андрогенам. На сегодняшний день хорошо известно, что гипогонадизм выявляется по крайней мере у каждого третьего мужчины с сахарным диабетом 2-го типа (СД 2) [1]. По последним данным, распространенность гипогонадизма при СД 2 может превышать 50% [2]. Еще в 2006 г. Эндокринологическое общество США рекомендовало оценивать уровень тестостерона у всех мужчин с СД 2 [3]. В нашей стране показание к определению уровня общего тестостерона сыворотки крови у пациентов с СД 2 и ожирением было сформулировано только в 2019 г. [4].
Известно, что гипогонадизм обусловлен нарушением функции яичек и/или гонадотропинпродуцирующей функции гипофиза, а также прерыванием определенных звеньев гипоталамо-гипофизарно-гонадной цепи. Кроме того, клиническая картина гипогонадизма может развиваться и при нормальном или повышенном уровне тестостерона, но нечувствительности андрогенных рецепторов [5].
По этиологическому критерию гипогонадизм классифицируется следующим образом [6]:
I. первичный (гипергонадотропный);
II. вторичный (гипогонадотропный);
III. смешанный;
IV. обусловленный нарушением отрицательной обратной связи «гипофиз–гонады».
Предложена и альтернативная классификация заболевания, основанная на выделении органического и функционального гипогонадизма. Органический гипогонадизм характеризуется любой доказанной патологией, затрагивающей гипоталамо-гипофизарно-гонадную ось, и его следует лечить с помощью гонадотропинов или тестостерона. Функциональный гипогонадизм возникает в отсутствие каких-либо признанных органических изменений в оси гипоталамус-гипофиз-гонады и должен лечиться в первую очередь путем устранения или улучшения сопутствующих заболеваний [7].
Первичную и вторичную формы гипогонадизма следует отличать друг от друга (по уровням лютеинизирующего гормона), поскольку это имеет значение для диагностики и лечения пациента с точки зрения реабилитации репродуктивной функции (возможна при вторичном гипогонадизме).
У пациентов с СД 2 наблюдается:
- снижение пула клеток Лейдига и их чувствительности к гонадотропинам в яичках;
- ишемические тестикулярные изменения;
- уменьшение выброса лютеинизирующего гормона (ЛГ);
- увеличение активности ароматазы жировой ткани.
Таким образом, при СД 2 имеют место компоненты как первичного, так и вторичного гипогонадизма, а также нарушение отрицательной обратной связи «гипофиз–гонады». Важно отметить, что гипогонадизм, развивающийся на фоне метаболических нарушений, потенциально обратим при их устранении, в отличие от истинно первичных и вторичных форм заболевания [5].
Метаанализ 43 исследований, выполненный Ding E.L. et al. (всего 6427 пациентов), показал, что уровень тестостерона у мужчин с СД 2 значительно ниже, чем в общей популяции, – в среднем на 76,6 нг/дл (2,7 нмоль/л) [8]. Данные этого метаанализа отражены на рисунке 1.

В настоящее время андрогенный дефицит рассматривается как самостоятельный фактор риска смертности. Так, 14-летнее наблюдение 396 мужчин с СД 2 и нормальным уровнем тестостерона и 154 мужчин с СД 2 и дефицитом тестостерона позволило установить, что смертность в течение года у мужчин со сниженным тестостероном составила 5%, тогда как у мужчин с нормальным уровнем этого гормона – 2,8%. К завершению наблюдения умерло 36,1% человек с нормальным уровнем тестостерона и 55,8% – с его дефицитом. Относительный риск смерти (скорректированный по возрасту) составил 1,54, что соответствует уменьшению ожидаемой продолжительности жизни на 3,2 года. Таким образом, пациенты с СД 2 и гипогонадизмом имеют потенциально более высокий риск смерти, чем пациенты с СД 2, но без гипогонадизма [9].
Целью нашего исследования стало изучение клинических и метаболических особенностей течения СД 2 у мужчин с гипогонадизмом.
Исследование было разделено на два этапа. Первый этап включал лабораторную диагностику гипогонадизма, изучение клинических и метаболических особенностей данной категории пациентов в общей популяции мужчин с СД 2. Задачей этого этапа также было сравнение распространенности дефицита тестостерона у мужчин с СД 2 в разных возрастных группах.
Во второй этап исследования были включены только пациенты со стажем СД 2 менее 1 года и при условии компенсации углеводного обмена. Были поставлены следующие задачи.
1. Оценить частоту встречаемости гипогонадизма у мужчин со стажем СД 2 менее 1 года.
2. Сравнить антропометрические (индекс массы тела, окружность талии, объем бедер, соотношение окружности талии и объема бедер, жировая масса и скелетная мышечная масса) характеристики мужчин с СД 2 и гипогонадизмом и без гипогонадизма.
3. Сравнить показатели углеводного обмена (гликированный гемоглобин, глюкоза плазмы натощак) у мужчин с СД 2 и гипогонадизмом и без гипогонадизма
4. Оценить факторы сердечно-сосудистого риска: частоту встречаемости артериальной гипертензии и показатели липидного профиля (общий холестерин, холестерин липопротеидов низкой плотности, холестерин липопротеидов высокой плотности, триглицериды).
МАТЕРИАЛ И МЕТОДЫ
Одной из задач исследования была оценка частоты встречаемости дефицита тестостерона у мужчин с СД 2 в разных возрастных группах. Всего в данное наблюдение вошли 287 мужчин с разным стажем СД 2. С учетом ненормальности распределения выборки применялась непараметрическая описательная статистика. Медиана возраста составила 54 [48; 60] года, где 48 – нижний квартиль, 60 – верхний квартиль. Медиана общего тестостерона сыворотки крови равнялась 10,96 [7,98; 14,48] нмоль/л, что значимо ниже порогового для потенциального дефицита уровня (12,1 нмоль/л) [6]. Снижение уровня общего тестостерона сыворотки менее 12,1 нмоль/л встречалось у 57,5% пациентов.
Пациенты на первом этапе (рис. 2) были разделены на две возрастные группы – до 55 лет (n=144) и ≥55 лет (n=143).
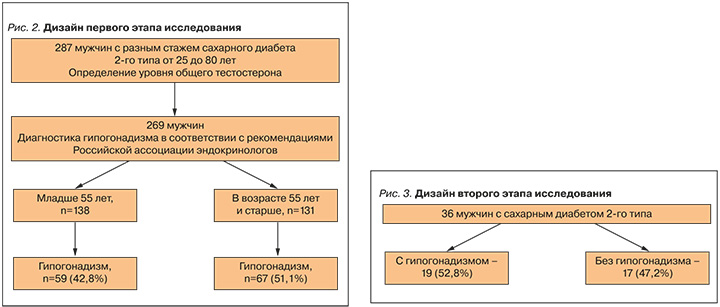
Во второй этап исследования (рис. 3) были отобраны 36 мужчин с СД 2: у 19 из них был диагностирован гипогонадизм, 17 составили группу контроля.
Критериями включения являлись:
- возраст младше 60 лет;
- СД 2 в течение от 3 до 12 мес;
- уровень гликированного гемоглобина (HbA1с) менее 7%;
- терапия метформином в комбинации с ингибиторами натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) или ингибиторами дипептидилпептидазы-4 (иДПП-4) или агонистами рецепторов глюкогоноподобного пептида-1 (арГПП-1);
- отсутствие острых сердечно-сосудистых событий в анамнезе.
Анализ сыворотки крови на общий тестостерон выполнялся с 07:00 до 11:00. В обеих группах оценивались индекс массы тела (ИМТ), окружность талии (ОТ), объем бедер (ОБ), соотношение ОТ/ОБ, проводился биоимпедансный анализ состава тела и измерение артериального давления. Из лабораторных параметров измерялись уровень HbA1с, глюкозы плазмы натощак, липидный профиль.
Для расчета свободного тестостерона определялись уровни сывороточного глобулина, связывающего половые гормоны (ГСПГ) и альбумина. Расчет проводился с помощью калькулятора University Hospital of Ghent (Бельгия) [10].
РЕЗУЛЬТАТЫ
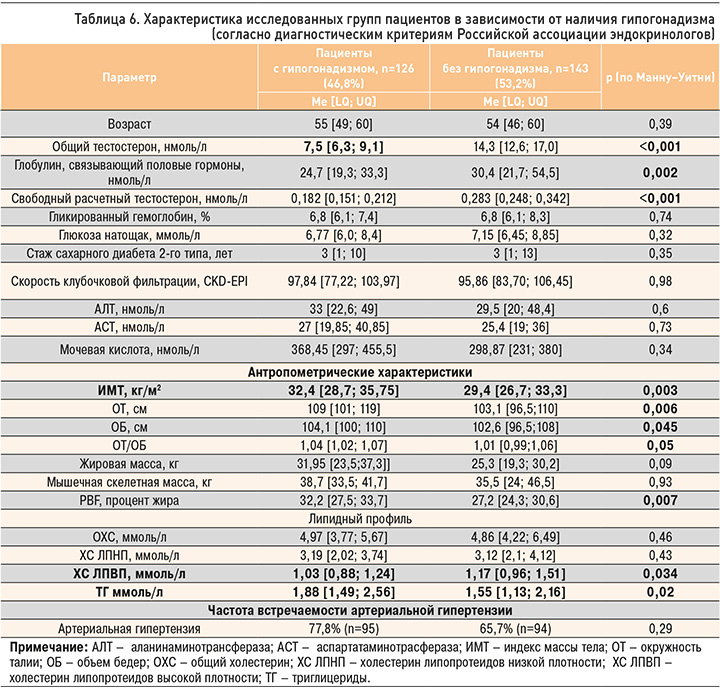
На первом этапе исследования частота снижения уровня общего тестостерона менее 12,1 нмоль/л в группах пациентов до 55 лет и старше составила 55,6 и 59,4% соответственно (табл. 1). При этом статистически значимой разницы между возрастными группами по уровню общего тестостерона получено не было, как и значимой корреляционной взаимосвязи между уровнем общего тестостерона и возрастом пациентов, что говорит об отсутствии существенного влияния возрастного фактора на развитие андрогенного дефицита у мужчин с СД 2 (табл. 2).
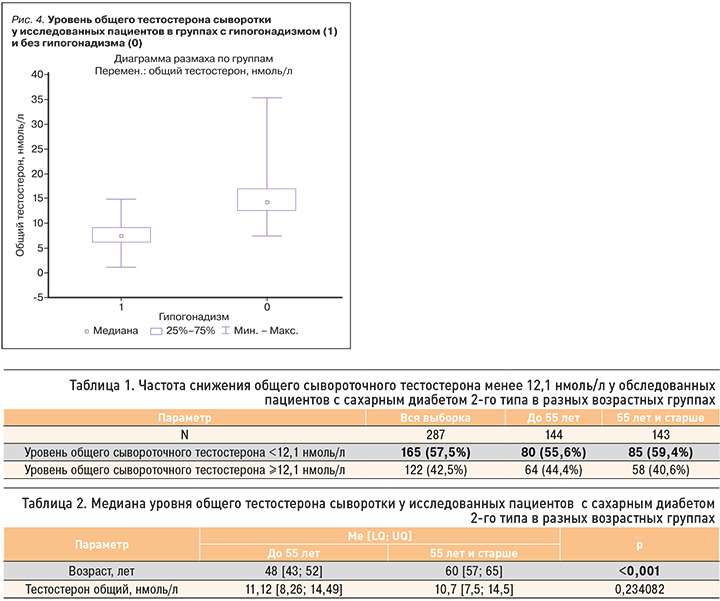
Лабораторная диагностика гипогонадизма была проведена у 269 мужчин в соответствии с рекомендациями Российской ассоциации эндокринологов. Гипогонадизм был подтвержден при уровне общего тестостерона менее 8 нмоль/л, а в диапазоне от 8 до 12,1 нмоль/л – при расчетном свободном тестостероне менее 243 пмоль/л (с учетом уровней ГСПГ и альбумина), определенных дважды, в сочетании с симптомами, ассоциированными с андрогенным дефицитом. Согласно вышеуказанным критериям, гипогонадизм был диагностирован у 46,8% (126) пациентов. Медиана уровня тестостерона в группе пациентов с гипогонадизмом составила 7,5 [6,3; 9,1] нмоль/л, а в группе без гипогонадизма она оказалась практически в 2 раза выше – 14,3 [12,6;17,0] нмоль/л (рис. 4). Уровень ГСПГ достоверно отличался между группами, как и уровень общего тестостерона, что лишний раз подчеркивает необходимость учета концентрации ГСПГ при пограничных значениях общего тестостерона. Медиана расчетного уровня свободного тестостерона в группе гипогонадизма равнялась 0,182 [0,151; 0,212] нмоль/л, в группе без гипогонадизма – 0,283 [0,248; 0,342] нмоль/л. При этом группы были сопоставимы по возрасту – 55 [49; 60] лет в группе гипогонадизма против 54 [46; 60] лет во 2-й группе.
Среди пациентов в возрасте до 55 лет гипогонадизм встречался с частотой 42,8%, в возрасте 55 лет и старше – 51,1%. В обеих возрастных группах медиана возраста пациентов с гипогонадизмом и без была сопоставима, а медиана общего тестостерона у пациентов с гипогонадизмом в разных возрастных группах отличалась только на 0,55 нмоль/л и не достигла статистической значимости. Медиана уровней ГСПГ и свободного тестостерона у пациентов разных возрастных групп в зависимости от наличия гипогонадизма представлена в таблицах 3 и 4. Медианы общего тестостерона, ГСПГ и расчетного тестостерона в группах с гипогонадизмом до 55 лет и старше значимо не отличалась (табл. 5).

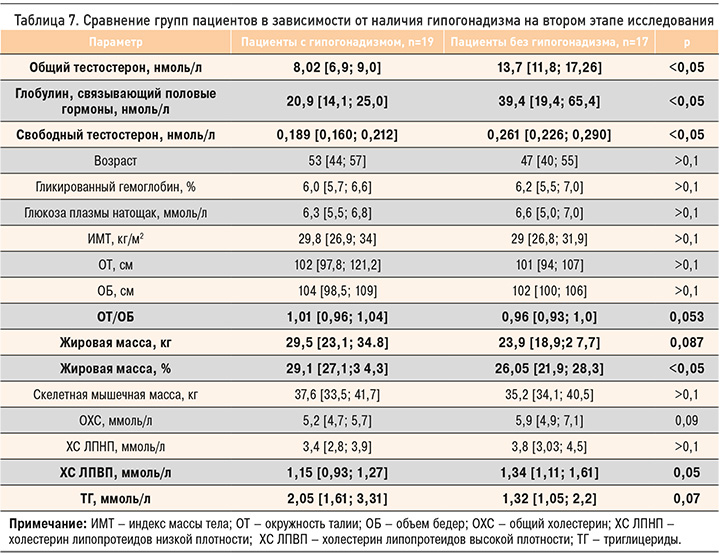
При анализе показателей углеводного обмена группа пациентов с андрогенным дефицитом оказалась сопоставима по стажу СД 2, уровню гликемии натощак и HbA1с с группой без андрогенного дефицита (табл. 6). Таким образом, корреляционной взаимосвязи между гликемическими параметрами, стажем диабета и уровнем общего тестостерона получено не было. Также группы были сопоставимы по уровню скорости клубочковой фильтрации, печеночных ферментов.
Сахароснижающая терапия также не отличалась в группах исследования – большая часть пациентов получала пероральные сахароснижающие препараты и/или арГПП-1 (82,1% в группе гипогонадизма и 81,7% в контрольной группе). Инсулинотерапия (базис-болюсная или только базальная) проводилась у 17,9% пациентов в 1-й группе и у 18,3% – во 2-й (рис. 5).

По антропометрическим параметрам наблюдались статистически значимые различия между группами. Так, медиана ИМТ в группе андрогенного дефицита составила 32,4 [28,7; 35,75] против 29,4 [26,7; 33,3] кг/м2 в группе с нормальным уровнем тестостерона, ОТ оказалась на 5,9 см достоверно больше в группе гипогонадизма, чем в контроле, ОБ был на 2,5 см больше у пациентов с гипогонадизмом. Обнаружена тенденция к более высоким значениям индекса ОТ/ОБ в группе дефицита тестостерона. Биоимпедансный анализ состава тела показал статистически значимое превышение процентного содержания жира в организме (на 5%) у мужчин с гипогонадизмом по сравнению с контрольной группой (p=0,007). При этом разницы по мышечной скелетной массе получено не было.
Группа мужчин с андрогенным дефицитом достоверно отличалась более высокими значениями триглицеридов (Δ0,33 нмоль/л) и более низким уровнем ХС ЛПВП (Δ0,14 нмоль/л) относительно мужчин с нормальным уровнем тестостерона (см. табл. 6).
Артериальная гипертензия при гипогонадизме встречалась чаще на 12,1%, но статистически значимой разницы по этому показателю получено не было.
Результаты второго этапа исследования, включавшего пациентов со стажем СД 2 не более 1 года и компенсацией углеводного обмена
Медиана возраста пациентов в обеих группах была сопоставима – 53 [44; 57] года в группе гипогонадизма и 47 [40; 55] лет во 2-й группе. В таблице 7 приведены гормональные характеристики обеих групп пациентов по уровню общего и расчетного свободного тестостерона, ГСПГ и ЛГ. Обращает на себя внимание факт: группы были сопоставимы по уровню ЛГ, что характерно для функционального гипогонадизма.
Достоверных различий по ИМТ, ОТ, ОБ и скелетной мышечной массе в данной выборке получено не было. В то же время выявлено достоверное отличие между группами по процентному содержанию жировой массы в соответствии с результатами биоимпедансного анализа состава тела. Разница медиан составила 3,01%. Также наблюдалась тенденция к достоверной разнице между абсолютным значением жировой массы тела (кг) и индексом ОТ/ОБ между группами, что говорит о преимущественной роли абдоминального ожирения в патогенетическом механизме формирования андрогенного дефицита.
Что касается факторов сердечно-сосудистого риска, таких как наличие артериальной гипертензии и дислипидемии, то здесь имела место тенденция к более высоким значениям ТГ и меньшим значениям ХС ЛПВП у мужчин с андрогенным дефицитом. Разница в медианах составила 0,73 ммоль/л для ТГ и 0,19 ммоль/л для ХС ЛПВП. Артериальная гипертензия достоверно чаще встречалась в группе пациентов с гипогонадизмом – 63% (n=12) против 47% (n=7) у мужчин без гипогонадизма (p <0,05).
ОБСУЖДЕНИЕ
Таким образом, у мужчин с СД 2 гипогонадизм был подтвержден в 46,8% случаев (42,8% у мужчин младше 55 лет и 51,1% среди мужчин в возрасте 55 лет и старше), что соответствует международным данным. При этом в когорте пациентов в возрасте до 60 лет со стажем СД 2 менее 1 года даже на фоне компенсации углеводного частота встречаемости гипогонадизма составила более половины случаев (52,8%). В общей выборке медиана уровня общего тестостерона в группе пациентов с гипогонадизмом была на 6,8 нмоль/л ниже, чем в группе без гипогонадизма.
Исследование антропометрических параметров показало, что мужчины с гипогонадизмом имеют достоверно более высокий процент жировой массы и тенденцию к более высокому индексу ОТ/ОБ по сравнению с мужчинами без гипогонадизма, что подтверждает роль преимущественно абдоминального типа ожирения в развитии ожирения у мужчин с СД 2.
Липидный профиль мужчин с гипогонадизмом уже в первый год противодиабетической терапии имеет тенденцию к более высоким показателям ТГ и более низким значениям ХС ЛПВП в крови по сравнению с контрольной группой, а артериальная гипертензия у мужчин с гипогонадизмом встречается чаще, чем у мужчин без андрогенного дефицита. Полученные данные могут свидетельствовать об отрицательном влиянии дефицита тестостерона на сердечно-сосудистый риск пациентов с СД 2.
ЗАКЛЮЧЕНИЕ
Полученные данные наглядно демонстрируют высокую распространенность гипогонадизма у мужчин среднего возраста с СД 2 стажем не более 1 года даже при условии стойкой компенсации углеводного обмена на фоне комбинированной противодиабетической терапии с применением инновационных классов сахароснижающих препаратов. Группа мужчин с андрогенным дефицитом из данной выборки отличается более высоким процентом жировой массы и сердечно-сосудистым риском, что в очередной раз диктует необходимость независимой оценки уровня тестостерона при впервые выявленном СД 2, особенно у пациентов с висцеральным ожирением.



