По мнению ряда авторов, ежегодно аневризмы грудного отдела аорты диагностируются в 5,9—10,4 случаев на 100 тыс. населения [1—3]. Из них более 60% аневризм включают восходящий отдел и дугу аорты и в 50—84% случаев сопровождаются развитием недостаточности аортального клапана (АК) различной степени выраженности [2, 4, 5]. Наряду с комплексной оценкой степени тяжести и гемодинамической значимости аортальной регургитации (АР) у пациентов с аневризмой восходящего отдела аорты (АВОА) и/или диссекцией аорты не менее важным вопросом на дооперационном этапе является определение анатомо-функциональных причин ее возникновения. В настоящее время чреспищеводная эхокардиоскопия (ЧП-ЭхоКС) благодаря высокому качеству изображения и дополнительным эхокардиографическим сечениям позволяет не только адекватно оценить морфологические особенности корня аорты, но открывает новые возможности в изучении причин и механизмов недостаточности АК у пациентов данной категории [6, 7].
Целью нашего исследования было изучение методом ЧП-ЭхоКС влияния линейных параметров корня аорты, а также показателей подстворочного пространства корня аорты (площади подстворочного пространства — ППП — в диастолу и высоты коаптации створок — ВКС) на тяжесть АР у пациентов с АВОА и анатомически неизмененным АК, так называемой функциональной аортальной регургитацией (ФАР).
Материал и методы
В период с 2003 по 2011 г. на базе Краевой клинической больницы №1 им. проф. С.В. Очаповского (Краснодар) обследованы и прооперированы 167 пациентов с аортальной недостаточностью (АН) I—IV степени на фоне аневризмы и/или диссекции восходящего отдела аорты. В исследование были включены 69 человек — 56 (81,2%) мужчин и 13 (18,8%) женщин с АВОА, сохранными створками АК и различной степенью ФАР (I—IV степени). Возраст больных варьировался от 25 до 73 лет, медиана 54 (47; 59) лет. Все участники исследования дали письменное информированное согласие на обработку персональных данных.
В зависимости от ширины наиболее узкой части струи АР — vena contracta (VC, см) все 69 пациентов были разделены на 2 группы: в 1-ю группу вошли 30 (43,5%) пациентов с клинически значимой ФАР (VC≥0,45 см), во 2-ю группу — 39 (56,5%) пациентов с клинически незначимой ФАР (VC<0,45 см). При пограничных значениях диаметра VC АР были использованы дополнительные критерии оценки тяжести АН Американского общества эхокардиографии (2003) [7—9].
Для проведения объективных сравнений в соответствии с целью исследования нами были выбраны 2 контрольные группы. В первую (К1) вошли 19 пациентов — 14 (73,7%) мужчин и 5 (26,3%) женщин с АВОА, неизмененным АК, без АР. Медиана возраста пациентов контрольной группы составила 56,0 (49,5; 59,0) лет.
В качестве второй контрольной группы (К2) были отобраны 20 пациентов — 14 (70%) мужчин и 6 (30%) женщин с неизмененными корнем аорты и створками АК, без АР.
Данным пациентам ЧП-ЭхоКС была выполнена с целью исключения источников эмболии в полостях сердца. Медиана возраста пациентов этой группы составила 50,5 (43,8; 60,8) года.
Всем пациентам в исследуемых группах ЧП-ЭхоКС выполняли в условиях операционной до начала этапа искусственного кровообращения на ультразвуковом аппарате Acuson ASPEN биплановым датчиком по общепринятой методике с использованием всех возможных режимов визуализации и плоскостей сканирования. В процессе ультразвукового исследования из среднепищеводного трехкамерного сечения оценивали следующие параметры: VC (см), ВКС (см) и ППП (см2) в диастолу. Размер VC определяли как ширину наиболее узкой части струи регургитации после прохождения ею отверстия АК. Ее измеряли на увеличенном изображении сердца при установленной величине предела Найквиста 50÷60 см/с. ВКС определяли как расстояние между концами створок и плоскостью фиброзного кольца АК (ФКАК), ППП — как пространство, ограниченное плоскостью ФКАК и желудочковой поверхностью аортальных створок, измеренное в протодиастолическую фазу сердечного цикла.
Кроме того, оценивали линейные размеры корня аорты на уровне ФКАК, синусов Вальсальвы, синотубулярного гребня (СТГ) и тубулярной части восходящей аорты, индексированные на площадь поверхности тела, а также проводили расчет коэффициента СТГ/ФКАК [7, 10].
Статистическую обработку полученных данных проводили с использованием программы Statistica 6.0. Проверка распределений на нормальность при помощи критерия Шапиро—Уилка показала, что распределение практически всех переменных достоверно отличалось от распределения Гаусса, поэтому использовали непараметрические методы сравнения. Для оценки достоверности различий независимых переменных использован критерий Манна—Уитни, результаты представлены в виде медианы и межквартильного интервала — Me (25-й процентиль; 75-й процентиль). Различия между сравниваемыми группами считали статистически значимыми при p≤0,05. Учитывая, что частота также является случайной величиной, относительные величины приведены в виде x±mx, где x — частота признака (%), а mx — ошибка частоты, определяемая по формуле
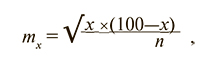
где n — объем выборки, для которой определена частота данного признака.
Результаты и обсуждение
В результате исследования установлено, что у всех пациентов 1-й и 2-й групп средняя ширина VC составила 0,42 (0,30; 0,57) см при вариабельности от 0,2 до 0,11 см. При этом у всех пациентов струя регургитации локализовалась между свободными краями створок АК и имела центральное направление. Межкомиссуральный или эксцентрический тип регургитации не встретился ни в одном из случаев. В 1-й группе диаметр VC составил 0,61 (0,53; 0,69) мм, во 2-й — 0,30 (0,25; 0,38) мм (p<0,0000).
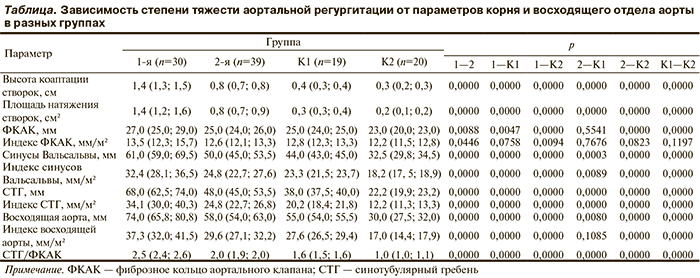
Зависимость степени тяжести АР от параметров корня и восходящего отдела аорты в разных группах представлена в таблице.
Как видно из представленных данных, установлены статистически значимые различия при сравнении показателей ВКС — 1,4 (1,3; 1,5) и 0,8 (0,7; 0,8) мм (p<0,0000), ППП — 1,4 (1,2; 1,6) см2 и 0,8 (0,7; 0,9) см2 (p<0,0000) в I и II группах соответственно. Кроме того, в группе пациентов с выраженной АР размеры ФКАК (p=0,0088), синусов Вальсальвы (p<0,0000), СТГ (p<0,0000), восходящей аорты (p<0,0000) и их индексированные показатели были больше, чем в группе с незначимой ФАР. Коэффициент диспропорции СТГ/ФКАК был также значительно выше в 1-й группе — 2,5(2,4; 2,6), чем во 2-й — 2,0 (1,9; 2,0).

Все показатели пациентов контрольных групп (как с АВОА без АР, так и без аневризмы) достоверно (p<0,0000) различались между собой (были больше в группе К1), за исключением индексированной величины ФКАК (p=0,1197).
При сравнении 1-й, 2-й и контрольных групп получены достоверные различия показателей ППП и ВКС, а также СТГ и отношения СТГ/ФКАК, которые в контрольных группах были достоверно меньше, чем в 1-й и 2-й группах (p<0,0000). Необходимо отметить, что несмотря на полученные достоверные различия по диаметру СТГ, для появления и усугубления функциональной АН важна не столько абсолютная величина расширения СТГ, сколько нарушение нормальной пропорции СТГ/ФКАК [7].
Аналогичное соотношение между исследуемыми группами имелось при изучении диаметров синусов Вальсальвы и восходящей аорты. Лишь только индексированный показатель восходящей аорты достоверно не различался у больных 2-й и К1 групп (p=0,1085). Однако, по мнению ряда авторов, синусы Вальсальвы, как и восходящий отдел аорты представляют собой комплекс оболочечных элементов, который не играет значимой роли непосредственно в процессе коаптации створок [10].
При изучении диаметра ФКАК не обнаружено достоверных различий (p=0,5541) только между исследуемой величиной в контрольной группе пациентов с АВОА без ФАР и в группе пациентов с незначимой ФАР (рис. 1). Остальные различия были высоко достоверными.
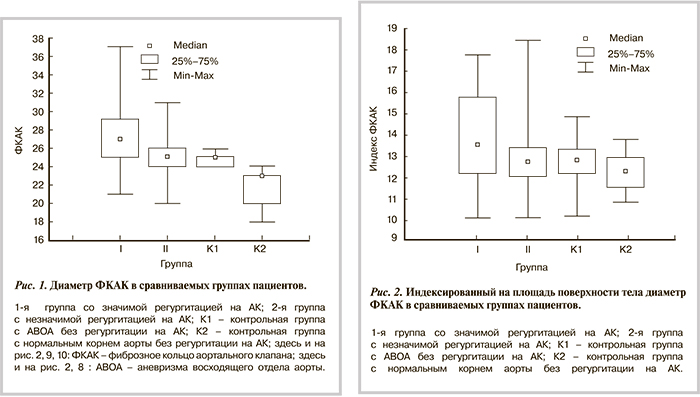
В то же время следует отметить, что индексированный на площадь поверхности тела размер ФКАК в большинстве случаев достоверно не различался в сравниваемых группах (рис. 2).
Достоверные различия в величине этого показателя мы наблюдали в 1-й и 2-й группах (p<0,0446), а также в 1-й и К2 (p<0,0094).
В ходе исследования выявлено, что тяжесть АР в значительной степени определяется некоторыми геометрическими характеристиками корня аорты. Для этого был проведен анализ построения интерактивных точечных диаграмм, связанный с построением ROC-кривых.
По результатам нашего исследования установлено, что появление ФАР ассоциируется с показателями подстворочного пространства корня аорты — ВКС и ППП в диастолу. Данные представлены на рис. 3 и рис. 4.


Как представлено на рис. 3, среди обследованных больных без ФАР нет ни одного с ВКС>0,40 см. В то же время среди пациентов с АВОА и незначимой ФАР мы не обнаружили ни одного с ВКС АК<0,54 см. Таким образом, пороговой величиной изучаемого показателя, разделяющей данные группы пациентов со 100% диагностической чувствительностью и специфичностью, может служить любая величина из данного интервала. Учитывая стохастический характер полученных данных и определенную вероятность выхода данного показателя из установленных пределов в генеральной выборке больных, в качестве граничного условия мы приняли точку, равноудаленную от полученных величин. Таким образом, при ВКС>0,47 см можно констатировать развитие ФАР.
Аналогичные рассуждения можно провести для показателей ППП АК (см. рис. 4). Как можно видеть, пограничной точкой в данном случае является величина ППП, равная 0,49 см2. При любых меньших значениях данного показателя можно утверждать об отсутствии ФАР.
Анализ, подобный проведенному выше, выполнен для поиска пограничных условий для больных с выраженной (VC≥0,45 см) и невыраженной ФАР (VC<0,45 см). В этом случае минимальный показатель ВКС в группе больных с выраженной ФАР (1,09 см) был только незначительно выше максимального уровня ВКС в группе пациентов с невыраженной ФАР (1,05 см) (рис. 5). Поэтому точкой разделения со 100% диагностической чувствительностью и специфичностью была принята величина, равная 1,07 см. В то же время величины показателя ППП в диастолу в сравниваемых группах пациентов незначительно перекрываются (рис. 6). Лучшей точкой разделения является величина ППП, равная 1,09 см2, для которой чуть более 10% выборки пациентов с невыраженной ФАР имеют величину показателя, превышающего эту границу, и нет ни одного в исследуемой группе больных с выраженной ФАР, у которого данный показатель был бы менее ее.
В свою очередь установлено, что показатели подстворочного пространства корня аорты (ВКС и ППП) находятся в прямой зависимости от диспропорции СТГ/ФКАК — основной причины возникновения и нарастания ФАР. Чем больше коэффициент диспропорции СТГ/ФКАК, тем больше ВКС (рис. 7), ППП (рис. 8) и, соответственно, ширина струи регургитации на АК.

По нашим наблюдениям (рис. 9, 10), коэффициент диспропорции СТГ/ФКАК более 1,67 должен рассматриваться как ассоциирующийся с появлением недостаточности АК со 100% диагностической чувствительностью и специфичностью. В то же время величина СТГ/ФКАК, превышающая 2,23, со 100% диагностической чувствительностью и специфичностью свидетельствует о наличии выраженной ФАР (VC≥0,45 см) у пациентов с АВОА и интактными створками АК.
Заключение
В нашем исследовании продемонстрирована прямая зависимость нарастания тяжести аортальной регургитации от показателей высоты коаптации створок и площади подстворочного пространства аортального клапана в диастолу. При этом высота коаптации створок и площадь подстворочного пространства находились в прямой зависимости, главным образом, от величины синотубулярный гребень/фиброзное кольцо аортального клапана, а не от абсолютных показателей проксимальной аорты. На наш взгляд, установленные в ходе исследования факты могут дополнить знания о механизмах ФАР и быть полезными для кардиохирурга при выборе оптимального метода хирургической коррекции АН у пациентов с аневризмой и/или диссекцией аорты.
С другой стороны, показатели подстворочного пространства корня аорты, наряду с общепринятыми критериями оценки тяжести АН, могут быть использованы в качестве дополнительных параметров анализа аортальной регургитации у пациентов с АВОА и интактными створками аортального клапана. Важность этих измерений становится очевидной, если вспомнить, что до настоящего времени при выполнении ЧП ЭхоКС оценивались в основном только полуколичественные критерии тяжести аортальной регургитации — диаметр vena contracta и ширина струи регургитации в ВТЛЖ (%).Это объясняется тем, что при чреспищеводной эхокардиоскопии не всегда удается получить сечение, при котором направление струи регургитации параллельно ультразвуковому лучу, а, следовательно, адекватно рассчитать количественные критерии тяжести аортальной регургитации. Поэтому, исходя из изложенного, мы считаем возможным при оценке тяжести аортальной регургитации использовать результаты нашего исследования в качестве дополнительных критериев. Согласно нашим результатам, появление функциональной аортальной регургитации ассоциируется с коэффициентом диспропорции синотубулярный гребень/фиброзное кольцо аортального клапана >1,67, высоты коаптации створок >0,47 см и площади подстворочного пространства >0,49 см².
В то же время величина синотубулярный гребень/фиброзное кольцо аортального клапана >2,23, высота коаптации створок >1,07 см и площадь подстворочного пространства >1,09 см² свидетельствуют о наличии выраженной функциональной аортальной регургитации (vena contracta ≥0,45 см) у пациентов с аневризмой восходящего отдела аорты и интактными створками аортального клапана.



