Спонтанный разрыв задней стенки левого желудочка (ЗСЛЖ) после протезирования митрального клапана (ПМК) — грозное осложнение, которое возникает у 0,5—1,7% больных [1—7]. Сопровождаясь высокой летальностью, данное осложнение является серьезным эмоциональным испытанием для хирурга [3, 8—13]. В ведущих клиниках мира разрывы ЗСЛЖ после ПМК составляют до 20% в структуре причин летальности [1, 14]. По мере накопления опыта вмешательств на митральном клапане (МК) летальность при возникновении подобного фатального осложнения удалось значительно снизить.
Разрывы ЗСЛЖ после ПМК классифицируются по анатомической локализации и срокам развития. По анатомической локализации [15—17]: I тип — разрыв атриовентрикулярной борозды; II тип — разрыв в проекции основания папиллярных мышц; III тип — промежуточный разрыв ЗСЛЖ между атриовентрикулярной бороздой и основанием папиллярных мышц. В клинической практике нередко встречаются сочетания I—III и III—II типов разрывов, развивающихся одномоментно или поэтапно после коррекции одного из них [13, 18, 19]. В ряде случаев верификация конкретного типа осложняется «продолжающимся» разрывом [19, 20], меняющим первоначальную траекторию линейности вплоть до левого предсердия (ЛП) с расслоением и разрывом его стенки [5, 21, 22]. Учитывая наблюдения комбинированных разрывов ЗСЛЖ и ЛП, особенно у больных старше 70 лет, некоторые авторы считают целесообразным выделение их самостоятельным IV типом. По срокам возникновения различаются ранние, отсроченные и поздние разрывы [9, 10, 23—26]. Ранними называются интраоперационные разрывы, которые чаще возникают после завершения основного этапа операции, составляя 30—66% всех разрывов ЗСЛЖ. Они являются прогностически относительно «благоприятными» ввиду наличия возможности коррекции за короткий промежуток времени в условиях искусственного кровообращения (ИК) [18, 27]. Отсроченные разрывы ЗСЛЖ, составляя 33—69%, развиваются с первых часов после операции до 5 сут, обычно во время пребывания больного в палате реанимации или общем отделении, что значительно затрудняет контроль над кровотечением, при этом не всегда существует возможность экстренного хирургического вмешательства [28]. Большинство больных с отсроченными разрывами не выживают после такого осложнения. Во-первых, это обусловлено потерей времени на диагностику и транспортировку пациента в операционную, так как попытки наружной коррекции разрывов без ИК в отделении реанимации, за редким исключением [20, 25], заканчиваются летальным исходом. При коррекции в условиях ИК летальность достигает 78% [7]. Во-вторых, сложность операции, требующей подчас нестандартных приемов [13, 18, 22], вплоть до аутотрансплантации сердца [18, 19, 29]. У пациентов данной категории причиной смерти служат массивная кровопотеря и тампонада сердца, реже происходит образование интрамиокардиальной гематомы с развитием низкого сердечного выброса. Поздние разрывы развиваются в сроки от 5—7 дней до года и более после ПМК и представлены псевдоаневризмами левого желудочка (ЛЖ), являющимися осложнением разрыва I типа без экстравазального кровотечения, с развитием расслаивающей гематомы и формированием субаннулярной псевдоаневризмы ЛЖ. Верификация последних в ряде случаев осложнена отсутствием симптомов при ложных аневризмах ЛЖ, спорадически выявляемых при рентгенологическом или эхокардиографическом обследовании. Псевдоаневризмы ЛЖ больших размеров проявляются нарушениями ритма сердца, ангинозными болями, клинической картиной сердечной недостаточности и тампонады сердца [30—32]. Описаны ранние и отсроченные осложнения разрывов ЛЖ I типа без экстравазального кровотечения, представленные диссекцией стенки ЛП с разрывом предсердия [21, 22, 33]. Общая летальность при возникновении разрывов ЛЖ колеблется от 40 до 100% и зависит от сроков развития данного осложнения [1–3, 7]. Высокая летальность даже при ранних разрывах ЗСЛЖ и безотлагательной коррекции оправдывает целесообразность анализа каждой успешной операции при этом осложнении.
Материал и методы
 В ФГБУ «ФЦВМТ» с сентября 2012 г. до октября 2015 г. нами выполнено 2764 операции на открытом сердце у взрослых пациентов, в 199 (7,1%) случаях было выполнено ПМК у 150 (5,4%) пациентов с применением механического протеза, у 49 (1,7%) с биологическими протезами. Спонтанный разрыв заднебоковой стенки ЛЖ произошел у 4 (0,14%) пациентов. Возраст пациентов составил 67,5±4,2 года. У 3 (0,1%) пациентов были выполнены ПМК и шовная пластика трикуспидального клапана, у 1 (0,04%) — ПМК в сочетании с аортокоронарным шунтированием. В 3 (0,1%) случаях имплантировали механические протезы, в 1 (0,04%) случае — биологический протез. Во всех случаях разрыв ЛЖ возникал после окончания ИК, отмечалось поступление крови в области заднебоковой стенки, размеры дефекта были от 1 до 2,5 см. В первых 2 случаях при повторном пережатии аорты выполнялось закрытие разрыва заплатами из просвета и снаружи желудочка с укреплением швами с прокладками, данные случаи закончились летальным исходом вследствие неконтролируемого кровотечения. Далее представляем технику успешного лечения 2 пациентов данной категории в ФЦВМТ г. Калининграда.
В ФГБУ «ФЦВМТ» с сентября 2012 г. до октября 2015 г. нами выполнено 2764 операции на открытом сердце у взрослых пациентов, в 199 (7,1%) случаях было выполнено ПМК у 150 (5,4%) пациентов с применением механического протеза, у 49 (1,7%) с биологическими протезами. Спонтанный разрыв заднебоковой стенки ЛЖ произошел у 4 (0,14%) пациентов. Возраст пациентов составил 67,5±4,2 года. У 3 (0,1%) пациентов были выполнены ПМК и шовная пластика трикуспидального клапана, у 1 (0,04%) — ПМК в сочетании с аортокоронарным шунтированием. В 3 (0,1%) случаях имплантировали механические протезы, в 1 (0,04%) случае — биологический протез. Во всех случаях разрыв ЛЖ возникал после окончания ИК, отмечалось поступление крови в области заднебоковой стенки, размеры дефекта были от 1 до 2,5 см. В первых 2 случаях при повторном пережатии аорты выполнялось закрытие разрыва заплатами из просвета и снаружи желудочка с укреплением швами с прокладками, данные случаи закончились летальным исходом вследствие неконтролируемого кровотечения. Далее представляем технику успешного лечения 2 пациентов данной категории в ФЦВМТ г. Калининграда.
Пациентка М., 69 лет. Поступила с диагнозом: хроническая ревматическая болезнь сердца. Выраженный митральный стеноз. Умеренная трикуспидальная недостаточность. Легочная гипертензия I стадии, хроническая сердечная недостаточность 2А стадии, III функционального класса по классификации NYHA; хроническая обструктивная болезнь легких. Дыхательная недостаточность 0—I степени». Пациентке были выполнены ПМК механическим протезом и пластика трикуспидального клапана. При ревизии МК отмечался кальциноз задней створки МК с переходом на фиброзное кольцо, подклапанный аппарат был сращен в единый конгломерат. МК вместе с подклапанным аппаратом был иссечен, проведена декальцинация фиброзного кольца. Выраженные морфологические изменения не представляли возможным сохранить заднюю створку. В супрааннулярную позицию МК был имплантирован механический протез диаметром 31 мм. Завершающим этапом выполнена шовная пластика трикуспидального клапана по Де Вега. Основной этап операции прошел без особенностей, после снятия зажима аорты и восстановления деятельности сердца отмечалось обильное поступление алой крови в рану по задней поверхности сердца. При ревизии обнаружен разрыв задней стенки ЛЖ I типа, на протяжении 2 см. Возобновлено ИК, после пережатия аорты, на «сухом» сердце, использовали биоклей на область разрыва с фиксацией на нем тканевого гемостатика размером 10×20 см с проклейкой между слоями. После этого нанесли второй слой клея на пластину с фиксацией на нем прилежащего аутоперикарда широкой площадкой (вся заднебоковая поверхность). После выдержки времени экспозиции, удостоверившись в отсутствии источника кровотечения на нагруженном сердце, завершили ИК (рис. 1). На 12-е сутки после операции пациентка выписана.
 Обсуждение
Обсуждение
С современных позиций этиологические факторы разрывов ЗСЛЖ после ПМК систематизируют по категориям, выделяя независимые факторы риска, хирургические факторы и пусковые факторы разрывов. По данным литературы, статистически значимыми независимыми факторами риска являются возраст 60 лет и старше, повторные операции, гемодиализ, конечный диастолический диаметр ЛЖ менее 50 мм [9, 10]. Способствующие факторы риска — женский пол, стеноз МК, инфаркт миокарда, дебютировавший не более чем за сутки до ПМК [3, 21, 25]. К хирургическим факторам риска разрыва I типа относятся агрессивная декальцинация и санация абсцессов фиброзного кольца МК, резекция задней створки и базальных хорд, пликация ЛП, чрезмерная резекция задней створки МК, чрезмерная тракция клапана [12, 34, 35]. Отмечая эффект полного или частичного сохранения задней створки МК, приоритетным считают сохранение базальных хорд с частичной резекцией створки, а не полную сохранность последней [11, 36, 37]. К хирургическим факторам риска разрыва II типа относятся избыточное иссечение папиллярных мышц, энергичная тракция подклапанных структур при удалении створок МК; к хирургическим факторам III типа — биопротезирование, механические протезы размером 29 и 31 мм, диспропорция протеза и фиброзного кольца МК [34, 38]. Пусковым фактором разрыва являются инфузия катехоламинов в постперфузионном периоде и гипертонические кризы в ближайшем послеоперационном периоде [37—39]. ПМК с сохранением задней створки и базальных хорд, щадящей декальцинацией кольца, частичной или полной супрааннулярной транслокацией протеза, применением низкопрофильных биопротезов, отказом от дренирования ЛЖ через верхушку способствовало снижению как общей частоты разрывов ЗСЛЖ до 0,24—0,8% в отдельных сериях [7, 9], так и частоты разрывов I и II типов с 76 и 31% до 26 и 13% соответственно [7, 9]. Доминирование частоты III типа (до 61%) связывают с биопротезированием МК у возросшей популяции больных в возрасте 60 лет и старше [38]. В то же время сводный анализ 10 978 операций ПМК показал, что даже скрупулезное соблюдение современных принципов протезирования, учет значимых факторов риска не гарантируют от разрывов ЗСЛЖ, которые являются прогнозируемыми и возникают в среднем с частотой 0,56% [31]. Алгоритм коррекции разрывов ЗСЛЖ после ПМК, предложенный S.I. Sersar и A.A. Jamjoom [25], предусматривает 3 варианта тактики: экстракардиальную (наружную) коррекцию, эндокардиальное восстановление целостности атриовентрикулярного продолжения, нетрадиционные приемы эндокардиальной коррекции. Наружная пластика или ушивание в условиях ИК оправданы в отсутствие спаек перикарда и при небольших разрывах II и III типов с операционным контролем адекватности коррекции чреспищеводной эхокардиографии (ЭхоКГ) [7, 9, 24, 25]. Это способствует выявлению как «продолжающихся» и сочетанных разрывов ЛЖ, так и верификации их внутренних размеров, нередко превышающих наружные [40—43]. Последнее даже при остановленном кровотечении и неглубоком наложении швов создает предпосылки для расслаивающей гематомы с потенциальной вероятностью отсроченного кровотечения или формирования псевдоаневризмы ЛЖ. Данные ЭхоКГ ориентируют хирурга на завершение операции либо на дополнительную эндокардиальную коррекцию. Современная концепция ориентирована на эндокардиальное восстановление целостности атриовентрикулярного продолжения с эксплантацией клапанного протеза, пластикой или шовной коррекцией разрыва и реимплантацией протеза [34, 35, 37, 38]. Показаниями служат верификация I типа или сочетанных разрывов; комбинированный разрыв ЛЖ и ЛП; неадекватная наружная коррекция II и III типов; спаечный процесс в перикарде. Обязательные условия эндокардиальной коррекции — удобная экспозиция операционного поля и мобилизация сердца. Как правило, коррекцию разрыва выполняют доступом через ЛП. При малых размерах ЛП применим трансаортальный доступ с пересечением верхней полой вены [13], который, как и пересечение нижней полой вены при доступе через ЛП, обеспечивает идеальную мобилизацию сердца, особенно при комбинированных разрывах ЛЖ и ЛП [6]. При разрыве задней стенки выходного отдела ЛЖ оптимальна поперечная аортотомия по типу мини-трансплантации [6, 11]. Эндокардиальная шовная коррекция на встречных прокладках, прослоенных биоклеем или композитными гелями, остается методом выбора при разрывах I типа, но чревата травмой огибающей ветви левой коронарной артерии или коронарного синуса [16, 19]. Более предпочтительна эндовентрикулярная или трансаннулярная пластика заплатой, покрывающей эндокард ЛЖ и ЛП [27, 37, 38]. Как правило, эндокард под заплатой пломбируют биоклеем или композитными гелями. Для лучшей герметизации хирурги Mount Sinai Medical Center (Майями) предложили трансаннулярную заплату из ксеноперикарда с тефлоновым вкладышем, пропитанным биоклеем [14]. Подобная операция успешно выполнена при раннем разрыве задней стенки ЛЖ I типа у пациента 82 лет после биопротезирования МК и коррекции дефекта межпредсердной перегородки [14]. Осложнением послеоперационного периода явились нарушение проводимости и необходимость имплантации электрокардиостимулятора. По мнению авторов, техническая сложность методики оправдана у больных в возрасте 70 лет и старше с «рыхлым» миокардом и потенциальной вероятностью прорезывания швов. После коррекции разрыва реимплантация протеза осуществляется механическими модулями меньшего размера во избежание повторной травмы ЗСЛЖ каркасом биопротеза [13, 19, 38]. При декальцинации/санации абсцессов фиброзного кольца рекомендуют частичную или полную супрааннулярную транслокацию протеза непосредственно на стенку ЛП либо в позицию сформированного неокольца [30, 38]. Реимплантация низкопрофильных биопротезов — прерогатива отдельных хирургов [14, 18, 34]. Герметизацию завершают наружным пломбированием задней стенки сердца биоклеем, композитными гелями или пластинами [4, 14, 25]. Ряд хирургов дополняют эндокардиальную коррекцию наружной пластикой или ушиванием [7, 9, 35]. Последнее оправдано до реимплантации протеза, так как вывихивание сердца после отключения ИК чревато рецидивом кровотечения.
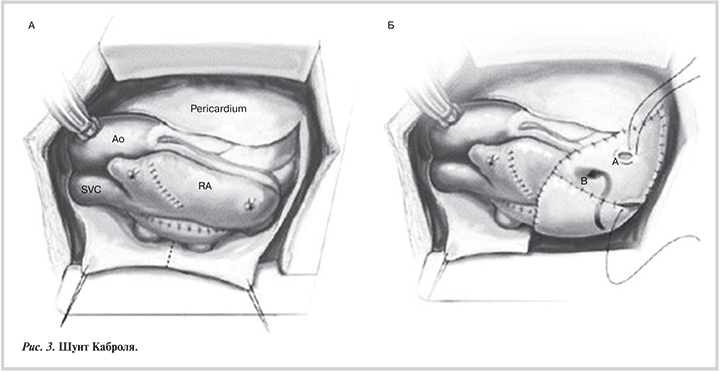
Нетрадиционные методы коррекции. Анализ литературы и собственный опыт [5, 10, 18, 29] показывают, что ни один из традиционных методов коррекции разрывов ЗСЛЖ не застрахован от продолжающегося или отсроченного кровотечения, обусловленного расширением зоны разрыва или негерметичностью швов. В подобных случаях возможна дополнительная герметизация задней стенки и правых отделов сердца перикардом для шунтирования продолжающегося или потенциального кровотечения из сформированной перикардом «сумки» в правое предсердие через фистулу в его стенке по Кабролю. Первая подобная операция успешно выполнена А.B. Goldstone и соавт. [10] в Mount Sinai School of Medicine (Нью-Йорк) у больной 84 лет после биопротезирования МК, осложнившегося ранним сочетанным разрывом ЛЖ III и II типа. Ввиду кровотечения, продолжавшегося после эндовентрикулярной пластики ЛЖ с реимплантацией биопротеза меньшего размера, проведена герметизация задней стенки сердца по Кабролю с отсроченным (до 5 дней) сведением грудины. При контроле через 6 мес пациентка жалоб на функцию сердца не предъявляла, развития псевдоаневризмы ЛЖ не отмечено. Предложенный метод представляется идеальной альтернативой при продолжающемся кровотечении.
Вариантом нетрадиционной тактики является эндокардиальная коррекция с техникой аутотрансплантации сердца, приемлемая в центрах с активно функционирующей программой трансплантации [29, 37, 40, 41]. Эти сообщения ограничены 4 операциями, 2 из которых выполнены на Тайване [29, 37], 1 в Шотландии [40] и 1 в Турции [29]. У всех больных аутотрансплантация сердца проводилась с техникой биатриального анастомоза. Два пациента (37 и 59 лет) с ранними разрывами ЗСЛЖ II типа после ПМК успешно прооперированы J. Wei и соавт. [9, 18]. ПМК выполнялось с частичной резекцией его задней створки и пересечением хорд на 2—3 мм выше папиллярных мышц. Пусковым фактором разрывов послужила инфузия эпинефрина для стабилизации гемодинамики. Обоим больным проведена эндовентрикулярная пластика разрыва с аутотрансплантацией сердца. Единственным осложнением послеоперационного периода явилось нарушение проводимости, потребовавшее имплантации электрокардиостимулятора. Развитие блокады авторы связали с биатриальной методикой, рекомендуя в подобных случаях технику бикавального анастомоза. Наблюдения J. Wei подтверждают мнение других авторов о непредсказуемости разрывов ЗСЛЖ даже при скрупулезном соблюдении принципов протезирования [9, 10, 13, 31]. У 2 больных операция закончилась летальным исходом: пациент, прооперированный С. Campanella [11], скончался в результате коагулопатии; больного, оперированного R. Tosun [22], не удалось отключить от аппарата ИК. Основной спектр осложнений ближайшего послеоперационного периода после коррекции разрывов ЗСЛЖ представлен синдромом малого выброса, почечно-печеночной недостаточностью, коагулопатиями, респираторными осложнениями, раневой инфекцией. Это обусловлено длительностью ИК и пережатия аорты; повышенными объемами гемотрансфузии, пролонгированной (до 24 ч и более) искусственной вентиляцией легких, отсроченным (до 3—5 дней) сведением грудины, связанным с потенциальной вероятностью рецидива кровотечения [4, 31, 37, 42]. Развитие блокады и имплантацию ЭКС у ряда больных считают приемлемой ценой успешной коррекции фатального осложнения [14, 29, 37]. Протокол ведения ближайшего послеоперационного периода при коррекции разрывов ЛЖ ориентирует на снижение пред- и посленагрузки ЛЖ во избежание его перерастяжения и прорезывания швов; профилактику гипертонических кризов, особенно при экстубации; продленную (до 7—9 дней) седацию пациентов [19, 27, 39]. Чтобы избежать агрессивной инотропной поддержки, рекомендуют превентивное подключение контрпульсатора при выходе из ИК как для стабилизации гемодинамики с минимальными дозами катехоламинов, так и для снижения посленагрузки ЛЖ, подчеркивая целесообразность ее продолжения до 5—7 дней после стабилизации гемодинамики [9—11, 19]. По данным разных авторов, современные принципы герметизации способствовали снижению летальности при ранних разрывах ЛЖ после ПМК до 25,0—33,3% [7, 10]. В то же время анализ литературы показал, что это осложнение остается непредсказуемым и трудно конт-ролируемым, с летальностью в среднем не ниже 57,4% [31].
Заключение
Концепция тактики при разрывах задней стенки левого желудочка после протезирования митрального клапана ориентирована на восстановление целостности атриовентрикулярного продолжения эндовентрикулярной или трансаннулярной заплатой либо шовной коррекцией. Реимплантация протеза предпочтительна механическими модулями меньшего размера, при необходимости с частичной или полной супрааннулярной транслокацией протеза. Реимплантация низкопрофильных биопротезов меньшего размера — прерогатива хирурга. Наружная коррекция в условиях искусственного кровообращения оправдана в отсутствие спаек перикарда и при небольших разрывах II—III типов с операционным контролем адекватности коррекции чреспищеводной эхокардиографии. Верификация «продолжающихся» или сочетанных разрывов либо внутренних размеров разрыва, превышающих наружные, требует дополнительной эндокардиальной коррекции. При продолжающемся кровотечении целесообразна герметизация задней стенки сердца по Кабролю. В центрах с активно функционирующей программой пересадки сердца приемлема коррекция разрывов левого желудочка с применением техники аутотрансплантации сердца. Отсроченное сведение грудины при коррекции разрыва задней стенки левого желудочка остается прерогативой хирурга, при этом требуются особая внимательность персонала и резервная готовность аппарата искусственного кровообращения. Протокол ближайшего послеоперационного периода при коррекции разрывов задней стенки левого желудочка ориентирует на снижение пред- и посленагрузки левого желудочка: превентивное подключение контрпульсатора, минимальную инотропную поддержку, инфузию нитратов, профилактику гипертонических кризов, продленную седацию больных. В этой группе целесообразно продолжение контрпульсации до 5—7 дней, не ограничиваясь сроками стабилизации гемодинамики. Предложенный нами вариант закрытия спонтанного разрыва левого желудочка во время хирургического вмешательства показал хорошие результаты. Метод не требует выполнения длительных реконструктивных манипуляций, увеличивающих зону повреждения миокарда, и не ведет к компрометации бассейна огибающей артерии. Дальнейшее применение данной методики позволит более точно оценить ее действительную эффективность. В то же время при самой скрупулезной герметизации разрывов задней стенки левого желудочка после протезирования митрального клапана летальность остается высокой, являясь «…ночным кошмаром кардиохирурга, вспоминающего отчаянные попытки остановить кровотечение» [43].
Competing interest
Данная работа выполнена при поддержке гранта Президента Российской Федерации - МК-3296.2017.7



