ВВЕДЕНИЕ
Тяжелый острый респираторный синдром, вызванный коронавирусом (SARS-CoV-2), спровоцировал глобальную заболеваемость коронавирусной инфекцией–2019 (COVID-19). Быстрое распространение инфекции SARS-CoV-2 вылилось в беспрецедентный кризис общественного здравоохранения во всем мире. Хотя большинство случаев COVID-19 протекают бессимптомно или в легкой форме, COVID-19 может проявляться в виде тяжелой вирусной пневмонии [1].
С 2021 г. и по настоящее время во всем мире проводится активная кампания вакцинации против COVID-19 [2, 3]. В ряде исследований показана значительно меньшая частота заболевания COVID-19 среди вакцинированных лиц по сравнению с не вакцинированными. Помимо этого, отмечается более благоприятное течение заболевания в случае его возникновения у иммунизированных лиц. Результаты ряда работ свидетельствуют об эффективности вакцинации против COVID-19, а также подтверждают значительную роль массовой вакцинации в борьбе с пандемией [4–8].
В то же время имеются данные о наличии тяжелых случаев коронавирусной инфекции и у вакцинированных пациентов. В настоящий момент аспекты тяжелого течения COVID-19 у этих пациентов мало изучены [9–11].
Целью настоящего исследования стала оценка клинико-рентгенологических параметров, показателей системного воспаления и иммунного статуса у вакцинированных пациентов, заболевших COVID-19.
Задачи работы
1. Изучить клинико-рентгенологические особенности течения коронавирусной инфекции у вакцинированных и не вакцинированных пациентов.
2. Исследовать уровни биомаркеров системного воспаления в плазме крови у данных категорий больных.
3. Определить особенности показателей иммунного статуса у вакцинированных и не вакцинированных пациентов.
4. Оценить варианты и исходы течения заболевания у иммунизированных и не иммунизированных лиц, заболевших COVID-19.
5. Выявить возможные взаимосвязи между клинико-рентгенологическими параметрами, показателями системного воспаления и иммунного статуса.
МАТЕРИАЛ И МЕТОДЫ
В исследование было включено 137 человек. 1-ю группу (основную) составили 74 вакцинированных пациента, заболевшие COVID-19, среди них 64,52±6,08% женщин и 35,48±6,08% мужчин Медиана возраста в этой группе составила 61,5 [56; 65,75] лет. Во 2-ю группу (контрольную) вошли 63 больных коронавирусной инфекцией средней степени тяжести и тяжелого течения, не проходившие вакцинацию против COVID-19, среди них 55,36±6,64% женщин и 44,64±6,64% мужчин. Медиана возраста во 2-й группе равнялась 56,5 [46; 65,25] лет.
Критерии включения пациента в исследование:
- наличие диагноза СOVID-19, лабораторно идентифицированного методом полимеразной цепной реакции (ПЦР);
- наличие осложнений СOVID (развитие вирусной пневмонии средней и тяжелой степени тяжести);
- возраст от 18 до 75 лет включительно;
- наличие письменного информированного согласия.
Критерии невключения:
- возраст пациентов менее 18 лет и более 76 лет;
- наличие инфаркта миокарда менее чем за год до начала исследования;
- декомпенсированные соматические заболевания;
- тяжелая почечная (С4–5) и печеночная недостаточность (класс 2–3 по Чальд–Пью);
- хроническая обструктивная болезнь легких и бронхиальная астма в стадии обострения;
- наличие злокачественных новообразований, аутоиммунных заболеваний, болезней крови;
- психические расстройства, тяжелые поражения центральной нервной системы в стадии декомпенсации (по данным анамнеза);
- другие заболевания органов дыхания: рак легкого, активный туберкулез, интерстициальные заболевания легких, острые и хронические нагноительные заболевания легких, муковисцидоз, легочная гипертензия;
- беременные женщины или кормящие грудью.
Более 60% пациентов в обеих группах отмечали наличие контакта с больными COVID-19 до развития клинической картины заболевания. Время от возникновения симптомов до первичного обращения за медицинской помощью не имело значимых различий в обеих группах и составило в среднем 3 дня. Период от первичного появления симптомов до госпитализации как у вакцинированных, так и у не иммунизированных пациентов составил 6–7 дней.
Среди вакцинированных пациентов против COVID-19 20,97±5,17% прошли только один этап вакцинации, 14,52±4,47% были вакцинированы полностью в два этапа, однако с момента вакцинации до заболевания у них прошло менее 21 дня. 37,10±6,13% человек заболели коровирусной инфекцией спустя 3 нед и более после проведенной вакцинации, 27,4±5,67% – через 6 мес после вакцинации.
По наименованию применявшихся вакцин распределение было следующим: 82,26±4,85 % пациентов иммунизировались вакциной на основе платформы вектора аденовируса человека (ГамКовидВак), 6,45±3,12% – препаратом на основе пептидных антигенов (ЭпивакКорона), 11,29±4,02% – однокомпонентной цельновирионной инактивированной вакциной против COVID-19 на основе вируса SARS-CoV-2 (КовиВак) [12].
Набор пациентов для включения в исследование проходил на базе инфекционного госпиталя Краевой клинической больницы г. Красноярска с октября 2021 по апрель 2022 г.
Для оценки тяжести течения коронавирусной инфекции COVID-19 и определения показаний к введению препаратов блокаторов интерлейкина (ИЛ-6) с целью купирования «цитокинового шторма» применялись критерии Временных методических рекомендаций «Профилактика, диагностика и лечение коронавирусной инфекции (COVID-19)» Минздрава России (версия 13 от 14.10.2021 – версия 15 от 22.02.2022), утвержденных на данный период времени.
Степень дыхательной недостаточности оценивалась методом пульсоксиметрии с использованием аппарата Spirolab III.
Для определения прогноза исходов у пациентов с коморбидной патологией использовался индекс Чарлстона. Этот индекс учитывает ухудшение прогноза с каждым десятилетием: после 40 лет за каждые 10 лет добавляется по баллу. Индекс Чарлстона выше 3 баллов расценивался как высокий риск летального исхода. Также применялась система CIRS (The Cumulative Illness Rating Scale): с ее помощью проводится отдельная суммарная оценка состояния 14 систем органов, в каждой из которых предусматривается 5 степеней тяжести нарушения функции. CIRS оценивает коморбидность по сумме баллов от 0 до 56. Максимальные результаты, по мнению авторов, несовместимы с жизнью больных [13–15].
Степень поражения легочной ткани определялась с применением методики мультиспиральной компьютерной томографии (МСКТ) с помощью аппарата Somatom Emotion 6 Slice Configuration, производства фирмы Siemens.
Для оценки активности воспалительного процесса выполнялся общеклинический (лейкоциты, эритроциты, тромбоциты, гемоглобин, лейкоцитарная формула, нейтрофильно-лимфоцитарный индекс) и биохимический анализ с определением С-реактивного белка (СРБ), ферритина, прокальцитонинового теста (ПКТ), показателей коагулограммы (Д-димер), фибриногена, протромбинового индекса (ПТИ).
Определение ИЛ-6 (пг/мл) проводилось в соответствии с инструкцией по применению фирмы-производителя иммуноферментной тест-системы (Platinum ELISA, eBioscience, USA).
Оценка иммунного статуса с определением количества лимфоцитов, экспрессирующих маркеры (CD3+, CD4+, CD8+, CD19+, CD3+CD16+CD56+, CD3+HLADR+), выполнялась на проточном цитофлуориметре NAVIOS Flow Cytometer на базе иммунологической лаборатории КГБУЗ «Краевая клиническая больница» с использованием конъюгат-моноклональных антител (МКАТ) к соответствующим антигенам (набор IMK, Becton Сoulter, США). Исследование внутриклеточного кислородозависимого метаболизма нейтрофилов проводилось с помощью НСТ-теста в модификации А.Н. Маянского и М.Е. Виксмана (1979) [16].
Статистическая обработка данных осуществлялась с помощью пакета прикладным программ Statistica 12,0 for Windows. Количественные значения представлены в виде медианы (Ме) и интерквартильного интервала (Q1 и Q3), где Q1 – 25 процентиль, Q3 – 75 процентиль. Качественные переменные описаны абсолютными значениями и в виде процентных долей и их стандартных ошибок. При сравнительном анализе групп по количественным признакам использовался непараметрический U-критерий Манна–Уитни (не зафиксировано нормальное распределение выборок, определяемое по методу Колмогорова–Смирнова и критерию Шапиро–Уилка). Для оценки связи признаков применялся корреляционный анализ с расчетом корреляции по методу Спирмена. Различия считались статистически значимыми при р <0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В обеих группах в 100% случаев регистрировался лихорадочный синдром с повышением температуры тела до фебрильных значений. В группе не вакцинированных пациентов значимо чаще отмечались следующие клинические проявления: одышка, дыхательная недостаточность, поражение желудочно-кишечного тракта (ЖКТ), потеря вкуса и обоняния (табл. 1).
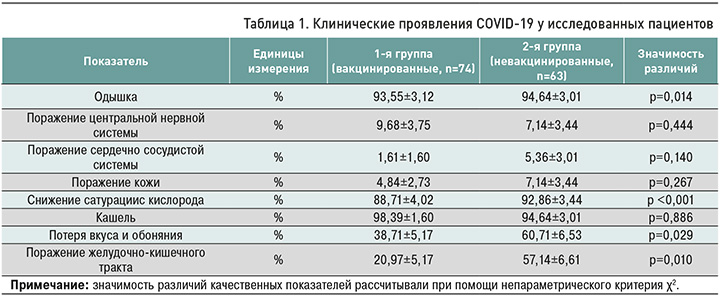
Потребность в оксигенотерапии была статистически больше у не вакцинированных пациентов – 96,43±2,48 против 85,48±4,47% у больных 1-й группы (р=0,041). Длительность оксигенотерапии у не иммунизированных больных составила 9 [6; 12] против 7 [5; 9] дней (р=0,013) у пациентов 1-й группы.
Индекс коморбидности, рассчитанный по методике Чарлстона, также оказался значимо выше во 2-й группе: 4 [1,75; 5,25] против 3 [2; 4] в 1-й (р <0,001), аналогичные результаты были получены и при оценке индекса коморбидности по CIRS. В группе невакцинированных пациентов установлена положительная корреляционная связь между потребностью в кислородотерапии и периодом обращения за медицинской помощью (r=0,63, p=0,002).
По данным МСКТ изменения в легочной ткани встречались в обеих группах пациентов, при этом больший объем и тяжесть поражения как при поступлении, так и на заключительных снимках регистрировались у пациентов, не проходивших вакцинацию (табл. 2).
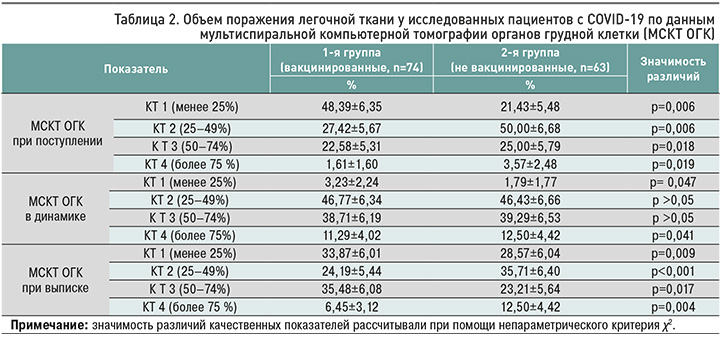
В обеих группах пациентам потребовалось введение блокаторов ИЛ-6 с целью купирования «цитокинового шторма» [17]. Так, данная терапия была проведена 83,87±4,67% пациентам в 1-й группе и 85,71±4,68% во 2-й когорте (р=0,090). В обеих группах препарат в среднем вводился на вторые сутки от момента госпитализации в стационар. В обеих когортах пациентов в большинстве случаев препаратом выбора являлся олокизумаб [18].
Во 2-й группе в 21,43±5,48% пациентам потребовалось повторное введение блокаторов ИЛ-6, тогда как в группе вакцинированных такая необходимость возникла только в 14,52± 4,47% случаев (р=0,040). Предпочтительным препаратом для повторного введения в обеих группах был сарилумаб.
В общеклиническом анализе крови как в основной группе, так и в контрольной группах при поступлении у четверти пациентов был выявлен лейкоцитоз, в среднем у 6% пациентов регистрировалась лейкопения, однако в большинстве случаев отмечались нормальные значения лейкоцитов. У трети пациентов в обеих группах при поступлении наблюдалась тромбоцитопения с тенденцией к нормализации на фоне проводимой терапии. Во 2-й группе значимо чаще имело место повышение абсолютного количества нейтрофилов: 33,93±6,33 против 20,97±5,17% в 1-й группе (р=0,035). Снижение уровня лимфоцитов отмечалось у 61,29±6,19% вакцинированных и у 64,29±6,40% не вакцинированных пациентов (р=0,176). Нейтрофильно-лимфоцитарный индекс как один из возможных маркеров тяжелого течения COVID-19 был значимо выше в группе не иммунизированных пациентов: 4,9 [2,4; 7,375] против 3,3 [1,4; 5,4] в 1-й группе (р=0,006). Во 2-й группе наблюдалась отрицательная корреляция между объемом поражения легочной ткани и уровнем абсолютных лимфоцитов в периферической крови (r=- 0,47, p=0,002). Согласно литературным данным, ус повышенное абсолютное количество нейтрофилов и соотношение нейтрофилов/лимфоцитов служит прогностическим признаком острого респираторного дистресс-синдрома (ОРДС) и смерти при COVID-19 [11, 19].
При изучении маркеров системной воспалительной активности отмечалось значимое повышение уровней С-реактивного белка, Д-димера и ИЛ-6 в обеих группах, при этом их наибольшие значения регистрировались у пациентов 2-й группы.
В динамике на фоне лечения отмечалось снижение указанных показателей до нормальных значений в обеих группах. У не иммунизированных больных было обнаружено существенное повышение содержания ферритина (табл. 3). При анализе уровня прокальцитонина (ПКТ) значимых отклонений от референсных значений выявлено не было. Уровень фибриногена оказался повышен в обеих группах и составил в среднем 5 г/л. Протромбиновый индекс был в норме у обеих категорий больных.
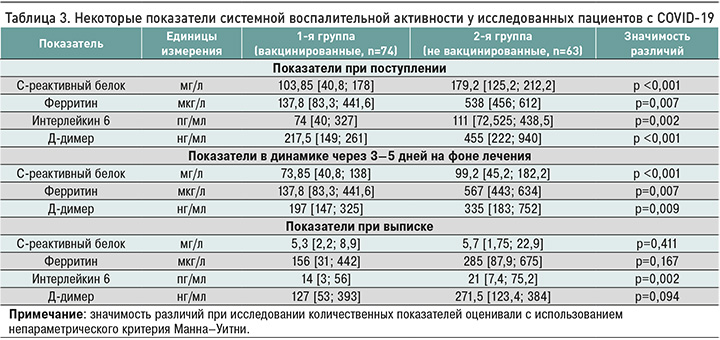
Результаты проведенного корреляционного анализа свидетельствуют о взаимосвязи клинических показателей и маркеров системного воспаления. Так, в группе вакцинированных пациентов были установлены положительные корреляционные взаимосвязи между снижением показателей пульсоксиметрии и уровнем С-реактивного белка (r=0,25, p=0,0049) и ферритином (r=0,64, p=0,031). В группе не иммунизированных больных выявлены положительные взаимосвязи между уровнем С-реактивного белка и нейтрофильно-лимфоцитарным индексом (r=0,73, p=0,0015), между объемом поражения легочной ткани при поступлении и уровнем ИЛ-6 (r=0,45, p=0,026).
Всем пациентам при поступлении в стационар была выполнена оценка показателей гуморального иммунитета против COVID-19. У пациентов основной группы регистрировался высокий титр уровня антител класса G: коэффициент позитивности (КП) в ней составил 11,85 [7,4; 12,2], против 3,5 [0; 4,6] в контрольной группе (р=0,041). В то же время уровень IgМ был значимо выше в группе не вакцинированных больных – КП 6,9 [3,45; 10,35] против 0,9 [0; 2,3] в когорте вакцинированных (р=0,006).
В группе вакцинированных пациентов отмечалось некоторое повышение уровней общего IgA (4,3 [2,7; 5,4] мг/мл) и общего IgG (17,5 [7,8; 21,7] мг/мл) по сравнению с не вакцинированными пациентами (3,9 [2,15; 4,3] мг/мл (р=0,074) и 12,55 [8,85; 16] мг/мл соответственно, р=0,015).
При исследовании клеточного звена иммунитета обращает на себя внимание значимое снижение уровней CD3+, CD4+, CD8+ лимфоцитов у пациентов 2-й группы в сравнении с показателями больных 1-й группы (табл. 4). Полученные нами данные согласуются с результатами других авторов. Так, в исследованиях Долгушиной Н.В. с соавт. [20], Xu B. et al. [21] продемонстрировано, что тяжелое течение коронавирусной инфекции ассоциировано с низким содержанием иммунных клеток (CD3 +, CD3 + CD8 +, СD19 +, CD19 + CD5 +).
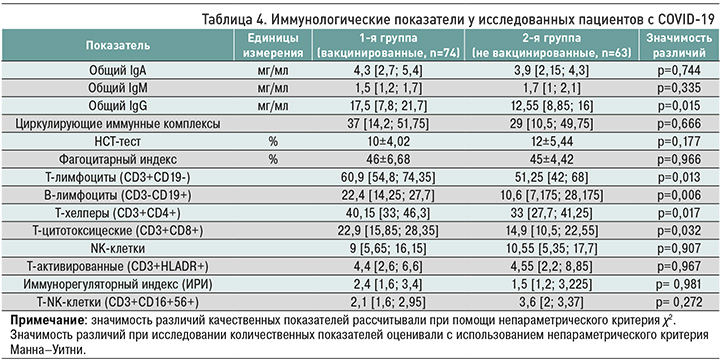
В группе вакцинированных пациентов выявлена отрицательная корреляционная взаимосвязь между уровнем Т-лимфоцитов и нейтрофильно- лимфоцитарным индексом (r=- 0,53, p=0,018). Среди не иммунизированных больных зарегистрирована положительная корреляционная взаимо-связь между объемом изменений в легочной ткани и показателем иммунорегуляторного индекса (r=0,56, p=0,0001). Полученные результаты также согласуются с рядом работ как российских [22], так и зарубежных авторов [23, 24]: снижение функции Т-клеточного звена иммунитета и гиперактивация врожденной системы иммунитета при COVID- 19 приводят к «цитокиновому шторму», гиперкоагуляции, тромбообразованию, которые ответственны за прогрессирование поражения легочной ткани.
При оценке тяжести течения и исходов заболевания более агрессивное течение коронавирусной инфекции отмечалось у пациентов, не проходивших профилактическую вакцинацию. Так, лечение в условиях отделения реанимации и интенсивной терапии (ОРИТ) в этой группе потребовалось 35,71±6,40% пациентам, среди вакцинированных – 8,06 ± 3,46% (р <0,001). Длительность лечения в ОРИТ была значимо больше в контрольной группе – 11 [9,5; 14,75] против 6,5 [4; 11,25] дней в основной (р=0,049). В обеих группах средним сроком перевода в ОРИТ были пятые сутки от момента госпитализации. 100% пациентов из группы не вакцинированных, проходивших лечение в реанимации, нуждались в инвазивной вентиляции легких (ИВЛ), тогда как в группе иммунизированных аналогичный показатель равнялся 80,00±17,89% (р=0,046). Медиана длительности ИВЛ у пациентов второй группы составила 10 [8; 11,25] дней против 3,5 [1; 5,25] в основной (р=0,008).
В группе вакцинированных пациентов были отмечены слабые положительные корреляции с индексом коморбидности Чарлстона и необходимости лечения в ОРИТ (r=0,28, p=0,025), а также установлена слабая положительная взаимосвязь между объемом поражения легких и исходом заболевания (r=0,282, p=0,024). В группе не вакцинированных пациентов отмечена положительная взаимосвязь между уровнем СРБ и длительностью лечения в ОРИТ (r=0,48, p=0,044). В этой же когорте отмечалась отрицательная корреляция между уровнем CD4+ лимфоцитов и длительностью нахождения в условиях реанимации (r=-0,69, p=0,002). По данным некоторых авторов, абсолютное количество лимфоцитов является прогностическим фактором тяжести заболевания и смертности, при этом значительное снижение периферических CD4+ и CD8+ Т-клеток отмечается в тяжелых случаях COVID-19 [25].
Необходимость в более длительной госпитализации отмечалась в группе не вакцинированных пациентов – 17 [13,5; 20,5] против 11 [9; 14,75] больных в основной группе (р=0,004).
При оценке исходов заболевания в обеих группах большинство пациентов было выписано на амбулаторный этап с улучшением состояния, однако смертность в стационаре была выше у не иммунизированных пациентов – 25,00±5,79 против 6,45±3,12% (р=0,039), причем летальный исход у вакцинированных пациентов в основном наблюдался среди больных, прошедших только первый этап вакцинации. При изучении структуры смертельных исходов в зависимости от причины более чем в 2/3 случаев в обеих группах ею был септический шок, еще 1/3 приходилась на ОРДС.
Таким образом, проведенный анализ свидетельствует о том, что у пациентов, не проходивших профилактическую вакцинацию, происходит более тяжелое течение заболевания, которое проявляется бóльшим объемом поражения легочной ткани, выраженными явлениями дыхательной недостаточности, более частым развитием серьезных осложнений заболевания, требующих госпитализации в ОРИТ и проведения ИВЛ, и в большем проценте случаев заканчивается неблагоприятным исходом.
Вакцинированные пациенты тоже заболевают COVID-19, однако развернутая картина заболевания чаще регистрируется у больных, не успевших завершить второй этап вакцинации, или в срок, когда полноценный титр защитных антител еще не сформировался. В результате проведенного анализа установлено, что у вакцинированных пациентов имеет место более благоприятное течение заболевания, характеризующееся менее распространенным объемом поражения легочной ткани как в дебюте заболевания, так и при выписке, меньшим количеством койко-дней, проведенных в стационаре (в том числе на кислородной поддержке), менее длительным пребыванием пациентов в ОРИТ (в том числе на ИВЛ). Кроме того, у таких пациентов заболевание в большем проценте случаев заканчивалось выздоровлением.
ЗАКЛЮЧЕНИЕ
1. Более тяжелое течение коронавирусной инфекции отмечалось у пациентов, не проходивших вакцинацию. Это проявлялось более частой потребностью в проведении респираторной поддержки и необходимостью лечения в условиях ОРИТ ввиду большого объема поражения легочной ткани.
2. Наиболее высокие показатели системного воспаления, такие как уровни С-реактивного белка, ИЛ-6, ферритина, нейтрофильно-лимфоцитарный индекс, регистрировались у не вакцинированных пациентов и были взаимосвязаны с явлениями дыхательной недостаточности, длительностью лечения в ОРИТ и неблагоприятным исходом заболевания.
3. При оценке иммунного статуса у не вакцинированных пациентов выявлялись нарушение функции Т-клеточного звена иммунитета и снижение активности гуморального иммунитета, ассоциированные с показателями системного воспаления, объемом поражения легочной ткани и прогнозом заболевания.
4. В обеих группах регистрировались летальные исходы заболевания COVID-19, однако значимо больший процент смертей пришелся на группу не вакцинированных пациентов.
5. При проведении корреляционного анализа в группе вакцинированных и не вакцинированных пациентов течение коронавирусной инфекции, развитие дыхательной недостаточности и объем поражения легочной ткани оказались взаимо-связаны с показателями системного воспаления, иммунного статуса и исходом заболевания.



