ВВЕДЕНИЕ
Ишемическая болезнь сердца (ИБС) по сей день остается наиболее распространенным заболеванием сердечно-сосудистой системы, которая является основной причиной смертности и инвалидизации населения в большинстве стран [1]. К наиболее распространенным формам ишемической болезни сердца относятся стабильная стенокардия, нестабильная стенокардия, инфаркт миокарда (с подъемом и без подъема сегмента ST) и/или внезапная сердечная смерть [1, 2] За последние десятилетия наблюдалось снижение смертности от этой группы заболеваний, в первую очередь за счет снижения острых инфарктов миокарда с подъемом сегмента ST, благодаря созданию доступной сети сосудистых центров, однако острый коронарный синдром (ОКС) без подъема сегмента ST, включая нестабильную стенокардию, сохраняет свои лидирующие позиции среди причин смертности [1, 2]. В связи с этим поиск воспроизводимых маркеров неблагоприятного течения ишемической болезни сердца не теряет своей актуальности.
Жировая ткань на протяжении многих лет рассматривается как важный фактор в патогенезе сердечно‐сосудистых заболеваний (ССЗ), в первую очередь за счет высвобождения активных молекул в системный кровоток [3, 4]. Однако, помимо висцерального жира, исследователи в последнее время были сосредоточены на роли локальных жировых депо в патогенезе ССЗ. В этом аспекте эпикардиальному жиру отводится потенциально важная роль в патофизиологии ИБС, учитывая наличие его метаболической активности и тесной анатомической близости с сердцем [4, 5].
Таким образом, целью исследования стала оценка возможности прогнозирования негативного течения стенокардии в течение года после госпитализации по поводу ОКС на основании толщины эпикардиального жира и концентрации адипокинов у лиц с метаболическими нарушениями.
МАТЕРИАЛ И МЕТОДЫ
В исследование вошли мужчины и женщины (медиана возраста составила 62 [55; 67] года), госпитализированные в отделение неотложной кардиологии регионального сосудистого центра в 2018–2019 гг. с диагнозом «нестабильная стенокардия». Пациенты имели средний или высокий риск по шкале Grace 2.0. Диагноз «нестабильная стенокардия» был выставлен на основании клинических рекомендаций Российского кардиологического общества для пациентов с ОКС без стойкого подъема сегмента ST электрокардиограммы (2020), рекомендаций Европейского общества кардиологов (ESC) по ведению пациентов с ОКС без стойкого подъема сегмента ST (2020) [1, 6].
Исследование было проведено в соответствии с принципами Хельсинской декларации, протокол исследования одобрен независимым локальным этическим комитетом. Все пациенты дали информированное согласие на участие и обработку результатов исследования.
Критерии включения в исследование: пациенты мужского и женского пола от 40 до 80 лет; наличие подписанного добровольного информированного согласия на участие в исследовании; наличие диагноза «нестабильная стенокардия» со средним и высоким риском по шкале Grace 2.0; наличие синусового ритма по электрокардиограмме.
Критерии невключения: отсутствие гемодинамически значимого поражения коронарного русла и отсутствие показаний для стентирования коронарных артерий; неудовлетворительная визуализация при трансторакальной эхокардиографии; постоянная форма фибрилляции предсердий; атриовентрикулярная блокада II–III степени; возраст пациента менее 18 лет; гемодинамически значимые пороки сердца; анемия средней и тяжелой степени.
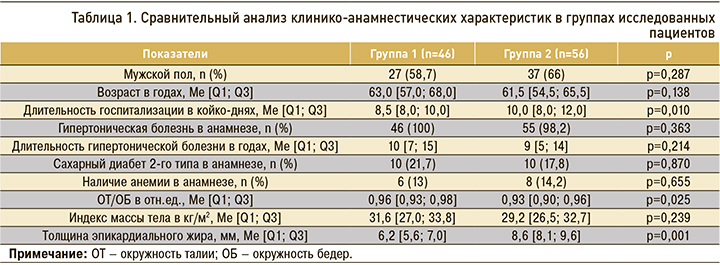
Исследование выполнялось в два этапа. На первом, помимо сбора анамнеза, всем участникам проводилось клиническое обследование с включением оценки антропометрических показателей (измерялись окружность талии и окружность бедер с последующим расчетом отношения окружности талии к окружности бедер, рост и вес тела). Измерение уровня артериального давления (АД) осуществлялось по методу Н.С. Короткова [7, 8]. Клинико-анамнестическая характеристика групп представлена в таблице 1.
Было выполнено стандартное лабораторное тестирование на анализаторе COBAS INTEGRA 400 plus (Roche) для пациентов с ОКС, дополнительно определялась концентрация адипокинов (лептина, адипонектина) и провоспалительных цитокинов (интерлейкина 6, фактора некроза опухоли-альфа).
Чрескожное коронарное вмешательство и стентирование одной или нескольких коронарных артерий было проведено в первые трое суток с момента госпитализации в отделение на ангиографическом комплексе SIEMENS Artis Zee Floor в зависимости от риска неблагоприятных сердечно-сосудистых событий по шкале GRACE. Пациентам были установлены коронарные стенты с лекарственным покрытием Зотаролимус Resolute Integrity фирмы Medtronic.
Эхокардиографическое исследование проводилось после коронарного стентирования на 2–4-е сутки с момента госпитализации, на аппарате Toshiba Aplio 500 в соответствии с современными рекомендациями [9]. Толщину эпикардиальной жировой ткани визуализировали при положении пациента на левом боку из парастернального сечения по длинной оси. Межжелудочковая перегородка, в частности корень аорты, рассматривались в качестве контрольных точек для измерения [10]. Эпикардиальный жир представляет собой эхонегативное пространство, простирающееся от эпикардиальной поверхности до париетального перикарда за свободной стенкой правого желудочка, его измерения проводятся вертикально в области с наибольшим размером [10, 11]. Измерение выполнялось в течение трех сердечных циклов, за значение толщины эпикардиального жира принимали среднее из последовательных величин [11, 12].
Пациенты были разделены на две группы в зависимости от толщины эпикардиального жира (ТЭЖ): 1-я группа – пациенты с ТЭЖ ≤7,6 мм (n=46); 2-я группа – ТЭЖ >7,6 мм (n=56).
Выбранные диапазоны толщины для каждой группы основываются на ряде ранее выполненных работ, где было показано, что толщина эпикардиального жира более 7 мм связана с риском кардиометаболических событий [11, 13]. Однако наиболее убедительные результаты связи увеличенной толщины эпикардиального жира и риска развития атеросклеротического поражения сердца были получены в работе Jeong J. et al. от 2007 г. [14], где были установлены референсные значения толщины жира на уровне 7,6 мм.
Значимых различий между группами в зависимости от пола, возраста, наличия и продолжительности гипертонической болезни в анамнезе, сахарного диабета, а также наличия анемии легкой степени тяжести получено не было.
Были получены значимые различия между пациентами в зависимости от продолжительности госпитализации: так, лицам во 2-й группе потребовалось более длительное нахождение на стационарном лечении (р=0,010).
Анализ антропометрических показателей показал наличие у исследуемых ожирения или избыточной массы тела. В группе с толщиной эпикардиального жира менее 7,6 мм значение индекса массы тела было выше, однако это различие не было статистически значимым. Значимое различие было получено в показателях отношения окружности талии к окружности бедер (р=0,025), которое также оказалось выше в первой группе.
Статистическая обработка результатов исследования выполнялась с использованием пакета прикладных программ Microsoft Office 2019 для работы с электронными таблицами и SPSS 26.0. При проведении анализа данных применялись стандартные методы описательной статистики с представлением количественных результатов в виде среднего арифметического (M) ± стандартного отклонения (SD) при нормальном распределении показателей и в виде медианы (Ме) и 25 и 75 квартилей значений ([Q1; Q3]) при распределении отличном от нормального. Качественные переменные выражались в виде частоты встречаемости признака в процентах и абсолютных значениях (n). Характер распределения количественных данных в представленном исследовании анализировался с помощью критерия Колмогорова–Смирнова.
Сравнение количественных признаков в группах осуществлялось с применением критерия Манна–Уитни. Для сравнения качественных признаков в работе использовались таблицы сопряженности с вычислением критерия Хи2 Пирсона. В случае анализа четырехпольных таблиц при ожидаемом диапазоне наблюдений хотя бы в одной ячейке менее 10, но более 5, рассчитывался критерий Хи2 Пирсона с поправкой Иейтса; при менее 5 ожидаемых наблюдениях в оценке уровня значимости различий применялся точный критерий Фишера.
Статистически значимыми в настоящем исследовании выступали уровни р <0,05.
РЕЗУЛЬТАТЫ
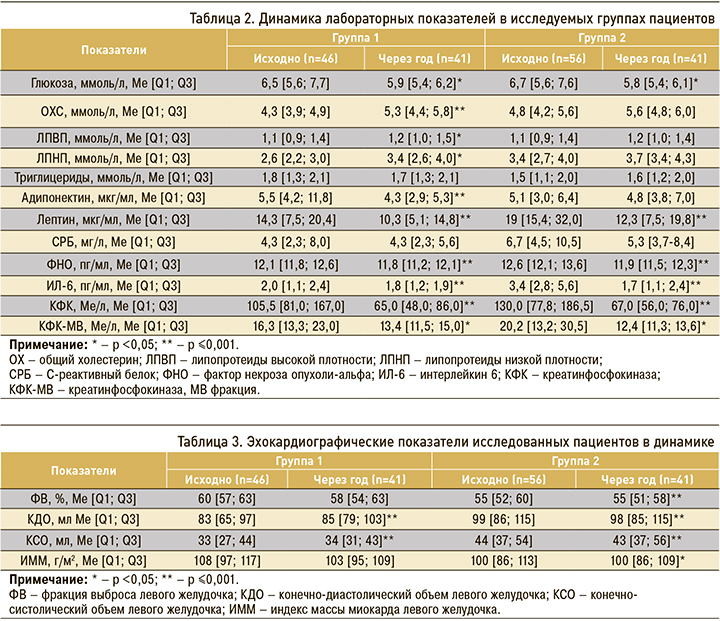
В таблице 2 представлены лабораторные показатели исследованных пациентов на момент включения и через 12 мес. При включении в исследование во 2-й группе было получено значимое увеличение уровня общего холестерина (р=0,023), липопротеидов низкой плотности (р=0,002) и уровня триглицеридов (р=0,036), кроме того, наблюдалось значимое повышение концентрации С-реактивного белка (р=0,007), лептина (р=0,001), интерлейкина 6 (р=0,001) и фактора некроза опухоли-альфа (р=0,001). Концентрация адипонектина оказалась значимо выше в 1-й группе (р=0,019).
В таблице 3 отражены структурно-функциональные параметры сердечной мышцы в группах на момент включения в исследование и через 12 мес. При сравнении исходных показателей между группами были получены статистически значимые различия в зависимости от фракции выброса левого желудочка (р=0,026) и индекса массы миокарда (р=0,035): так, в 1-й группе значение фракции выброса и индекса массы миокарда было выше, при этом во 2-й группе было выявлено значимое увеличение конечного диастолического (р=0,001) и конечного систолического объема левого желудочка (р=0,001).
Через 12 мес пациенты были приглашены на контрольный визит, в рамках второго (проспективного) этапа исследования. Всего повторно опрошено 89 пациентов (87,2%) – 44 человека из 1-й и 45 человек из 2-й группы. 13 пациентов (12,7%) отказались повторно контактировать, 7 человек не смогли явиться на контрольное обследование (были опрошены по телефону о имеющихся в течение года госпитализациях, утяжелении функционального класса стенокардии, ухудшении состояния качества жизни, а также о принимаемой терапии). Запланированный объем обследований был выполнен для 82 участников, что составило 80,4% от изначально включенных в исследование (41 человек из 1-й группы и 41 из 2-й).
Сравнительный анализ лабораторных показателей, представленный в таблице 2, показал закономерное снижение острофазных маркеров в обеих группах через год после включения. В то же время неожиданным было повышение уровней общего холестерина и липопротеидов низкой плотности, а также отсутствие повышения уровней адипонектина и липопротеидов высокой плотности через год после индексного события.
Значимые различия лабораторных показателей в 1-й группе в динамике были выявлены в отношении глюкозы крови (р=0,005), общего холестерина (р=0,001), липопротеидов высокой (р=0,002) и низкой плотности (р=0,032), уровня адипонектина (р=0,001), лептина (р=0,001), фактора некроза опухоли-альфа (р=0,001), концентрации интерлейкина 6 (р=0,001), креатинфосфокиназы (р=0,001) и креатинфосфокиназы МВ фракции (р=0,007).
Во 2-й группе значимые различия в динамике были установлены в отношении глюкозы (р=0,020), скорости оседания эритроцитов (р=0,001), лептина (р=0,001), фактора некроза опухоли-альфа (р=0,001) и интерлейкина-6 (р=0,001), креатинфосфокиназы (р=0,001) и креатинфосфокиназы МВ фракции (р=0,002).
В ходе исследования была разработана прогностическая модель для определения риска утяжеления стенокардии в зависимости от пола, возраста, антропометрических и анамнестических данных, а также результатов лабораторных и клинических исследований. В таблице 4 указаны факторы, оказывающие влияние на риск утяжеления стенокардии по результатам однофакторного анализа.

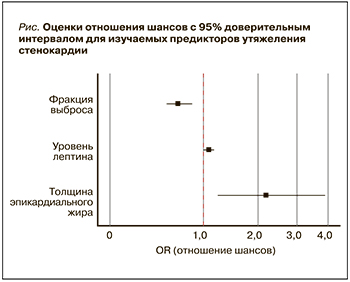
При проведении многофакторного анализа статистически значимое влияние на вероятность утяжеления стенокардии оказывали такие факторы, как уровень лептина, значение ФВ и толщина эпикардиального жира по длинной оси на момент включения в исследование. Характеристики каждого из этих факторов представлены в таблице 5.
Наблюдаемая зависимость описывается уравнением (1):
Р = 1/(1 + e-z) × 100% (1);
z = 15,43 + 0,07 × Xлептин исходно - 0,42 × XФВ ЛЖ исходно+ 0,78 × ХЭЖдлин исходно, ,где Р – вероятность утяжеления стенокардии (%); Xлептин исходно – уровень лептина на момент включения в исследование (мкг/ мл); XФВ ЛЖ исходно – значение ФВ ЛЖ на момент включения в исследование (%); ХЭЖ длин исходно – толщина эпикардиального жира по длинной оси на момент включения в исследование.
Полученная регрессионная модель является статистически значимой (p <0,001). Исходя из значения коэффициента детерминации Найджелкерка, модель (1) учитывает 73,6% факторов, определяющих вероятность утяжеления стенокардии.
На рисунке сопоставлены значения отношения шансов с 95% ДИ для изучаемых факторов, вошедших в модель (1).
ОБСУЖДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ), включающие нестабильную стенокардию, остаются ведущей причиной смертности во всем мире, несмотря на значительное улучшение методов диагностики и подходов к лечению [1]. Сегодня наиболее изученной причиной развития коронарной болезни сердца является атеросклеротическая болезнь [15].
Атеросклероз представляет собой хроническое заболевание, в патогенезе которого ведущую роль играет отложение липидов в стенке артерий [15, 16]. Липопротеиды низкой плотности (ЛПНП), содержащие аполипопротеин В, признаны основной движущей силой в развитии атеросклеротической болезни сердца и ее клинических последствий [16, 17]. Они выступают ключевыми доставщиками холестерина в стенку артерий [17]. Однако патофизиологические и генетические компоненты атеросклеротической болезни сердца до конца не изучены [15].
В настоящее время активно исследуется роль увеличенного объема эпикардиальной жировой ткани в нарушении липидного и глюкозного обмена [18]. В ряде ранее выполненных работ была продемонстрирована связь между толщиной эпикардиального жира и снижением концентрации ЛПВП и повышении уровня общего холестерина и ЛПНП [18].
В нашем исследовании на момент включения показатели липидного спектра (общий холестерин, ЛПНП) были повышены в обеих группах, однако во 2-й группе оба указанных параметра были значимо выше.
При анализе лабораторных данных через 12 мес целевые значения показателей липидного спектра достигнуты не были, напротив, концентрация ЛПНП и общего холестерина имела тенденцию к повышению. Вероятно, это связано с неадекватной дозой статинов или отсутствием комбинированной терапии при неэффективности монотерапии статинами на амбулаторном этапе лечения.
Сегодня эпикардиальный жир рассматривается в качестве метаболически активной ткани: так, рядом исследователей была показана его роль как источника медиаторов воспаления [4, 5]. Первые исследования, демонстрирующие экскреторную активность эпикардиального жира, были выполнены Mazurek T. et al. еще в 2003 г. [19]. Было показано, что повышенная толщина эпикардиального жира, у лиц с многососудистым поражением коронарного русла, в сравнении с подкожно жировой тканью, значимо чаще сопряжена с повышенной продукцией воспалительных цитокинов (ИЛ-6, ФНО-α и др.). К тому же воспаление эпикардиальной жировой ткани не зависело от степени ожирения и наличия диабета. Однако данное исследование имело ряд ограничений [4]. В 2011 г. Hirata Y. et al. продемонстрировали более высокую концентрацию воспалительных макрофагов М1, чем противовоспалительных макрофагов М2, в образцах эпикардиальной жировой ткани, полученных от пациентов с нестабильной стенокардией. Известно, что повышенная концентрация макрофагов М1 приводит к дестабилизации покрышек бляшек в коронарных артериях и последующему их разрыву [3].
В нашем исследовании в группе участников со значениями толщины эпикардиального жира более 7,6 мм наблюдалось значимое увеличение уровня С-реактивного белка, интерлейкина 6 и фактора некроза опухоли-альфа в сравнении с группой, где этот показатель был менее 7,6 мм, что можно расценивать как вклад увеличенной толщины эпикардиального жира в повышение концентрации указанных медиаторов воспаления. В то же время следует отметить, что забор крови осуществлялся у пациентов из системного (периферическая вена), а не коронарного кровотока, что значительно ограничивает вышеописанное заключение. Данный вопрос представляет значительный интерес и планируется к рассмотрению в будущем.
Уровени интерлейкина 6, фактора некроза опухоли-альфа, С-реактивного белка через год после индексного события имели нормальные значения в обеих группах, что было ожидаемо с учетом перенесенного острого коронарного события. Однако во 2-й группе вышеперечисленные показатели оставались значимо бόльшими.
Еще в 2000 гг. Iacobellis G. et al. продемонстрировали, что эпикардиальная жировая ткань может функционировать как эндокринный орган, секретируя различные адипокины, в первую очередь адипонектин и лептин [20]. В дальнейшем Nabati M. et al. [11] на своей выборке подтвердили взаимосвязь эпикардиального жира с коронарным атеросклерозом, причем, что не менее важно, они выявили взаимосвязь между развитием коронарной болезни сердца и секретируемыми эпикардиальными адипоцитокинами.
При сравнении уровней адипонектина и лептина в группах в зависимости от толщины эпикардиального жира было выявлено значимое увеличение концентрации лептина во 2-й группе, а также значимое снижение концентрации адипонектина в той же группе пациентов, что согласуется с результатами ранее выполненных работ [12].
Через год наблюдалось снижение уровня лептина в группах, однако ожидаемого увеличения концентрации адипонектина получено не было, к тому же во 2-й группе наблюдалось некоторое дополнительное снижение уровня адипонектина. Таким образом, представленная динамика адипокинов в течение года, а также сохраняющаяся сниженная продукция адипонектина через год после острого коронарного события, вероятно, может свидетельствовать о метаболической активности эпикардиальной жировой ткани и рассматриваться как возможный фактор прогрессирования атеросклеротического процесса в коронарном русле.
Эпикардиальная жировая ткань во многих исследованиях рассматривалась как значимый источник фиброзирования миокарда с нарушением диастолической функции левого желудочка независимо от метаболического статуса или наличия ИБС [12].
Анализ структурно-функциональных изменений сердечной мышцы показал значимое снижение сократительной способности миокарда левого желудочка во 2-й группе при значимом увеличении объемных показателей (конечный диастолический и конечный систолический объем). Полученные данные, вероятно, свидетельствуют о более выраженных процессах ремоделирования сердечной мышцы у лиц с нестабильной стенокардией и толщиной эпикардиального жира более 7,6 мм. Однако данное заключение требует дальнейшего изучения в связи со сложностью подтверждения влияния только толщины эпикардиального жира на снижение сократительной способности сердца.
Дизайн нашего исследования предполагал оценку возможности прогнозирования наступления неблагоприятного исхода (утяжеления стенокардии) у пациентов, перенесших госпитализацию по поводу нестабильной стенокардии и выполненным стентированием коронарной артерии с имеющимися метаболическими нарушениями, исходя из толщины эпикардиальной жировой ткани. Для решения этой задачи была построена регрессионная модель.
С учетом полученной регрессионной модели к наиболее значимым факторам риска утяжеления стенокардии в течение года после индексного события (госпитализация по поводу нестабильной стенокардии) относятся увеличение уровня лептина – при его повышении на 1 мкг/мл шансы на утяжеление стенокардии возрастают в 1,08 раза (95% ДИ: 1,0–1,16); снижение фракции выброса левого желудочка – увеличение значения этого параметра на 1% снижает вероятность утяжеления стенокардии в 1,52 раза (95% ДИ: 0,52–2,84); увеличенная толщина эпикардиальной жировой ткани по длинной оси (наиболее значимый фактор) – при повышении этого показателя на 1 мм вероятность утяжеления стенокардии возрастает в 2,18 раза (95% ДИ: 1,21–3,93).
ЗАКЛЮЧЕНИЕ
Таким образом, толщина эпикардиального жира более 7,6 мм, а также повышенная концентрация лептина и сниженная фракция выброса левого желудочка выступают независимыми предикторами неблагоприятного течения стенокардии в течение 12 мес у лиц с метаболическими нарушениями, перенесших коронарную реваскуляризацию по поводу нестабильной стенокардии.



