ВВЕДЕНИЕ
Синдром старческой астении (ССА), или «старческой хрупкости», – широко распространенное состояние среди людей пожилого и особенно старческого возраста, связанное со снижением физической и функциональной активности, мышечной массы, склонностью к падениям и когнитивными расстройствами различной степени выраженности. Помимо возраста, на организм пожилого человека оказывают влияние хронические заболевания, образ жизни, характер питания, социально-экономические условия жизни человека [1].
Часто пациенты с ССА обращаются за медицинской помощью по поводу других соматических заболеваний, из-за чего выявление патологии задерживается, так как первичной диагностикой вынуждены заниматься не геронтологи и гериатры, а специалисты другого профиля – чаще неврологи, эндокринологи и др. Именно поэтому скрининг на наличие ССА с использованием коротких опросников и шкал должен осуществляться везде, где пожилой человек встречается с медицинским работником: в кабинетах участкового врача/врача общей практики, при нахождении на стационарном лечении, в отделениях и кабинетах медицинской профилактики, центрах здоровья [2]. Осуществление мер по выявлению лиц с признаками ССА предупреждает его развитие и прогрессирование, способствует сохранению когнитивных функций и функциональной независимости пациентов.
Цель исследования – определить роль ожирения как предиктора снижения физической и функцио-нальной активности, а также когнитивных нарушений у лиц старше 75 лет.
Задачи:
1. оценить частоту встречаемости признаков ССА среди обследуемых пациентов;
2. выявить разницу в показателях ССА у лиц с нормальным индексом массы тела (ИМТ) и среди пациентов, страдающих ожирением;
3. определить зависимость показателей опросников, данных динамометрии от ИМТ.
МАТЕРИАЛ И МЕТОДЫ
Исследование включало 40 пациентов терапевтического отделения в возрасте 80,2±3,8 лет – группу мужчин 80,9±5,5 лет (n=1) и группe женщин в возрасте 79,5±3,6 лет (n=21), которые были сопоставимы друг с другом по возрасту и заболеваниям. Наиболее часто пациенты наблюдались по поводу сердечно-сосудистых заболеваний (72,3%), хронической обструктивной болезни легких (8,2%), ожирения (28,6%), сахарного диабета (7,5%).
В исследование не включались пациенты с выраженной полиорганной недостаточностью, заболеваниями в стадии декомпенсации, нарушениями, затрудняющими передвижение и самообслуживание. Вероятность ССА оценивалась с применением опросника «Возраст не помеха», оценка риска падений у госпитализированных пациентов – посредством шкалы Морсе, когнитивные нарушения – при помощи опросника MINI-COG и Шкалы оценки психического статуса (Mini-Mental State Examination, MMSE).
Оценка состояния мышечной системы всем участникам исследования проводилась путем определения силы кистей с помощью динамометра ДК-50 (ЗАО «Нижнетагильский медико-инструментальный завод», г. Нижний Тагил). Измерения выполнялись на каждой руке трижды, выбирался наилучший результат (в деканьютонах – daN). Затем вычислялся средний суммарный показатель правой и левой руки. Значения менее 16 daN у женщин и менее 27 daN у мужчин расценивались как признак вероятной саркопении.
Статистическая обработка результатов исследования осуществлялась с использованием программного обеспечения, включающего электронные таблицы Excel 7.00, пакеты статистических программ BioStat (версия 5.9.8.5, AnalystSoft, Copyright 2023). Вычислялись показатели среднего значения и стандартного отклонения и их различия по критерию Стьюдента. Анализ зависимостей проводился методом Пирсена. За уровень достоверности принималось значение p <0,05.
РЕЗУЛЬТАТЫ
ИМТ участников составил 30,1±4,6 кг/м2, результаты опросника «Возраст не помеха» – 3,7±1,6 баллов, шкалы Морсе – 61,9±20,5 баллов. По данным опросника «Возраст не помеха», показатели 5–7 баллов были выявлены у 14 человек (35% случаев), что говорит о вероятной старческой астении. По данным шкалы Морсе, у 5% (2 человека) не было риска падений (0–24 баллов), у 37,5% (15 человек) имелся низкий (25–50 баллов), у 57,5% (23 человека) – высокий риск падений (≥51 баллов).
Показатели когнитивного статуса, согласно опроснику MINI-COG, составили 3,3±0,9 баллов, по шкале MMSE – 21,1±4,3 баллов. По результатам опросника MINI-COG, 11 человек (27,5%) набрали менее 3 баллов, что является одним из показателей деменции. Шкала MMSE позволяет оценить когнитивные нарушения более детально. У 3 человек (7,5%) при ее использовании не было выявлено нарушений. Легкие когнитивные нарушения (28 баллов) были обнаружены у 3 (7,5%), умеренные (25–27 баллов) – у 9 (22,5%), легкая деменция (24–20 баллов) – у 13 (32,5%), умеренная (19–10 баллов) – у 12 человек (30%).
Значения динамометрии менее 16 daN у женщин и менее 27 daN у мужчин были обнаружены у 27 пациентов. Проявления ССА у наблюдаемых пациентов, по данным используемых опросников и шкал, представлены в таблице 1.

Были выявлены положительная корреляция ИМТ с показателями шкалы Морсе (r=0,49, p <0,05) и обратная зависимость ИМТ с данными шкалы MMSE (r=-0,56, p >0,05). Однако значимой связи между показателями опросников и возраста пациентов установлено не было. Наблюдалась обратная корреляционная связь между показателями динамометрии и возрастом пациентов (r=-0,53, p <0,05), а также ИМТ (r=-0,42, p <0,05).
По результатам анализа участников исследования с точки зрения ИМТ, 17 человек (42,5%) имели ИМТ менее 30 кг/м2 (25,8±2,1 кг/м2), и 23 пациента (57,5%) страдали ожирением (ИМТ 33,2±2,9 кг/м2).
Показатели физической активности в соответствии с опросником «Возраст не помеха» составили 3,0±1,2 баллов в группе пациентов с ИМТ менее 30 кг/м2 и 4,2±1,7 баллов в группе страдающих ожирением. У лиц с ИМТ менее 30 кг/м2 и пациентов с ИМТ более 30 кг/м2 значения шкалы Морсе равнялись 43,8±14,0 и 75,0±17,3 баллов соответственно. В таблице 2 отражена разница показателей физических возможностей у пациентов старше 75 лет в зависимости от ИМТ.
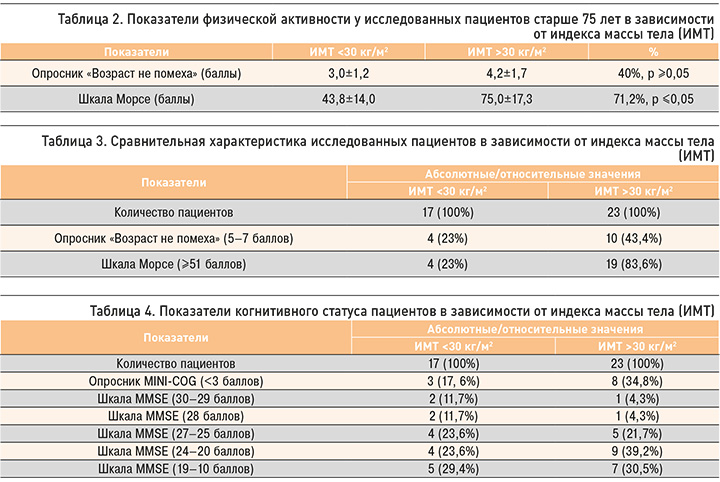
Таким образом, риск старческой астении по шкале Морсе оказался достоверно выше в группе пациентов с ожирением.
Признаки вероятной старческой астении (5–7 баллов по опроснику «Возраст не помеха») в группе пациентов с ИМТ менее 30 кг/м2 были выявлены у 4 (23% случаев), в группе пациентов с ожирением – у 10 человек (43,4%). В группе участников с ИМТ менее 30 кг/м2 высокий риск падений (≥51 баллов по шкале Морсе) отмечался у 4 человек (23% случаев), среди пациентов с ожирением – у 19 (83,6%) пациентов. В таблице 3 отражена сравнительная характеристика участников исследования в зависимости от ИМТ.
Показатели когнитивного статуса в группе пациентов с нормальным ИМТ, по данным опросника MINI-COG, составили 3,3±0,9 баллов, по шкале MMSE – 21,1±4,3 баллов. У пациентов с ИМТ более 30 кг/м2 эти показатели составили 3,0±1,1 и 20,8±4,7 баллов соответственно.
По результатам опросника MINI-COG, менее 3 баллов в группе с нормальным ИМТ набрали 3 пациента (17,6%), в группе пациентов с ожирением – 8 человек (34,8%), что является одним из показателей деменции. По данным шкалы MMSE, в группах участников с ИМТ менее 30 кг/м2 и в группе пациентов с ожирением не было выявлено нарушений у 2 (11,7%) и 1 (4,3%) пациента соответственно; легкие когнитивные нарушения (28 баллов) были обнаружены также у 2 (11,7%) и 1 человека (4,3%), умеренные (25–27 баллов) – у 4 (23,6%) и у 5 (21,7%) пациентов соответственно. Легкая деменция (24–20 баллов) была установлена у 4 человек (23,6%) в группе лиц с нормальным ИМТ и у 9 (39,2%) с ожирением, умеренная (19–10 баллов) – у 5 (29,4%) и 7 (30,5%) пациентов соответственно.
В таблице 4 отражена характеристика пациентов по показателям когнитивного статуса в зависимости от ИМТ.
Данные опросников показывают, что проявления легкой и умеренной деменции чаще встречаются в группе пациентов, страдающих ожирением.
Низкие показатели динамометрии в группе участников с ИМТ менее 30 кг/м2 были выявлены у 8 (23,6±0,15 daN), в группе с ожирением – у 19 человек (19,8±0,9 daN). При этом у всех пациентов с высоким риском падений по шкале Морсе (≥51 баллов) и дементными нарушениями по шкале MMSE наблюдалось снижение мышечной силы по данным кистевой динамометрии.
ОБСУЖДЕНИЕ
Признаки снижения функциональной активности и когнитивных нарушений по данным скрининга были выявлены более чем у половины обследуемых, что согласуется с эпидемиологическими исследованиями пациентов пожилого и старческого возраста [3]. Проявления старческой астении тесно связаны с другими гериатрическими синдромами, например с потерей мышечной массы, развитием саркопении.
По данным исследований, особую настороженность в плане развития ССА должны вызывать лица с ИМТ менее 23 кг/м2, ненамеренной потерей веса более 5 кг за последние 6 мес. В соответствии с клиническими рекомендациями пациентам с ССА и значением ИМТ 25–29,9 кг/м² не рекомендовано снижение веса. Показатели ИМТ менее 23 кг/м2 повышают риск развития саркопении, приводят к уменьшению минеральной плотности тканей и потере костной массы [4]. Однако повышение ИМТ более 30 кг/м2 также не несет никаких преимуществ для пациентов с ССА. В проведенном нами исследовании обнаружено значимое снижение уровня функциональной активности и когнитивного статуса среди пациентов с ИМТ более 30 кг/м2. Вероятно, полученные данные свидетельствуют о варианте «саркопенического ожирения», когда избыточная масса тела не гарантирует отсутствие дефицита мышечной массы, что подтверждается данными динамометрии. Саркопеническое ожирение характеризуется значительным снижением мышечной массы, силы и функциональных возможностей мышц вследствие накопления жировой ткани и замещения мышечных клеток жировыми. Этот процесс одинаково характерен как для мужчин, так и женщин старшей возрастной группы. Уменьшение мышечной силы обычно опережает уменьшение объема мышц [5, 6]. Это несоответствие между массой и силой мышц выражается в том, что при относительном сохранении объема мышечной ткани ее функция тем не менее страдает. Доказано, что потеря мышечной массы не всегда приводит к снижению веса и уменьшению ИМТ. Саркопеническое ожирение маскирует уменьшение мышечной ткани, так как вес тела не только не снижается, но может и увеличиваться.
В настоящее время рассматриваются несколько различных механизмов, способствующих развитию саркопенического ожирения. Среди них выделяют воспалительные процессы, хронические заболевания, инсулинорезистентность, снижение уровня андрогенов и гормона роста. Уменьшение физической активности и переедание вносят дополнительный вклад в развитие этого состояния [7]. Данные наблюдения подтверждают факт зависимости проявлений ССА от ИМТ пациентов.
Пациенты группы риска нуждаются в более детальном обследовании для выявления признаков саркопении, снижения минеральной плотности костной ткани, а также в рекомендациях специалиста по изменению питания с достаточным потреблением белка (1,0–1,5 г/кг/сут) и, возможно, в нутриционной поддержке [8]. Специалистам необходимо ориентироваться на концепцию «успешного» старения, включающую не только отсутствие хронических заболеваний, но и сохранность мыслительной деятельности, вовлеченность пожилого человека в общественную жизнь, стремление к развитию, желание творческой деятельности, положительный эмоциональный настрой.
ЗАКЛЮЧЕНИЕ
Признаки ССА выявлены нами более чем у половины обследуемых пациентов, что свидетельствует о необходимости более широкого внедрения в медицинскую практику методик комплексного гериатрического осмотра пациентов старших возрастных групп. В дальнейшем данные скрининга можно использовать для рекомендации более детального обследования, например денситометрии.
Показатели физической активности по результатам опросника «Возраст не помеха» и шкалы Морсе, когнитивного статуса по данным MINI-COG и MMSE, а также показатели динамометрии оказались достоверно ниже в группе пациентов с ИМТ более 30 кг/м2.
Обнаруженная нами корреляция ИМТ с признаками ССА по шкалам Морсе (r=0,49, p <0,05) и MMSE (r=-0,56, p >0,05), показателями динамометрии (r=-0,42, p <0,05) позволяет рассматривать ожирение в качестве предиктора развития ССА у лиц старше 75 лет.



