Свертывание крови — каскадный ферментативный процесс, в котором участвуют физико-химические реакции, проходящие в плазме, форменных элементах крови, тканях. Очень важны морфофункциональный статус тромбоцитов, степень его активности. Активация тромбоцитов представляет собой целую серию биохимических реакций, которые приводят к формированию тромба с последующим нарастанием других форменных элементов. Повышенная активность тромбоцитов влечет за собой тромботический статус [1, 2].
Во время активации живая система тромбоцита переходит из состояния относительного физиологического покоя к деятельности. При этом нарушается ионное равновесие между цитоплазмой и средой, окружающей клетку, что вызывает изменение мембранного потенциала, развитие локального процесса деполяризации клеточной мембраны. Распространяющееся возбуждение возникает только после достижения пороговой величины и сразу приобретает максимальную амплитуду [3, 4].
Стимулом активации может служить практически любое возмущение окружающей среды, вплоть до простого механического напряжения. Основными физиологическими активаторами тромбоцитов считаются коллаген (главный белок внеклеточного матрикса), тромбин (основной белок плазменной системы свертывания), аденозиндифосфат (АДФ). После активации тромбоциты становятся способными прикрепляться к месту повреждения (адгезия) и друг к другу (агрегация).
Существует такое понятие, как «жидкостность» клеточных мембран. Клетка постоянно обменивается различными веществами с окружающей ее внешней средой. Через наружную клеточную мембрану внутрь клетки поступают все питательные вещества, гормоны, витамины, биорегуляторы и т.д. При потере мембраной своих жидкостных свойств такой транспорт сразу затрудняется. Насыщенные жирные кислоты (ЖК) и холестерин (ХС) повышают ригидность (твердость) клеточных мембран. Вот почему с увеличением возраста клетка все хуже реагирует на гормональные сигналы и анаболические стимулы. Фосфолипиды и ненасыщенные ЖК, наоборот, устраняют ригидность клеточных мембран и повышают ее жидкостные свойства. Клетка как бы оживает, усиливается коммуникабельность клетки с эндотелием и гормональным сигналом [5, 6].
У здоровых лиц клеточная мембрана тромбоцитов не реагирует на патологию эндотелия и гормональную стимуляцию. Логично возникает вопрос, почему у больных ишемической болезнью сердца (ИБС) изменяется морфофункциональная структура тромбоцита.
Целью нашего исследования являлись изучение биохимических различий в структуре тромбоцитов, сравнение нарушений антитромбиновых компонентов в сосудах, сопоставление фосфолипидных спектров тромбоцитов у здоровых лиц и больных ИБС.
Материал и методы
В исследование были включены 42 больных ИБС мужского пола (средний возраст 55,4±6,1 года), госпитализированных в ГКБ №70 ДЗ г. Москва. Контрольную группу составили 30 здоровых мужчин, средний возраст 54,7±5,8 года.
Были отобраны больные ИБС: со стенокардией напряжения II—III функционального класса (ФК), среди которых 14 (33,3%) ранее перенесли инфаркт миокарда (ИМ), у 2 (5%) ИМ был повторным. Уровень общего ХС в среднем составил 5,60±0,12 ммоль/л, у 13 больных уровень ХС превышал 5,3 ммоль/л.
Всем больным проведена селективная коронарография для выяснения характеристик и распространения поражения коронарных сосудов.
Из анамнеза больных ИБС выявлено, что 85% курят, причем 67% лиц с стабильной стенокардией напряжения и перенесенным ранее ИМ выкуривают в течение длительного времени (20—30 лет) более 20 сигарет в сутки и 22% — менее 20 сигарет.
Больные были обследованы сразу после клинической стабилизации, на 3—7-й день после отмены гепарина.
К моменту исследования они не получали антикоагулянтной и антиагрегантной терапии. Для достоверности результатов у больных также исключалось применение любого холестеринснижающего препарата в течение последних 3—5 дней до исследования.
В исследование не включали больных острым ИМ, инсультом, сахарным диабетом, тяжелыми формами ожирения, хронической пневмонией, системными заболеваниями, острыми инфекционными заболеваниями, нарушениями функции печени и почек, постоянной формой мерцательной аритмии, хронической сердечной недостаточностью III и IV ФК по классификации Нью-Йоркской ассоциации сердца, получавших терапию непрямыми антикоагулянтами.
Для изучения функционального состояния эндотелия сосудов у здоровых лиц и больных ИБС проводили локальную гипоксическую пробу (манжеточную пробу) с дозированной физической нагрузкой по методике Н.А. Мирзоян в нашей модификации [7]. Локальную гипоксию верхней конечности создавали путем нагнетания воздуха в манжетку мембранного тонометра, наложенную на предплечье, в которую нагнетался воздух под давлением, превышающим системное на 20—30 мм рт.ст. Время воздействия составило 4 минуты. В исходном состоянии в первую минуту восстановительного периода кровь, взятую натощак из локтевой вены, после центрифугирования и получения сыворотки исследовали для оценки показателей гемодинамики.
Исследование агрегации тромбоцитов, индуцированных АДФ 10—3М (%), коллагеном (%) и адреналином 10—4М (%) производили на аппарате Aggregation Analyzer BIOLA ltd Solar LA-230 с определением агрегационной способности тромбоцитов по среднему размеру агрегатов и турбидометрическим методом.
Измерение активности антитромбина III (с) и фибринолитической активности крови (%) проводили на автоматическом анализаторе Behring Coagulation Timer хромогенным методом.
Фракции липидов: общие фосфолипиды (ФЛ), свободный ХС, триглицериды (ТГ), эфиры ХС и спектр ФЛ: лизофосфатидилхолин (ммоль/л), фосфатидилхолин (ммоль/л), фосфатидилэтаноламин (ммоль/л), сфингомиелин (ммоль/л) регистрировали на денситометре ЕР1-65. Содержание ТГ (ммоль/л) определяли ферментативным методом на анализаторе Олли 300, суммарный ХС (ммоль/л) — ферментативным методом на биохимическом анализаторе ФП-901, ХС липопротеидов высокой плоскости (ЛВП) — в супернатанте после осаждения липопротеидов низкой плотности (ЛНП) и липопротеидов очень низкой плотности (ЛОНП) гепарином и двухлористым марганцем.
Исследование линолевой (%), арахидоновой (%), эйкозапентаеновой (%), докозагексаеновой кислот (%) проводили на жидкостном микроколоночном хроматографе Милихром А-02 методом высокоэффективной жидкостной хроматографии с последующим детектированием элюата с помощью спектрофотометрического УФ-детектора.
Статистическую обработку данных исследования проводили с использованием стандартных пакетов программ Statistica 6.0. Данные представлены в виде M±SD, где M — среднее значение показателя, SD — стандартное отклонение. Для определения статистической значимости использовали критерий Стьюдента (при сравнении 2 групп), критерий Ньюмена—Кейлса (для множественных сравнений), коэффициент ранговой корреляции Спирмена (для выявления связи признаков). Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Значение ЖК у больных ИБС. Биохимические исследования, выполненные в последние годы [8, 9] показали, что в тромбоцитах и эндотелиальных клетках сосудов существует автономная система синтеза ЖК. В соответствии с этим уровень активности ЖК в плазме и ФЛ тромбоцитов отражает прогноз тромботической наклонности данного человека, его склонность к атеросклерозу.
Известно также, что основным субстратом для образования простагландинов, тромбоксанов, простациклина является арахидоновая кислота. Ингибирование синтеза этой кислоты из линолевой осуществляется с помощью эйкозапентаеновой и докозагексаеновой кислот [8, 10].
Из представленной табл. 1 можно отметить динамику уровней арахидоновой и докозагексаеновой кислот. У больных ИБС произошло увеличение концентрации арахидоновой (от 19,1 до 25,47%) и снижение уровня докозагексаеновой кислоты (от 2,05 до 1,8%).
Какое значение имеют эти изменения у больных ИБС? Эйкозапентаеновая и докозагексаеновая кислоты ингибируют синтез арахидоновой кислоты. Увеличение уровня арахидоновой кислоты смещает равновесие тромбоксан—простациклин в сторону усиления синтеза тромбоксана А2(ТхА2) и соответственно повышение агрегации тромбоцитоарахидонового каскада у больных ИБС. Значительное увеличение уровня ТхА2 создает гиперчувствительность тромбоцитов.
Тромбоксан А2 — очень активный фактор; он способствует быстрой агрегации тромбоцитов, увеличивает доступность их рецепторов для фибриногена, активирует коагуляцию, сужает кровеносные сосуды.
В этой позиции специфический рецептор на поверхности тромбоцита, активированный ТхА2, вызывает адгезию и агрегацию тромбоцита.
Для количественной оценки уровня арахидоновой кислоты и полиненасыщенных ЖК нами выведен коэффициент:
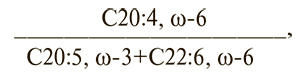
характеризующий конкурентное отношение между арахидоновой кислотой и эйкозопентаеновой и докозагексаеновыми кислотами [7]. Мы показали, что у здоровых лиц этот коэффициент составляет 7,80, а у больных ИБС – 10,21 (см. табл. 1).
Особенно большое значение имеет преобразование формы тромбоцитов (превращение из дискоидной в сферическую), образование отростков, которые прикрепляются к различным компонентам базальной мембраны (именно к коллагену поврежденного сосуда). Адгезия тромбоцитов к нитям коллагена является специфическим свойством этих клеток и отличает их от всех других.
 Таким образом, рецепторный аппарат тромбоцитов испытывает влияние сложной динамической системы (простациклин, ТхА2, тромбин, аденилатциклаза и др.), которая регулирует метаболизм и биологическую активность тромбоцитов.
Таким образом, рецепторный аппарат тромбоцитов испытывает влияние сложной динамической системы (простациклин, ТхА2, тромбин, аденилатциклаза и др.), которая регулирует метаболизм и биологическую активность тромбоцитов.
Многие исследователи экспериментально и в клинических условиях [4, 9] пытаются доказать связь между изменением липидного обмена и функциональной активностью тромбоцитов. Однако многие звенья этой взаимосвязи до сих пор не расшифрованы. В частности, отмечено, что существует связь между уровнем мембранного ХС и гиперактивностью тромбоцитов. Повышение концентрации мембранного ХС вызывает гиперактивность тромбоцитов.
Уровень ХС у здоровых лиц составляет 4,78 ммоль/л, а у больных ИБС — 6,03 ммоль/л.
Из биохимии известно, что высокое содержание ХС в мембране тромбоцитов тесно связано с гиперлипидемией.
Какие еще факторы создают гиперактивность тромбоцитов?
Без сомнения, важную роль играет изменение физико-химических свойств тромбоцита: прежде всего, ишемия в органах и тканях, которая нарушает энергетический потенциал тромбоцита [11, 12].
В случае развития ишемии в клетке возникает деполяризация мембраны с соответствующей потерей клеткой одной из форм «свободной энергии», т.е. энергии трансмембранного потенциала. Именно в этом случае возникает нарушение гомеостаза клетки с ограниченной возможностью утилизировать энергию.
Подводя итоги данного раздела, мы отмечаем, что рецепторный аппарат тромбоцитов смещает равновесие тромбоксан-простациклин в сторону активности ТхА2. Это смещение изменяет качественную чувствительность тромбоцитов, нарушая его энергетический потенциал.
Антитромбогенная активность стенки сосудов у больных ИБС. Важным звеном системы гемостаза являются сосудистая стенка, ее эндотелий, морфологические и функциональные свойства которого обеспечивают жидкое состояние циркулирующей крови. Эндотелий сосудов — очень чувствительный морфологический субстрат, который тонко реагирует на модулирующее действие тромбоцитов.
Эндотелий выполняет многочисленные функции для поддержания гемостаза [13]:
- осуществляет активный транспорт метаболических веществ между кровью и тканями;
- создает препятствие для проникновения макромолекул крови, являясь своеобразным барьером;
- осуществляет синтез различных медиаторов, регулирующих реакцию между сосудистой стенкой и кровью для сохранения гемостатического гомеостаза;
- дополняет фагоцитарную функцию путем удаления из крови высокоактивных биологических веществ, активных факторов системы гемостаза и т.д.;
- обеспечивает антитромбогенные свойства стенки сосудов, ее тромборезистентность;
- участвует в регуляции тонуса сосудов, способствуя выделению простациклина (ПЦ);
- обеспечивает пролиферацию клеток, метаболизм, функционирование механизмов клеточной миграции.
Клинико-экспериментальные исследования показали [14], что функции тромбоцитов в регуляции атерогенеза многоплановы и функционально зависят от состояния метаболизма. Модулирующее действие тромбоцитов на метаболизм и функции эндотелия может регулироваться за счет как прямого контакта клеток и выделения в зону повреждения стенки митогенного фактора с последующей пролиферацией гладких мышечных клеток, так и химической модификации ЛНП [10].
Тромборезистентность сосудистой стенки определяется вкладом не одного, а ряда факторов. Некоторые факторы предупреждают адгезию и агрегацию тромбоцитов, другие инактивируют тромбин и активные факторы свертывания крови.
Сопоставление антитромбогенной активности стенки сосудов у больных ИБС и здоровых лиц является важной задачей для терапевтического лечения.
Устойчивость организма к гипоксии — один из основных вопросов реактивности биологических систем. Резистентность к гипоксии определяется генотипическими и фенотипическими свойствами организма: характером его энергетического обмена, степенью совершенства его регуляторных механизмов, их способностью перестраиваться и приспосабливаться к гипоксическими условиям, сохраняя жизнеспособность [15, 16].
 По теории метаболического запроса тканевые капилляры изменяют свой просвет и интенсивность кровотока при гипоксии тканей и накопления недоокисленных продуктов метаболизма. При этом изменяется число функционирующих капилляров, насыщение крови кислородом, включаются артериовенозные анастомозы.
По теории метаболического запроса тканевые капилляры изменяют свой просвет и интенсивность кровотока при гипоксии тканей и накопления недоокисленных продуктов метаболизма. При этом изменяется число функционирующих капилляров, насыщение крови кислородом, включаются артериовенозные анастомозы.
С нашей точки зрения, большое значение имеет оценка характера тканевого обмена в условиях ишемии. Локальная гипоксическая проба дает эту возможность. Под влиянием гипоксии уровень РО2 в артериальной крови снизился с 91,7 до 37,52 мм рт.ст. (табл. 2).
В табл. 2 отмечаются количественные различия между контрольной группой (лица с функционально активными антитромбогенными свойствами стенки сосудов) и больными ИБС. Наиболее существенные отличия отмечены в уровне ПЦ, фибринолитической активности крови (ФАК) и уровне антитромбина III (АТ III).
Уровень ПЦ у здоровых лиц — 65,0 пг/мл до компрессии и 109,0 пг/мл после компрессии. ФАК — 20,3% до компрессии и 32% после компрессии. АТ III — 37,6 с до компрессии и 49,0 с после компрессии.
Совершенно иные результаты отмечены у больных ИБС: ПЦ — 51,0 пг/мл до компрессии и 52,0 пг/мл после компрессии. Уровень ФАК составлял 11,2% до компрессии и 8,4% после компрессии; АТ III 27,3 с до компрессии и 22,1 с после компрессии.
Гипоксическое состояние сосудов у больных ИБС изменяет гормональную реакцию сосудов.
Как осуществляется трансдукция сигнала гормонами?
При взаимодействии индуктора с рецептором внутрь тромбоцита поступает сигнал, активирующий фосфолипазу А и фосфолипазу С, происходит мобилизация Са2+ из тромбоцитов в цитоплазму.
Действие гормонов, которые воспринимаются рецепторами на поверхности клеток, осуществляется посредством основных механизмов через трансдукцию сигнала. Отдельные гормоны, такие как полипептиды (инсулин, глюкагон, аргинин-вазопрессин, интерлейкины) и амины (катехоламины, серотонин) связываются с мембранными рецепторами. Связанные с мембраной рецепторы также осуществляют трансдукцию сигналов инсулина и факторов роста с помощью рецепторных киназ. Нейротрансмиттеры воздействуют на клетку через связанные с мембраной ворота ионных каналов. Стероиды и трийодтиронин (Т3) связываются с цитозольными рецепторами, которые распадаются от белков теплового шока, переносятся в ядро и вызывают специфическую генную транскрипцию [17].
Оценивая взаимосвязь тромбоцитов с эндотелием, мы можем подчеркнуть 3 основных направления этой активности:
- осуществление синтеза медиаторов, регулирующих функцию тромбоцитов;
- нарушение антитромбогенных свойств эндотелия способствует активации ТхА2;
- нарушение гомеостатического равновесия у больных ИБС создается при гипоксии.
Значение фосфолипидов в агрегации тромбоцитов в плазме крови у больных ИБС. Жировая ткань под кожей человека представляет собой триглицерид, т.е. глицерин, соединенный эфирными связями с тремя ЖК. Фосфолипид — это такой же триглицерид, только вместо одной ЖК эфирной связью с глицерином связан остаток фосфорной кислоты. Эта фосфорная кислота к тому же имеет две эфирные связи: одна связана с триглицеридом, а другая с аминоспиртом [5, 9].
Фосфолипиды делятся на несколько классов:
- фосфатидилхолин (ФХ) — в молекуле которого соединены глицерин, высшие ЖК, фосфорная кислота и азотистое основание — холин;
- фосфатидилэтаноламин (ФЭА) — его отличие от лецитина состоит в том, что он имеет азотистое основание – этаноламин.
ФХ и ФЭА встречаются в организме животных в наибольшем количестве. Эти две группы фосфоглицеридов метаболически связаны друг с другом и являются главными липидными компонентами мембран клеток в плане стабилизации их двухслойности.
Липидные мембраны в клетках обладают свойствами «текучести», так как в пределах одного слоя отдельные липидные молекулы способны меняться местами между собой [18, 19].
Мембрана тромбоцита обладает выраженной асимметрией в плане распределения фосфолипидов различных классов во внешнем и внутреннем слоях. Холинсодержащие нейтральные ФЛ, такие так сфингомиелин и ФХ, локализуются на внешней стороне мембраны в сочетании с небольшим количеством ФЭА. Внутренняя (цитозольная) часть ее состоит из большого количества ФХ и большого количества ФЭА.
Сочетание «текучести» и асимметрии в мембране тромбоцита при его биосинтезе в эндоплазматические сети вызывает неустойчивость структуры тромбоцита.
Мембранная асимметрия ФЛ — феноменальное явление, характерное практически для всех клеток. Доказано, что поддержание асимметрии является активным процессом, реализующимся за счет активности аденозинтрифосфата и сульфгидрилзависимого липидного насоса (аминофосфолипидтранслоказы), который перемещает аминофосфолипиды по направлению к внутренней мембране [20].
Очень важна морфологическая стабильность мембраны тромбоцита. Активация этого процесса приводит к увеличению движения ФЛ между слоями, что сопровождается потерей асимметрии. В частности, активные тромбоциты утрачивают нормальную асимметрию мембраны.
Наряду с ФЛ важнейшим компонентом биомембран является ХС, который составляет 23% от общей массы липидов.
Почему ФЛ способны влиять на холестериновый обмен?
 Для понимания этого механизма необходимо уяснить один очень важный момент: ни жир, ни ХС не могут транспортироваться в крови в свободном состоянии, ведь они не обладают способностью растворяться в воде, это жирорастворимые соединения. Здесь нам на помощь приходят ФЛ. Один конец молекулы ФЛ (гидрофобный) способен связываться с жирами и ХС, а другой конец молекулы (гидрофильный) — с водой [9, 21].
Для понимания этого механизма необходимо уяснить один очень важный момент: ни жир, ни ХС не могут транспортироваться в крови в свободном состоянии, ведь они не обладают способностью растворяться в воде, это жирорастворимые соединения. Здесь нам на помощь приходят ФЛ. Один конец молекулы ФЛ (гидрофобный) способен связываться с жирами и ХС, а другой конец молекулы (гидрофильный) — с водой [9, 21].
Жир транспортируется в крови в виде хиломикронов. Хиломикроны — это капля жира, «облепленная» молекулами ФЛ.
В месте своей локализации ХС ограничивает подвижность соседних молекул, что приводит к образованию зон с высокой и низкой текучестью.
ХС является обязательным компонентом биологической мембраны и действует наподобие челнока, переносящего через мембрану глюкозу, аминокислоты, соли.
Из всех липидов ХС как наиболее подвижный компонент является важным регулятором, определяющим физиологическое состояние липидов в биологических мембранах.
Он влияет на подвижность углеводородных «хвостов» мембранных липидов. Если мембрана очень плотная, то ХС как бы разжижает ее в цепи ЖК. В присутствии ХС она становится более подвижной. Если же мембрана чрезмерно «жидкая», то ХС уплотняет ее.
Какова же связь между нарушениями в системе липидов, состоянием гемостаза и повреждениями сосудистой стенки?
С чем связаны эти изменения?
Без сомнения, важную роль играет изменение физико-химических свойств тромбоцита: прежде всего, ишемия у больных ИБС в органах и тканях нарушает энергетический потенциал тромбоцита, что и доказано в многочисленных экспериментах [22, 23].
Изменение функции клетки (в частности тромбоцита) может возникнуть при воздействии гипоксии, ишемии, прогрессирующей гиперфункции, дефицита энергии. В случае развития ишемии в клетке может возникнуть деполяризация мембраны с соответствующей потерей клеткой одной из форм «свободной энергии», т.е. энергии трансмембранного потенциала. Именно в этом случае возникает нарушение гомеостаза клетки с ограниченной возможностью утилизировать энергию и адекватно воспринимать поступающую информацию. Возникает состояние, которое в физиологии принято называть метаболическими нарушениями. При этом страдает внутриклеточная регуляция гомеостаза.
Из представленной табл. 3 можно отметить различия в показателях здоровых лиц и больных ИБС. Повышение уровня ФЛ отмечено у лизофосфатидилхолина (с 3,75 до 6,55) и фосфатидилэтаноламина (с 9,96 до 15,86). Увеличение этих ФЛ нарушает асимметрию структуры тромбоцита, в результате чего происходят конформационные перестройки белков и липидов, а это является сигналом для быстрого агрегирования тромбоцитов и создания тромбоза [24, 25].
Чрезвычайно важную роль в регуляции тромбоцитарного гемостаза играют продукты арахидоновой кислоты. Под влиянием фосфолипаз из сосудистой стенки и из мембранных ФЛ тромбоцитов под влиянием циклооксигеназы образуются простагландины, при дальнейшем превращении которых образуется агрегирующий агент ТхА2.
Подводя итоги различий тромбоцитарной агрегации у здоровых лиц и больных ИБС, мы отметили, что сложная динамическая система реологии под влиянием гипоксии (ИБС) повреждает рецепторный аппарат тромбоцитов в нескольких аспектах:
- при ИБС постоянно осуществляется активация тромбоцитов;
- увеличение уровня арахидоновой кислоты на фоне снижения концентрации эйкозапентаеновой и докозагексаеновой кислот увеличивает синтез ТхА2;
- увеличение количества арахидоновой кислоты смещает равновесие тромбоксан—простациклин с последующим изменением мембранного потенциала тромбоцита;
- увеличение уровня лизофосфатидилхолина и фосфатидилэтаноламина нарушает морфофункциональную асимметрию тромбоцита с последующей конформационной перестройкой белков и липидов.
Все эти факторы у больных ИБС обеспечивают агрегационную способность тромбоцитов.
Выводы
- Количественное увеличение арахидоновой кислоты в тромбоцитах больных ишемической болезнью сердца и снижение уровня докозагексаеновой кислоты повышают биологическую активность тромбоцитов и являются основой для формирования тромбоксана А2.
- Высокий уровень холестерина у больных ишемической болезнью сердца способствует активации тромбоцитов и вызывает агрегацию тромбоцитов.
- У больных ишемической болезнью сердца снижается тромборезистентность сосудистой стенки в связи с уменьшением уровня простациклина и антитромбина III.
- Увеличение уровня фосфатидилэтаноламина у больных ишемической болезнью сердца нарушает асимметрию структуры тромбоцита с последующей конфармационной перестройкой белков и липидов и развитием агрегации.



