Содержание
Введение
1. Определение, диагностические критерии и классификация хронической болезни почек
2. Методы оценки функции почек
3. Оценка альбуминурии/протеинурии
4. Алгоритм выявления хронической болезни почек у больных с сердечно-сосудистыми заболеваниями
5. Принципы ведения пациентов с сердечно-сосудистыми заболеваниями и хронической болезнью почек
5.1. Артериальная гипертония
5.2. Нарушения липидного обмена
5.3. Метаболический синдром и сахарный диабет 2 типа
5.4. Хроническая сердечная недостаточность
6. Острое повреждение почек у пациентов с сердечно-сосудистыми заболеваниями
6.1. Острое повреждение почек при острой сердечной недостаточности и острой декомпенсации хронической сердечной недостаточности
6.2. Острое повреждение почек при остром коронарном синдроме
7. Особенности наблюдения пациентов при хронической болезни почек с разным риском прогрессирования
8. Профилактика прогрессирования хронической болезни почек
8.1. Изменения образа жизни
8.2. Особенности назначения медикаментозных препаратов
8.3. Визуализирующие исследования
Приложения
Приложение 1. Классы рекомендаций и уровни доказательств
Приложение 2. Номограмма определения площади поверхности тела взрослого человека
Приложение 3. Номограмма определения стадии хронической болезни почек по формуле CKD-EPI
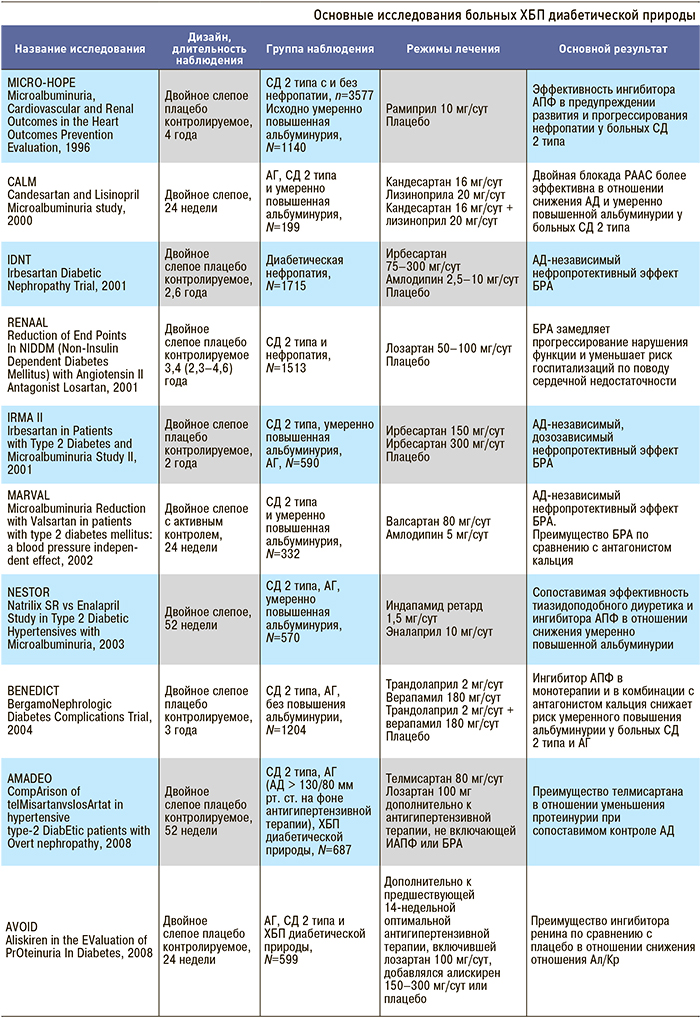
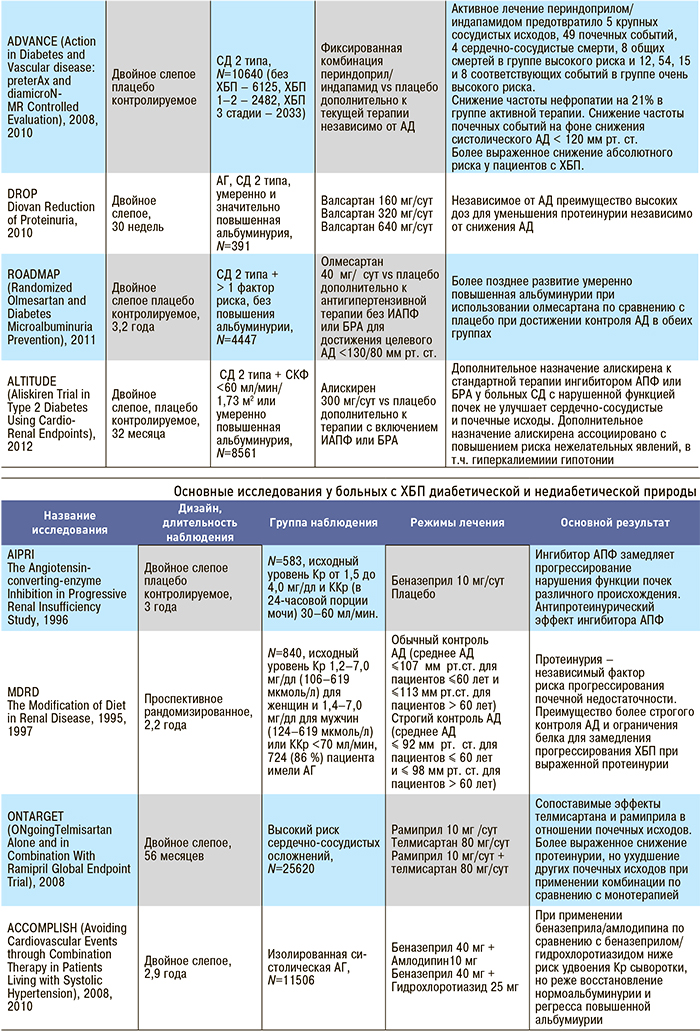
Приложение 4. Основные клинические исследования у больных с нарушением функции почек
Список сокращений и условных обозначений
Введение
Концепция хронической болезни почек (ХБП) была сформулирована экспертами Национального почечного фонда США в 2002 г. и к настоящему времени получила признание мирового медицинского сообщества. В 2007 г. ХБП была введена в Международную классификацию болезней 10-го пересмотра (МКБ-10), а термин «хроническая почечная недостаточность» был из нее изъят как устаревший [1].
В многочисленных крупномасштабных международных исследованиях была подтверждена высокая распространенность ХБП, сопоставимая с распространенностью ишемической болезни сердца (ИБС) и сахарного диабета (СД). Результаты изучения прогноза ХБП (Chronic Kidney Disease Prognosis Consortium) продемонстрировали достоверную и самостоятельную связь расчетной скорости клубочковой фильтрации (рСКФ) и альбуминурии с общей и сердечно-сосудистой смертностью, прогрессированием ХБП и риском развития острого повреждения почек (ОПП) [2].
 В 2008 г. была разработана и принята концепция кардиоренальных взаимодействий, выделены разные типы кардиоренального синдрома [3]. За период с 2008 г. завершилось несколько крупных рандомизированных клинических исследований, позволивших оценить эффективность и безопасность антигипертензивных, липидмодифицирующих, диуретических препаратов и ультрафильтрации у пациентов с сердечно-сосудистыми заболеваниями (ССЗ) и ХБП, разработать новую стратегию и тактику кардио-нефропротекции. Результаты исследований ACCOMPLISH, ADVANCE, ALTITUDE, CARRESS-HF, ONTARGET, ROADMAP, SHARP [4–12] и некоторых других легли в основу современных национальных и международных рекомендаций по ХБП [13–15], ОПП [16], артериальной гипертонии (АГ) [17], кардиоваскулярной профилактике [18, 19], нарушениям липидного обмена [20–22]. ХБП признана независимым фактором риска развития ССЗ и эквивалентом ИБС по риску сердечно-сосудистых осложнений [21, 22].
В 2008 г. была разработана и принята концепция кардиоренальных взаимодействий, выделены разные типы кардиоренального синдрома [3]. За период с 2008 г. завершилось несколько крупных рандомизированных клинических исследований, позволивших оценить эффективность и безопасность антигипертензивных, липидмодифицирующих, диуретических препаратов и ультрафильтрации у пациентов с сердечно-сосудистыми заболеваниями (ССЗ) и ХБП, разработать новую стратегию и тактику кардио-нефропротекции. Результаты исследований ACCOMPLISH, ADVANCE, ALTITUDE, CARRESS-HF, ONTARGET, ROADMAP, SHARP [4–12] и некоторых других легли в основу современных национальных и международных рекомендаций по ХБП [13–15], ОПП [16], артериальной гипертонии (АГ) [17], кардиоваскулярной профилактике [18, 19], нарушениям липидного обмена [20–22]. ХБП признана независимым фактором риска развития ССЗ и эквивалентом ИБС по риску сердечно-сосудистых осложнений [21, 22].
Первые совместные рекомендации Всероссийского научного общества кардиологов и Научного общества нефрологов России «Функциональное состояние почек и прогнозирование сердечно-сосудистого риска» были опубликованы в 2008 г. [23]. Основной целью выпуска новой версии национальных междисциплинарных рекомендаций является внедрение в клиническую практику ключевых подходов к ранней диагностике ХБП, прогнозированию сердечно-сосудистого риска и риска развития терминальной почечной недостаточности (ТПН), а также принципов эффективной и безопасной терапии больных с кардиоренальной патологией. В данных рекомендациях определены основные термины и понятия, используемые для характеристики функционального состояния почек, представлены наиболее обоснованные с точки зрения доказательной медицины и применения в широкой клинической практике методы оценки функции почек для стратификации риска и выбора медикаментозной терапии. Настоящие рекомендации не касаются вопросов коррекции нарушений фосфорно-кальциевого обмена и анемии. Учитывая, что они имеют преимущественное значение на поздних стадиях ХБП, эти вопросы детально освещены в специальных рекомендациях [24–26].
 Новая версия рекомендаций является не только обобщением принятых в мире подходов к решению проблемы ХБП и сердечно-сосудистого риска, но и попыткой адаптации накопленного международного опыта к условиям отечественного здравоохранения. Рекомендации предназначены для широкого круга врачей различных специальностей: врачей общей практики, терапевтов, кардиологов, нефрологов и эндокринологов.
Новая версия рекомендаций является не только обобщением принятых в мире подходов к решению проблемы ХБП и сердечно-сосудистого риска, но и попыткой адаптации накопленного международного опыта к условиям отечественного здравоохранения. Рекомендации предназначены для широкого круга врачей различных специальностей: врачей общей практики, терапевтов, кардиологов, нефрологов и эндокринологов.
1. Определение, диагностические критерии и классификация хронической болезни почек
Определение. ХБП – наднозологическое понятие, объединяющее всех пациентов с сохраняющимися в течение 3 и более месяцев признаками повреждения почек и/или снижением их функции.
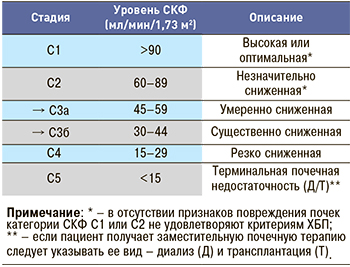
В случае сохранной или повышенной СКФ, а также у больных с ее начальным снижением (60≤СКФ<90 мл/мин/1,73 м2) для диагноза ХБП необходимо присутствие признаков повреждения почек (альбуминурия ≥30 мг/сут или отношение Ал/Кр в моче ≥30 мг/г (≥3 мг/ммоль), изменение осадка мочи, электролитные нарушения, структурные и морфологические изменения, трансплантация почки в анамнезе). При СКФ <60 мл/мин/1,73 м2 ХБП диагностируется даже при отсутствии маркеров повреждения почек (табл. 1). Современные международные рекомендации предлагают классифицировать ХБП с учетом величины СКФ (табл. 2) и уровня альбуминурии (табл. 3), поскольку СКФ и экскреция альбумина с мочой имеют самостоятельное диагностическое и прогностическое значение. Кроме того, новые рекомендации предполагают разделение 3 стадии ХБП по уровню СКФ на стадии 3а и 3б, поскольку почечный и сердечно-сосудистый прогнозы не одинаковы в группах лиц с ХБП 3 стадии с СКФ от 59 до 45 мл/мин/1,73 м2 и от 44 до 30 мл/мин/1,73 м2. Если в подгруппе лиц с СКФ от 59 до 45 мл/мин/1,73 м2 весьма высоки сердечно-сосудистые риски при умеренных темпах прогрессирования ХБП, то у пациентов с уровнем СКФ от 44 до 30 мл/мин/1,73 м2 риск развития ТПН оказывается выше, чем риск летальных сердечно-сосудистых осложнений [13, 14].
Основанием для введения классификации ХБП по уровню альбуминурии послужили убедительные данные о том, что риски общей и сердечно-сосудистой смертности, развития ТПН, ОПП и прогрессирования ХБП в любом диапазоне СКФ существенно отличаются в зависимости от уровня экскреции альбумина с мочой [2].
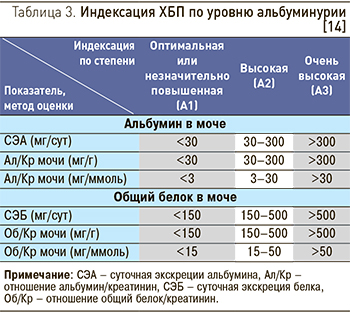 Длительное время «нормальным» уровнем альбуминурии считали мочевую экскрецию альбумина <30/мг сут. Однако накопленные в настоящее время сведения обосновывают более строгую нижнюю границу нормы экскреции альбумина почками – 10 мг/сут (или 10 мг альбумина/г креатинина), поскольку в диапазоне 10–29 мг/сут сохраняется связь между уровнем альбумина мочи и риском сердечно-сосудистых осложнений.
Длительное время «нормальным» уровнем альбуминурии считали мочевую экскрецию альбумина <30/мг сут. Однако накопленные в настоящее время сведения обосновывают более строгую нижнюю границу нормы экскреции альбумина почками – 10 мг/сут (или 10 мг альбумина/г креатинина), поскольку в диапазоне 10–29 мг/сут сохраняется связь между уровнем альбумина мочи и риском сердечно-сосудистых осложнений.
В рекомендациях KDIGO [14] было предложено оставить текущие градации альбуминурии, но с новой их характеристикой: А1 (отношение Ал/ Кр мочи <30 мг/г или <3 мг/ммоль) – норма или незначительное повышение; А2 (Ал/ Кр 30–300 мг/г или 3–30 мг/ммоль) – умеренное повышение; А3 (Ал/Кр >300 мг/г или >30 мг/ммоль) – значительное повышение, включая очень высокое при нефротическом синдроме (табл. 3).
В настоящих рекомендациях также принята индексация альбуминурии KDIGO [14], предусматривающая выделение 3 категорий, а не 5, как было сделано в опубликованных ранее Российских рекомендациях по ХБП 2012 г. [13]. Поскольку подходы к нефропротективной терапии у пациентов с альбуминурией <10 и 10–29 мг/г не различаются, предлагается градации А0 и А1 (по Российским рекомендациям 2012 г.) рассматривать вместе, называя «Оптимальная или незначительно повышенная альбуминурия», и обозначать как А1. Это же касается стадий А3 и А4 (по Российским рекомендациям 2012 г.), которые объединены в одну градацию «Очень высокая альбуминурия», индекс А3 (табл. 3).
Применение ранее использовавшихся терминов «нормоальбуминурия», «микроальбуминурия» и «макроальбуминурия» в настоящее время представляется нежелательным. Очевидно, что у больных, получающих лечение постоянным гемодиализом или перитонеальным диализом, необходимости в индексации альбуминурии/протеинурии нет.
Введение понятия ХБП ни в коем случае не отменяет использование современной нозологической классификации болезней почек. В диагностическом заключении следует указывать нозологическую форму заболевания с описанием особенностей клинического течения и морфологических изменений (если проводилась биопсия), а затем – стадию ХБП по степени снижения СКФ и категорию альбуминурии.
Примеры диагностических заключений с учетом категорий СКФ и альбуминурии
- Гипертоническая болезнь 3 стадии, риск 4. СД 2 типа. Диабетическая и гипертоническая нефропатия. ХБП С3а А3.
- Мезангиокапиллярный гломерулонефрит. Нефротический синдром. АГ 3 стадии, риск 4. ХБП 5д (постоянный гемодиализ с 12.05.2013).
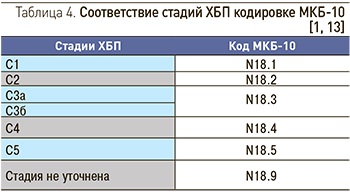 В новой редакции МКБ-10 для обозначения ХБП используется код N18 (который прежде применялся для обозначения хронической почечной недостаточности). Коды N18.1–N18.5 были присвоены 1–5 стадиям ХБП (табл. 4), а код N18.9 предназначен для обозначения ХБП с неуточненной стадией [1]. Данные коды необходимо использовать во всех случаях, когда имеются признаки ХБП, это важно для регистрации новых случаев ХБП и учета ее распространенности.
В новой редакции МКБ-10 для обозначения ХБП используется код N18 (который прежде применялся для обозначения хронической почечной недостаточности). Коды N18.1–N18.5 были присвоены 1–5 стадиям ХБП (табл. 4), а код N18.9 предназначен для обозначения ХБП с неуточненной стадией [1]. Данные коды необходимо использовать во всех случаях, когда имеются признаки ХБП, это важно для регистрации новых случаев ХБП и учета ее распространенности.
Внедрение в реальную клиническую практику ключевых подходов к диагностике ХБП имело важные последствия. За десять лет, прошедших с момента принятия концепции ХБП, значительно повысилась осведомленность и настороженность врачей различных специальностей в отношении ХБП как значимой проблемы здравоохранения. Введение автоматического расчета СКФ в лабораториях и включение ее величины в результаты лабораторного исследования в дополнение к уровню Кр сыворотки способствовало увеличению первичного обращения к нефрологу пациентов с ХБП на 68,4% [27].
Использование категорий СКФ и альбуминурии позволяет стратифицировать больных ХБП по риску почечных исходов (снижение СКФ, прогрессирование альбуминурии, ОПП, ТПН) и других осложнений (сердечно-сосудистая заболеваемость и смертность, эндокринные и метаболические нарушения, лекарственная токсичность) (табл. 5).
2. Методы оценки функции почек
Согласно современным рекомендациям с целью диагностики и классификации ХБП необходимо определение СКФ, которая может быть измерена клиренсовыми методами либо рассчитана при помощи специальных формул по концентрации в сыворотке крови Кр или других веществ, которые выводятся из организма путем клубочковой фильтрации. Расчетный метод определения СКФ является предпочтительным для широкой практики как более простой и доступный.
Из формул, используемых для расчета СКФ у взрослых, на сегодняшний день наиболее совершенной является формула CKD-EPI, в которой учитываются раса, пол, возраст, Кр сыворотки. Расчет СКФ по этой формуле по сравнению с другими формулами (Кокрофта–Голта, MDRD) дает результаты, наиболее точно сопоставимые с данными, полученными при оценке клиренса 99mTc-DTPA, в том числе и при сохранной функции почек [28]. Нужный вариант формулы выбирается в зависимости от расы, пола и уровня Кр сыворотки пациента, что позволяет преодолеть влияние различий в мышечной массе лиц разного возраста и пола и ошибку, связанную с активацией канальцевой секреции Кр на поздних стадиях ХБП (табл. 6).
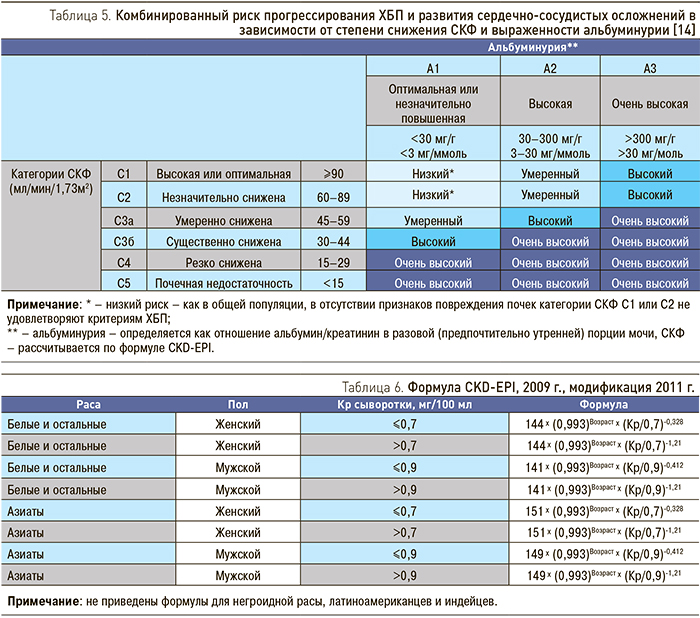
Для расчета СКФ по формуле CKD-EPI можно воспользоваться калькуляторами, представленными в интернете (http://www.kidney.org/professionals/kdoqi/gfr_calculator.cfm, http://nkdep.nih.gov/professionals/gfr_calculators/index.htm), специальными приложениями для мобильных устройств (QxMDCalculator – английской язык; Personal Nefro Calc (PNC) – русский язык), номограммами (приложение 3).
Оценка СКФ клиренсовым методом с использованием 24-часовой пробы Реберга–Тареева характеризуется высокой точностью при условии правильного проведения и точного измерения объема мочи, который должен быть не менее 1000 мл. Она может использоваться при специализированном стационарном обследовании. Существуют ситуации, когда использование формул некорректно и клиренсовый метод остается единственно возможным для оценки СКФ: беременность, нестандартные размеры тела, тяжелая белково-энергетическая недостаточность, заболевания скелетных мышц, параплегия и тетраплегия, вегетарианская диета, быстро меняющаяся функция почек. При необходимости назначения нефротоксичных препаратов больным с нарушенной функцией почек, когда требуется особо точная оценка функционального состояния почек для определения безопасной дозы препаратов и при решении вопроса о начале заместительной почечной терапии, также следует использовать клиренсовые методы определения СКФ.
Наиболее точным методом оценки СКФ остается метод измерения клиренса экзогенных гломерулотропных веществ, например радиофармацевтических препаратов [51Cr]-EDTA (этилендиамин тетрауксусная кислота) [99mTc]-DTPA (диэтилентриамин пентауксусная кислота), [125I]-иоталамат. Радиоизотопное исследование СКФ позволяет раздельно оценить функцию каждой почки, что имеет большое значение при односторонних поражениях.
В качестве альтернативного маркера для оценки функционального состояния почек и сердечно-сосудистого риска в последние годы рассматривается цистатин С, уровень которого, в отличие от Кр, не зависит от мышечной массы, что позволяет более точно определять СКФ у людей с нестандартным телосложением, дефицитом или избыточным развитием мышечной массы, детей, пожилых, больных СД, ожирением, беременных. Уровень цистатина С в сыворотке крови более динамично меняется по сравнению с Кр при остром нарушении функции почек, что дает ему большие преимущества в ранней диагностике ОПП. Однако высокая стоимость данного исследования в настоящее время ограничивает его широкое применение. Разработаны формулы для расчета СКФ на основании цистатина С.
3. Оценка альбуминурии/протеинурии
Существуют качественные/полуколичественные и количественные методы оценки экскреции альбумина и общего белка (всех фракций белка, в т.ч. альбумина) с мочой. Качественную оценку альбуминурии/протеинурии выполняют с использованием тест-полосок (метод сухой химии), что привлекает доступностью, удобством, невысокой стоимостью определения. Однако данный метод характеризуется довольно большой погрешностью. Для количественного определения альбуминурии используются иммуноферментные, иммунотурбидиметрические и радиоиммунные методы. Наиболее чувствительными и точными методами определения общего белка в моче являются фотометрические (в частности, с использованием красителя пирогалоллового красного), широко используемые в России.
Организация исследования альбуминурии/протеинурии
- Для скрининговых исследований и обследования лиц с отсутствием факторов риска ХБП могут использоваться тест-полоски, дающие качественное или полуколичественное определение альбумина/общего белка в моче, что позволяет существенно снизить стоимость исследования.
- Лицам с положительными результатами исследования при помощи тест-полосок необходимо провести точное количественное определение.
- Обследование лиц с высоким риском развития ХБП целесообразно начинать сразу с количественных методов.
- При проведении скрининговых исследований среди условно здорового населения в качестве начального теста целесообразно определение уровня альбуминурии.
- У пациентов с выраженной потерей белка (>0,5 г/сут) целесообразно с точки зрения экономии бюджета вместо определения альбуминурии проводить исследование общего белка в суточной моче или отношения Об/Кр в утренней порции мочи.
- Для исследований, требующих повышенной точности (уточнение диагноза, выбор и оценка эффективности лечения, оценка прогноза, экспертиза и т.д.), применяется количественное определение альбумина или общего белка в суточной моче, однако это требует правильного сбора и измерения объема мочи, поэтому больше подходит для стационарных обследований.
- Анализ разовых порций мочи дает приблизительный результат, поскольку на концентрацию белка влияют случайные факторы (в частности, водный режим). Исследование утренней пробы мочи дает более воспроизводимые результаты, чем в случайной порции, взятой в течение суток.
- Методом, повышающим точность оценки степени протеинурии/альбуминурии по разовой или утренней порции мочи, является поправка на уровень Кр мочи, которая нивелирует искажения результатов, связанные с водным режимом.
- При оценке протеинурии/альбуминурии необходимо учитывать внепочечные факторы, влияющие на их уровень (интенсивная физическая нагрузка, лихорадка, злоупотребление белковой пищей), целесообразно соблюдение условий, минимизирующих вариабельность показателя протеинурии/альбуминурии.
- Впервые выявленная повышенная протеинурия/альбуминурия нуждается в подтверждении 1–2 повторными анализами с интервалом в 1–2 нед.
4. Алгоритм выявления хронической болезни почек у больных с сердечно-сосудистыми заболеваниями
- Для диагностики ХБП у взрослых пациентов с ССЗ или повышенным риском их развития необходимо определить уровень Кр сыворотки и рассчитать СКФ по формуле CKD-EPI. Если рСКФ <60 мл/мин/1,73 м2, повторить исследование через 3 мес или ранее. В утренней порции мочи определить отношение Ал/Кр. Если отношение Ал/Кр >30 мг/г (>3 мг/ммоль), повторить исследование через 3 мес или ранее. Выполнить визуализирующие исследования для уточнения наличия почечного повреждения.
- Если значения СКФ <60 мл/мин/1,73 м2 и/или отношение Ал/Кр >30 мг/г (>3 мг/ммоль) сохраняются по крайней мере 3 мес, диагностируется ХБП, показано лечение в соответствии с рекомендациями.
- Если СКФ <30 мл/мин/1,73 м2 или быстро снижается или отношение Ал/Кр>300 мг/г (>30 мг/ ммоль), пациента следует направить к нефрологу.
- Если признаки ХБП отсутствуют, рекомендуется ежегодный контроль выше названных показателей.
5. Принципы ведения больных с сердечно-сосудистыми заболеваниями и хронической болезнью почек
Несмотря на снижение сердечно-сосудистой смертности в последние десятилетия, ССЗ остаются основной причиной заболеваемости, смерти и инвалидизации как в развитых, так и развивающихся странах. По данным различных популяционных регистров и исследований, распространенность почечной патологии составляет 10–13%, достигая в группах высокого риска 20%. При этом рост числа больных с почечной патологией в последние годы происходит за счет их вторичного поражения в рамках АГ и СД. Смерть, обусловленная ССЗ, в 10–20 раз чаще встречается среди больных с ХБП, чем в популяции, а вероятность развития сердечно-сосудистых осложнений в 25–100 раз выше, чем риск ТПН [29–31].
Заболевания сердца и почек имеют общие «традиционные» факторы риска (АГ, СД, ожирение, дислипидемия и др.), а при их сочетании действуют и «нетрадиционные» почечные факторы (гипергидратация, анемия, нарушения фосфорно-кальциевого обмена, системное воспаление и гиперкоагуляция), которые также могут оказывать влияние на риск развития и патогенез ССЗ.

По данным многочисленных проспективных исследований, даже незначительное снижение функции почек ассоциировано с увеличением риска сердечно-сосудистой заболеваемости и смерти независимо от других факторов риска. Было показано, что распространенность ССЗ в популяции больных со сниженной функциональной способностью почек на 64% выше, чем у лиц с сохранной функцией. Выявлена независимая обратная связь между СКФ <60 мл/мин/1,73 м2 и увеличением риска смерти, сердечно-сосудистых осложнений и госпитализации [32]. Частота новых сердечно-сосудистых осложнений составляет 4,8% у больных со 2 стадией ХБП и возрастает почти вдвое при 3–4 стадиях [33]. Риск развития неблагоприятных сердечно-сосудистых исходов у пациентов на диализе или у реципиентов почечного трансплантата в десятки раз выше, чем в общей популяции. При ТПН частота выявления гипертрофии миокарда левого желудочка (ГЛЖ) и ИБС составляет соответственно около 75 и 40%. У половины пациентов с ТПН инфаркт миокарда развивается в течение двух лет от начала диализа [30]. Более половины смертей при ТПН связаны с ССЗ [34, 35].
Почечная дисфункция ассоциируется с более частым развитием осложнений и повышением риска сердечно-сосудистой смерти при остром коронарном синдроме, инфаркте миокарда, тромболитической терапии, чрескожном коронарном вмешательстве и аорто-коронарном шунтировании.
При сочетании любых двух факторов сердечно-сосудистого риска вероятность снижения СКФ до уровня <60 мл/мин/1,73 м2 в 3,7 раза больше, чем при отсутствии факторов риска, а у трети больных, перенесших инфаркт миокарда, диагностируют ХБП 3–5 стадии [36–38]. При сердечной недостаточности (СН) уровень смертности обратно пропорционален СКФ, которая является таким же значимым прогностическим фактором, как и величина фракции выброса ЛЖ или функциональный класс СН [39].
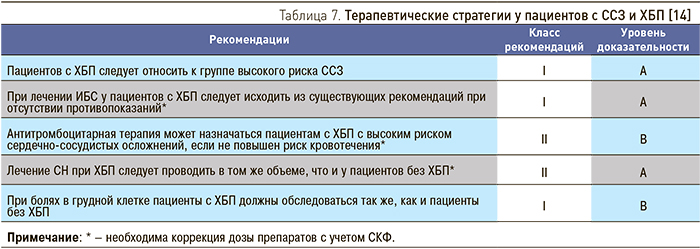
Важнейшим положением, определяющим тактику ведения больных с ССЗ и ХБП, является признание ХБП независимым фактором риска развития ССЗ и эквивалентом ИБС по риску осложнений. Пациентов с ХБП относят к группе высокого/очень высокого сердечно-сосудистого риска. Соответственно пациенты с ХБП должны получать лечение по поводу кардиальной патологии в полном объеме в соответствии с национальными и международными рекомендациями, если нет противопоказаний (табл. 7). В то же время при проведении терапии, особенно СН, следует строго контролировать состояние больных и мониторировать СКФ и уровень калия сыворотки крови.
Следует иметь в виду, что при СКФ <60 мл/мин/1,73 м2 (ХБП С3а–С5) сывороточные уровни тропонина и натрийуретических пептидов могут быть повышены и должны оцениваться с учетом функционального состояния почек и клинической картины (IВ) [14].
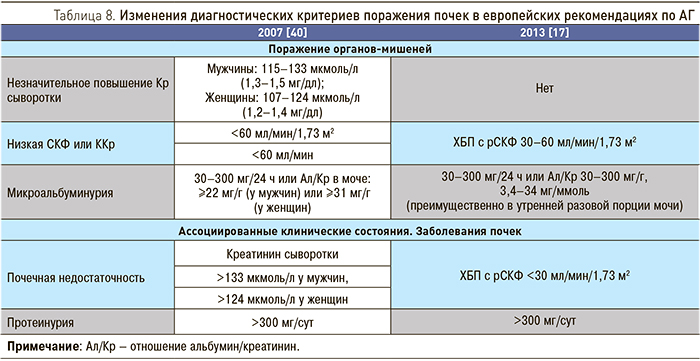
5.1. Артериальная гипертония
В европейских рекомендациях 2013 г. по АГ был изменен почечный раздел [17] (табл. 8). В рубриках «Поражение органов-мишеней» и «Ассоциированные клинические состояния» исключены диагностические критерии по Кр сыворотки, а критерии по СКФ заменены на категорию ХБП. При этом ХБП разделена по рубрикам в зависимости от уровня СКФ: пациенты с ХБП и СКФ 30–60 мл/мин/1,73 м2 (ХБП 3 стадии) относятся к имеющим поражение органов-мишеней, а пациенты с ХБП и СКФ <30 мл/мин/1,73 м2 (ХБП 4–5 стадии) – ассоциированные клинические состояния.
Вопрос о целевом уровне артериального давления (АД) у пациентов с ХБП до настоящего времени не имеет однозначного решения. Эпидемиологические исследования свидетельствуют о наличии прямой взаимосвязи между АГ и ХБП/ТПН. Данные исследования MRFIT (332 544 мужчины, средняя длительность наблюдения 16 лет) показали, что у лиц с высоким нормальным АД риск ТПН в 1,9 раз выше, чем у лиц с оптимальным АД (<120/80 мм рт.ст.). На основании этих и других данных в середине 1990-х гг. был выдвинут тезис: «чем ниже АД, тем меньше риск ТПН».
Однако проведенные до настоящего времени интервенционные исследования не дали достаточного обоснования для более строгого (<125–130/75–80 мм рт.ст.) контроля АД при ХБП. Число исследований, посвященных определению целевого уровня АД при ХБП, намного меньше, чем исследований, где изучается эффективность тех или иных препаратов. Для доказательства пользы и безопасности строгого контроля АД требуется исследование, включающее очень большое число пациентов и предусматривающее многолетнее наблюдение. На фоне приема блокаторов ренин-ангиотензин-альдостероновой системы (РААС), обладающих помимо антигипертензивного выраженным антипротеинурическим и нефропротективным действием, различия в скорости прогрессирования ХБП при разном целевом уровне АД не доказаны. Наконец, у большинства пациентов с ХБП не удается достичь цифр АД <125–130/75–80 мм рт.ст.
Исследование MDRD, в котором было изучено влияние сочетания малобелковой диеты и строгого контроля АД на скорость снижения функции почек, показало, что более строгий контроль АД (<125/75 мм рт.ст.) и ограничение потребления белка по сравнению со стандартной терапией (АД <140/90 мм рт.ст.) снижали риск ТПН у больных с выраженной протеинурией. У больных с протеинурией <1 г/сут различий в группах с разным целевым уровнем АД не было. Оценка отдаленных исходов вне рамок основного исследования показала тенденцию к снижению риска неблагоприятного почечного исхода у больных с более строгим контролем АД, малобелковой диетой и выраженной протеинурией [41]. Анализ отдаленных результатов исследования AASK у больных ХБП в целом также не показал различий по влиянию более строгого и стандартного контроля АД на прогрессирование ХБП, однако достоверные различия были получены у больных с протеинурией. Таким образом, анализ результатов исследований, в которых больные ХБП были рандомизированы для достижения более низкого (<125–130 мм рт.ст.) и обычного (<140 мм рт.ст.) целевого уровня систолического АД, не выявил достоверных различий между группами по риску развития почечной недостаточности или смерти, однако в подгруппе пациентов с выраженной протеинурией более строгий контроль АД имел преимущества.
С позиций доказательной медицины у пациентов с ХБП диабетической и недиабетической природы следует достигать уровня систолического АД <140 мм рт.ст. (IIаВ). При наличии протеинурии или альбуминурии А3 можно рассмотреть достижение целевого уровня АД <130 мм рт.ст. при условии мониторирования динамики СКФ (IIbB) [17].
Данные об оптимальном уровне диастолического АД при ХБП ограничены, в большинстве исследований в качестве целевого показателя использовались цифры систолического АД. На сегодняшний день принято, что целевой уровень диастолического АД при ХБП составляет <90 мм рт.ст. для всех пациентов, а для больных с СД в качестве целевых рассматриваются уровни между 80 и 85 мм рт.ст. (IА), которые обычно хорошо переносятся и безопасны.
По данным проспективных рандомизированных исследований (REIN, IDNT, RENAAL и др.), снижение протеинурии при использовании препаратов, подавляющих РААС, ведет к достоверному снижению скорости прогрессирования ХБП, что позволяет считать их основным компонентом кардио-нефропротективной стратегии. Убедительно показано, что блокаторы РААС, ингибиторы АПФ и блокаторы рецепторов ангиотензина II (БРА) 1 типа, более эффективны в снижении альбуминурии по сравнению с плацебо или другими антигипертензивными препаратами у больных с диабетической и недиабетической нефропатией, ССЗ, а также эффективны в предотвращении высокой альбуминурии (IRMA-II).
В настоящее время мы не располагаем данными исследований, сравнивающих режимы более или менее агрессивного снижения протеинурии в отношении почечных или сердечно-сосудистых исходов. В большинстве исследований по нефропротекции достигали снижения исходного уровня протеинурии/альбуминурии в 1,5 раза, которое обеспечивалось использованием средних и субмаксимальных доз препаратов, что может быть использовано в качестве ориентира при выборе тактики лечения. Максимальный антипротеинурический эффект наступает через 3–6 месяцев после начала терапии.
Достижение целевого АД обычно требует использования комбинированной терапии. Сочетание ингибиторов АПФ либо БРА с диуретиками в 1,5 раза увеличивает их антигипертензивный и антипротеинурический эффект. В исследовании ADVANCE у больных с СД добавление фиксированной комбинации периндоприла 4 мг/индапамида 1,25 мг (Нолипрел-Форте) к обычной антигипертензивной терапии ассоциировалось как со снижением общей и сердечно-сосудистой смертности, коронарных событий, так и со снижением почечных осложнений (на 21%; р<0,0001), в основном за счет снижения риска умеренного повышения альбуминурии (на 21%; р<0,0001), замедления дальнейшего прогрессирования альбуминурии (на 31%, р=0,0074). Эффект лечения не зависел от уровня исходного АД [6, 7]. Это позволяет рекомендовать данную фиксированную комбинацию у пациентов с СД 2 типа и АГ для снижения риска развития микро- и макрососудистых осложнений.
Важно учитывать, что тиазидные диуретики, широко используемые в составе фиксированных комбинаций, становятся малоэффективны, начиная с 3б стадии ХБП, и связаны с высоким риском гиперурикемии. Для поздних стадий ХБП предпочтительно использование петлевых диуретиков.
В исследовании ACCOMPLISH комбинация ингибитора АПФ с блокатором кальциевых каналов по сравнению с комбинацией ингибитора АПФ с тиазидным диуретиком была более эффективна в отношении предотвращения повышения Кр сыворотки, но менее эффективна в отношении профилактики протеинурии [5, 6].
Бета-адреноблокаторы, агонисты имидазолиновых рецепторов, альфа-адреноблокаторы, альфа-бета-адреноблокаторы также могут использоваться при тяжелой АГ в качестве препаратов 3–4 ряда.
Возможности комбинированного назначения двух блокаторов РААС (ингибитор АПФ+БРА, БРА+ингибитор ренина, ингибитор АПФ+ингибитор ренина) с целью более полного антипротеинурического эффекта активно изучались в последние годы. Было установлено, что при выраженной протеинурии эти комбинации оказывают более выраженный антипротеинурический эффект по сравнению с монотерапией, однако преимущества комбинации в отношении темпов снижения СКФ остаются недоказанными. При альбуминурии уровня А1–А2 преимуществ комбинации двух блокаторов РААС в отношении снижения альбуминурии не установлено, в то же время по сравнению с монотерапией значительно повышается риск ОПП и гиперкалиемии, особенно у пожилых пациентов [8, 10]. На сегодняшний день комбинация двух блокаторов РААС не рекомендуется для широкого применения, несмотря на то, что она может быть эффективна при протеинурии более 1 г/сут, персистирующей на фоне монотерапии.
Антагонисты альдостерона обладают хорошим антигипертензивным эффектом, а также благоприятно воздействуют на процессы ремоделирования миокарда и фиброгенеза в почках и могут назначаться в дополнение к ингибитору АПФ или БРА, однако они могут усугублять гиперкалиемию, особенно при СКФ <30 мл/мин/1,73 м2. Применение неселективного антагониста альдостерона спиронолактона у мужчин приводит к гормональным нарушениям (гинекомастия) и повышает риск развития рака молочной железы, поэтому длительный его прием у мужчин нежелателен. Селективный антагонист альдостерона эплеренон более безопасен и не имеет гендерных ограничений по длительности применения.
Основные терапевтические стратегии у больных АГ с ХБП суммированы в табл. 9.
В некоторых исследованиях было показано, что регресс признаков поражения органов-мишеней на фоне антигипертензивной терапии отражает снижение сердечно-сосудистой заболеваемости и смертности и позволяет оценить эффективность избранной терапевтической стратегии. Такая лекарственно обусловленная ассоциация была выявлена в отношении регресса электрокардиографических и эхокардиографических признаков ГЛЖ, протеинурии и умеренно повышенной альбуминурии [42–46]. Представляется целесообразным мониторировать выраженность изменений органов-мишеней на фоне проводимой терапии, выбрав наиболее информативные и доступные методы исследования (табл. 10).
В исследовании HOT было показано, что прием аспирина ассоциировался со значимым снижением риска сердечно-сосудистых событий, в том числе и риска смерти, эта связь была особенно заметной у пациентов с АГ и рСКФ <45 мл/мин/1,73 м2, при этом риск кровотечений был значительно ниже, чем положительные сердечно-сосудистые эффекты [47]. Таким образом, сохраняют свою силу европейские рекомендации 2007 г.: низкие дозы аспирина показаны пациентам с контролируемой АГ и анамнезом сердечно-сосудистых осложнений, о назначении его следует подумать также у пациентов с АГ и сниженной функцией почек или высоким сердечно-сосудистым риском [40].
5.2. Нарушения липидного обмена
ХБП рассматривается как независимый фактор риска развития ССЗ и как эквивалент ИБС по риску осложнений. В соответствии с национальными рекомендациями по кардиоваскулярной профилактике 2011 г., диагностике и коррекции нарушений липидного обмена с целью профилактики и лечения атеросклероза 2012 г., пациенты с ХБП (определяемой по рСКФ <60 мл/мин/1,73 м2) относятся к категории очень высокого риска развития смертельных сердечно-сосудистых осложнений, что предполагает соответствующую тактику достижения целевых уровней холестерина липопротеинов низкой плотности (ХС ЛПНП) для данной категории риска [18, 20]. Однако представляется, что разделение больных ХБП на категории высокого (СКФ 30–60 мл/мин/1,73 м2) и очень высокого (СКФ <30 мл/мин/1,73 м2) риска в большей степени отражает современные представления о различном прогнозе больных в зависимости от уровня СКФ. Современные международные рекомендации по сердечно-сосудистой профилактике предлагают в качестве целевых уровни ХС ЛПНП <2,5 ммоль/л для больных ХБП с СКФ 30–60 мл/мин/1,73 м2 и <1,8 ммоль/л для больных ХБП с СКФ <30 мл/мин/1,73 м2 [19].
Вторичный анализ, анализ в подгруппах и мета-анализ результатов крупных исследований по применению статинов демонстрируют их эффективность и безопасность в снижении риска основных сердечно-сосудистых осложнений у больных с ХБП 1–3 стадии. Данные об эффективности и безопасности липидмодифицирующей терапии у больных ХБП 4 стадии до недавнего времени отсутствовали. Достижение целевого уровня ХС ЛПНП у большинства пациентов очень высокого риска возможно при использовании высоких доз статинов или комбинированной гиполипидемической терапии, что объясняет настороженность в отношении риска развития миопатии и обосновывает применение комбинированной терапии низкими дозами статина и эзитимиба у больных с тяжелыми нарушениями функции почек.
В рандомизированном исследовании SHARP у больных ХБП комбинированная терапия симвастатином 20 мг и эзетимибом 10 мг по сравнению с плацебо приводила к снижению уровня ХС-ЛПНП на 0,85 ммоль/л и соответствующему снижению риска основных атеросклеротических осложнений на 17% [12]. На основании результатов исследования SHARP Министерство здравоохранения Российской Федерации зарегистрировало новое показание для препарата Инеджи (симвастатин/эзетимиб) в дозе 20/10 мг – профилактика основных сердечно-сосудистых осложнений у пациентов с ХБП.
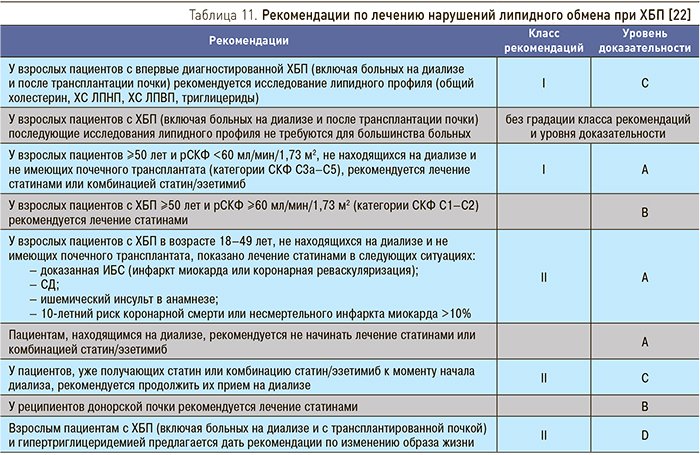
В обновленных рекомендациях KDIGO 2013 г. по лечению нарушений липидного обмена при ХБП расширены показания к применению статинов, а комбинация статин/эзитимиб рассматривается как терапия первого ряда у взрослых пациентов ≥50 лет и рСКФ <60 мл/мин/1,73 м2, не находящихся на диализе и не имеющих почечного трансплантата (табл. 11) [22].
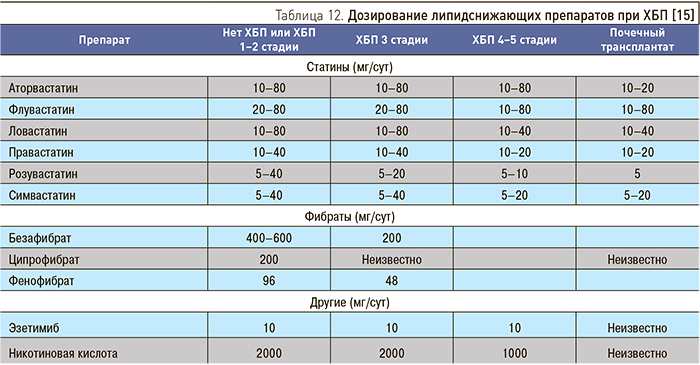
Дозирование липидснижающих препаратов при ХБП представлено в табл. 12.
5.3. Метаболический синдром и сахарный диабет 2 типа
Результаты многочисленных популяционных исследований свидетельствуют о существовании тесной связи кардиоренальных взаимодействий и обменных нарушений, а также о ведущей роли обменных нарушений в сочетании с АГ в формировании постоянно увеличивающейся популяции больных с сердечно-сосудистой и почечной патологией.
Не вызывает сомнения тот факт, что именно сердечно-сосудистые факторы риска являются ключевыми с точки зрения формирования предрасположенности к стойкому ухудшению функции почек. Скринингу на наличие умеренной альбуминурии подлежат те же лица, у которых необходим прицельный поиск ССЗ, особенно страдающие метаболическим синдромом (МС). МС увеличивает вероятность развития ХБП не менее чем в 2,6 раза, однако и каждая из его составляющих ассоциируется с повышенным риском развития альбуминурии и снижения СКФ, сочетание же пяти компонентов увеличивает риск почти в 6 раз. Патогенетической основой развития сочетанного повреждения сердечно-сосудистой системы и почек при МС является инсулинорезистентность и гиперинсулинемия, активация симпатической нервной системы и РААС, гиперурикемия и развитие эндотелиальной дисфункции, что приводит к стойкой вазоконстрикции и активации тромбогенеза [48, 49].
Изучение взаимосвязей ХБП с МС позволяет утверждать, что высокая распространенность снижения СКФ в популяции определяется, главным образом, нефропатиями метаболического генеза (диабетического, уратного, ассоциированного с ожирением), а также гипертоническим нефроангиосклерозом. Факторы, приводящие к их развитию, во многом связаны с особенностями образа жизни, их своевременное и, по возможности, полное устранение представляет собой один из основных подходов к глобальной профилактике ХБП.
Ожирение, особенно абдоминальное, является самостоятельным фактором риска необратимого ухудшения функции почек: увеличение индекса массы тела на 10% обусловливает увеличение вероятности стойкого уменьшения СКФ в 1,27 раза, что связано с развитием относительной олигонефронии при ожирении [50]. Патогенетические механизмы поражения органов-мишеней при ожирении реализуются через воздействие адипокинов и, прежде всего, лептина на миокард, сосудистую стенку и почечную ткань с развитием генерализованной эндотелиальной дисфункции.
Сочетание СД и АГ повышает риск развития ИБС в 2–4 раза, инсульта – в 2–3 раза, полной потери зрения – в 10–25 раз, уремии – в 15–20 раз и гангрены нижних конечностей – в 20 раз в сравнении с пациентами, не страдающими АГ. При неконтролируемой АГ функция почек прогрессивно ухудшается, а снижение СКФ может достигать 13% в год [51]. Частота сердечно-сосудистых событий на 100 человеко-лет среди пациентов без СД и ХБП составила 14,1, при наличии ХБП – 35,7, а при сочетании ХБП и СД – 49 случаев. При ХСН частота осложнений возрастала еще более драматически – с 8,6 до 30,7 при наличии ХБП и до 52,3 случаев на 100 человеко-лет в случае сочетаня ХБП и СД [34].

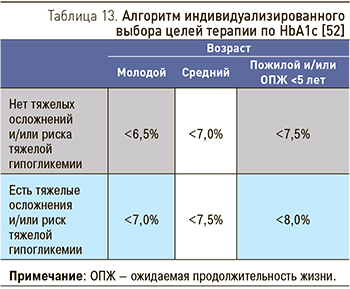
У пациентов с ХБП и СД контроль гликемии является частью нефро- и кардиопротективной стратегии, наравне с антигипертензивной и гиполипидемической терапией, с целью предупреждения сердечно-сосудистых осложнений и замедления прогрессирования ХБП. Для предупреждения и замедления прогрессирования макро- и микрососудистых осложнений СД, в том числе и диабетической нефропатии, у пациентов рекомендуется поддерживать гликированный гемоглобин (HbA1c) на индивидуально выбранном уровне с учетом возраста, ожидаемой продолжительности жизни, наличия тяжелых осложнений и риска развития тяжелых гипогликемических состояний (табл. 13) [52].
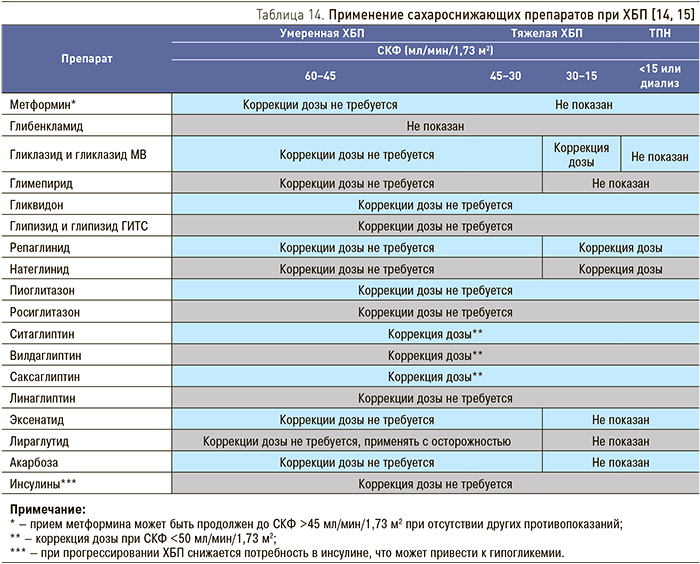
При назначении сахароснижающей терапии больным СД с диабетической нефропатией необходима оценка функции почек и, при необходимости, коррекция дозы препаратов при СКФ <60 мл/мин/1,73 м2 (табл. 14). Необходимо также помнить о повышении риска развития гипогликемии при инсулинотерапии по мере прогрессирования заболевания почек, что требует снижения дозы инсулина.
Гиперурикемия встречается с высокой частотой у больных с АГ, СД, МС, ожирением. По-видимому, существует генетическая общность между этими нарушениями. Кроме того, немалую роль в развитии нарушений пуринового обмена играет широкое применение диуретиков, в первую очередь, тиазидов. Существует тесная взаимосвязь между гиперурикемией и ХБП: повышение уровня мочевой кислоты может быть следствием снижения функции почек, с другой стороны, гиперурикемия может приводить к хроническим заболеваниям почек (хронический интерстициальный нефрит, камнеобразование) и ОПП (уратный криз).
В эксперименте показано неблагоприятное влияние гиперурикемии на системное АД, почечную гемодинамику, состояние эндотелия. Повреждающее действие повышенных уровней мочевой кислоты связано, по-видимому, с инициацией эндотелиальной дисфункции и хронического системного воспаления, замедлением окислительного метаболизма, адгезией тромбоцитов, нарушением реологии крови и агрегации [53, 54]. Однако данных эпидемиологических исследований о роли гиперурикемии как возможного самостоятельного фактора риска сердечно-сосудистых осложнений и ТПН недостаточно. Так, концентрация мочевой кислоты в сыворотке крови достоверно коррелирует со степенью выраженности абдоминального ожирения и триглицеридемией, а у пациентов с АГ и гиперурикемией чаще отмечается ГЛЖ. Вместе с тем определяется сильная независимая связь уровня мочевой кислоты с риском развития сердечно-сосудистой патологии у женщин по сравнению с мужчинами, у представителей негроидной расы по сравнению с белой, а также у больных с АГ или застойной ХСН по сравнению с общей популяцией.
Всем пациентам с гиперурикемией показана низкопуриновая диета и, по-возможности, исключение препаратов, нарушающих пуриновый обмен. Вопрос о целесообразности медикаментозной коррекции гиперурикемии с целью нефро- и кардиопротекции при отсутствии клинических признаков подагрического артрита, уратного уролитиаза и уратного хронического интерстициального нефрита остается открытым в связи с отсутствием доказательной базы. Однако, по мнению экспертов, такая тактика целесообразна [53, 54].

5.4. Хроническая сердечная недостаточность
Распространенность нарушения функции почек при ХСН по данным различных исследований колеблется от 25 до 60%. Сочетание ХСН и ХБП описывается термином «хронический кардиоренальный синдром 2 типа» [55]. Нарушенная функция почек является важнейшим предиктором неблагоприятного прогноза у больных с ХСН наравне с тяжестью ХСН и фракцией выброса ЛЖ. При СКФ <60 мл/мин/1,73 м2 риск смертности увеличивается в 2,1 раза, при сниженной систолической функции ЛЖ риск смерти пациентов при наличии почечной недостаточности возрастает в 3,8 раза, при неизмененной систолической функции – в 2,9 раза. При выраженных нарушениях сократимости миокарда ЛЖ снижение СКФ, как правило, совпадает с появлением другого неблагоприятного маркера – увеличением плазменной концентрации натрийуретических пептидов [56, 57].
У пациентов с ХСН, особенно при уже имеющихся признаках почечной дисфункции, прогрессирующее нарастание Кр сыворотки нередко наблюдает после назначения блокаторов РААС и спиронолактона. Именно нарушение функции почек в наибольшей степени ограничивает применение этих классов препаратов у больных с ХСН, что всегда приводит к значительному снижению эффективности лечения последней, особенно с позиции улучшения долгосрочного прогноза. Следует подчеркнуть высокий риск дальнейшего ухудшения функции почек при ХСН, обусловленной назначением ингибиторами АПФ в больших дозах без должного контроля Кр и калия сыворотки, передозировкой петлевых или тиазидных диуретиков, применением некоторых антибактериальных препаратов, рентген-контрастных агентов, а также нестероидных противовоспалительных средств (НПВС).
У пациентов с ХСН и ХБП проводимая терапия должна соответствовать требованиям современных рекомендаций [14], однако необходим тщательный контроль функции почек, а лечение следует начинать с назначения минимальных доз препаратов (табл. 15).
Алгоритм назначения блокаторов РААС (ингибиторов АПФ и БРА) пациентам с ХСН и риском ухудшения функции почек
- Противопоказаны при двустороннем стенозе почечных артерий, беременности, анамнезе ангионевротического отека.
- Оценить функциональное состояние почек (рСКФ) и уровень калия в сыворотке крови.
- Назначение блокаторов РААС требует особой осторожности в следующих ситуациях: калий сыворотки >5,0 ммоль/л, Кр сыворотки >221 мкмоль/л (>2,5 мг/ дл), рСКФ <30 мл/мин/1,73 м2, систолическое АД <90 мм рт.ст.
- Начинать лечение с минимальных доз (табл. 15).
- Удвоение дозы следует проводить не ранее, чем через 2 нед при амбулаторном ведении пациентов; более быстрое увеличение дозы возможно у больных в стационаре при тщательном мониторировании состояния больного и функции почек.
- Следует стремиться к достижению целевых или, по крайней мере, максимально переносимых доз препаратов (табл. 15).
- Контроль сывороточных уровней Кр и калия следует проводить через 1–2 нед после начала терапии и через 1–2 нед после последнего повышения дозы, после чего – 1 раз в 4 мес.
- При назначении блокаторов РААС следует ожидать некоторого ухудшения функции почек и повышения уровня калия.
- Повышение уровня Кр менее, чем на 50% от исходного или до уровня <266 мкмоль/л (3 мг/ дл), снижение рСКФ до 25 мл/мин/1,73 м2, повышение калия до ≤5,5 ммоль/л допустимо, никаких изменений терапии не требуется.
- Если уровень Кр после назначения блокатора РААС повысился на 50–100% от исходного, следует уменьшить дозу блокатора РААС в 2 раза и оценить уровни Кр и калия через 1–2 нед.
- При повышении уровня калия >5,5 ммоль/л, Кр более, чем на 100% или >310 мкмоль/л (3,5 мг/дл), снижении рСКФ <20 мл/мин/1,73 м2 блокаторы РААС следует отменить и направить пациента на консультацию к нефрологу.
- При повышении уровней мочевины, Кр или калия следует оценить возможность отмены нефротоксичных (прежде всего НПВС, аминогликозидов) и калийсодержащих и калийсберегающих препаратов, при отсутствии признаков застоя – уменьшения дозы диуретиков.
- Уровни Кр и калия следует мониторировать до их стабилизации.

Алгоритм назначения диуретиков пациентам с ХСН и риском ухудшения функции почек
- Оценить функциональное состояние почек (рСКФ) и уровень калия в сыворотке крови.
- Назначение диуретиков требует особой осторожности, если уровень Кр сыворотки >221 мкмоль/л (>2,5 мг/дл) или рСКФ <30 мл/ мин/1,73 м2, поскольку может привести к ухудшению функции почек (или не дать диуретического эффекта).
- Комбинация с ингибиторами АПФ или БРА может привести к гипотонии.
- Комбинация с другими диуретиками (петлевые+тиазидные) повышает риск гиповолемии, гипотонии, гипокалиемии и ухудшения функции почек.
- Комбинация с НПВС уменьшает диуретический эффект.
- Начинать лечение с минимальных доз (табл. 16).
- Контроль сывороточных уровней мочевины, креатинина, мочевой кислоты, калия следует проводить через 1–2 нед после начала терапии и после повышения дозы.
При ухудшении функции почек
- Исключить гиповолемию/дегидратацию.
- Отменить нефротоксичные препараты.
- Воздержаться от назначения антагонистов минералокортикоидных рецепторов (АМКР).
- При использовании комбинации петлевого и тиазидного диуретика отменить тиазидный диуретик.
- При необходимости – уменьшить дозу ингибиторов АПФ/БРА.
Алгоритм назначения антагонистов минералокортикоидных рецепторов пациентам с ХСН и риском ухудшения функции почек
- Оценить функциональное состояние почек (рСКФ) и уровень калия в сыворотке крови.
- АМКР следует назначать с особой осторожностью в исключительных случаях при уровне калия сыворотки >5,0 ммоль/л, Кр сыворотки >221 мкмоль/л (>2,5 мг/дл), рСКФ <30 мл/мин/1,73 м2 [58].
- Начинать лечение с минимальных доз (табл. 15, 16).
- Повышение дозы, если необходимо, следует начинать через 4–8 нед от начала терапии.
- Контроль сывороточных уровней Кр и калия следует проводить через 1 и 4 нед после начала терапии или повышения дозы, затем – на 8 и 12 нед, через 6, 9 и 12 мес, после чего – 1 раз в 4 мес.
- Если уровень калия >5,5 ммоль/л, уровень Кр >221 мкмоль/л (>2,5 мг/дл) или рСКФ <30 мл/мин/1,73 м2, следует уменьшить дозу в 2 раза и контролировать уровни калия и Кр.
- Следует избегать комбинации с калийсодержащими препаратами, калийсберегающими диуретиками, нефротоксичными препаратами (НПВС); некоторые заменители соли содержат значительное количество калия.
- Тройная комбинация АМКР, ингибиторов АПФ и БРА противопоказана.
- При повышении уровня калия >6,0 ммоль/л, Кр >310 мкмоль/л (3,5 мг/дл), снижении рСКФ <20 мл/мин/1,73 м2 препарат следует отменить и направить пациента на консультацию к нефрологу.
6. Острое повреждение почек у пациентов с сердечно-сосудистыми заболеваниями
Термин ОПП был принят в 2004 г. вместо понятия «острая почечная недостаточность», диагностические критерии которой не были четко установлены, вследствие чего оценить реальную распространенность этой патологии было сложно. В 2012 г. опубликованы первые рекомендации по диагностике и лечению ОПП [16]. Диагностическими критериями ОПП являются повышение сывороточного Кр хотя бы на >0,3 мл/дл (26,5 мкмоль/л) в течение 48 ч либо в 1,5 раз в течение предшествующих 7 дней и/ или снижение диуреза менее 0,5 мл/кг/ч за 6 ч. Стадия ОПП определяется на основании уровня Кр и/или диуреза (табл. 17).
Риск развития ОПП повышается как в присутствии факторов риска ОПП (критическое состояние больного, сепсис, шок, травмы и ожоги, кардиохирургические и большие хирургические вмешательства, нефротоксичные и рентгенконтрастные препараты, отравления) [60–65], так и при наличии состояний, повышающих восприимчивость пациента к факторам риска ОПП (дегидратация, пожилой возраст, женский пол, негроидная раса, острые и хронические заболевания, СД, рак, анемия, проводимая терапия) [66–68]. Пациенты с риском развития ОПП нуждаются в тщательном контроле уровня Кр и диуреза, при этом частота и длительность мониторинга определяется индивидуально в зависимости от степени риска и конкретной клинической ситуации.
Причина ОПП должна быть установлена во всех случаях, когда это возможно. Пациенты с ОПП должны наблюдаться в течение 3 мес для оценки степени восстановления функции почек, повторного эпизода ОПП или ухудшения течения имевшей место прежде ХБП.
6.1. Острая сердечная недостаточность и острая декомпенсация хронической сердечной недостаточности
У трети больных с острой сердечной недостаточностью и в 25–70% случаев острой декомпенсации ХСН развивается ОПП; сочетанное повреждение сердца и почек описывается термином «острый кардиоренальный синдром 1 типа» [55]. Установлено, что у больных с острой декомпенсацией ХСН развитие ОПП ассоциируется с более продолжительной госпитализацией и большей частотой повторных госпитализаций по поводу ХСН, прогрессированием ХБП, повышением риска сердечно-сосудистой и общей смертности.
Нарушение функции почек лимитирует назначение этой популяции больных блокаторов РААС и АМКР, а нарастающая уремия и гипергидратация могут привести к необходимости проведения заместительной почечной терапии. Среди пациентов, начинающих лечение программным гемодиализом, 33% имеют диагноз ХСН, смертность у этих пациентов значительно выше, чем у больных с ТПН без признаков ХСН. Проведение диализа при тяжелой ХСН, особенно у пожилых пациентов с наличием других сопутствующих заболеваний, представляет сложную задачу и не всегда приводит к улучшению качества и увеличению продолжительности жизни.
6.2. Острый коронарный синдром
Нарушение функции почек встречается у 30–40% пациентов с острым коронарным синдромом (ОКС), а при кардиогенном шоке у 70% пациентов [69]. Снижение СКФ <60 мл/ мин/1,73 м2 является независимым предиктором (относительный риск (ОР) 2,13, 95% доверительный интервал (ДИ) 1,7–2,6) смерти от инфаркта миокарда, рецидива инфаркта миокарда, развития сердечной недостаточности, инсульта и кровотечений при ОКС как с подъемом сегмента ST, так и без подъема сегмента ST [69]. Результаты объединенного анализа регистров больных c ОКС свидетельствуют о том, что снижение СКФ ассоциировано с повышением 30-дневной (ОР 1,19, 95% ДИ 1,12–1,27, p<0,001) и 6-месячной (ОР 1,16, 95% ДИ 1,11–1,22, p<0,001) смертности [70].
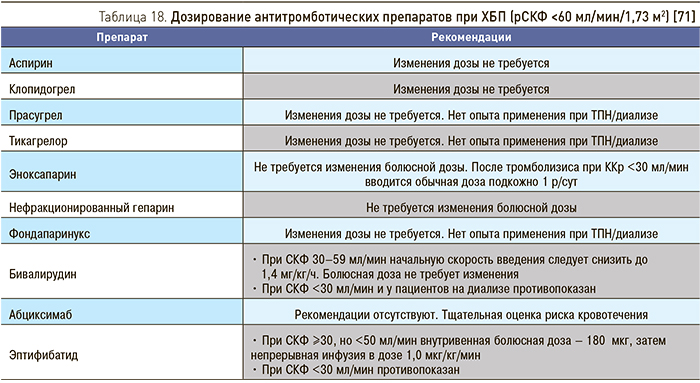
Пациенты с ОКС, имеющие нарушение функции почек, часто не получают адекватную терапию [71, 72], что объясняется как отсутствием данных о клинических исследованиях в этой популяции, так и высоким риском осложнений, прежде всего кровотечений и дальнейшего ухудшения функции почек. Есть данные, что у больных ХБП часто развиваются кровотечения вследствие передозировки антитромботических препаратов, дозы которых, при преимущественно почечном пути выведения, нуждаются в коррекции с учетом функционального состояния почек (табл. 18) [73–75].
Снижение функции почек предрасполагает к неблагоприятным исходам процедур реваскуляризации миокарда. Интраоперационная смертность при аортокоронарном шунтировании у больных со стойким ухудшением функции почек возрастает более чем в 7 раз. Влияние СКФ на смертность больных, перенесших аортокоронарное шунтирование, остается значимым и при длительном (>15 лет) наблюдении.
7. Особенности наблюдения пациентов при хронической болезни почек с разным риском прогрессирования
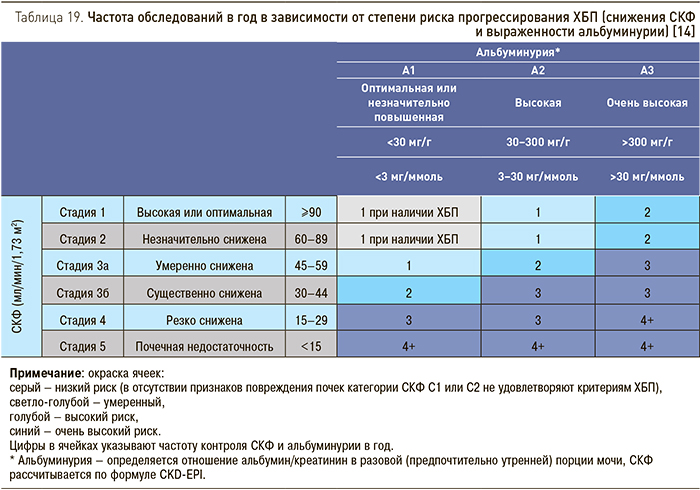
У пациентов с ХБП необходимо оценивать уровень СКФ и альбуминурии не реже 1 раза в год, чаще следует мониторировать функцию почек у больных с высоким риском прогрессирования и в тех случаях, когда величины этих показателей следует учитывать при назначении терапии (табл. 19). При этом следует иметь в виду, что небольшие изменения СКФ встречаются достаточно часто и не всегда указывают на прогрессирующее течение заболевания.
Прогрессирование ХБП определяется при наличии хотя бы одного из следующих признаков:
- Снижение уровня СКФ на категорию или больше (≥90 [С1] → 60–89 [С2] → 45–59 [С3a] → 30–44 [С3б] → 15–29 [С4] → <15 [С5] мл/ мин/1,73 м2). Не вызывающее сомнений снижение рСКФ определяется как снижение категории СКФ в сочетании со снижением рСКФ не менее, чем на 25% от предыдущего значения.
- Под ускоренным прогрессированием следует понимать стабильное снижение рСКФ более, чем на 5 мл/мин/1,73 м2/год (физиологическое снижение СКФ с возрастом составляет около 1 мл/мин/1,73 м2/год).
- Чем чаще мониторируется уровень сывороточного Кр и дольше период наблюдения, тем выше вероятность выявления прогрессирования ХБП.
Пациентам с прогрессирующим течением ХБП необходима коррекция проводимой терапии, а также дополнительное обследование для выявления обратимых причин ухудшения функции почек. При необходимости показана консультация специалиста. Больные с СКФ >30 мл/мин/1,73 м2 (ХБП С1-3) в большинстве случаев должны находиться под наблюдением терапевтов, а наблюдение нефролога показано всем больным с СКФ <30 мл/мин/1,73 м2 (ХБП С4–5) (табл. 20).

Консультация нефролога необходима пациентам в следующих ситуациях:
- Развитие ОПП или подтвержденное снижение СКФ.
- Постоянная выраженная альбуминурия (Ал/Кр>300 мг/г или 30 мг/ммоль или экскреция альбумина с мочой >300 мг/сут) или стойкая протеинурия.
- Прогрессирование ХБП.
- Появление эритроцитарных цилиндров или эритроцитов >20 в поле зрения в моче.
- ХБП и резистентная АГ.
- Стойкое снижение или повышение уровня калия в сыворотке крови.
- Стойкая депрессия удельного веса мочи, полиурия, глюкозурия при нормальном уровне глюкозы крови.
- Нефролитиаз (с частым образованием и/или большим количеством конкрементов показана консультация уролога).
- Наследственные заболевания почек.
Под поздним обращением к нефрологу следует понимать обращение менее чем за год до начала заместительной почечной терапии [14].
8. Профилактика прогрессирования хронической болезни почек
8.1. Изменения образа жизни
Пациентам с ХБП рекомендуются физические нагрузки с учетом состояния сердечно-сосудистого здоровья и переносимости (по крайней мере 30 мин физических упражнений 5 раз в нед), поддержание веса в оптимальном диапазоне (индекс массы тела 20–25 кг/м2), прекращение курения (ID) [14].
Всем пациентам с ХБП рекомендуется консультация диетолога, а также обучение в рамках образовательных программам соответственно тяжести заболевания и необходимости ограничения поваренной соли, фосфатов, калия и белка в рационе (IВ) [14]. Высокобелковая диета (содержание белка в пище более 1,3 г/кг/сут) является фактором риска развития и прогрессирования ХБП. На 1–2 стадиях ХБП рекомендуемое суточное потребление белка составляет 1,0 г/кг веса тела. На 3а и 3б стадиях ХБП как пациентам без СД, так и с СД рекомендуется малобелковая диета, то есть ограничение содержания белка в пище до 0,8–0,6 г/кг/сут. На 4 и 5 (до начала диализа) стадиях ХБП рекомендуется низкобелковая диета (0,6–0,3 г/кг/сут). Пациентам с ХБП, соблюдающим малобелковую и низкобелковую диету, необходим обязательный контроль пищевого рациона и питательного статуса для профилактики синдрома белково-энергетической недостаточности. Назначение комплекса кетоаналогов незаменимых аминокислот (кетостерил по 1 таб. на 5 кг массы тела в сут или 0,1 г/ кг/сут) и высокая калорийность рациона (30–35 ккал/кг/ сут) позволяют безопасно ограничивать потребление белка, при этом наблюдается замедление прогрессирования ХБП (IIС) [13], отмечается более эффективный контроль АГ, протеинурии, гиперфосфатемии, гиперкалиемии, дислипидемии, инсулинорезистентности, ассоциированных с ХБП.
8.2. Особенности назначения медикаментозных препаратов
Дозирование лекарственных препаратов у пациентов с ХБП следует осуществлять с учетом уровня СКФ (IA) [14]. При необходимости точного дозирования препарата из-за его высокой токсичности или узкого терапевтического окна и в ситуациях, когда использование расчетных формул, включающих в себя сывороточный Кр, противопоказано, рекомендуется использовать методы оценки функции почек, основанные на определении концентрации цистатина С или ККр (IС) [14].
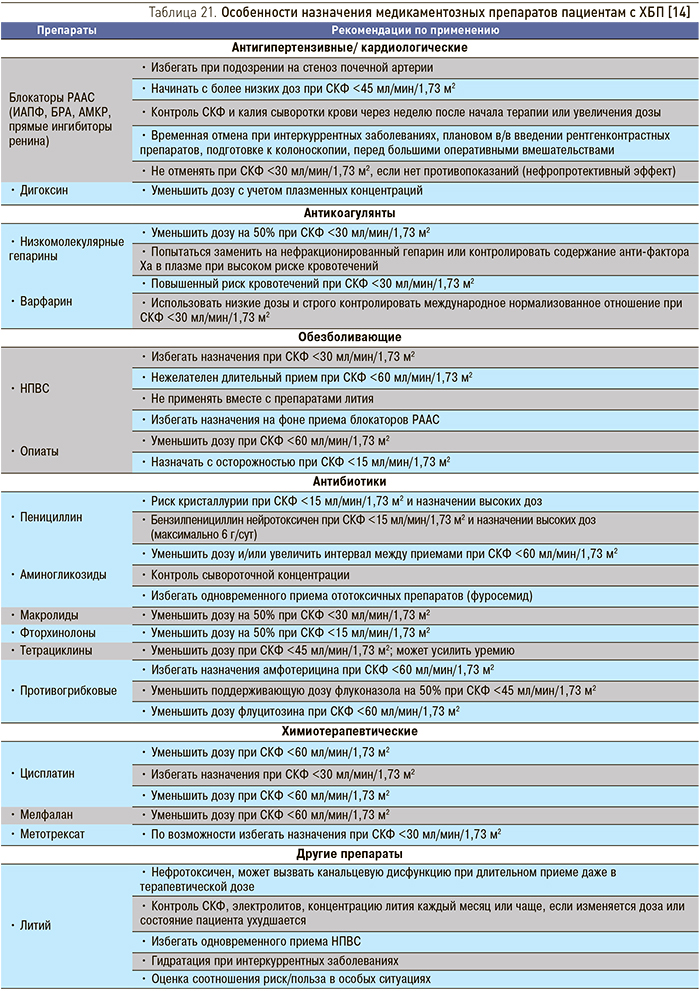
Пациентам c ХБП С3а–С5, тяжелыми интеркуррентными заболеваниями и высоким риском развития ОПП показана временная отмена потенциально нефротоксичных препаратов и препаратов с почечным путем выведения, к которым относятся блокаторы РААС (ингибиторы АПФ, БРА, АМР, прямые ингибиторы ренина), диуретики, НПВС, метформин, препараты лития, дигоксин и др. (IС) (табл. 21) [14].
Всем пациентам, принимающим потенциально нефротоксичные препараты, независимо от уровня СКФ и наличия ХБП, необходимо проводить регулярный контроль уровня СКФ, электролитов и сывороточной концентрации препарата (IА) [13]. Всем пациентам с ХБП следует разъяснить недопустимость приема каких-либо препаратов, в том числе и биологических добавок и трав, без предварительной консультации с врачом (IВ) [14].
Антикоагулянты при фибрилляции предсердий у пациентов с хронической болезнью почек
Решение вопроса о лечении антикоагулянтами пациентов с ХБП, имеющих фибрилляцию предсердий, должно основываться на оценке риска тромбоэмболических осложнений и риска кровотечения. Целесообразно использовать шкалу CHA2DS2-VASc для оценки риска инсульта и системных тромбоэмболий, а также шкалу HAS-BLED для оценки риска кровотечений (IA).
Варфарин можно использовать у пациентов с ХБП 1–4 стадий, основываясь на соотношении тромбоэмболический риск/риск кровотечения (IIaC). Варфарин c большой осторожностью может использоваться у пациентов с ХБП 5 стадии. Крупных многоцентровых клинических исследований эффективности варфарина у больных с ХБП 5 стадии и фибрилляцией предсердий нет. Решение принимается исходя из соотношения тромбоэмболический риск/риск кровотечения (IIbC). Убедительных данных об эффективности и безопасности варфарина у больных, получающих лечение гемодиализом, нет. Варфарин может быть использован у больных с ФП, получающих лечение гемодиализом, в случае явного преобладания риска тромбоэмболий над риском кровотечения (IIbC).
Дабигатран не иcпользуется при СКФ <30 мл/мин/1,73 м2. Ривароксабан не иcпользуется при СКФ <15 мл/мин/1,73 м2, при СКФ от 15 до 49 мл/мин/1,73 м2 доза составляет 15 мг 1 раз в сут. Апиксабан не иcпользуется при СКФ <25 мл/мин/1,73 м2, при Кр сыворотки >133 мкмоль/л доза составляет 2,5 мг 2 раза в сут. Данных об эффективности и безопасности дабигатрана, ривароксабана и апиксабана у пациентов, получающих лечение гемодиализом, нет, следовательно они не могут быть рекомендованы у этой категории больных (IIIC).
8.3. Визуализирующие исследования
Пациенты с ХБП входят в группу высокого риска развития ОПП (IА) [14] и требуют особой осторожности при проведении исследований и назначении препаратов, которые могут вызвать ухудшение функции почек. При решении вопроса о необходимости проведения визуализирующих исследований с применением рентгенконтрастных препаратов необходимо тщательно взвесить диагностическую и терапевтическую ценность ожидаемых результатов и риск развития ОПП. Исследования с внутривенным введением йодсодержащих рентгенконтрастных препаратов у пациентов с ХБП С3а–C5 должны проводиться с учетом клинических рекомендаций по ОПП [16]:
- избегать применения высокоосмолярных препаратов (IВ);
- использовать минимально возможную дозу рентгенконтрастного препарата;
- отмена потенциально нефротоксичных препаратов до и после исследования (IС);
- адекватная гидратация пациента с использованием физиологического раствора до, во время и после проведения исследования (IА);
- оценка СКФ через 48–96 ч после исследования (IС).
Применение гадолиний-содержащих контрастных препаратов при ХБП С5 не рекомендуется и допустимо только при невозможности заменить их другими методами исследования (IВ). Для пациентов с ХБП С4–С5 рекомендуется использовать гадолиниевые препараты на основе макроциклических хелатных комплексов (IIВ).
Приложения
Приложение 1. Классы рекомендаций и уровни доказательств
Класс I: Условия, при которых, согласно данным исследований и/или общему мнению экспертов, выполнение процедур или лечения полезно и эффективно.
Класс II: Условия, при наличии которых данные исследований противоречивы и имеются различия во мнениях экспертов о полезности/эффективности процедуры или лечения.
Класс IIа: Данные исследований и мнения экспертов склоняются в сторону полезности и эффективности выполнения процедур.
Класс IIb: Полезность и эффективность процедуры или лечения не так хорошо установлены, согласно данным исследований или мнениям экспертов.
Класс III: Условия, при которых, согласно имеющимся данным, общему мнению экспертов, процедуры не полезны и не эффективны, а в отдельных случаях вредны.
Уровень доказательств А: данные основаны на результатах многоцентровых рандомизированных клинических исследований.
Уровень доказательств В: данные основаны на результатах единственного рандомизированного или нерандомизированных исследований.
Уровень доказательств С: данные основаны на общем согласии экспертов.
Приложение 2. Номограмма определения площади поверхности тела взрослого человека*

Приложение 3. Номограмма определения стадии хронической болезни почек по формуле CKD–EPI
[http://medpro.ru/groups/khronicheskaya_bolezn_pochek_prilozhenie]
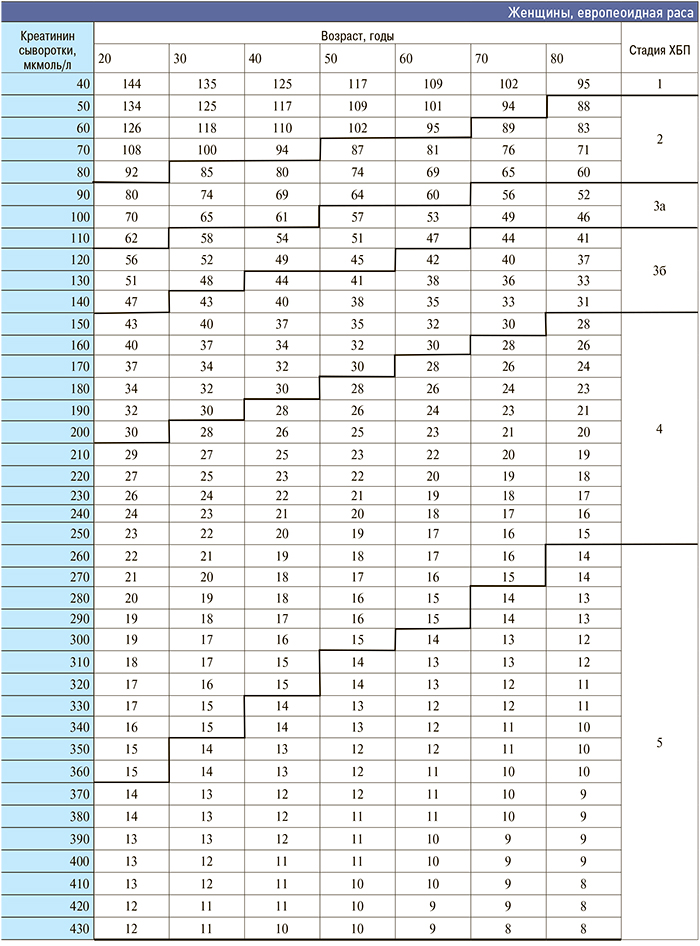
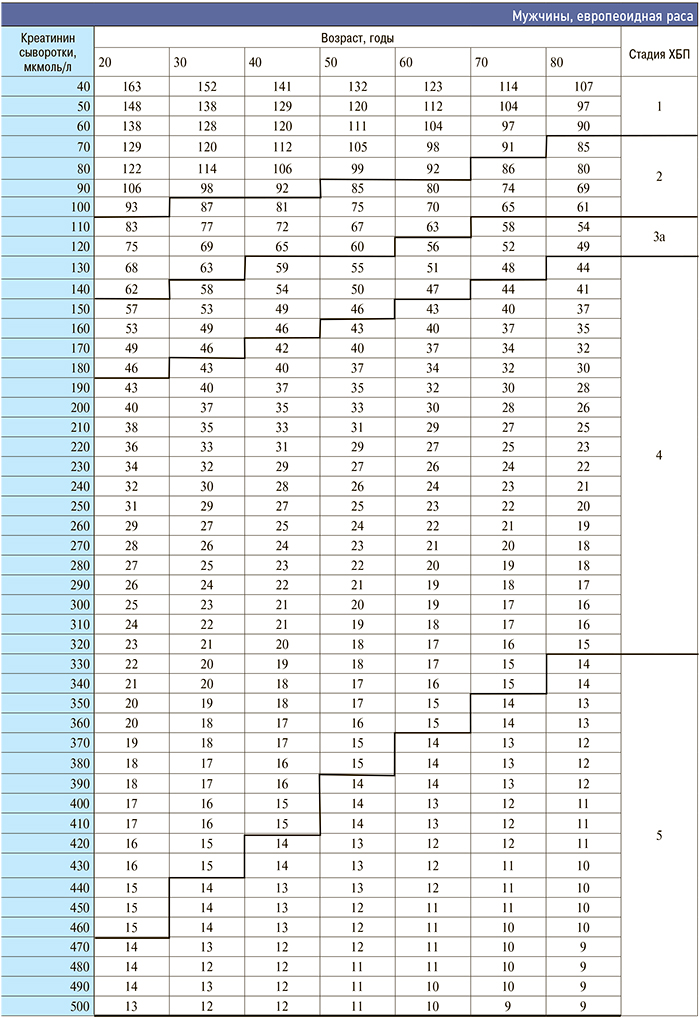
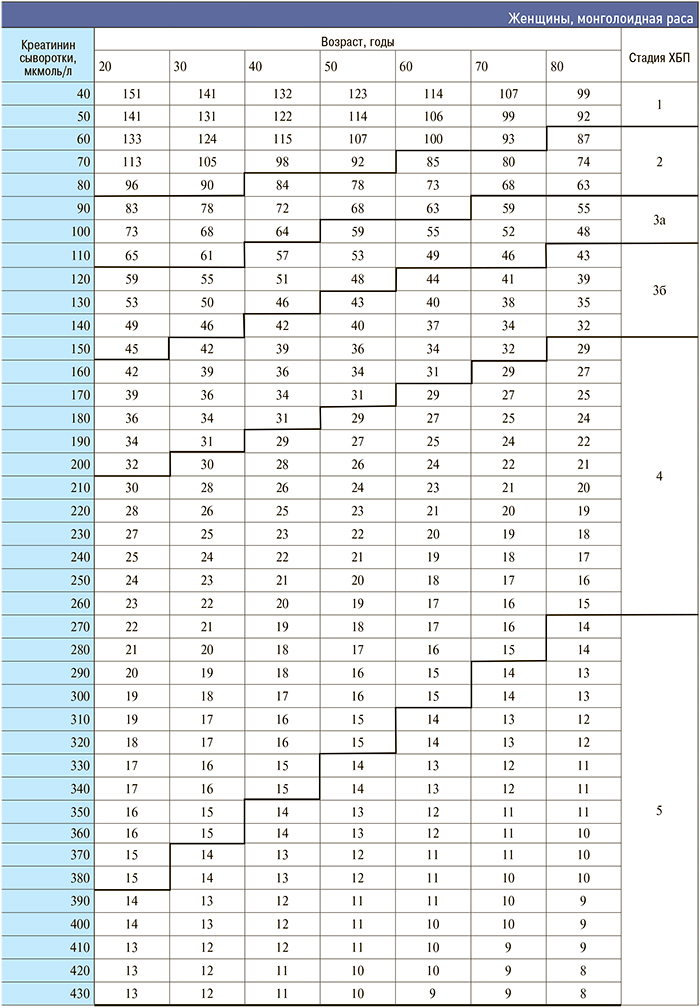
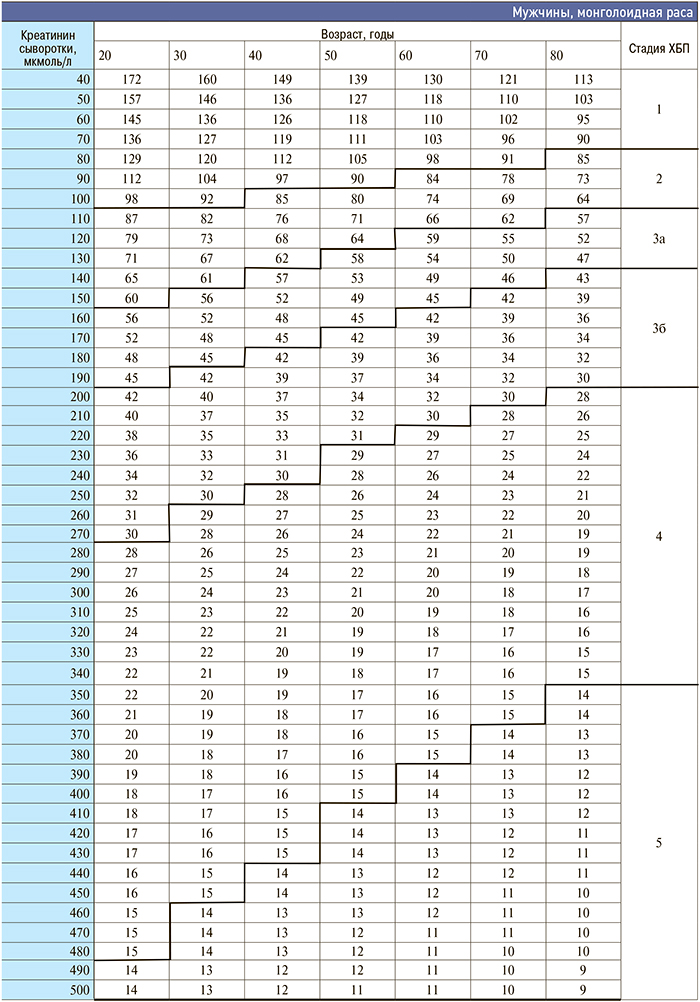
Приложение 4. Основные клинические исследования у больных с нарушением функции почек