Экспертная группа по подготовке рекомендаций:
председатели экспертной группы: акад. РАН Г.А. Мельниченко, акад. РАН Н.Н. Яхно, академик РАН А.И. Мартынов;
ответственные исполнители: проф. Г.Р. Галстян, проф. Е.Г. Старостина, проф. И.В. Гурьева, д.м.н. А.Ю. Токмакова, к.м.н. М.В. Чурюканов;
Состав экспертной группы: Г.А. Мельниченко – зам. директора ФГБУ «Эндокринологический научный центр», директор Института клинической эндокринологии, председатель Московской ассоциации эндокринологов, вице-президент Российской ассоциации эндокринологов, академик РАН, проф., д.м.н.; М.В. Шестакова – зам. директора ФГБУ «Эндокринологический научный центр» по научной работе, директор Института диабета, академик РАН, проф., д.м.н.; Н.Н. Яхно – профессор кафедры нервных болезней лечебного факультета, директор научно-образовательного клинического центра неврологии Первого Московского государственного медицинского университета им. И.М. Сеченова, президент Российского общества по изучению боли, академик РАН, проф., д.м.н.; А.И. Мартынов – профессор кафедры госпитальной терапии № 1 лечебного факультета Московского государственного медико-стоматологического университета им. А.И. Евдокимова, президент Российского научного медицинского общества терапевтов, академик РАН, проф., д.м.н.; Г.Р. Галстян – зав. отделением диабетической стопы, главный научный сотрудник ФГБУ «Эндокринологический научный центр», проф., д.м.н.; Е.Г. Старостина – профессор кафедры эндокринологии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», проф., д.м.н.; И.В. Гурьева – профессор кафедры эндокринологии терапевтического факультета ГБУ ДПО Российской медицинской академии непрерывного профессионального образования, заведующая сектором медико-социальной экспертизы и реабилитации при эндокринных заболеваниях ФГБУ ФБ МСЭ Минтруда России, проф., д.м.н.; М.Л. Кукушкин – руководитель лаборатории фундаментальных и прикладных проблем боли НИИ общей патологии и патофизиологии РАН, ответственный секретарь Российского общества по изучению боли, проф., д.м.н.; М.В. Чурюканов – доцент кафедры нервных болезней лечебного факультета Первого МГМУ им. И.М. Сеченова, к.м.н.; И.А. Строков – доцент кафедры нервных болезней лечебного факультета Первого МГМУ им. И.М. Сеченова, к.м.н.; А.Ю. Токмакова – главный научный сотрудник отделения диабетической стопы ФГБУ «Эндокринологический научный центр», д.м.н.
1. ВВЕДЕНИЕ И ОБЩИЕ ВОПРОСЫ
Диабетическая периферическая нейропатия (ДПН) – комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным поражением периферических и/или автономных нервных волокон в результате сахарного диабета (СД).
ДПН, особенно ее болевая форма (БДПН), серьезно ухудшает состояние, трудоспособность и качество жизни пациентов, способствует усилению тревоги, депрессии и нарушений сна, нарушает физическое и психическое функционирование больных, снижая, в частности, их комплаентность в отношении ведения СД. Наличие ДПН ассоциировано с ухудшением прогноза, повышением риска развития язв стопы и 15-кратным ростом риска ампутации нижних конечностей и инвалидизации. Кроме того, она является предиктором развития ретинопатии, нефропатии и более высокой смертности пациентов.
По данным российского Регистра СД, ДПН выявлена в среднем у 33,6% больных СД1 и у 18,6% больных СД2, причем в разных регионах России эти показатели колеблются от 0,1 до 67,2% при СД1 и от 0,1 до 42,4% при СД2 [1]. Однако, судя по широкомасштабным эпидемиологическим исследованиям, истинная распространенность ДПН гораздо выше (50–70%), причем БДПН страдает от 16 до более 30% пациентов. Таким образом, хотя ДПН остается самым распространенным хроническим осложнением СД, ее диагностика и соответственно лечение оставляют желать лучшего.
Несмотря на некоторые различия в классификациях ДПН и существование индивидуально сложных диагностических ситуаций, в большинстве случаев диагностика ДПН, особенно БДПН, и ее лечение без труда могут осуществляться не только неврологами, но и эндокринологами, диабетологами, о чем прямо говорится в основополагающем отечественном документе по ведению больных СД «Алгоритмы специализированной медицинской помощи больным сахарным диабетом: клинические рекомендации» [2], но и, вне всякого сомнения, врачами общей практики или терапевтами. Это обусловлено тем, что диагноз данного состояния ставится на основании тщательного собранного анамнеза, внимательной оценки характера жалоб и физикального обследования нижних конечностей и в большинстве случаев практически не требует специальных методов диагностики.
В связи с этим, по мнению экспертов, представляющих ведущие российские профессиональные медицинские сообщества, назрела необходимость разработки клинических рекомендаций по диагностике и лечению пациентов с болевой формой диабетической нейропатии. Учитывая важное обстоятельство, когда врачи различных специальностей задействованы в диагностике и лечении пациентов с БДПН, настоящие рекомендации должны быть созданы совместными усилиями экспертов, представляющих различные медицинские специальности.
В октябре 2017 г. и январе 2018 г. в Москве прошли совместные совещания ведущих экспертов Российской ассоциации эндокринологов, Российского общества по изучению боли, Российского научного медицинского общества терапевтов. Совещания были посвящены разработке клинических рекомендаций по диагностике и лечению пациентов с болевой формой диабетической нейропатии, а также внедрению в клиническую практику современных методов диагностики и терапии БДПН. Подготовленный проект рекомендаций был представлен участникам экспертной группы для согласования всех спорных вопросов оказания медицинской помощи пациентам именно в условиях российского здравоохранения, после чего рекомендации были утверждены на совещании междисциплинарного Экспертного совета.
Данный документ посвящен практическим аспектам диагностики, дифференциальной диагностики и симптоматической терапии БДПН и предназначен эндокринологам, диабетологам, неврологам, терапевтам, врачам общей практики и врачам любых специальностей, к которым могут обратиться пациенты с СД и жалобами на болевой синдром.
2. КЛАССИФИКАЦИЯ ПОКАЗАНИЙ К ЛЕЧЕБНЫМ ВМЕШАТЕЛЬСТВАМ ПО СТЕПЕНИ ДОКАЗАТЕЛЬНОЙ ЭФФЕКТИВНОСТИ
В течение последних двух десятилетий мировое сообщество использует следующую Классификацию показаний к лечебным и диагностическим вмешательствам по степени доказательной эффективности (табл. 1).

3. ОПРЕДЕЛЕНИЯ, ТЕРМИНОЛОГИЯ: БОЛЬ, ВИДЫ БОЛИ, НЕЙРОПАТИЧЕСКАЯ БОЛЬ
С позиций патофизиологии различают ноцицептивную и нейропатическую боль [3, 4]. Ноцицептивной называют боль, обусловленную воздействием какого-либо фактора (механическая травма, ожог, воспаление и т.д.) на периферические болевые рецепторы при интактности всех отделов нервной системы. Под нейропатической подразумевают боль, возникающую при органическом поражении или нарушении функции различных отделов нервной системы. Причинами нейропатической боли могут быть повреждения нервной системы на любом уровне, начиная от периферических нервов и заканчивая корой больших полушарий. В неврологии термин «нейропатическая» обычно указывает на поражение периферического нерва. В связи с этим может возникнуть неверное представление о том, что нейропатическая боль возникает исключительно при периферической нейропатии или полинейропатии. Следует еще раз подчеркнуть, что термин «нейропатическая боль» указывает на болевой синдром, возникающий при поражении или нарушении функции как периферической, так и центральной нервной системы.
В популяции нейропатическая боль встречается в 11,5% случаев. Сегодня она объединяет целую группу хронических болевых синдромов, которые ранее рассматривались самостоятельно. К этой группе относят болевой синдром при различных моно- и полинейропатиях. Среди них наиболее часто боли возникают при диабетической и алкогольной полинейропатиях (25–45%). Постгерпетическая невралгия (в пожилом возрасте это осложнение возникает в 70% случаев опоясывающего герпеса) также является вариантом нейропатической боли. По данным разных авторов, частота нейропатической боли при диабетической полиневропатии достигает 45%, рассеянном склерозе — 28%, сирингомиелии — 75%, мозговом инсульте — 8%, травме нерва — 5%. Среди всех пациентов с нейропатической болью около 50% составляют больные с диабетической полинейропатии. К сожалению, нередко боли у этих пациентов трактуются как сосудистые или вертеброгенные, что приводит к неадекватным терапевтическим мероприятиям.
Нейропатическая боль имеет некоторые особенности. Прежде всего она сопровождается специфическими чувствительными расстройствами. Очень характерной для нейропатической боли является аллодиния — появление боли в ответ на стимул, который в нормальных условиях не вызывает боли. В таких случаях больные испытывают сильные боли при малейшем прикосновении, иногда даже при дуновении ветра. Различают температурную и механическую аллодинию. Механическая аллодиния подразделяется на статическую, которая появляется при давлении на фиксированную точку кожного покрова, и динамическую, возникающую при движущихся стимулах, например легком раздражении кожи кисточкой или пальцем.
При нейропатической боли часто наблюдаются гиперестезия, гипералгезия, гиперпатия, невралгия. При гипералгезии чувствительность к болевому стимулу оказывается значительно выше, чем ожидается в норме. При гиперпатии субъективный ответ как на болевой, так и неболевой стимулы является чрезмерным и часто сохраняется в течение долгого времени уже после прекращения раздражения. Пациента могут также беспокоить спонтанные боли, возникающие при очевидном отсутствии какого-либо внешнего воздействия. Они, как правило, носят жгучий, колющий характер. Чувство щекотания, безболезненного покалывания или другие подобные ощущения относятся к парестезиям; если эти ощущения причиняют боль, то их называют дизестезиями.
 4. КЛАССИФИКАЦИЯ ДИАБЕТИЧЕСКИХ НЕЙРОПАТИЙ
4. КЛАССИФИКАЦИЯ ДИАБЕТИЧЕСКИХ НЕЙРОПАТИЙ
В повседневной клинической практике чаще всего нейропатические боли в ногах у больных СД вызваны хронической сенсорной/сенсомоторной ДПН (около 80%). Существенно меньший процент приходится на острые сенсорные, или атипичные, нейропатии – нейропатию Элленберга и острую «инсулиновую» нейропатию. Редкие формы болевых нейропатий при СД – проксимальная моторная нейропатия (син. диабетическая пояснично-крестцовая радикулоплексопатия) и другие фокальные и мультифокальные несимметричные нейропатии, поражающие периферические, черепно-мозговые и другие нервы, – требуют направления к неврологу для специального обследования, дифференциальной диагностики и лечения. Классификация приведена в табл. 2.
5. ДИАБЕТИЧЕСКАЯ ПЕРИФЕРИЧЕСКАЯ НЕЙРОПАТИЯ
Диабетическая нейропатия – это наиболее распространенное хроническое осложнение сахарного диабета, представляющее собой гетерогенную группу состояний, поражающих различные части нервной системы и представленных различными клиническими проявлениями [5]. Ранняя диагностика и должная тактика лечения нейропатии у пациентов с сахарным диабетом важны по многим причинам:
- Диабетическая нейропатия – это диагноз исключения. У пациентов с сахарным диабетом могут присутствовать недиабетические нейропатии, для лечения которых могут применяться специфические методы.
- Существует несколько вариантов лечения симптоматической диабетической нейропатии.
- До 50% случаев диабетической периферической нейропатии характеризуются бессимптомным течением. При отсутствии своевременной диагностики и профилактического ухода за стопами пациенты находятся в группе риска повреждений нечувствительных стоп.
Среди различных форм диабетической нейропатии наиболее изученными являются дистальная симметричная полинейропатия и диабетическая автономная полинейропатия, особенно кардиоваскулярная автономная невропатия [5].
Диабетическая периферическая нейропатия (ДПН) – это наиболее распространенная форма диабетической нейропатии; на ее долю приходится около 75% всех диабетических нейропатий [6, 7]. В клинической практике диагностика ДПН включает выявление симптомов и/или признаков дисфункции периферических нервов у пациентов с сахарным диабетом после исключения других причин.
 ДПН развивается, как правило, не ранее чем через 5 лет от дебюта СД1, но к моменту постановки диагноза СД2 она уже может присутствовать, так как СД2 часто протекает латентно и диагностируется поздно. ДПН начинается постепенно, как правило, со снижения чувствительности, которое иногда может не ощущаться пациентом или обнаруживаться лишь тогда, когда больной с удивлением обнаруживает отсутствие боли при травмах или ожогах кожи или когда развиваются язвы в местах наибольшего давления на стопе или нейропатическая остеоартропатия. Гораздо чаще пациенты жалуются на онемение, парестезии (покалывание, ползание мурашек) и боли в ногах, которые они описывают как жгучие, стреляющие («как током»), режущие. Боли усиливаются ночью и несколько уменьшаются при ходьбе. Их интенсивность сильно варьирует у разных пациентов, и, как в целом принято считать, она тем выше, чем больше в нейропатический процесс вовлечены мелкие нервные волокна. Поражение мелких нервных волокон также сопровождается гипералгезией – усиленным ощущением боли от раздражителей, которые у здорового человека вызывают небольшую болевую реакцию (например, укол тупой иглой). В тяжелых случаях может иметь место аллодиния – восприятие сильной боли от раздражителей, которые в норме боли не вызывают (например, прикосновение одеяла, одежды, кусочка ваты). Симптомы манифестируют с пальцев стоп, симметричны и постепенно распространяются по направлению снизу вверх, на всю стопу, голень и более проксимальные отделы конечностей, а в редких случаях на верхние конечности (где они также вначале проявляются в пальцах и кистях) и передние отделы туловища. Такая динамика локализации не специфична для ДПН и наблюдается также, например, при алкогольной и амилоидной полинейропатиях. По мере прогрессирования ДПН появляются моторные симптомы, в основном в виде слабости и постепенной атрофии мышц. Хроническая сенсорная ДПН – необратимое прогрессирующее осложнение. Основные клинические симптомы приведены в табл. 3.
ДПН развивается, как правило, не ранее чем через 5 лет от дебюта СД1, но к моменту постановки диагноза СД2 она уже может присутствовать, так как СД2 часто протекает латентно и диагностируется поздно. ДПН начинается постепенно, как правило, со снижения чувствительности, которое иногда может не ощущаться пациентом или обнаруживаться лишь тогда, когда больной с удивлением обнаруживает отсутствие боли при травмах или ожогах кожи или когда развиваются язвы в местах наибольшего давления на стопе или нейропатическая остеоартропатия. Гораздо чаще пациенты жалуются на онемение, парестезии (покалывание, ползание мурашек) и боли в ногах, которые они описывают как жгучие, стреляющие («как током»), режущие. Боли усиливаются ночью и несколько уменьшаются при ходьбе. Их интенсивность сильно варьирует у разных пациентов, и, как в целом принято считать, она тем выше, чем больше в нейропатический процесс вовлечены мелкие нервные волокна. Поражение мелких нервных волокон также сопровождается гипералгезией – усиленным ощущением боли от раздражителей, которые у здорового человека вызывают небольшую болевую реакцию (например, укол тупой иглой). В тяжелых случаях может иметь место аллодиния – восприятие сильной боли от раздражителей, которые в норме боли не вызывают (например, прикосновение одеяла, одежды, кусочка ваты). Симптомы манифестируют с пальцев стоп, симметричны и постепенно распространяются по направлению снизу вверх, на всю стопу, голень и более проксимальные отделы конечностей, а в редких случаях на верхние конечности (где они также вначале проявляются в пальцах и кистях) и передние отделы туловища. Такая динамика локализации не специфична для ДПН и наблюдается также, например, при алкогольной и амилоидной полинейропатиях. По мере прогрессирования ДПН появляются моторные симптомы, в основном в виде слабости и постепенной атрофии мышц. Хроническая сенсорная ДПН – необратимое прогрессирующее осложнение. Основные клинические симптомы приведены в табл. 3.
5.1 Дифференциальная диагностика с другими нейропатиями и с болями в нижних конечностях другой этиологии
БДПН – диагноз исключения. У больных СД могут иметься и недиабетические болевые нейропатии, этиопатогенез которых не связан с СД [8]. К возможным этиологическим факторам недиабетических болевых нейропатий относятся интоксикации (чаще всего злоупотребление алкоголем, реже отравление свинцом, ртутью), онкологические заболевания (классический пример заболевания, часто сопровождающегося полинейропатией, – бронхогенный рак легкого), инфекции (ВИЧ, герпес-вирусная и др.), дефицит витаминов В12, В6 и В1, амилоидоз, применение некоторых лекарств средств (изониазида, алкалоидов барвинка, противоопухолевых средств, антиретровирусных препаратов). Большинство этих причинных факторов несложно установить или предположить путем тщательного сбора анамнеза и диагностики сопутствующих заболеваний у конкретного пациента. По нашим наблюдениям, если симптомы болевой полинейропатии выявляются у молодых пациентов длительностью СД1 до 5 лет и тем более впервые выявленным, то в первую очередь следует думать об алкогольной нейропатии, тем более что распространенность злоупотребления алкоголем среди подростков и молодых взрослых довольно высока [8].
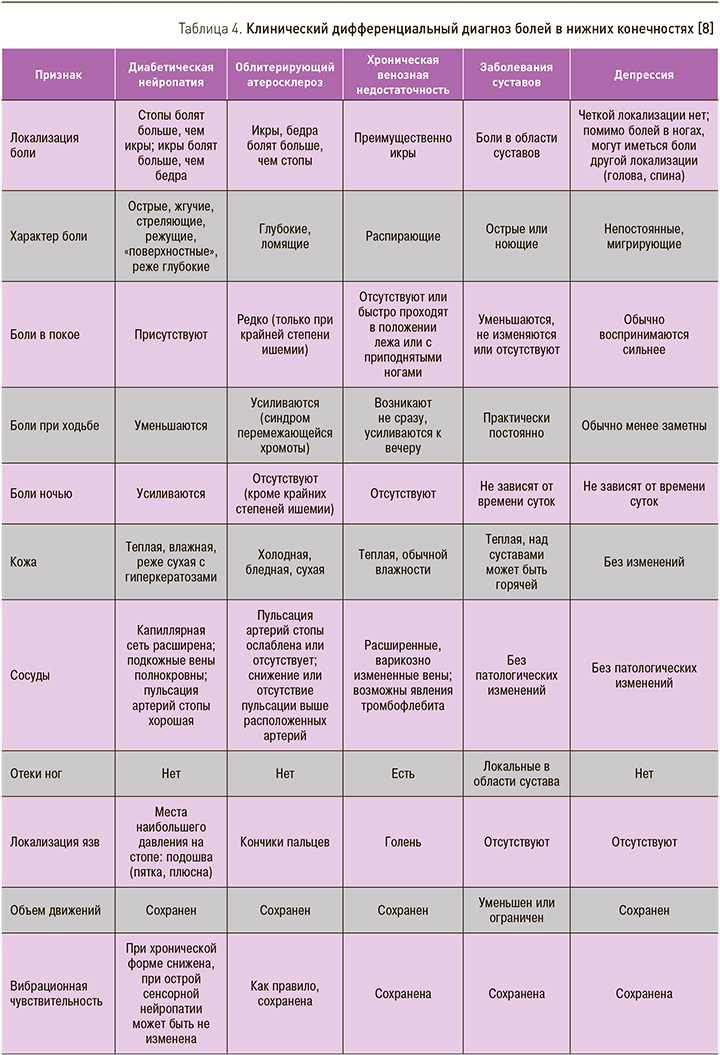
В рутинной клинической практике очень часто приходится дифференцировать болевой синдром, обусловленный ДПН, от болей в ногах, вызванных другой патологией. Как правило, больной СД на приеме предъявляет жалобы просто на «боли в ногах», не конкретизируя их. В табл. 3 представлены заболевания, сопровождающиеся болями в ногах и часто встречающиеся у больных СД. Опрашивая и осматривая пациента в соответствии с предложенными пунктами (см. колонку «Признак»), в большинстве случаев можно достаточно быстро и надежно установить причину болевого синдрома. Диагностическая задача усложняется тем, что у многих больных СД встречается сочетание указанных в таблице видов патологии, например, чаще всего комбинация нейропатического и ишемического характера поражения нижних конечностей. Тем не менее детальный расспрос и внимательное физикальное обследование и здесь помогают идентифицировать нейропатический и ишемический компонент болевого синдрома.
Особенно необходима высокая настороженность практических врачей в отношении депрессивных расстройств как возможной причины болевого синдрома. Распространенность депрессии у больных СД достигает 20–30%, при этом главными жалобами 45–95% больных. Клинический дифференциальный диагноз болей в нижних конечностях приведен в табл. 4.
5.2. Патогенез диабетической полинейропатии
Экспериментальные исследования свидетельствуют о многофакторном патогенезе ДПН (рис. 1), однако ее причины остаются неизвестными [9–11]. Поражение периферических нервов при СД обусловлено метаболическими нарушениями и микроангиопатией, вызванными хронической гипергликемией и сердечно-сосудистыми факторами риска. Наиболее распространенной точкой зрения о патогенезе заболевания является оксидативный и воспалительный стресс, который может в контексте метаболической дисфункции вызывать повреждение нервных клеток.
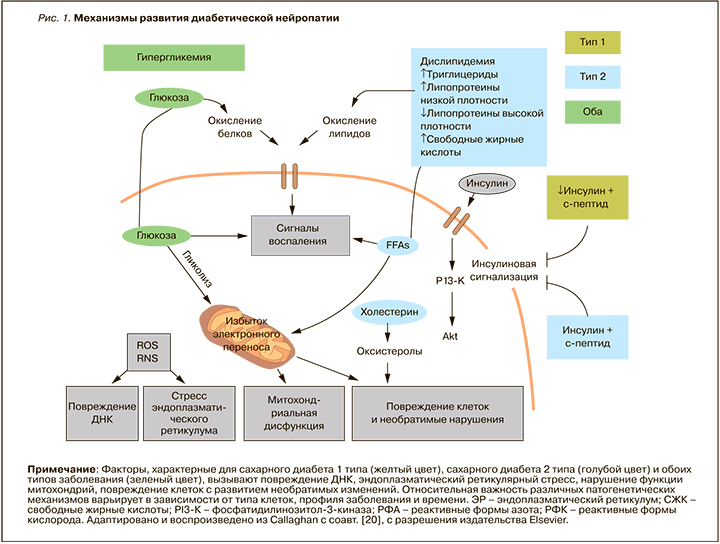
В патогенезе всех форм ДПН как таковой участвуют взаимосвязанные и синергидно действующие механизмы, пусковым фактором которых является гипергликемия. К ним относятся активация полиольного пути окисления глюкозы с внутриклеточным накоплением сорбитола и инозитола, гипоксия и ишемия нервов, усиление окислительного стресса, избыточная продукция конечных продуктов гликирования, липидные нарушения, включая дефицит гамма-линоленовой кислоты, повышение активности протеинкиназы С и других протеинкиназ, эндотелиальная дисфункция, дефицит инсулина и С-пептида, являющихся нейротрофическими факторами, активация поли-АДФ-рибозополимеразы (PARP).
5.3. Патогенез боли при диабетической полинейропатии
Нейропатическая боль может присутствовать на любой стадии развития ДПН, от субклинической до тяжелых, далеко зашедших стадий в сочетании с остеоартропатией Шарко и нейропатически инфицированными язвами стопы. Считается, что при БДПН поражены так называемые мелкие нервные волокна, причем изолированная или преимущественная сенсорная нейропатия мелких волокон может существовать при СД отдельно или до поражения длинных волокон. Однако объяснить болевой синдром исключительно поражением мелких волокон не удается – у определенного процента больных есть поражение мелких волокон, но нет боли, и наоборот. Парадоксальным остается и существование так называемой болевой нечувствительной нейропатии (англ. – painful painless leg, или болевая безболевая нога), при которой сильный болевой синдром сочетается с полной утратой всех видов чувствительности в нижних конечностях.
Четких морфологических или функциональных различий периферических нервов у больных с БДПН и безболевой ДПН не выявлено, кроме изменения плотности мелких волокон (внутрикожных и роговичных) при БДПН. Однако, какие именно механизмы отвечают за развитие БДПН, до конца не ясно. Предположительно генез любой нейропатической боли неспецифичен, сходен при разных заболеваниях, но даже разные механизмы могут вызвать одинаковые симптомы, и у одного и того же пациента таких механизмов может быть множество.
Не исключено, что гипергликемия как таковая может вызывать гипералгезию независимо от структурного поражения нервов. Одним из возможных посредников в развитии повышенной болевой чувствительности служит метилглиоксаль – продукт неполного расщепления глюкозы, образующийся в цепочке реакций гликирования. Его уровни при БДПН выше, чем при безболевой ДПН; он модифицирует активность натриевого канала, участвующего в восприятии болевых стимулов, вызывая гипералгезию к тепловым и механическим раздражителям. За последние годы важную роль в генезе БДПН стали отводить иммунным клеткам, микроглии и нейронам ЦНС. Так, клетки микроглии спинного мозга в условиях гипергликемии активируются, вырабатывают большое количество провоспалительных цитокинов, которые могут индуцировать и поддерживать нейропатическую боль; повышение концентрации провоспалительных цитокинов и фактора некроза опухоли-α при БДПН (но не при безболевой ДПН) обнаружено в макрофагах. Определенную роль придают и поражению микроциркуляторного русла, снабжающего кровью нервные стволы (vasa nervorum): так, при острой инсулиновой нейропатии отмечаются изменения этих микрососудов, близкие к таковым при пролиферативной ретинопатии, с резким повышением проницаемости и нарушением микроархитектоники.
При БДПН задействованы две группы механизмов повышения чувствительности к боли – периферическая сенситизация и центральная сенситизация. Периферическая сенситизация – снижение порога чувствительности периферических окончаний нервов, отвечающих за рецепцию боли, в ответ на воздействие медиаторов воспаления и других перечисленных веществ, продукция которых усиливается при гипергликемии. Отсюда воздействие слабых болевых раздражителей может восприниматься гораздо сильнее (гипералгезия), а неболевых раздражителей – как болевое (аллодиния). Центральная сенситизация обусловлена повышением нейрональной активности и расширением рецепторных полей в спинном мозге, таламусе и сенсорной коре, что также ведет к усилению центральной перцепции боли и ее генерализации, следовательно, к усилению ощущения спонтанных болей, гипералгезии и аллодинии.
5.4. Скрининг и диагностика ДПН
Ежегодную оценку симптомов и признаков ДПН необходимо выполнять у всех пациентов с СД1 при длительности заболевания ≥5 лет и у всех пациентов с СД2 на основании сбора анамнеза и простых клинических тестов. Симптомы ДСПН могут присутствовать почти у 50% пациентов, в то время как у остальных пациентов она протекает бессимптомно. Пациенты могут сами не предъявлять жалоб, однако при расспросе могут рассказать о наличии онемения или других симптомов ДСПН.
Симптомы могут варьировать в зависимости от того, какой класс волокон вовлечен в патологический процесс. Наиболее частыми ранними симптомами, вызванными вовлечением волокон малого диаметра, являются боль и дизестезии (неприятные ощущения или жжение) [12–14]. Нейропатические боли могут быть первым симптомом, побуждающим пациента обратиться к врачу, и присутствуют почти у 25% пациентов с ДПН [15–17]. Боли носят жгучий, режущий, покалывающий или стреляющий характер (как разряд электрического тока); сопровождаются парестезиями; присутствуют в различных комбинациях; их выраженность обычно усиливается по ночам. Нейропатические боли могут сопровождаться повышением ответа на болевые стимулы (гипералгезия) и болями, провоцируемыми контактом (с носками, обувью и постельным бельем; аллодиния). Нейропатические боли могут оказывать негативное влияние на повседневную активность, приводить к инвалидизации, психологическим нарушениям и снижать качество жизни, связанное с состоянием здоровья [18–20].
О вовлечении волокон большого диаметра может свидетельствовать чувство онемения, покалывания без болевого синдрома и утраты протективной чувствительности. Потеря протективной чувствительности свидетельствует о наличии ДПН и является фактором риска образования диабетических язв стопы. Пациенты также могут предъявлять жалобы на отсутствие чувствительности и онемение стоп в связи с утратой волокон большого диаметра. Пациенты часто описывают свои ощущения, как будто стопа обернута шерстью или одета в толстые носки. Это свидетельствует о потере способности чувствовать боль, что позволяет пациентам с нейропатическими язвами подошвенной поверхности стопы ходить при наличии повреждений, что приводит к хронизации процесса, зачастую осложняющегося инфекцией [21]. Сочетание типичных болевых жалоб и нарушений чувствительности обычно достаточно для постановки диагноза нейропатической боли.
Вибрационная чувствительность, как правило, нарушается раньше, чем тактильная, болевая, позиционная и температурная, и гораздо раньше, чем появляются моторные симптомы в виде мышечной слабости. Снижение виброчувствительности ниже возрастной границы нормы служит надежным, простым и удобным скрининговым тестом для диагностики ДПН. В ряде случаев, особенно при СД2, нарушение вибрационной чувствительности идет параллельно с повышением порогов к термическим раздражителям; такие пациенты нередко получают ожоги при «распаривании» ног, так как они не чувствуют высокой температуры воды.
Для оценки вибрационной чувствительности может использоваться камертон с частотой 128 Гц. Оценка тактильной чувствительности с использованием монофиламента весом 10 г должна включать оценку дорсальной поверхности большого пальца стопы, как было ранее валидировано Perkins с соавт. [22]. Монофиламент весом 10 г – это полезный инструмент для клинической диагностики, используемый главным образом для выявления прогрессирующих стадий нейропатии и идентификации пациентов группы повышенного риска по развитию язв и ампутации [23].
 Врачи должны помнить, что тест с монофиламентом 10 г, включенный в программу ежегодного скрининга и диагностики ДПН, отличается от теста для диагностики «стопы высокого риска» в плане развития язв – позднего осложнения ДПН и требует исследования 4 областей (головки первой, третьей и пятой плюсневых костей и подошвенная поверхность дистального сегмента большого пальца стопы) на каждой стопе [24].
Врачи должны помнить, что тест с монофиламентом 10 г, включенный в программу ежегодного скрининга и диагностики ДПН, отличается от теста для диагностики «стопы высокого риска» в плане развития язв – позднего осложнения ДПН и требует исследования 4 областей (головки первой, третьей и пятой плюсневых костей и подошвенная поверхность дистального сегмента большого пальца стопы) на каждой стопе [24].
Диагноз ДПН является преимущественно клиническим. Сочетание типичной симптоматики и симметричной утраты чувствительности в дистальных отделах или типичные признаки в отсутствие симптомов у пациента с сахарным диабетом с большой степенью вероятности свидетельствуют о наличии ДПН и могут не требовать дополнительного обследования или направления к специалисту. Так как почти у половины пациентов заболевание протекает бессимптомно, диагноз может быть установлен только при обследовании или в некоторых случаях при наличии у пациента безболезненной язвы стопы. Рекомендации по проведению скрининга и диагностики ДНП приведены в табл. 5.
6. АТИПИЧНАЯ ОСТРАЯ ДИАБЕТИЧЕСКАЯ НЕЙРОПАТИЯ
Атипичная ОДН встречается значительно реже и в значительной мере отличается от типичной формы по патофизиологическим механизмам развития, течению и клинической манифестации [25–26]. Развитие и манифестация атипичной ДПН возможны при любой продолжительности сахарного диабета [26]. Симптоматика атипичной ДПН может возникнуть как остро, так и носить хронический характер; возможны варианты как с монофазным вариантом течения, так и с волнообразным. Для атипичной ДПН характерно наличие болевой симптоматики и автономной дисфункции [25].
Однозначных критериев диагностики и определения тяжести течения атипичных форм ДПН в настоящее время нет. Характерным случаем, в котором следует заподозрить атипичный вариант ДПН, является ситуация наличия нейропатической болевой симптоматики и/или признаков автономной дисфункции в сочетании с нормальными результатами оценки нервной проводимости. В основе атипичной картины ДПН лежит нейропатия тонких волокон. С целью диагностики поражения немиелинизированных и слабо миелинизированных нервных волокон малого калибра используются различные диагностические тесты и инструменты: количественное сенсорное тестирование температурной/болевой чувствительности, биопсия кожи с исследованием тонких волокон, оценка функции потовых желез, лазерная допплеровская флоуметрия, конфокальная микроскопия роговицы.
В случае отсутствия изменений нервной проводимости при ЭНМГ диагноз атипичной ДПН может быть подтвержден исследованием интраэпидермальной плотности нервных волокон в коже голени (уровень доказательств класса А), либо количественным сенсорным тестированием температурной чувствительности на стопах, либо конфокальной микроскопией роговицы, хотя изучение распределения тонких нервов в роговице является только косвенным параметром, отражающим состояние тонких нервных волокон в конечностях. Диагноз атипичной ДПН с поражением тонких сенсорных волокон может быть установлен на основании нижеперечисленных критериев [27]:
- диагноз возможен: присутствие типичной дистальной нейропатической симптоматики и/или клинические признаки поражения тонких сенсорных волокон;
- диагноз вероятен: присутствие типичной дистальной нейропатической симптоматики, клинические признаки поражения тонких сенсорных волокон и нормальная проводимость по n. suralis;
- диагноз подтвержден: присутствие типичной дистальной нейропатической симптоматики, клинические признаки поражения тонких сенсорных волокон, нормальная проводимость по n. suralis и положительные результаты биопсии кожи голеней (снижение интраэпидермальной плотности нервных волокон) и/или изменения при количественном тестировании температурной чувствительности на стопах.
Нейропатия, индуцированная лечением (TIND – treatment induced diabetic neuropathy), в последние годы привлекает внимание и, по-видимому, встречается чаще, чем это было принято считать ранее: до 10% в центрах третичного уровня (ссылки). Эту форму нейропатии также называют острым инсулиновым невритом, или обратимой болевой автономной нейропатией. «Диабетическая кахексия», описанная Элленбергом в 1973 г., по-видимому, является одним из ее симптомов, а в ряде случаев патогенетическим механизмом (возможный дефицит микроэлементов или витаминов), на фоне чего может развиваться болевая симптоматика и автономная дисфункция.
Для этой формы нейропатии, которая может встречаться как при СД1, так и при СД2, характерны более выраженная и рефрактерная к лечению боль, у ряда больных достигающая 10 баллов по 10-балльной рейтинговой шкале. Боль является симметричной и дистальной, однако у трети больных носит генерализованный характер, распространяясь на туловище и верхние конечности.
У всех больных боль возникает остро, как правило, через 6–8 нед после быстрого снижения глюкозы крови после предшествующего периода неудовлетворительного контроля глюкозы. Аллодиния отмечается при СД1 в 60 и 40% случаев при СД2, что гораздо чаще, чем при типичной сенсомоторной форме ДН. Вегетативные расстройства присутствуют в виде кардиальной симптоматики, нарушений вариативности сердечного ритма, падения систолического АД, желудочно-кишечных нарушений, мальабсорбции. Отмечена корреляция TIND c прогрессивным развитием диабетической ретинопатии, наблюдающейся при резком снижении глюкозы крови. Отмечено, что фактором риска развития острой болевой и автономной дисфункции является снижение HbA1c более 2% за 3 мес и при падении HbA1c более чем на 4% за 3 мес риск TIND составляет 80%.
Лечение острой болевой автономной нейропатии и диабетической кахексии – сложная задача ввиду рефрактерности боли к лечению. Необходимо улучшение контроля глюкозы, особенно важно снижение чрезмерных колебаний глюкозы крови. Для облегчения боли можно пробовать применять типичные препараты первой линии (прегабалин, дулоксетин, габапентин и их сочетания друг с другом, а также с препаратами патогенетического действия, включая коррекцию дефицита витаминов, особенно В и Д). Часто лечение вышеназванными препаратами не эффективно, и в 50% случаев требуется добавление адъювантных опиоидных анальгетиков второй линии, например трамадола [28].
Прогноз обычно благоприятный и болевая симптоматика разрешается через 12–18 мес. Возможно наличие резидуальной или сопутствуюшей сенсомоторной дисфункции, а также рецидивов болевой симптоматики.
Патогенез этой формы нейропатии остается не до конца ясным. Среди возможных механизмов развития рассматриваются эпиневральное артериовенозное шунтирование, приводящее к эндоневральной ишемии; невральный апоптоз из-за внезапного падения глюкозы крови; рецидивирующие гипогликемии, приводящие к повреждениям микрососудистого кровоснабжения; эктопические болевые сигналы от регенерирующих нервов (наиболее вероятно вследствие нарушения экспрессии ионных каналов или их рецепторов); инсулин-индуцированное снижение парциального давления кислорода в тканях вследствие развития артериовенозного шунтирования. Кроме перечисленных механизмов, возможно влияние активного воспаления, так как при болевой острой нейропатии происходит особо значимое повышение уровней провоспалительных цитокинов (Ил-6, ФНО-альфа). Морфологически наблюдается значительный отек тонких нервных волокон и уменьшение плотности тонких нервных волокон в коже. Изменения обратимы больше при СД1, чем при СД2, но и при СД2 нарушения также претерпевают обратное развитие, но с меньшими темпами. Полагают, что термин «нейропатия, индуцированная лечением» более адекватно отражает суть процесса в нерве, чем термин «инсулиновый неврит» [29].
7. СОВРЕМЕННЫЕ ПОДХОДЫ К ПРОФИЛАКТИКЕ РАЗВИТИЯ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ
Профилактика диабетических нейропатий основана на контроле гликемии и изменении образа жизни.
7.1. Факторы риска развития диабетической периферической нейропатии
В исследовании осложнений при СД1 (EURODIAB) было показано, что вероятность развития ДПН статистически значимо повышается при артериальной гипертонии (относительный риск [ОР] 1,5), большой длительности СД (ОР 1,4), гипергликемии и ее колебаниях (ОР 1,4 и 1,3 соответственно), курении (ОР 1,3), ожирении (ОР 1,2) и гипертриглицеридемии (ОР 1,2). Можно ли повлиять на ДПН путем воздействия на эти факторы риска?
При СД1 достижение близкого к нормальному уровня гликемии снижает риск развития микроангиопатии и нейропатии, но не может полностью исключить ее возникновение или значительно уменьшить симптомы. При СД2 достижение нормогликемии практически не влияет на профилактику или торможение ДПН и БДПН.
Хотя качественные клинические исследования по оценке роли нормализации АД, дислипидемии, отказа от курения в профилактике и лечении ДПН не проводились, большинство экспертов сходятся во мнении, что достижение целевого АД, контроль уровня липидов (особенно триглицеридов), отказ от курения и употребления алкоголя могут оказать определенный положительный эффект в отношении ДПН.
7.2. Контроль гликемии
Интенсивный контроль гликемии у пациентов с СД1 способствовал резкому уменьшению частоты ДПН (уменьшение относительного риска на 78%) [30–32]. Напротив, у пациентов с СД2 интенсивный контроль гликемии ассоциировался лишь с умеренным снижением риска развития ДПН (уменьшение относительного риска на 5–9%) [33–34]. В небольшом исследовании у пациентов с ранними стадиями СД2, выполненном в Японии, интенсифицированная инсулинотерапия сопровождалась улучшением отдельных параметров оценки ДПН [35], а в исследовании ACCORD (мероприятия для контроля сердечно-сосудистого риска при сахарном диабете) было показано умеренное, но значимое снижение риска развития ДСПН на фоне контроля гликемии у пациентов с СД2 по истечении 5 лет наблюдения [36]. Другие масштабные исследования не продемонстрировали какого-либо эффекта [37–39]. Это несоответствие подчеркивает различия между СД1 и СД2 и свидетельствует о том, что у многих пациентов с СД2 типа ДПН развивается, несмотря на адекватный контроль гликемии. Наличие многочисленных сопутствующих заболеваний, полипрагмазия, гипогликемии и набор массы тела могли ослаблять эффекты контроля гликемии в этих исследованиях и обусловливать несогласованность их результатов. Специфические стратегии снижения уровня гликемии также могут обусловливать эти разногласия. Например, у участников, особенно у мужчин, исследования BARI 2D (изучение шунтирующей ангиопластики у пациентов с СД2), получавших препараты, повышающие чувствительность периферических тканей к инсулину (сенситайзеры инсулина), была отмечена меньшая частота ДСПН через 4 года по сравнению с участниками, получавшими инсулин/препараты сульфонилмочевины [40].
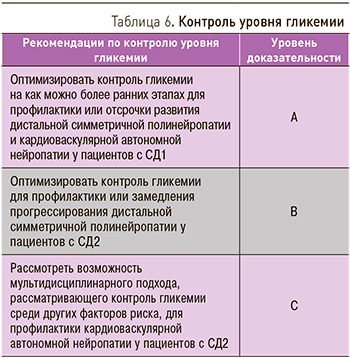 Полученные результаты могут объясняться меньшим увеличением массы тела и меньшей частотой гипогликемии. Наконец, тот факт, что у многих пациентов присутствует бессимптомная гипергликемия в течение многих лет до диагностики СД2, может также объяснять ограниченные преимущества у этих пациентов. Рекомендации по контролю гликемии приведены в табл. 6.
Полученные результаты могут объясняться меньшим увеличением массы тела и меньшей частотой гипогликемии. Наконец, тот факт, что у многих пациентов присутствует бессимптомная гипергликемия в течение многих лет до диагностики СД2, может также объяснять ограниченные преимущества у этих пациентов. Рекомендации по контролю гликемии приведены в табл. 6.
7.3. Изменение образа жизни
На сегодняшний день наилучшая, основанная на доказательствах модель интенсивного изменения образа жизни была разработана в рамках Программы профилактики диабета, в исследовании Steno-2 [41], итальянском исследовании на беговой дорожке под контролем [42] и исследовании у пациентов с СД2, выполненном в Университете Юты [43]. Последнее исследование недавно продемонстрировало регенерацию нервных волокон у пациентов с СД2 на фоне программы физических упражнений по сравнению с утратой нервных волокон у пациентов, которым проводили только стандартную терапию.
В целом такой подход фокусируется либо только на физических упражнениях (аэробные и/или силовые тренировки под контролем), либо на комбинации модификации диеты и физической активности. Не существует консенсуса относительно режимов диеты, и, хотя в исследовании DPP использовали низкокалорийную диету, бедную жирами, в других исследованиях были показаны преимущества применения средиземноморской диеты, характеризующейся несколько меньшей долей углеводов (45%) и более высокой долей жиров (35–40%), при этом доля насыщенных жиров не превышает 10%.
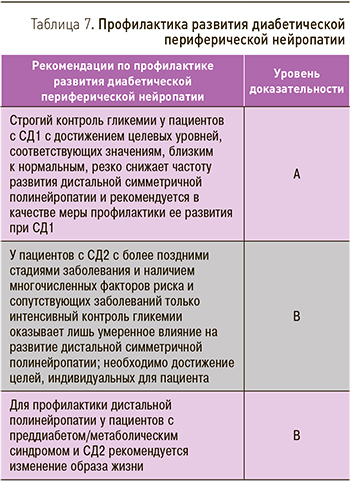 Хотя программа профилактики диабета [44] и исследование «Нейропатия при нарушении толерантности к глюкозе» [45] показали положительное влияние изменения образа жизни на развитие ДПН, эти исследования не включали пациентов с установленным диагнозом сахарного диабета. Рекомендации по профилактике развития ДПН приведены в табл. 7.
Хотя программа профилактики диабета [44] и исследование «Нейропатия при нарушении толерантности к глюкозе» [45] показали положительное влияние изменения образа жизни на развитие ДПН, эти исследования не включали пациентов с установленным диагнозом сахарного диабета. Рекомендации по профилактике развития ДПН приведены в табл. 7.
8. КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ С НЕЙРОПАТИЧЕСКОЙ БОЛЬЮ ПРИ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ
Диагностика нейропатической боли должна базироваться на сочетании данных анамнеза, клинического исследования чувствительности и инструментальных данных, подтверждающих поражение структур соматосенсорной системы.
Выявление нейропатической боли у пациентов с сахарным диабетом должно носить активный характер и быть неотъемлемой частью сбора анамнеза с уточнением наличия и характера боли. У пациента следует проводить детальное клиническое исследование поверхностной (температурной и тактильной) и глубокой (вибрационной и суставно-мышечной) чувствительности. Исследование чувствительности с помощью монофиламента должно проводиться не реже одного раза в год у всех пациентов с сахарным диабетом.
Нейропатическая боль при диабетической полинейропатии имеет ряд клинических особенностей и характеризуется полиморфизмом болевых ощущений. Боль может быть спонтанной или носить стимул-зависимый характер. Спонтанная боль может быть постоянной или пароксизмальной: описываться как жгучая, стреляющая, сдавливающая, пекущая, мозжащая, скручивающая, холодящая и др. В области болезненных ощущений, как правило, выявляются расстройства тактильной, болевой и/или температурной чувствительности. Среди спонтанных ощущений отмечаются парестезии, описываемые как ощущения покалывания или ползания мурашек, дизестезии – извращенное восприятие раздражения, гиперпатия – усиленное восприятие стимула, снижение или повышение болевой и температурной чувствительности – гипо-, гиперестезия. Стимул-зависимая боль, возникающая в ответ на легкое механическое раздражение при обследовании кисточкой либо в повседневной жизни бельем, одеждой или дуновением воздуха, носит название аллодинии.
В области боли могут наблюдаться трофические изменения кожи, подкожной клетчатки, волос, ногтей, нарушение мышечного тонуса или локальные вегетативные расстройства, связанные с одновременным поражением вегетативных волокон в составе периферических нервов.
Выявление нейропатической боли основывается на распознавании различных, связанных с болью симптомов, таких как гипералгезия, дизестезия, гиперпатия, аллодиния и др., отражающих преобладание тех или иных механизмов ее формирования. Каждый из симптомов должен локализоваться в нейроанатомическом соответствии с участком повреждения нерва.
8.1. Скрининг и диагностика нейропатической боли
 Для облегчения идентификации нейропатической боли были разработаны скрининговые шкалы: Leeds Assesment of Neuropathic Symptoms andSigns (LANSS) (Лидская шкала оценки нейропатических симптомов и признаков), Douleur Neuropathic 4 (DN4) (Диагностический опросник нейропатической боли), Pain DETECT, Neuropathic Pain Questionnaire (Опросник нейропатической боли), ID Pain и др. Каждая шкала характеризует нейропатическую боль путем наличия позитивных и негативных симптомов и знаков, включающих спонтанную боль, парестезии, дизестезии, аллодинию, двигательный и чувствительный дефект. Учитывая важность определения наличия нейропатической боли для дальнейшего лечения, обязательна надежность, валидность и диагностическая точность подобных шкал. Опросники Pain DETECT и Standardized Evaluation of Pain (StEP) (Стандартизированная оценка боли) позволяют дифференцировать нейропатический характер боли на основе вербальных дескрипторов с ограниченным клиническим обследованием или без такового.
Для облегчения идентификации нейропатической боли были разработаны скрининговые шкалы: Leeds Assesment of Neuropathic Symptoms andSigns (LANSS) (Лидская шкала оценки нейропатических симптомов и признаков), Douleur Neuropathic 4 (DN4) (Диагностический опросник нейропатической боли), Pain DETECT, Neuropathic Pain Questionnaire (Опросник нейропатической боли), ID Pain и др. Каждая шкала характеризует нейропатическую боль путем наличия позитивных и негативных симптомов и знаков, включающих спонтанную боль, парестезии, дизестезии, аллодинию, двигательный и чувствительный дефект. Учитывая важность определения наличия нейропатической боли для дальнейшего лечения, обязательна надежность, валидность и диагностическая точность подобных шкал. Опросники Pain DETECT и Standardized Evaluation of Pain (StEP) (Стандартизированная оценка боли) позволяют дифференцировать нейропатический характер боли на основе вербальных дескрипторов с ограниченным клиническим обследованием или без такового.
В настоящее время одним из самых чувствительных в отношении выявления нейропатической боли является опросник DN4 (рис. 2).
При положительном ответе на 4 и более вопросов из 10 пунктов этого опросника диагноз «нейропатическая боль» становится обоснованным. Чувствительность методики DN4 (количество пациентов с нейропатической болью, у которых выявляется эта патология по результатам тестирования) составляет 80%, что позволяет использовать ее в качестве скрининга для выявления нейропатических болевых синдромов. При этом специфичность опросника не является столь высокой.
Данные количественного сенсорного тестирования с использованием контролируемых физиологических стимулов, таких как температура, давление, укол и вибрация, используются для точной верификации чувствительных нарушений при нейропатической боли. Изменения по данным соматосенсорных и лазерных вызванных потенциалов характерны для нейропатической боли, но имеют ограниченное диагностическое значение. Количественное сенсорное тестирование и нейрофизиологические данные могут быть использованы у пациентов с нейропатической болью, когда поражение трудно выявить по данным клинического обследования, для исключения других причин боли и изучения механизмов развития болевого синдрома.
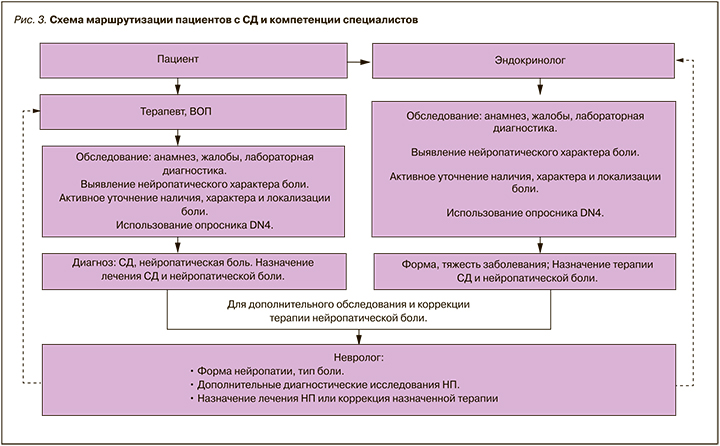
8.2. Маршрутизация пациентов и компетенции специалистов в ведении пациентов с нейропатической болью при диабетической периферической нейропатии
Пациент с сахарным диабетом и диабетической нейропатией требует комплексного и дифференцированного подхода в лечении и обследовании с участием терапевта, эндокринолога и невролога.
В задачи терапевта и врача общей практики входит тщательный сбор анамнеза, клиническое обследование пациента и лабораторная диагностика, направленные на установку диагноза «сахарный диабет» и выявление нейропатического характера боли. В ходе сбора анамнеза обязательно активное уточнение наличия, характера и локализации боли. Описательные характеристики (жжение, покалывание, зуд, онемение, ползание мурашек и др.) требуют использование опросника DN4 для верификации нейропатического характера боли. В задачи терапевта и врача общей практики также входит первичное назначение терапии сахарного диабета и нейропатической боли.
Назначение или коррекция терапии сахарного диабета и нейропатической боли входят в задачи эндокринолога.
При необходимости, в случае неэффективности лечения, для уточнения характера поражения нервной системы, признаках атипичной формы нейропатии пациент должен быть направлен к неврологу для дополнительного обследования и коррекции терапии нейропатической боли. Маршрутизация пациентов представлена на рис. 3.
9. ЛЕЧЕНИЕ БОЛЕВОЙ ФОРМЫ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ
В реальной жизни полное купирование болевого синдрома при БДПН не всегда достижимо, поэтому хорошим результатом лечения считается уменьшение его выраженности на 50% по визуальной аналоговой шкале (ВАШ), а удовлетворительным результатом – уменьшение на 30%. После уменьшения интенсивности болевого синдрома обычно достигается основная цель лечения – восстановление или улучшение функционирования больного и его качества жизни.
9.1. Симптоматическая терапия болевого синдрома
С учетом сказанного выше в распоряжении врача имеются лишь различные варианты симптоматической терапии БДПН, направленные на купирование боли.
9.2. Препараты центрального действия. Обзор рекомендаций профессиональных ассоциаций по лечению болевой ДПН и общие принципы терапии
В настоящий момент имеется довольно обширная доказательная база в поддержку фармакотерапии БДПН препаратами, относящимися к различным классам. С этой целью применяются препараты центрального действия (некоторые антидепрессанты, противосудорожные средства и опиоиды). В табл. 8 обобщены рекомендации различных профессиональных ассоциаций и экспертных групп по первой и последующим линиям терапии БДПН. К первой линии терапии относятся препараты с наиболее доказанной эффективностью и наилучшим соотношением эффективности и безопасности/переносимости.
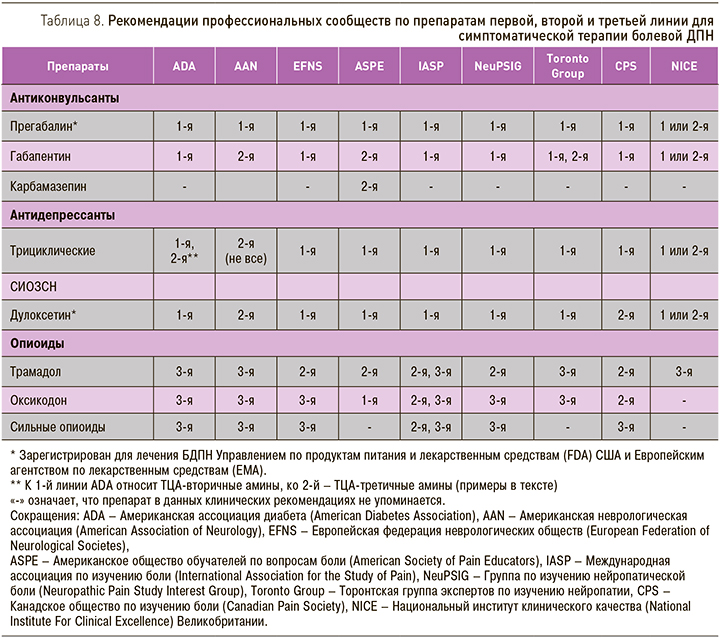
Ко второй линии терапии относятся препараты с меньшим объемом доказательных данных при болевой ДПН или с несколько худшей переносимостью. Наконец, к третьей линии, или препаратам резерва, относятся препараты, обладающие высокой эффективностью, применение которых сопряжено с серьезными побочными эффектами.
Все препараты, против которых в табл. 8 указано «1-я или 2-я линия», могут использоваться на первой линии терапии, а при неэффективности или непереносимости можно перейти на любой другой препарат, также отнесенный к 1-й или 2-й линии.
При назначении каждого препарата следует придерживаться правила постепенного увеличения (титрования) дозы для лучшей переносимости и для выбора минимальной эффективной дозы. Делать вывод о неэффективности того или иного препарата можно только при его приеме в максимальной переносимой дозе в течение времени, строго определенного для каждого препарата (здесь и далее – «продолжительность тестовой терапии»). Отмену препаратов в большинстве случаев также желательно производить путем постепенного снижения дозы во избежание развития синдрома отмены и других побочных эффектов. Данное правило неприменимо к тем случаям, когда препарат отменяют из-за аллергических реакций или других тяжелых и серьезных побочных эффектов.
9.3. Противосудорожные препараты (антиконвульсанты)
Модуляторы кальциевых каналов (габапентиноиды)
В эту группу входят два препарата с близким строением молекулы – габапентин и прегабалин. Они являются производными гамма-аминомасляной кислоты (ГАМК, англ. аббревиатура – GABA, откуда и образовалось название группы – «габапентиноиды»). Препараты этой группы связываются не с рецепторами ГАМК, а с α-2-δ субъединицей потенциал-зависимых кальциевых каналов нейронов, что вызывает уменьшение поступления ионов Ca2+ пресинаптические окончания нейронов, находящихся в состоянии гипервозбуждения. Это ведет к торможению выхода возбуждающих нейромедиаторов в синаптическую щель и замедлению передачи нервного импульса на следующий нейрон. Габапентиноиды действуют только на «перевозбужденные» нейроны в заднем роге спинного мозга и ЦНС и не влияют на нормально функционирующие нейроны. Антидепрессивным действием габапентиноиды не обладают.
Габапентин – первый габапентиноид, внедренный в клиническую практику. Он продемонстрировал эффективность в многочисленных клинических исследованиях лечения боли при ДСПН. Однако ряд неопубликованных исследований при болевой форме ДПН не показал положительных результатов.
Режим дозирования: начальная доза 300 мг 1 раз в сутки, на 2-й день 300 мг 2 раза в сутки, на 3-й день 300 мг 3 раза в сутки. В дальнейшем дозу постепенно увеличивают до достижения эффекта, возможно, до 1800–3600 мг в сутки. В 2017 г. в РФ была зарегистрирована новая дозировка препарата 600 мг таблетка с риской.
Минимальная продолжительность тестовой терапии составляет от 3 до 8 нед титрования дозы плюс не менее 2 нед приема в максимальной переносимой дозе.
NNT1 габапентина равняется 3–7, т.е. как минимум удовлетворительный обезболивающий эффект достигается у 1 из 3–7 пациентов.
Дополнительные положительные эффекты: противотревожный, седативный.
Наиболее частые побочные эффекты: сонливость, головокружение, атаксия, слабость, периферические отеки. Они могут быть более выраженными у пациентов пожилого и старческого возраста.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: пациентам с нарушениями функции почек, а также больным, находящимся на гемодиализе, требуется коррекция режима дозирования.
Лекарственные взаимодействия: практически отсутствуют. Антациды уменьшают всасывание габапентина из желудочно-кишечного тракта.
Прегабалин является самым изученным при БДПН препаратом, с обезболивающим эффектом, доказанным в большинстве исследований. Его молекула представляет собой модифицированную молекулу габапентина. Сродство молекулы прегабалина к α-2-δ субъединице Ca2+-канала в 6 раз выше, чем габапентина, а всасывание является линейным и зависит от дозы, что также в положительную сторону отличает прегабалин от габапентина. В связи с этими особенностями фармакокинетики обезболивающий эффект наступает раньше, чем у габапентина, длительный период подбора дозы не требуется. Кроме того, прегабалин эффективнее габапентина: его средняя доза (450 мг в сутки) по обезболивающему действию сопоставима с высшей суточной дозой габапентина (3600 мг). Около 50% больных с БДПН отмечают уменьшение боли на 50% и более на суточной дозе прегабалина 300 мг, а на дозе 600 мг в сутки почти у 30% пациентов отмечается уменьшение болевого синдрома на 70% и более. Как правило, улучшение появляется уже в первую неделю лечения. Важно, что прегабалин имеет смысл назначать и тем пациентам, которые не ответили или недостаточно ответили на терапию габапентином или трициклическими антидепрессантами (см. далее): у таких больных через 6 мес лечения прегабалином отмечается дополнительное уменьшение болевого синдрома примерно на 25%.
Режим дозирования: начальная доза 25–75 мг 1–2 раза в сутки, с 3-го по 7-й день по 150 мг 2 раза в сутки, далее при необходимости по 300 мг 2 раза в сутки.
Минимальная продолжительность тестовой терапии: 2–4 нед в максимальной переносимой дозе.
NNT прегабалина равняется 3–8, т.е. минимум удовлетворительный обезболивающий эффект наблюдается у одного из 3–8 пациентов с БДПН.
Дополнительные положительные эффекты: стойкое улучшение сна и уменьшение хронической патологической тревоги, часто сопутствующей болевому синдрому.
Наиболее частые побочные эффекты: головокружение (21–46% больных), сонливость (14–46% больных), эйфория; реже периферические отеки, прибавка массы тела, слабость, головная боль, сухость во рту, атаксия. Обычно головокружение и сонливость возникают в первый или второй день приема препарата и проходят через 6–17 дней (головокружение) или 26–31 день (сонливость), о чем следует предупредить больного заранее. Из-за плохой переносимости от приема доз 150–300 мг в сутки отказываются 2,6 и 2,1% больных соответственно, от приема дозы 600 мг в сутки – до 28%. Как и при приеме любых психотропных средств, к побочным эффектам более склонны пациенты старческого возраста, которым в связи с этим требуется начинать с меньшей дозы и титровать дозы медленнее.
Основные противопоказания: повышенная чувствительность к препарату, беременность и лактация, дети до 17 лет.
Меры предосторожности: с осторожностью при отеках (сердечная, почечная недостаточность).
Лекарственные взаимодействия: возможно усиление эффекта седативных препаратов.
Модуляторы натриевых каналов
Карбамазепин, который традиционно назначали для лечения БДПН, не продемонстрировал эффективность по этому показанию, в связи с чем в подавляющем большинстве зарубежных клинических рекомендаций по БДПН карбамазепин не упоминается и в настоящее время не должен использоваться для лечения БДПН. Препарат из той же фармакологической группы окскарбазепин до последнего времени считался неэффективным при БДПН. Недавно было установлено, что его эффективность зависит от фенотипа нейропатической боли: он эффективен при симптомах гипералгезии/аллодинии в сочетании с сохранной чувствительности (т.е. при клинической картине острой сенсорной ДПН) и не эффективен при болевой ДПН с потерей чувствительности (т.е. хронической сенсорной ДПН). Следовательно, перед назначением этого препарата необходимо определять вариант болевой ДПН, что требует тщательной оценки всех видов чувствительности.
Режим дозирования: начальная доза 300 мг 2 раза в сутки, терапевтическая для обезболивания 1800–2400 мг в сутки. Принципы титрования дозы такие же, как у карбамазепина.
Минимальная продолжительность тестовой терапии: 2–3 нед в максимальной переносимой дозе.
NNT окскарбазепина равняется 3, т.е. хорошее обезболивание достигается у каждого третьего пациента с острой сенсорной болевой ДПН.
Дополнительные положительные эффекты: улучшение сна.
Наиболее частые побочные эффекты: сонливость, головная боль, головокружение, диплопия, тошнота, рвота, чувство усталости, атаксия, депрессия, тошнота, рвота.
Основные противопоказания: гиперчувствительность к препарату, лактация.
С осторожностью: повышенная чувствительность к окскарбазепину и карбамазепину, тяжелая печеночная недостаточность, тяжелая сердечная недостаточность; с крайней осторожностью при беременности.
Лекарственные взаимодействия: с препаратами, метаболизирующимися с CYP2C19 (фенитоин, фенобарбитал), CYP3A4 и CYP3A5 (дигидропиридиновые антагонисты кальция, пероральные контрацептивы и противоэпилептические препараты).
9.4. Антидепрессанты – ингибиторы обратного захвата моноаминов
Препараты, ингибирующие обратный захват моноаминов – серотонина и норадреналина, повышают концентрацию этих нейротрансмиттеров в синаптической щели и оказывают непосредственное влияние на ингибирующую активность нисходящих нейронов, влияя на центральные механизмы болевой перцепции. Их обезболивающий эффект не зависит от антидепрессивного.
В эту группу относятся селективный ингибитор обратного захвата серотонина и норадреналина (СИОЗСН) дулоксетин и трициклические антидепрессанты (ТЦА). В связи с тем что ТЦА не являются селективными препаратами, они, помимо моноаминов, действуют на центральные гистаминовые рецепторы, а также обладают холинолитическими, альфа-адреноблокирующим и бета-адреностимулирующим и хинидиноподобными эффектами, что определяет их худшую переносимость и большее число противопоказаний, чем у СИОЗСН.
Селективные ингибиторы обратного захвата серотонина и норадреналина.
Дулоксетин
В многоцентровых рандомизированных исследованиях была продемонстрирована эффективность доз 60 и 120 мг/сут в лечении БДПН (15, 86, 94, 96, 98–101). Все дозы дулоксетина довольно хорошо переносятся, практически не влияют на гликемию и показатели липидного спектра.
Режим дозирования: начальная доза 60 мг 1 раз в сутки, эффективные обезболивающие дозы 60 и 90 мг один раз в сутки и 120 мг в сутки в два приема. В связи с тем что в первые 1–2 нед приема дозы 60 мг у некоторых пациентов может появляться тревога, которая проявляется нарушением сна, тахикардией или легкой тошнотой («норадренолиновые эффекты»), можно начинать прием с 30 мг в сутки с увеличением дозы до 60 мг через неделю. Альтернативой является комбинация 60 мг дулоксетина с небольшими дозами любого противотревожного препарата (валериана 2–3 табл. в сутки; тофизопама 50 мг 2 раза в сутки; гидроксизина 12,5–25 мг в сутки в один или два приема; тиаприд 50 мг 2 раза в сутки; феназепам 0,025 мг 1–2 раза в сутки и т.д.). Через 2–3 нед противотревожный препарат отменяют, а прием дулоксетина продолжают.
Минимальная продолжительность тестовой терапии: не менее 4 нед в максимальной переносимой дозе. У большинства пациентов уменьшение болевого синдрома отмечается уже в первые дни приема препарата.
NNT дулоксетина равняется 1,7–7, т.е. ослабление болей на 30–50% и более отмечается примерно у 1 из 2–7 пациентов.
Дополнительные положительные эффекты: доказанное улучшение качества жизни, нарушенного в связи с БДПН; антидепрессивный эффект.
Наиболее распространенные побочные эффекты: на дозе 60 мг нарушения сна (трудности засыпания или сонливость), легкая тошнота, тахикардия, склонность к запорам; на более высоких дозах – сухость по рту, потливость, усиление или чаще снижение аппетита. Из-за побочных эффектов от приема препарата в дозе 60 мг в сутки отказывается 4–10% больных, в дозе 120 мг в сутки – 12–19%. В плацебо-контролируемых исследованиях дулоксетин не повышал уровень HbA1c у больных СД; клинически незначимое повышение (разница 0,33% с контрольной группой) отмечалось лишь в одном долгосрочном исследовании. У пожилых пациентов побочные эффекты могут быть выражены сильнее; их выраженность можно уменьшить назначением меньших начальных доз и более медленным титрованием.
Противопоказания: декомпенсированная закрытоугольная глаукома, повышенная чувствительность к препарату, лактация.
С предосторожностью: печеночная недостаточность, почечная недостаточность с СКФ менее 30 мл/мин, рефрактерная к терапии артериальная гипертония, эпилепсия, беременность.
Лекарственные взаимодействия: одновременный прием дулоксетина с потенциальными ингибиторами CYP1A2 (фторхинолоны) требует осторожности и снижения доз дулоксетина. Не рекомендуется прием одновременно с ингибиторами МАО и ТЦА.
9.5. Трициклические антидепрессанты
Наиболее известный ТЦА – амитриптилин; кроме него, в эту группу входят имипрамин, дезипрамин, кломипрамин и нортриптилин. В течение многих десятилетий ТЦА используются для лечения хронических болевых синдромов различного генеза, в том числе БДПН. В нескольких рандомизированных, слепых, плацебо-контролируемых клинических исследованиях было показано значительное уменьшение выраженности нейропатической боли. Последний кокрановский обзор поставил под сомнение качество результатов исследований амитриптилина, указав на небольшие размеры выборки в большинстве случаев, и заключил, что в действительности нет ни убедительных доказательств положительного влияния амитриптилина на выраженность болевого синдрома при ДПН, ни доказательств отсутствия эффекта. Однако большой практический опыт применения ТЦА для лечения боли позволяет использовать эти препараты при БДПН.
Амитриптилин, имипрамин и кломипрамин по химическому строению представляют собой третичные амины. ТЦА, которые относятся ко вторичным аминам (нортриптилин и дезипрамин), переносятся несколько лучше, чем третичные, однако рандомизированных контролируемых исследований по лечению болевых синдромов этими препаратами проведено меньше и на очень небольших выборках.
Режим дозирования (на примере амитриптилина): начальная доза 5–10 мг в сутки в два приема. При хорошей переносимости через 3–4 дня дозу увеличивают до 10–25 мг в два приема, дальнейшее увеличение проводится 1 раз в 10–14 дней до достижения терапевтической дозы 50–150 мг/сутки в 2–3 приема.
Основные ошибки при назначении амитриптилина: 1) назначение более высоких начальных доз или более быстрое увеличение дозы, в связи с чем больные отказываются от дальнейшего приема из-за побочных эффектов; 2) назначение слишком малых доз амитриптилина: от 2,5 до 25 мг в сутки, которые не купируют болевой синдром, и пациенты отказываются от приема препарата из-за мнимой неэффективности.
Минимальная продолжительность тестовой терапии: не менее 3 нед в максимальной переносимой дозе.
NNT амитриптилина: 1,3–4, т.е. хороший обезболивающий эффект достигается примерно у каждых трех из четырех пациентов; по другим данным, хотя бы удовлетворительный эффект достигается минимум у каждого четвертого, а хороший эффект – у каждого второго пациента.
Дополнительные положительные эффекты: антидепрессивный и противотревожный эффект, улучшение сна.
Наиболее распространенные побочные эффекты: 1) центральные гистаминные (выраженная седация, сонливость, заторможенность, вплоть до спутанности сознания, повышение аппетита и массы тела); 2) холинолитические (спутанность сознания, делирий, когнитивная дисфункция у пожилых при длительном приеме, затруднение мочеиспускания, запоры, сухость во рту, нечеткость зрения, синусовая тахикардия, ишемия миокарда); 3) адренолитические (ортостатическая гипотония, рефлекторная тахикардия, сонливость, головокружение); 4) адренергические (отмечаются только в первые 2 нед применения беспокойство, ощущение внутренней дрожи, тремор); 5) хинидиноподобные (удлинение интервалов PR, QRS и QT на ЭКГ, АВ-блокада и другие нарушения проводимости). Побочные эффекты возникают не реже чем у 25–55% пациентов и являются причиной прекращения приема амитриптилина у 3–4 из каждых 100 человек.
Противопоказания: острый и ранний восстановительный период после инфаркта миокарда, острая алкогольная интоксикация, острая интоксикация снотворными, анальгезирующими и психотропными лекарственными средствами, закрытоугольная глаукома, нарушения ритма и проводимости сердца, удлинение интервала QT на ЭКГ; одновременный прием препаратов, удлиняющих интервал QT на ЭКГ; лактация, повышенная чувствительность к амитриптилину, гипертрофия предстательной железы.
С крайней осторожностью: старческий возраст, цереброваскулярная болезнь, инсульт, хроническая ишемия головного мозга любого генеза, ИБС, аритмии, сердечная недостаточность, артериальная гипертония, склонность к ортостатической гипотонии, в том числе при кардиоваскулярной форме диабетической вегетативной полинейропатии, эпилепсия, сахарный диабет (нарастание гипергликемии, может потребоваться увеличение дозы сахароснижающих препаратов), хронический алкоголизм, тиреотоксикоз.
Лекарственные взаимодействия: не применять одновременно с препаратами, оказывающими угнетающее влияние на ЦНС, холинолитиками, симпатомиметиками, ингибиторами МАО, селективными ингибиторами обратного захвата серотонина (СИОЗС) (возможность токсических реакций), этанолом. При одновременном применении с нейролептиками взаимно угнетается метаболизм, при этом происходит снижение порога судорожной готовности. При одновременном применении с антигипертензивными средствами (за исключением клонидина, гуанетидина и их производных) возможно усиление антигипертензивного действия и риска развития ортостатической гипотензии. При одновременном применении с карбамазепином возможно уменьшение действия амитриптилина вследствие повышения его метаболизма.
9.6. Опиоидные и атипичные опиоидные анальгетики
В эту группу входят опиоиды, из которых для лечения БДПН применяют трамадол (смешанный агонист-антагонист мю-опиатных рецепторов, ингибитор обратного захвата серотонина и норадреналина), оксикодон и реже морфин (оба агонисты каппа-, мю- и дельта-опиатных рецепторов). Будучи наиболее сильными анальгетиками, они подтвердили свой эффект в тяжелых случаях БДПН и относятся к препаратам глубокого резерва, так как для всех этих препаратов характерен высокий риск развития зависимости, злоупотребления, седативных и других побочных эффектов, даже при кратковременном приеме. По этим причинам назначение опиоидов для лечения болевого синдрома при ДПН возможно только после доказанной неудачи лечения другими препаратами с соблюдением минимальной тестовой продолжительности терапии.
Трамадол – опиоидный анальгетик центрального действия, обладающий меньшим потенциалом развития зависимости и злоупотребления, чем другие опиоиды. Тем не менее его следует использовать лишь в том случае, если все возможности обезболивания с помощью антидепрессантов и противосудорожных средств исчерпаны.
Режим дозирования: начальная доза 50 мг 1–2 раза в сутки, постепенно увеличивая ее при необходимости до 100 мг 2–4 раза в сутки. У пациентов старше 75 лет высшая суточная доза не должна превышать 300 мг в связи с риском нарушения сознания (спутанность).
Минимальная продолжительность тестовой терапии: 4 нед приема максимальной переносимой дозы.
NNT трамадола равняется 3–6 (уменьшение боли на 30–50% и более у каждого 3–6 пациента).
Дополнительные положительные эффекты: седативный, противокашлевой.
Наиболее распространенные побочные эффекты: развитие зависимости, сонливость, слабость, спутанность сознания, сухость во рту, тошнота, рвота, запоры, ортостатическая гипотония, тахикардия, головокружение, головная боль, потливость.
Противопоказания: острая интоксикация алкоголем и препаратами, оказывающими угнетающее влияние на ЦНС, повышенная чувствительность к препарату.
С осторожностью: беременность, лактация, печеночная недостаточность, почечная недостаточность, судорожные синдромы.
Лекарственные взаимодействия: с антидепрессантами, действующими на серотонин (группы СИОЗС, СИОЗСН, ТЦА) и ингибиторами МАО (опасность развития серотонинового синдрома).
Тапентадол – опиоидный анальгетик центрального действия, являющийся агонистом µ-опиатных рецепторов и ингибитором обратного захвата серотонина. Систематический обзор и метаанализ, выполненный группой NeuPSIG, считает доказательную базу по эффективности тапентадола при нейропатической боли недостаточно убедительной. Как и другие опиаты, его следует использовать лишь в том случае, если все возможности обезболивания с помощью антидепрессантов и противосудорожных средств исчерпаны.
Режим дозирования тапентадола: для препарата с немедленным высвобождением начальная доза в первый день 50–100 мг 4–6 раза в сутки, затем по 60 мг в сутки. Для препарата с замедленным высвобождением начальная доза и поддерживающая доза 50 мг 2 раза в сутки.
Минимальная продолжительность тестовой терапии: 4 нед приема максимальной переносимой дозы.
NNT тапентадола: неизвестна.
Наиболее распространенные побочные эффекты: развитие зависимости, рвота, запор, головокружение, нарушения сна, тревога, подавленное настроение, повышенная возбудимость, беспокойство.
Противопоказания: острая интоксикация алкоголем и препаратами, оказывающими угнетающее влияние на ЦНС, повышенная чувствительность к препарату, значительное угнетение дыхания, атония кишечника, тяжелая почечная или печеночная недостаточность.
С осторожностью: беременность, лактация, черепно-мозговая травма, судорожный синдром в анамнезе, патология желчных путей, панкреатит.
Лекарственные взаимодействия: может усиливать эффект ингибиторов МАО и антидепрессантов, являющихся селективными ингибиторами обратного захвата норадреналина. Одновременное применение с бензодиазепинами, барбитуратами и опиоидами (анальгезирующие, противокашлевые средства и средства для лечения синдрома отмены) может повысить риск угнетения дыхания.
 10. ИНДИВИДУАЛЬНЫЙ ВЫБОР ПРЕПАРАТА
10. ИНДИВИДУАЛЬНЫЙ ВЫБОР ПРЕПАРАТА
Учитывая достаточно большой ассортимент препаратов для обезболивания пациентов с БДПН, их выбор следует проводить с учетом следующих факторов (табл. 9):
- доказанной эффективности при БДПН;
- переносимости с учетом профиля пациента;
- возраста пациента;
- сопутствующих заболеваний;
- сопутствующей медикаментозной терапии;
- стоимости и предпочтений пациента.
Критерии выбора препарата первой линии в зависимости от сопутствующих состояний
- Пациенты старческого возраста: прегабалин, габапентин, реже дулоксетин.
- Пациенты с почечной недостаточностью: прегабалин, габапентин, амитриптилин, реже дулоксетин.
- Пациенты с печеночной недостаточностью: прегабалин, габапентин, реже амитриптилин.
- Пациенты с сопутствующими сердечно-сосудистыми заболеваниями: прегабалин, габапентин, дулоксетин.
- Пациенты с болевой ДПН и нарушением сна, а также хронической патологической тревогой (ее частота при СД 15–60%): прегабалин, габапентин.
- Пациенты с болевой ДПН и депрессией: дулоксетин, амитриптилин.
11. КОМОРБИДНОСТЬ ПРИ ДИАБЕТИЧЕСКОЙ ПЕРИФЕРИЧЕСКОЙ НЕЙРОПАТИИ
11.1. Депрессия и болевая форма диабетической периферической нейропатии
Особенно необходима высокая настороженность практических врачей в отношении депрессивных расстройств как возможной причины болевого синдрома [8]. Распространенность депрессии у больных СД достигает 20–30%, при этом главными жалобами 45–95% больных СД и депрессией являются именно соматические: постоянная слабость, усталость, отсутствие энергии, упадок сил, непреднамеренное повышение или снижение аппетита и массы тела, бессонница или сонливость, тошнота, запоры, поносы, синдром раздраженной толстой кишки, снижение либидо и эректильная дисфункция, нарушение менструального цикла.
Наиболее типичным соматическим симптомом депрессивных расстройств являются жалобы на боли без явной соматической причины: мигрирующие, меняющие свой характер, наиболее часто боли в конечностях, особенно в ногах, головные боли, боли в пояснице, хронические тазовые боли и т.д. Необходимо быть внимательным к типичным для депрессивного пациента формулировкам болевых жалоб («все болит», «все тело болит», «болят руки и ноги», «каждый день что-нибудь где-нибудь болит»).
Депрессия не только сама способна вызвать болевой синдром, но и усиливает боли, связанные с собственно БДПН. Тесная ассоциация депрессии с болями объясняется тем, что и в восприятии боли, и в патогенезе депрессии участвует ряд общих механизмов, главным из которых является дисбаланс нейромедиаторов серотонина и норадреналина в ЦНС. При наличии депрессии у больного СД врач может столкнуться с тремя клиническими ситуациями: 1) боли в ногах обусловлены только БДПН; 2) боли в ногах обусловлены только депрессией, а БДПН отсутствует; 3) боли в ногах обусловлены и БДПН, и депрессией. Конкретная клиническая ситуация будет влиять на выбор медикаментозной обезболивающей терапии БДПН (см. далее).
Для скрининга на наличие депрессивных расстройств можно использовать шкалы самоотчета, например Госпитальную шкалу тревоги и депрессии (HADS) (табл. 10).

Сумма баллов в левой колонке отражает состояние тревоги, в правой колонке – состояние депрессии. Сумма баллов от 8 до 10 означает наличие субклинической тревоги или депрессии, 11 и более баллов – клинически выраженной тревоги или депрессии.
Кроме того, для скрининга депрессивных расстройств врачами-непсихиатрами Всемирная организация здравоохранения предлагает использовать два вопроса:
- За последние 2 нед ощущали ли вы подавленность, сниженное настроение или безнадежность?
- За последние 2 нед ощущали ли вы снижение или потерю интереса и удовольствия?
Вот почему, если хотя бы на один из двух скрининговых вопросов дан положительный ответ или набрана диагностическая сумма баллов по шкале HADS, необходимо проводить клиническую диагностику депрессии, в том числе у специалиста.
11.2. Контроль эффективности терапии в динамике и смена препарата
Контроль эффективности лечения должен опираться на субъективную оценку болевого синдрома пациентом. Желательно оценивать выраженность болевого синдрома в динамике с помощью ВАШ и в зависимости от результатов принимать решение о продолжении приема или смене препарата (см. рис. 4 и 5):
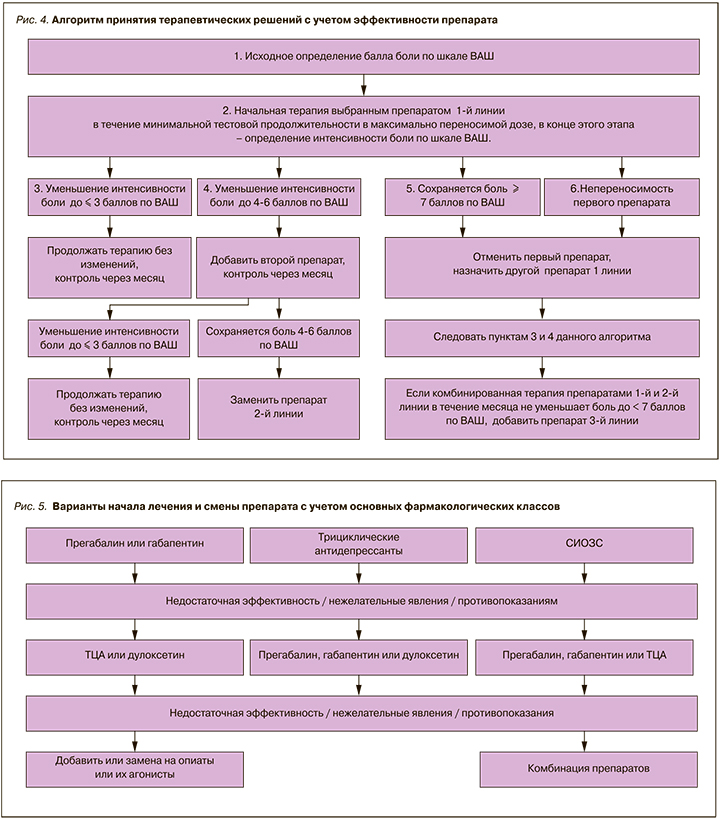
- Исходное определение балла боли по ВАШ.
- Начальная терапия выбранным препаратом 1-й линии в течение минимальной тестовой продолжительности в максимально переносимой дозе, в конце этого этапа – определение интенсивности боли по ВАШ.
- Если интенсивность боли уменьшилась до 3 баллов по ВАШ, продолжать терапию, контроль через месяц.
- Если интенсивность боли уменьшилась до 4–5 баллов по ВАШ, добавить второй препарат (см. раздел «Комбинированная терапия), контроль через месяц.
- Если интенсивность боли уменьшилась только до 7 баллов по ВАШ или если пациент не переносит назначенный первый препарат, следует отменить его и назначить другой препарат 1-й линии.
- Если комбинированная терапия препаратами 1-й и 2-й линии в течение месяца не уменьшает болевой синдром до менее 7 баллов, следует добавить препарат 3-й линии.
 11.3. Комбинированная терапия
11.3. Комбинированная терапия
Комбинированная терапия, включая комбинации опиоидов, может обеспечить эффективное лечение болевого синдрома при ДПН [8]. В табл. 11 приводятся рекомендации по оптимальному сочетанию препаратов в комбинации и по сочетаниям препаратов, которых нужно избегать.
Большинство указанных в табл. 11 комбинаций основано на принципе сочетания препаратов с разным механизмом действия и избегания лекарственных взаимодействий. По большинству указанных комбинаций качественные рандомизированные клинические исследования не проводились. Единственной комбинацией, подтвердившей свою высокую эффективность и приемлемую безопасность в двойном слепом рандомизированном исследовании с параллельными группами, была комбинация дулоксетина и прегабалина.
В этом исследовании пациентов с болевой ДПН, не ответивших на средние дозы обезболивающих препаратов, переводили либо на высокие дозы дулоксетина (120 мг в сутки), либо на комбинацию дулоксетина в дозе 60 мг с прегабалином 300 мг в сутки, либо на высокие дозы прегабалина (600 мг в сутки). Значимой разницы в эффективности комбинированной терапии и высокодозной монотерапии прегабалином или дулоксетином по главной конечной точке в целом не получено, однако отмечалась существенно более выраженная положительная динамика по многочисленным вторичным конечным точкам, чем на высшей дозе прегабалина. Комбинированная терапия прегабалином и дулоксетином переносилась хорошо.
Хотя некоторым пациентам, не ответившим на все остальные комбинации препаратов, может потребоваться дополнительная терапия «сильными» опиоидами, в этих случаях рекомендуется направить пациента к специалисту по лечению боли для предотвращения сопровождающих лечение рисков.
11.4. Не рекомендуемые к применению препараты для лечения болевой ДПН
Доказана неэффективность или получены противоречивые результаты по эффективности, не позволяющие их рекомендовать при болевой ДПН:
- Из противосудорожных: ламотриджин, лакосамид, вальпроаты, топирамат, цонизамид.
- Из антидепрессантов: селективные ингибиторы обратного захвата серотонина (СИОЗС), миансерин, тразодон, ингибиторы моноаминооксидазы (МАО).
- Из прочих фармакологических групп: клонидин, пентоксифиллин, мексилетин, мемантин, каннабиноиды, тапентадол.
В связи с побочными действиями для лечения БДПН не рекомендуются следующие лекарственные средства:
- НПВП (повышенный риск кровотечений, обострения язвенной болезни, сердечно-сосудистых и цереброваскулярных событий, нефротоксичность при длительном применении).
- Ацетаминофен (гепатотоксичность больших доз и при длительном приеме).
- Витамин В6 (нейротоксичность больших доз).
- Петидин, тримеперидин (промедол) и пропоксифен (нейротоксичность метаболитов), пентазоцин (нейротоксичность и исчезновение обезболивающего эффекта с течением времени).
12. ПРАВИЛА ВЫПИСКИ ПРЕПАРАТОВ НА РЕЦЕПТУРНЫХ БЛАНКАХ
C 1 октября 2015 года, согласно Приказу Минздрава России от 30.06.2015 № 386н «О внесении изменений в приложения к приказу Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. № 1175н „Об утверждении порядка назначения и выписывания лекарственных препаратов, а также форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения”» лекарственный препарат прегабалин был включен в перечень предметно-количественно учета (ПКУ), раздел IV «Иные лекарственные средства, подлежащие предметно-количественному учету: прегабалин, тропикамид, циклопентолат, тапентадол) с требованиями выписывания препаратов на форме рецептурного бланка 148- 1/у- 88 с соответствующими реквизитами, согласно Приказу № 1175н [46].
Важные правила заполнения рецептов 148-1/у-88
- Отпуск всего выписанного на рецепте количества препарата осуществляется единовременно, без возможности последующего возврата рецепта пациенту.
- На 1 рецепт 1 МНН только одной дозировки. При необходимости выписывания на курс различных дозировок препарата необходим отдельный рецепт на каждую дозировку.
- Учет рецептов в аптеке.
- В медицинскую карту пациента носится номер и серия рецепта.
- Исправления в рецепте, выписанном на рецептурном бланке, не допускается.
- Рецепт заполняется разборчиво, четко, чернилами или шариковой ручкой.
- Рецепт, выписанный с нарушением установленных настоящим Порядком требований, считается недействительным.
- Допускается оформление всех реквизитов (за исключением реквизита «Подпись лечащего врача») с использованием печатающих устройств.
- Сведения о назначенном, и выписанном лекарственном препарате (наименование лекарственного средства, разовая доза, способ и кратность приема или введения, длительность курса, обоснование назначенного лекарственного средства) указываются в медицинской карте пациента.
В графе «Rp» рецептурных бланков указывается:
- На латинском языке наименование лекарственного препарата (международное непатентованное, при его отсутствии – группировочное, при его отсутствии – торговое), его дозировка.
- Только принятые правилами сокращения обозначений; твердые и сыпучие фармацевтические субстанции выписываются в граммах (0,001; 0,5; 1,0), жидкие – в миллилитрах, граммах и каплях.
- На русском или русском и национальном языках способ применения лекарственного препарата.
- Способ применения лекарственного препарата – доза, частота, время приема относительно сна (утром, на ночь) и его длительности, а для лекарственных препаратов, взаимодействующих с пищей, – время их употребления относительно приема пищи (до еды, во время еды, после еды).
Запрещается ограничиваться общими указаниями, например «внутреннее», «известно».
Печати на бланке рецепта. В левом верхнем углу проставляется штамп медицинской организации с указанием ее наименования, адреса и телефона. (Это очень важный реквизит, так как у фармацевта должна быть обеспечена связь с ЛПУ в случае неправильно выписанного рецепта.)
Рецепт, выписанный на рецептурном бланке, подписывается медицинским работником и заверяется его личной печатью. (Должность медицинского работника вписывать не нужно.)
Дополнительно рецепт заверяется печатью медицинской организации «Для рецептов».
При выписке лекарственного препарата по решению врачебной комиссии на обороте рецептурного бланка дополнительно ставится специальная отметка («Штамп»).
Назначение и выписывание препаратов по решению врачебной комиссии производится, в частности, при первичном назначении пациенту наркотических и психотропных ЛП списков II и III Перечня (в случае принятия руководителем медицинской организации решения о необходимости согласования назначения таких ЛП с ВК).
Для выписывания прегабалина согласно законодательству не требуется дополнительных согласований с администрацией ЛПУ, не требуется решение о выписке врачебной комиссии. На рецепте ставится только подпись медицинского работника, дополнительных подписей администрации ЛПУ не требуется. Для выписывания прегабалина не установлено предельно допустимой нормы на один рецепт и на курс. Врач имеет право выписать любое количество капсул одной дозировки на курс на одном рецепте. Если имеется необходимость выписать сразу две дозировки препарата прегабалин, то на каждую дозировку выписывается отдельный рецепт формы 148-1/у-88.


