На протяжении последнего десятилетия в структуре заболеваемости злокачественными новообразованиями мужского населения России и многих стран мира рак предстательной железы (РПЖ) занимает второе место после опухолей трахеи, бронхов и легкого [1]. Еще в 1941 г. С. Huggins и С.V. Hodges продемонстрировали эффективность хирургической кастрации и эстрогенной терапии при прогрессировании метастатического РПЖ [2]. Они впервые установили чувствительность РПЖ к андрогенной блокаде. Развитие методов андрогенной депривации, несмотря на сохранение двусторонней орхэктомии, в настоящее время заключается в появлении новых препаратов, относящихся к одной из групп:
- эстрогенам, действие которых заключается в снижении секреции ЛГРГ (лютеинизирующего гормона рилизинг-гормон), инактивации андрогенов, прямом подавлении функции клеток Лейдига, прямом цитотоксическом действии на эпителий предстательной железы (ПЖ) и клетки аденокарциномы ПЖ (только в экспериментах in vitro);
- агонистам ЛГРГ, действие которых заключается в снижении регуляции ЛГРГ-рецепторов. Это сопровождается снижением секреции ЛГ (лютеинизирующий гормон) и ФСГ (фолликулостимулирующий гормон) гипофизом и, как следствие, тeстостерона, так что концентрация тестостерона достигает кастрационного уровня в течение 2–4 нед от начала терапии;
- антагонистам ЛГРГ, которые конкурентно связываются с рецепторами в гипоталамо-гипофизарной системе, в связи с чем резко снижается синтез ЛГ и тестостерона;
- антиандрогенам, которые конкурируют с тестостероном и дигидротестостероном за андрогенные рецепторы в ядрах клеток ПЖ, что приводит к ингибированию роста и апоптозу клеток опухоли [3].
В настоящее время все методы лечения требуют оценки сердечно-сосудистых и метаболических рисков, поскольку лечение основного заболевания может привести к смерти пациента из-за фатального сердечно-сосудистого события, что обесценивает эффективность терапии. Проведено несколько исследований, которые выявили связь между андрогендепривационной терапией (АДТ) и повышенным риском развития сердечно-сосудистых событий, включая инфаркт миокарда и сердечно-сосудистую смертность [4–8]. Эти сообщения привели к росту интереса и обсуждению метаболических эффектов АДТ и его возможной связи с увеличением сердечно-сосудистых рисков.
ПОБОЧНЫЕ ЭФФЕКТЫ AДT
В первой декаде ХХI в. проведено немало исследований, показывающих увеличение риска сердечно-сосудистых заболеваний за счет увеличения массы тела, снижения чувствительности к инсулину и/или в результате дислипидемии.
Изменение композиционного состава тела. В нескольких работах показано уменьшение мышечной массы тела и увеличение жировой массы преимущественно за счет подкожного жира, что является отличительным признаком метаболического синдрома (МС) при РПЖ от МС вне депривационной терапии [9–13]. В 2 проспективных исследованиях мужчин с неметастатическим РПЖ после 1 года AДT снижение мышечной массы составило 2,7 и 3,8% и увеличение жировой массы 9,4 и 11,0% [11, 13]. AДT увеличивает подкожный, а не висцеральный жир [13, 14]. Изменения в составе тела являются ранним побочным эффектом, связанным с лечением, и проявляются в течение первых нескольких месяцев терапии [14].
Влияние АДТ на уровень холестерина и триглицеридов крови. В проспективном 12-месячном исследовании 40 мужчин с РПЖ AДT увеличивала уровни общего холестерина, холестерина липопротеидов низкой плотности (ЛПНП), холестерина липопротеидов высокой плотности (ЛПВП) и триглицеридов на 9, 7, 11 и 27% соответственно [14]. Большинство наблюдаемых долгосрочных изменений липидов в сыворотке крови проявляются в течение первых 3 мес терапии [15].
Инсулинорезистентность. В нескольких работах продемонстрировано, что AДT увеличивает уровень инсулина в плазме натощак [10, 16]. Гиперинсулинемия, как показано в исследованиях, является независимым фактором риска развития сердечно-сосудистых заболеваний [17, 18]. В 3-месячном проспективном исследовании мужчин без диабета AДT увеличивала уровень инсулина натощак на 26% и вызывала снижение чувствительности к инсулину на 13% [15].
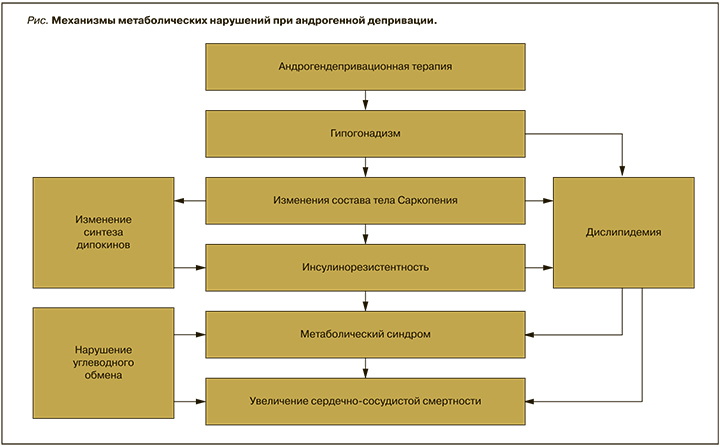
Нарушение углеводного обмена. Нарушение чувствительности к инсулину является одним из важнейших метаболических расстройств в патогенезе сахарного диабета 2 типа наряду с дисфункцией β-клеток поджелудочной железы. Нарастание инсулинорезистентности вследствие АДТ приводит сначала к компенсаторной гиперинсулинемии, а впоследствии к гипергликемии в связи с истощением компенсаторных механизмов [19]. Механизмы метаболических нарушений при андрогенной депривации представлены схематично (см. рис.).
Таким образом, при АДТ развивается комплекс метаболических нарушений, который во многом схож с классическим МС. Согласно Рекомендациям экспертов Всероссийского научного общества кардиологов по диагностике и лечению МС (второй пересмотр), выделены критерии диагностики данного состояния. Основным критерием является центральный (абдоминальный) тип ожирения – окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин. Дополнительные критерии: артериальная гипертензия (артериальное давление ≥130/85 мм рт.ст.), повышение уровня триглицеридов (≥1,7 ммоль/л), снижение уровня ЛПВП (< 1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин), повышение уровня ЛПНП >3,0 ммоль/л, гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л), нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 ч после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л). Наличие у пациента центрального ожирения и двух дополнительных критериев является основанием для диагностирования у него МС.
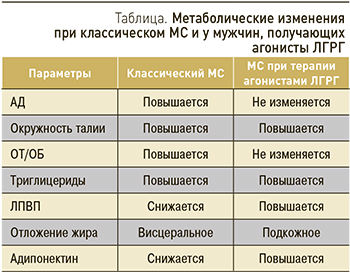 Схожи и некоторые патофизиологические механизмы развития повреждения органов-мишеней. МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обменов и артериальной гипертензии. Отличия заключаются в том, что классический МС характеризуется низкими уровнями адипонектина и повышением маркеров воспаления, а AДT значительно повышает уровень адипонектина в сыворотке крови и не изменяет уровни С-реактивного белка или других маркеров воспаления [20]. Эти наблюдения указывают на то, что AДT вызывает картину метаболических изменений, которые отличаются от классически определенного МС. Недавний обзор G.N. Levine, A.V. D’Amico и соавт. говорит о том, что наряду с большим числом исследований, демонстрирующих увеличение рисков сердечно-сосудистой смертности, существуют исследования, которые не показывают такого повышения [21, 22].
Схожи и некоторые патофизиологические механизмы развития повреждения органов-мишеней. МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обменов и артериальной гипертензии. Отличия заключаются в том, что классический МС характеризуется низкими уровнями адипонектина и повышением маркеров воспаления, а AДT значительно повышает уровень адипонектина в сыворотке крови и не изменяет уровни С-реактивного белка или других маркеров воспаления [20]. Эти наблюдения указывают на то, что AДT вызывает картину метаболических изменений, которые отличаются от классически определенного МС. Недавний обзор G.N. Levine, A.V. D’Amico и соавт. говорит о том, что наряду с большим числом исследований, демонстрирующих увеличение рисков сердечно-сосудистой смертности, существуют исследования, которые не показывают такого повышения [21, 22].
Отличия МС при андрогенной депривации от классического МС представлены в таблице.
УПРАВЛЕНИЕ МЕТАБОЛИЧЕСКИМИ ИЗМЕНЕНИЯМИ ПРИ AДТ
Таким образом, негативные эффекты AДT были подтверждены в исследованиях, и теперь необходимо оценить, существует ли возможность их уменьшить или предотвратить. Прежде всего, необходимо информировать пациента и его лечащего врача о развитии неблагоприятных метаболических изменений во время проведения AДT. Метаболические изменения при AДT отмечаются в ранний период лечения, и шведские исследователи недавно сообщили, что риск сердечно-сосудистых событий был самым высоким в первые 6 мес [23]. Поэтому такое информирование или обучение следует проводить до начала AДT, особенно для пациентов с факторами риска, такими как сахарный диабет или предшествующие сердечно-сосудистые заболевания. В нескольких исследованиях была продемонстрирована эффективность дозированных физических нагрузок (ДФН) для уменьшения или предотвращения метаболических изменений в результате AДT. В 2003 г. R.J. Segal и соавт. провели рандомизированное исследование, в котором изучалось влияние 12-недельных ДФН на побочные эффекты, связанные с AДT. Они показали, что ДФН сопряжены со снижением утомляемости, мышечной слабости и улучшением качества жизни у пациентов, получающих AДT, по сравнению с отсутствием вмешательства [24]. Недавно P. Cormie и соавт. также провели рандомизированное исследование для определения эффективности ДФН на осложнения при AДT. Они показали, что 3-месячная программа упражнений предотвращает рост жировой массы и поддерживает тонус сердечно-сосудистой системы, мышечную силу, функцию тазовых органов и уровень холестерина крови по сравнению с отсутствием ДФН [25]. Таким образом, показано, что ДФН эффективно снижают неблагоприятные последствия, вызванные AДT, но, поскольку тип упражнений, их интенсивность, частота и длительность в исследованиях различались, это нуждается в дальнейшем изучении [26].
Недостаточно данных по ведению пациентов с нарушениями углеводного обмена, однако существует целая серия исследовательских программ по оценке наиболее целесообразного и обоснованного пути ведения пациентов с предиабетом, в рамках которых использовали противодиабетические средства. Основные исследования эффективности метформина у пациентов с предиабетом – DPP и DPPOS. Механизмы действия метформина позволили на сегодняшний день выделить этот препарат из большого перечня молекул-кандидатов. Метформин оказывает влияние на ключевой патогенетический механизм развития сахарного диабета 2 типа (СД2) – инсулинорезистентность (ИР) периферических тканей-мишеней. Опираясь на высокие современные требования к медикаментозной профилактике хронических заболеваний, большинство международных экспертных ассоциаций рекомендует метформин при предиабете, опираясь на результаты исследований по профилактике СД2, выявивших снижение риска развития СД на 31% на фоне монотрапии метформином и на 58% на фоне терапии метформином в комбинации с изменением образа жизни [27].
МОНИТОРИНГ ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ AДT
Во время проведения AДT необходим мониторинг в отношении метаболических изменений. Для предотвращения неблагоприятных событий необходимы регулярные измерения массы тела, контроль лабораторных показателей, включая уровни липидов, глюкозы крови, контроль артериального давления и минеральной плотности костной ткани.
Многие из существующих исследований показали, что AДT высоко эффективна при РПЖ и существенно улучшает прогноз заболевания даже при наличии метастазов. Улучшить «метаболическое здоровье» таких пациентов, т.е. избежать неблагоприятных метаболических эффектов в результате AДT, можно путем информирования, обучения, контроля и возможной терапии. По нашему мнению, следует запланировать исследования с целью выяснения возможных способов коррекции ассоциированных с AДT негативных явлений.


